Schwefel
Schwefel (über mittelhochdeutsch swëbel von althochdeutsch swëbal; lateinisch sulpur und gräzisiert Sulphur bzw. Sulfur, wie swëbal vermutlich von einer indogermanischen Wurzel suel- mit der Bedeutung ‚langsam verbrennen‘, woraus im Germanischen auch deutsch „schwelen“ entstand;[15] die zur Benennung schwefelhaltiger Verbindungen verwendete Silbe „-thio-“ stammt vom griechischen Wort θεῖον theĩon) ist ein chemisches Element mit dem Elementsymbol S und der Ordnungszahl 16. Er zählt zu den Chalkogenen in der sechzehnten Gruppe des Periodensystems. In der Häufigkeit der in der Lithosphäre vorkommenden Elemente steht er an 16. Stelle. Elementarer Schwefel ist ein bei 25 °C gelber, nichtmetallischer Feststoff, der eine Vielzahl allotroper Modifikationen bildet. In der unbelebten Natur kommt er sowohl gediegen als auch in Form zahlreicher Mineralien vor, in diesen vor allem als Sulfid, Disulfid und Sulfat, seltener als Sulfit. Schwefelverbindungen sind auch Bestandteile aller Pflanzen, Tiere und Menschen, zum Beispiel als essentielle Aminosäuren und Coenzyme. Auch Kohle und Erdöl enthalten daher Schwefelverbindungen. In Mikroorganismen spielt Schwefel auch eine Rolle bei der anaeroben Energiegewinnung. Den größten Teil des elementar gewonnenen oder in Raffinerien erzeugten Schwefels verwendet die chemische Industrie zur Herstellung von Schwefelsäure, einer der technisch wichtigsten und meistproduzierten Grundchemikalien. Als Komponente des sauren Regens besitzen Schwefeloxide und verschiedene Schwefelsäuren erhebliche Umweltrelevanz.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Schwefel, S, 16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Nichtmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 16, 3, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | gelb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-722-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.839 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-Code |
D10AB02 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,048 %[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 32,06 (32,059 – 32,076)[3][4][5] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 100 (88) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 102,5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ne] 3s2 3p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 10.36001(12) eV[6] ≈ 999.59 kJ/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 23.33788(25) eV[6] ≈ 2251.76 kJ/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 34.86(4) eV[6] ≈ 3363.48 kJ/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 47.222(12) eV[6] ≈ 4556.23 kJ/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 72.5945(4) eV[6] ≈ 7004.3 kJ/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. Ionisierungsenergie | 88.0529(4) eV[6] ≈ 8495.81 kJ/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | orthorhombisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 2,07 g/cm³[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −1,3 · 10−5)[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 388,36 K (115,21 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 718,2 K[11] (445 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 15,53 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 45 kJ/mol[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 1,713 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 736[1] J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,205 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −2 bis +6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,48 V (S + 2 e− → S2−) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,58 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Geschichte

Schwefel ist ein seit langem vom Menschen genutztes Element. Chinesen und Ägypter nutzten um etwa 5000 v. Chr. Schwefel zum Bleichen von Textilien, als Arzneimittel und zur Desinfektion. Der Papyrus Ebers beschreibt die Verwendung von Schwefel zur Behandlung von bakteriellen Entzündungen des Auges (Trachom).
Eine natürlich vorkommende Modifikation des Schwefels, genannt Shiliuhuang, war in China seit dem sechsten Jahrhundert v. Chr. bekannt. Chinesen gewannen im dritten vorchristlichen Jahrhundert Schwefel aus Pyrit.[16]
Das vorklassische Griechenland verwendete Schwefel als Arzneimittel und das durch Verbrennung von Schwefel entstehende Schwefeldioxid sowohl als Desinfektionsmittel zur Verhütung von Infektionskrankheiten wie der Pest als auch zur Schwefelung von Wein. Bereits um 800 v. Chr. erwähnte Homer dies in der Odyssee.[17][18] Die antike Kriegsführung verwendete Schwefel als Brandwaffe oder Brandbeschleuniger.[16] Plinius der Ältere erwähnte um das Jahr 79 n. Chr. in seinem Werk Naturalis historia die Insel Milos als Lagerstätte des Elements sowie seine Verwendung als Desinfektionsmittel, Arzneimittel und Bleiche.[19] Als weitere Anwendungen erwähnt er Schwefelhölzer.[20]
Eine Abhandlung aus der Zeit der Song-Dynastie um 1044 beschreibt verschiedene Formen des chinesischen Schwarzpulvers, einer Mischung aus Kaliumnitrat, Holzkohle und Schwefel. Roger Bacon beschrieb im Jahr 1242 die Herstellung einer ähnlichen Mischung. Schwarzpulver blieb lange Zeit der einzige Spreng- und Explosivstoff.[21] Die Rolle des deutschen Mönches Berthold Schwarz, dem die Wiederentdeckung des Schwarzpulvers meist zugeschrieben wird, ist historisch nicht eindeutig belegt.[22]
Im Mittelalter und in der Frühen Neuzeit unterschied man gewöhnlichen (natürlich vorkommenden), noch nicht erhitzten Schwefel (auch „lebendiger Schwefel“, mittellateinisch sulfur vivum, später auch Sulphur vivum[23] oder auch sulphur fossile[24]) vom sublimierten Schwefel (sulfur sublimatum).[25]
Die Umweltauswirkungen von Schwefeloxiden aus der Verbrennung von Kohle auf die Luftqualität in London beschrieb im Jahr 1661 John Evelyn in einem Brief an Karl II. sowie in seinem Werk Fumifugium (The Inconveniencie of the Aer and Smoak of London Dissipated), dem ersten Buch über die Luftverschmutzung in London.
Als einen der ersten chemisch-technischen Prozesse entwickelte John Roebuck ab 1746 das Bleikammerverfahren zur Herstellung von Schwefelsäure. Im November 1777 vermutete Antoine Laurent de Lavoisier erstmals, dass Schwefel ein Element ist. Seine Versuche und Beobachtungen zum Verbrennungsverhalten von Schwefel führten letztendlich zum Fall der Phlogistontheorie.[26] Dennoch gelangte Humphry Davy noch 1809 experimentell zu dem Ergebnis, dass Schwefel Sauerstoff und Wasserstoff enthalte. Der letztendliche Nachweis des Elementcharakters gelang im Jahr 1810 Joseph Louis Gay-Lussac und Louis Jacques Thénard bei der Überprüfung der Davy’schen Versuche.[27]
Seit 1814 wird das Elementsymbol S nach einem Vorschlag von Jöns Jakob Berzelius, der es unter dem Namen Sulphur in seine Atomgewichtstabelle aufnahm, verwendet.[28] Der dänische Chemiker William Christopher Zeise entdeckte um 1822 die Xanthogenate und stellte 1834 mit Ethanthiol das erste Mercaptan her.[29]
Die Entwicklung und Patentierung des Kontaktverfahrens erfolgte im Jahr 1831 durch den Essigproduzenten Peregrine Phillips. Im britischen Patent Nr. 6096 beschreibt er die spontane Oxidation von Schwefeldioxid zu Schwefeltrioxid in Luft in Gegenwart eines Platinkatalysators. Durch nachfolgende Absorption des Trioxids in Wasser gelangte er zu Schwefelsäure.[30] In der Folgezeit ersetzte Vanadiumpentoxid das Platin als Katalysator. Ein weiterer Meilenstein bei der Entwicklung chemisch-technischer Verfahren gelang Charles Goodyear 1839 durch die Entdeckung der Vulkanisierung von Kautschuk mit elementarem Schwefel; sie bildet die Grundlage der Kautschukindustrie. Das Verfahren legte den Grundstein für den Aufbau eines Reifenimperiums durch Frank und Charles Seiberling, die den Namen Goodyear im Firmennamen zu seinen Ehren wählten.
In den Jahren 1891 bis 1894 entwickelte der deutschstämmige Chemiker Hermann Frasch das nach ihm benannte Frasch-Verfahren, mit dem die 1865 in Louisiana entdeckten unterirdischen Schwefellager abgebaut werden konnten. Das Verfahren nutzt den niedrigen Schmelzpunkt und die geringe Dichte von Schwefel und presst mit überhitztem Wasser und Druckluft den geschmolzenen Schwefel durch ein geeignet geformtes Rohr an die Oberfläche.[31][32]
Im Jahr 1912 wies Ernst Beckmann kryoskopisch nach, dass rhombischer Schwefel aus S8-Ringen besteht.[33] Röntgenstrukturanalytisch gelang dieser Nachweis 1935 B. E. Warren und J. T. Burwell.[34] In den Jahren 1968–1998 stellten die Arbeitsgruppen von Max Schmidt und Ralf Steudel zahlreiche neue allotrope Modifikationen des Schwefels her.
Vorkommen
Terrestrische Vorkommen
Schwefel kommt in vielen Erdsphären vor. Den Austausch zwischen diesen Sphären beschreibt der Schwefelkreislauf, das System der Umwandlungen von Schwefel und Schwefelverbindungen in Lithosphäre, Hydrosphäre, Erdatmosphäre und Biosphäre sowie den Austausch zwischen diesen Erdsphären. Schwefel kommt dabei in der Oxidationsstufe −2, etwa bei Metallsulfiden und Schwefelwasserstoff, sowie −1 vor, zum Beispiel in dem Mineral Pyrit. Die Oxidationsstufe 0 (elementarer Schwefel) tritt in Sedimenten, die aus der bakteriellen Reduktion von Sulfaten stammen, wie etwa in Louisiana, oder bei Schwefelvorkommen vulkanischen Ursprungs auf. In der Oxidationsstufe +4 kommt es als Schwefeldioxid in der Atmosphäre vor und in der Oxidationsstufe +6 als Sulfat in der Hydro- und Lithosphäre.[32]
Schwefel steht bezüglich der Elementhäufigkeit mit einem Massenanteil von
- 0,46 % an der gesamten Erde an 8. Stelle,
- 0,048 % in der Erdhülle an 15. Stelle,
- 0,035 % in der kontinentalen Erdkruste an 16. Stelle.
Lithosphäre
Elementarer Schwefel kommt in der Natur in mächtigen Lagerstätten, zum Beispiel in Sizilien, Polen, Irak, Iran, Louisiana, Texas und Mexiko vor. Weltweit konnte gediegener Schwefel bis 2011 an rund 1500 Fundorten nachgewiesen werden. Neben den bereits genannten Lagerstätten wurde Schwefel unter anderem in mehreren Regionen von Australien, Nord- und Südamerika, Asien und Europa gefunden. Schwefel fand sich in Mineralproben vom Meeresboden des Golfes von Mexiko, des Mittelatlantischen Rückens und des Ostpazifischen Rückens.[35]
Schwefel tritt gediegen, das heißt in elementarer Form, in der Natur auf. Reiner Schwefel ist zwar insgesamt relativ selten, Vulkanausbrüche setzen ihn jedoch in großen Mengen frei. Er findet sich in Vulkanschloten oder an anderen postvulkanischen Erscheinungen als Resublimationsprodukt in pulvriger Form als sogenannte Schwefelblüte. Synthetisch durch Raffinierung hergestellter Schwefel wird allerdings ebenfalls als Schwefelblume oder Schwefelblüte bezeichnet.[36]
Elementarer Schwefel ist als eigenständiges Mineral anerkannt und wird von der International Mineralogical Association (IMA) gemäß der Systematik der Minerale nach Strunz (9. Auflage) unter der System-Nr. „1.CC.05“ (Elemente – Halbmetalle (Metalloide) und Nichtmetalle – [Gruppe] Schwefel-Selen-Iod)[37] (8. Auflage: I/B.03-10). Die im englischsprachigen Raum ebenfalls geläufige Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. „01.03.05.01“.
Die natürlich auftretenden Modifikationen β-Schwefel und Rosickýit (γ-Schwefel) sind ebenfalls als Minerale anerkannt.
Oberhalb etwa 95 °C kristallisiert Schwefel monoklin (β-Schwefel). Diese Form wandelt sich bei Standardbedingungen langsam in den dann thermodynamisch stabilen α-Schwefel um. Letzterer kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Fddd (Nr. 70) mit den Gitterparametern a = 1044 pm; b = 1284 pm und c = 2437 pm sowie 128 Formeleinheiten pro Elementarzelle.[38]
Die Dichte von α-Schwefel beträgt 2,07 g/cm³. Meist zeigt er hellgelbe bis dunkelgelbe Kristallprismen oder Pyramidenformen, die sich auf Gesteinsflächen aus schwefelreichen Gasen durch unvollständige Oxidation von Schwefelwasserstoff (H2S) oder Reduktion von Schwefeldioxid (SO2) bilden. Auf einer Strichtafel hinterlässt Schwefel einen weißen Strich.
Schwefel kommt meist in derber Form vor, das heißt, ohne mit bloßem Auge erkennbare Kristalle, insbesondere in Sedimenten oder Sedimentgesteinen. Häufig findet er sich in Evaporiten (Salzgesteinen), wo er meistens durch Reduktion von Sulfaten entstanden ist.
Größere Kristalle von α-Schwefel sind durchsichtig bis durchscheinend, zeigen auf ihren Flächen einen harzigen bis fettigen Glanz und weisen folgende, optische Eigenschaften auf:[39]
- Hauptbrechungsindices: nα = 1,9579; nβ = 2,0377 und nγ = 2,2452 (zweiachsig positiv)
- Winkel, Dispersion der optischen Achsen: 2vz ≈ 68°58'
Pulvrige oder massige Aggregate sind dagegen undurchsichtig matt.
 Dallol Vulkanlandschaft mit braunem Eisenoxid und gelbem Schwefel in der Afar-Region Äthiopiens
Dallol Vulkanlandschaft mit braunem Eisenoxid und gelbem Schwefel in der Afar-Region Äthiopiens Dampfende Schwefel-Fumarole auf Whakaari / White Island in Neuseeland
Dampfende Schwefel-Fumarole auf Whakaari / White Island in Neuseeland Nadelige Schwefelkristalle an einer Fumarole in der Nähe des Vulkans Krafla auf Island
Nadelige Schwefelkristalle an einer Fumarole in der Nähe des Vulkans Krafla auf Island Tiefgelbe, pyramidale Schwefelkristalle mit weißem Aragonit
Tiefgelbe, pyramidale Schwefelkristalle mit weißem Aragonit Schwefelkristalle mit verschiedenen Kristallflächen auf Muttergestein
Schwefelkristalle mit verschiedenen Kristallflächen auf Muttergestein Schwefel in Gips aus der Gipsgrube Weenzen
Schwefel in Gips aus der Gipsgrube Weenzen Hellgelber Schwefel auf Calcit
Hellgelber Schwefel auf Calcit Strichfarbe von Schwefel
Strichfarbe von Schwefel
Je nach Fundort kann Schwefel in Paragenese mit verschiedenen anderen Mineralen wie beispielsweise Anhydrit, Aragonit, Calcit, Coelestin, Gips und Halit auftreten.[39]
Wesentlich häufiger als in gediegener Form tritt Schwefel in der anorganischen Natur in verschiedenen Mineralen auf, vor allem in Sulfiden, Disulfiden und Sulfaten. Insgesamt waren im Jahr 2010 fast 1000 schwefelhaltige Minerale bekannt. Weitverbreitet ist Schwefel in sulfidischen Mineralen, wie Pyrit und Markasit (FeS2), Kupferkies (CuFeS2), Bleiglanz (PbS) und Zinkblende (ZnS). Schwermetalle liegen in der Natur oft als schwerlösliche Sulfide vor. In Form von Sulfat-Ionen in den Meeren (etwa 0,9 g/l), als Gips (CaSO4 · 2 H2O), Schwerspat (BaSO4) und anderen schwer wasserlöslichen Sulfaten kommt Schwefel ebenfalls natürlich vor, und zwar in riesigen Mengen. Die Minerale mit den höchsten Schwefelgehalten sind die seltenen Disulfide Patrónit VS4 (circa 71,6 %), Villamanínit CuS2 (circa 55,9 %), Hauerit MnS2 (circa 53,9 %) sowie der sehr häufige Pyrit und Markasit FeS2. Beispiele für schwefelhaltige Halogenide sind Connellit und Kleinit, für schwefelhaltige Oxide Kuzelit, für schwefelhaltige Carbonate Leadhillit und Tychit, für Sulfate Cyanotrichit und Schwertmannit, für schwefelhaltige Phosphate Arsentsumebit und Chalkophyllit und für schwefelhaltige Silikate Haüyn und Nosean. In allen diesen Mineralien liegt der Schwefel als Sulfat vor, nur Hannebachit ist ein Sulfit der Formel CaSO3 · 2 1/2 H2O.
Eine wichtige Quelle für die Gewinnung von Schwefel sind fossile Brennstoffe wie Erdöl, Erdgas und Kohle. Vor allem Erdgas enthält in manchen Regionen relativ viel Schwefelwasserstoff (H2S). In Braunkohle beträgt der Schwefelgehalt bis zu 10 %.[40]
Hydrosphäre
In der Hydrosphäre tritt Schwefel meist in Form des Sulfat-Ions auf; es ist mit einer Konzentration von 7,68 % des Gesamtsalzgehaltes nach den Chlorid- und Natrium-Ionen das dritthäufigste Ion im Meerwasser.[41] Marine Mikroorganismen nutzen Sulfat zum Abbau des am Meeresboden vorhandenen Methans. Das Sulfat wird dabei zu Schwefelwasserstoff reduziert, das von anderen Mikroorganismen in höheren Meeresschichten wieder oxidiert wird.[42]
Im Süßwasser kommen Sulfate aus natürlichen Quellen wie Gipslagern vor und tragen maßgeblich zur Wasserhärte bei. Für Trinkwasser gilt nach der deutschen Trinkwasserverordnung ein Sulfat-Grenzwert von 240 mg/l. Sulfat-Konzentrationen über 100 mg/l gelten als korrosionsfördernd und greifen sowohl Stahl- als auch Betonkonstruktionen an.[43]
Atmosphäre
In den oberen Regionen der Atmosphäre finden sich, etwa bedingt durch Vulkanausbrüche, schwefelreiche Partikel als Aerosole mit Partikelgrößen von 0,1 bis 1 Mikrometer. Da die Partikel Sonnenlicht in der Stratosphäre reflektieren, wird ihnen eine kühlende Wirkung auf das Weltklima zugeschrieben.[44]
Durch Verbrennungsprozesse schwefelhaltiger Brennstoffe kommt Schwefel als Schwefeldioxid in der Troposphäre vor. Aus anthropogenen Quellen stammen etwa 35 % der Gesamtschwefeldioxidemissionen von etwa 400 Mio. Tonnen SO2 jährlich.[45] Der Großteil organischer Sulfide stammt von marinem Phytoplankton, das vor allem Dimethylsulfid und Schwefelwasserstoff freisetzt und als zweitgrößte Gesamtemissionsquelle für schwefelhaltige Partikel gilt.[45]
Es ist Gegenstand der wissenschaftlichen Debatte zur Klimakrise, inwiefern die künstliche Einbringung von Schwefel in die Atmosphäre eine geeignete Maßnahme des Geoengineerings darstellt, um der Überhitzung des Klimasystems der Erde entgegenzuwirken und so das im Pariser Übereinkommen vereinbarte Zwei-Grad-Ziel noch erreichen zu können.[46] Die Atmosphärenwissenschaftlerinnen Ulrike Niemeier und Simone Tilmes äußerten sich einmal wie folgt: „Um den globalen Temperaturanstieg in Schach zu halten, müsste der jährliche Schwefeleintrag in die Stratosphäre dem beim Ausbruch des Pinatubo am 12. Juni 1991 entsprechen.“[47] In der Tat lieferte der Ausbruch des Pinatubo, bei dem große Mengen an Schwefel ausgestoßen wurden, wichtige Erkenntnisse. So konnte gefolgert werden, dass ein Schwefeleintrag, der groß genug ist, um die durch die Verdoppelung des atmosphärischen CO2 verursachte Überhitzung der Erdoberfläche auszugleichen, große Folgen für die Ozonschicht hätte.[48] Tilmes warnte vor den Risiken des Geoengineerings durch die Einbringung von Schwefel in die Atmosphäre: „Unsere Ergebnisse zeigen, dass dieser Ansatz einer künstlichen Verringerung der globalen Erwärmung große Risiken mit sich bringen würde.“[49]
Biosphäre
Schwefel kommt in der Biosphäre in vielfältiger Form vor, oft in reduzierter Form. Im Zuge des Abbaus der Biomasse durch Enzyme und Mikroorganismen wird aus organischen Stoffen Schwefelwasserstoff freigesetzt. Schwefel steht Pflanzen vor allem in Form von anionischem Sulfat aus dem Boden zur Verfügung, welches über die Wurzeln aufgenommen und verteilt wird und sich meistens unmetabolisiert im vakuolären Pflanzensaft befindet. Die Reduktion von Sulfat zu Sulfid erfordert 732 kJ mol−1. Schwefeldioxid wird dagegen leicht durch Blätter absorbiert und assimiliert. Sulfat ist ein Makronährelement, dessen Mangel zu Ertragsverlusten in der landwirtschaftlichen Produktion führen kann.[50]
Von chemoautotrophen, aeroben, sulfid-oxidierenden Bakterien wird Schwefelwasserstoff mit Sauerstoff zu elementarem Schwefel oxidiert. Von phototrophen (anaeroben) Bakterien wird Schwefelwasserstoff unter anoxischen Bedingungen in anoxygener Photosynthese als Reduktionsmittel zur Assimilation von Kohlenstoffdioxid genutzt und dabei zu elementarem Schwefel oder Sulfat oxidiert.
Stellare Vorkommen
Diatomarer Schwefel wurde zunächst im Schweif des Kometen IRAS-Araki-Alcock (C/1983 H1) nachgewiesen. Nach dem Nachweis in weiteren Kometen wird mittlerweile angenommen, dass das Vorkommen in Kometenschweifen allgegenwärtig ist. Dabei ist die Herkunft des S2-Moleküls nicht geklärt.[51]
Die Wolken der Venus bestehen zum großen Teil aus Schwefeldioxid und Schwefelsäuretröpfchen. Die Schwefelsäure entsteht photochemisch in der oberen Venusatmosphäre durch die ultraviolette Strahlung der Sonne aus Kohlenstoffdioxid und Schwefeldioxid. Die kurzwellige Strahlung setzt aus dem Kohlenstoffdioxid Sauerstoff frei, welcher mit Schwefeldioxid unter Wasseraufnahme zu Schwefelsäure reagiert.
Die Viking-Sonden entdeckten Schwefel auf dem Mars. Der Gehalt der schwefelhaltigen Verbindungen, vorwiegend als Magnesium- und Eisensulfat vorliegend, im Marsstaub lag bei bis zu drei Gewichtsprozenten. Die Bildung der Sulfate erforderte wahrscheinlich eine wässrige Umgebung und wird daher als Hinweis auf das Vorhandensein einer prähistorischen Hydrosphäre auf dem Mars gedeutet.
Auf dem Jupitermond Io wurden zahlreiche Seen aus geschmolzenem Schwefel gefunden. Das breite Farbspektrum der Schwefelablagerungen verleiht dem Mond ein farbenreiches Erscheinungsbild. Bei den Lavaflüssen, die sich über mehrere hundert Kilometer ausdehnen, wird vermutet, dass sie vornehmlich aus Schwefel oder Schwefelverbindungen bestehen.[52]
Untersuchungen von NASA-Forschern legen nahe, dass Salze auf der Oberfläche des Jupitermondes Europa zu zwei Dritteln aus Schwefelsäure bestehen könnten. Andere glauben, dass der mutmaßliche Ozean unter der Eiskruste reich an Schwefelsäure sein könnte.[53]
Interstellare Vorkommen
Bislang wiesen Astronomen 13 verschiedene Schwefelverbindungen im interstellaren Raum nach. Darunter sind Kohlenstoffsulfid (CS), Schwefelmonoxid (SO), Siliciumsulfid (SiS), Carbonylsulfid (COS), Schwefelwasserstoff (H2S), Thioformaldehyd (H2CS) und Schwefeldioxid (SO2).[54][55] Astronomen haben die Hoffnung, mittels der Detektion von Schwefeldioxid Vulkanismus auf extrasolaren Planeten nachzuweisen.[56]
Die meisten Verbindungen wiesen sie in interstellaren Molekülwolken nach, deren Größe, Dichte und Temperatur die Bildung von Molekülen erlaubt und sie vor hochenergetischer Strahlung schützt. Der Nachweis der Verbindungen gelang den Wissenschaftlern mittels Radioteleskopie im Millimeter-Wellenlängenbereich.
Gewinnung

Schwefel wird entweder als elementarer Schwefel gewonnen, der zu über 90 % weiter zu Schwefelsäure verarbeitet wird, oder in Form seines Oxids durch Rösten von sulfidischen Erzen. Elementarer Schwefel wird weltweit gewonnen und gehandelt. Die größten Produktionsstandorte liegen in den Vereinigten Staaten von Amerika, Kanada, den Ländern der ehemaligen Sowjetunion und Westasien. Die Volksrepublik China ist der weltweit größte Importeur, gefolgt von Marokko und den Vereinigten Staaten. Kanada ist der größte Exporteur, gefolgt von Russland und Saudi-Arabien.[57]
Abbau geologischer Schwefelvorkommen

Schwefel kann aus geologischen Lagerstätten von elementarem Rohschwefel oder schwefelhaltigen Verbindungen in Kohlenwasserstoffquellen wie Erdöl, Erdgas und Kohle sowie aus sulfidischen Erzen von Schwermetallen gewonnen werden. In Form von Sulfaten steht Schwefel, zum Beispiel als Gips, in praktisch unbegrenzter Menge zur Verfügung. Die zurzeit ökonomisch zugänglichen Quellen werden insgesamt auf 5 × 1012 t Schwefel geschätzt. Weitere 600 × 1012 t Schwefel werden in Form von schwefelhaltiger Kohle, Ölschiefer und -sanden vermutet. In den USA betrug im Jahr 2007 die Menge des gewonnenen elementaren Schwefels 8,2 Millionen Tonnen.[58]
An Vulkanen und in ihrer Nähe kommen Fumarolen vor, die mit ihren Gasen neben Schwefelwasserstoff auch gasförmigen elementaren Schwefel ausstoßen, der beim Abkühlen an der Austrittsstelle kondensiert und Kristalle bildet. Im Mittelalter waren Ablagerungen von solchen Fumarolen auf Island, etwa Námafjall, eine wichtige Quelle für die Herstellung von Schießpulver in ganz Europa. In Ijen, einem Vulkankomplex im indonesischen Ost-Java, befindet sich eine Solfatare, die als größte Schwefellagerstätte Indonesiens gilt. Aus den dort etwa acht Meter dicken Schwefelbänken wird der Schwefel ausgebrochen und mit Bambuskörben aus dem Krater abtransportiert.
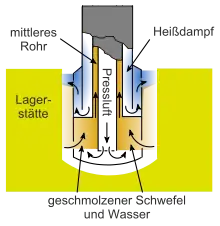
Unterirdische Schwefellagerstätten wurden mittels des von Hermann Frasch entwickelten Frasch-Verfahrens hauptsächlich in den USA und in Polen ausgebeutet. Dazu werden durch darüber liegende Schichten drei konzentrische Rohre in die Schwefellagerstätte getrieben. Durch eingespeistes überhitztes Wasser verflüssigt sich der Schwefel und wird durch eingepresste Luft an die Oberfläche befördert. Noch im Jahre 1995 betrug die jährliche Gewinnung nach diesem Verfahren 3,1 Millionen Tonnen.[59] Die wirtschaftlich abzubauenden Vorkommen sind jedoch selten geworden und die Energiekosten des Verfahrens sind ebenso immens wie die Umweltprobleme. In den USA wurde die Förderung des letzten Vorkommens nach diesem Verfahren im Jahr 2001 eingestellt.
Schwefelrückgewinnung
Heute fällt Schwefel in großen Mengen als Abfallprodukt bei der Abtrennung von Schwefelwasserstoff aus Erdgasen und vor allem bei der hydrierenden Entschwefelung von Erdöl in Raffinerien an, wobei der Schwefelwasserstoff mit Hilfe des Claus-Verfahrens zu flüssigem Schwefel oxidiert wird. Erdgas enthält bis zu 35 % Schwefelwasserstoff,[60] Erdöl enthält in schwefelarmer Form etwa 0,5 bis 1 % Schwefel, je nach Vorkommen beträgt der Gehalt bis zu 5 % Schwefel in Form von organischen Verbindungen.[61] Der grundlegende chemische Prozess der Schwefelrückgewinnung besteht aus zwei Schritten:[62] Im ersten Schritt verbrennt ein Drittel des Schwefelwasserstoffs zu Schwefeldioxid. Die verbleibenden zwei Drittel des Schwefelwasserstoffs reagieren mit dem Schwefeldioxid (SO2) unter Komproportionierung zu Schwefel.
Gewinnung als Schwefeldioxid
Die sulfidischen Erze des Eisens, Kupfers, Zinks, Bleis und anderer Metalle werden an Luft zum Metalloxid und Schwefeldioxid geröstet. Das entstehende Schwefeldioxid wird durch katalytische Oxidation zum Schwefeltrioxid aufoxidiert und direkt zu Schwefelsäure weiterverarbeitet. Die Darstellung aus Pyrit kann vereinfacht durch folgende Gleichungen beschrieben werden:
Beim Erhitzen des Pyrits unter Luftabschluss wird elementarer Schwefel gewonnen und FeS bleibt zurück. Das Verfahren war schon im Mittelalter bekannt.[63]
Lagerung und Distribution
Im Claus-Prozess fällt Schwefel flüssig an und wird meist auch in dieser Form gelagert und transportiert. Das hat gegenüber dem Umgang mit festem Schwefel eine Reihe von Kosten- und Qualitätsvorteilen, denn fester Schwefel muss vor der Verwendung ohnehin häufig verflüssigt werden. Bei der Lagerung von festem Schwefel kann sowohl durch Luftfeuchtigkeit als auch durch Schwefelbakterien unerwünschte Schwefelsäure gebildet werden. Durch Korrosion gebildetes Eisensulfid wirkt in feiner Verteilung pyrophor und kann Brände oder Explosionen verursachen.[64]
Flüssiger Schwefel wird bei 135 bis 140 °C abgefüllt; die Temperatur darf beim Transport 118 °C nicht unter- und 160 °C nicht überschreiten. Er wird durch Beheizung mit Niederdruckdampf von 3 bis 4 bar im flüssigen Zustand gehalten und per Schiff, in Kesselwagen oder in speziell ausgerüsteten Tankwagen sowie in beheizten Pipelines transportiert. Zuvor muss flüssiger Schwefel aus Sicherheitsgründen so weit wie möglich von Schwefelwasserstoff befreit werden.[65] Eine vollständige Entgasung ist meist nicht möglich. Das führt bei offenem Umgang mit flüssigem Schwefel zu Geruchsbelästigung und Gesundheitsgefahr. In Rohrleitungen eingefrorener Schwefel muss auf Grund des hohen Wärmeausdehnungskoeffizienten vorsichtig – konkret: langsam räumlich fortschreitend – aufgetaut werden, da zu schnelles Auftauen zum Bersten der Leitung führen kann.
Physikalische Eigenschaften
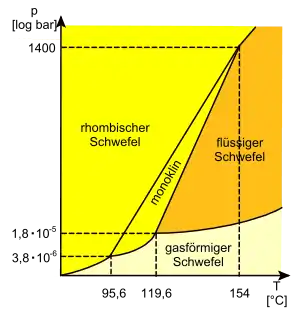
Die physikalischen Eigenschaften des Schwefels sind stark temperaturabhängig, da bei gegebener Temperatur eine Reihe allotroper Modifikationen vorliegen können. Wird Schwefel auf über 120 °C erhitzt, bildet sich zunächst eine niedrigviskose Flüssigkeit hellgelber Farbe, in der zunächst überwiegend S8-Ringe vorhanden sind. Wird die Temperatur gehalten, kommt es durch eine Teilumwandlung der S8-Ringe in kleinere und größere Ringe zu einer Schmelzpunkterniedrigung, die ihr Minimum bei 114,5 °C hat. Beim weiteren Erhitzen nimmt die Viskosität zunächst ab, um ab 160 °C stark anzusteigen. Das Viskostätsmaximum wird bei 178 °C erreicht, gefolgt von einer Abnahme bis zum Siedepunkt. Dabei brechen die Schwefelringe auf und bilden langkettige Moleküle, ein Beispiel einer ringöffnenden Polymerisation. Oberhalb von 180 °C zerfallen die Makromoleküle zunehmend in kleinere Bruchstücke und die Viskosität nimmt wieder ab. Schwefel ist das Element mit den meisten allotropen Modifikationen. Allotrope sind Festkörperphasen eines Elements, die sich in der Kristallstruktur und damit in ihrem Röntgenbeugungsmuster unterscheiden. Bislang sind etwa 30 verschiedene Schwefelallotrope bekannt. Die bei Normalbedingungen thermodynamisch stabile Form ist der orthorhombische Schwefel, der aus kronenförmigen S8-Ringen besteht.
Cyclooctaschwefel
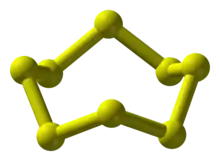
Natürlich vorkommender fester Schwefel kommt in drei allotropen Formen vor, die alle aus S8-Molekülen bestehen (α-, β- und γ-S8).
Die bei Raumtemperatur thermodynamisch stabilste Modifikation des Schwefels ist der orthorhombisch kristallisierende α-Schwefel. Er ist geruch- und geschmacklos und hat die typische schwefelgelbe Farbe. α-Schwefel kristallisiert orthorhombisch in der Raumgruppe Fddd (Nr. 70) mit den Gitterparametern a = 1044 pm, b = 1284 pm und c = 2437 pm sowie 16 Formeleinheiten S8 pro Elementarzelle.
α-Schwefel tritt gediegen als Schwefelblüte (Gelber Schwefel) in der Natur auf, hat eine Dichte von 2,0 g/cm³ bis 2,1 g/cm³, eine Härte von 1,5 bis 2,5 und eine hell- bis dunkelgelbe Farbe sowie eine weiße Strichfarbe. Meist zeigt er hellgelbe prismen- oder pyramidenförmige Kristalle, die sich auf Gesteinsflächen aus schwefelreichen Gasen durch unvollständige Oxidation von Schwefelwasserstoff oder Reduktion von Schwefeldioxid bilden.
Bei 95,6 °C liegt der Umwandlungspunkt zu β-Schwefel. Diese Schwefelmodifikation ist fast farblos und kristallisiert monoklin in der Raumgruppe P21/a (Nr. 14, Stellung 3) mit den Gitterparametern a = 1085 pm; b = 1093 pm; c = 1095 pm und β = 96,2° sowie 6 Formeleinheiten S8 pro Elementarzelle. Wird β-Schwefel auf 100 °C erhitzt und schnell auf Raumtemperatur abgekühlt, ist diese Modifikation mehrere Wochen beständig.
Seltener ist der ebenfalls monoklin kristallisierende γ-Schwefel (Rosickýit) mit der Raumgruppe P2/c (Nr. 13) und den Gitterparametern a = 844 pm; b = 1302 pm; c = 936 pm und β = 125,0° sowie 4 Formeleinheiten S8 pro Elementarzelle.[38][66] Das Mineral wird im Death Valley in den USA gefunden, wo es durch mikrobiologische Reduktion von Sulfat entsteht und stabilisiert wird.
Cyclohexaschwefel
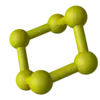
Cyclohexaschwefel S6, früher als Engels-Schwefel bezeichnet, liegt in einer Sessel-Konformation mit einer S–S–Bindungslänge von 206,8(2) pm, einem S–S–S–Bindungswinkel von 102,6(6)° und einem S–S–S–S-Torsionswinkel von 73.8(1)°[67] vor. Die orangefarbigen, rhomboedrischen Kristalle können nach verschiedenen Methoden hergestellt werden. Engel stellte bereits 1891 Cyclohexaschwefel durch Ansäuern einer Natriumthiosulfat-Lösung mit Salzsäure her.[68]
Die Dichte beträgt 2,21 g/cm³, der Schmelzpunkt liegt bei etwa 100 °C (unter Zersetzung). Unter Normalbedingungen wandelt sich Cyclohexaschwefel innerhalb weniger Tage in ein Gemisch von Cyclooctaschwefel und polymerem Schwefel um, vor allem im Licht.
Cycloheptaschwefel
Cycloheptaschwefel kann durch Reaktion von Cyclopentadienyl-Titan-pentasulfid mit Dischwefeldichlorid hergestellt werden.
- Cp = η5-C5H5
Cycloheptaschwefel liegt je nach Herstellungsbedingungen in vier verschiedenen intermolekularen allotropen Modifikationen vor (α-, β-, γ-, δ-Cycloheptaschwefel). Diese sind alle temperaturempfindlich und wandeln sich bei Temperaturen oberhalb von 20 °C schnell in die thermodynamisch stabile Form um. Bei einer Temperatur von −78 °C sind die Modifikationen jedoch längere Zeit haltbar. Die im Ring vorkommenden Schwefel-Schwefel-Bindungslängen liegen zwischen 199,3 und 218,1 pm.
Größere Schwefelringe

Größere Schwefelringe (Sn mit n = 9 – 15, 18, 20) können mittels der Cyclopentadienyl-Titan-pentasulfid-Methode oder durch Reaktion von Dichlorsulfanen SmCl2 mit Polysulfanen H2Sp gebildet werden.
Von Cyclononaschwefel S9 liegen vier intermolekulare Allotrope vor, von denen zwei, α- und β-Cyclononaschwefel genannt, charakterisiert sind.
Mit Ausnahme des Cyclododecaschwefels S12 sind die intramolekularen Bindungslängen und -winkel in den Schwefelmodifikationen unterschiedlich. Cyclododecaschwefel ist nach Cyclooctaschwefel die stabilste Modifikation. Von Cyclooctadecaschwefel S18 liegen zwei intermolekulare Modifikationen als Ring-Konformationsisomere vor.[69]
Polymerer Schwefel
Polymerer Schwefel besteht aus langen polymeren Schwefelketten, genannt Catenapolyschwefel. Die Natur der Endgruppe ist nicht bekannt. Das Polymer wird durch Erhitzen auf Temperaturen oberhalb von 120 °C und anschließendes schnelles Abkühlen in kaltem Wasser oder flüssigem Stickstoff gewonnen. Die maximale Kettenkonzentration findet sich bei Temperaturen zwischen 250 und 300 °C. Vorliegende Schwefelringe können mit Kohlenstoffdisulfid extrahiert werden.
Flüssiger Schwefel
Beim Erhitzen auf 119,6 °C schmilzt der β-Schwefel. Die Schmelze besteht anfangs aus Cyclooctaschwefel-Molekülen, so genanntem λ-Schwefel (Schwefelblüte, Sλ). Nach einer Zeit stellt sich ein Gleichgewicht zwischen den verschiedenen intramolekularen Allotropen in der Schmelze ein, wobei andere Ringe (v. a. S6, S7, S12) temperaturabhängig auftreten. Es treten auch wesentlich größere Ringe wie S50 sowie bei höheren Temperaturen Kettenstrukturen auf.
Bei weiterer Erhöhung der Temperatur nimmt die Konzentration der kleineren Ringe zunächst zu und die Viskosität ab, so genannter π-Schwefel mit Sn (6 ≤ n ≤ 25, n ≠ 8). Ab einer Temperatur von 159 °C beginnt der so genannte λ-Übergang, bei dem die Ringe durch thermische Anregung aufbrechen und durch Polymerisation lange Ketten bilden. Der polymere Schwefel erreicht sein Viskositätsmaximum bei 187 °C. Am λ-Übergang ändern sich eine Reihe physikalischer Eigenschaften, zum Beispiel die Viskosität, die optische Absorption und damit auch die Farbe. Es liegt so genannter ω-Schwefel vor. Wird dieser rasch abgekühlt, liegt er nach Extraktion mit Kohlenstoffdisulfid in fester Form als amorpher, plastischer μ-Schwefel vor, mit Sn (103 ≤ n ≤ 106).
Durch weiteres Erhitzen bis zum Siedepunkt bei 444,6 °C zerfallen die Ketten wieder in kleinere Bruchstücke, und die Viskosität der Schmelze nimmt ab.
Gasförmiger Schwefel
Gasförmiger Schwefel ist dunkelrot und besteht anfangs aus S8-Ringen, die bei höheren Temperaturen weiter aufbrechen. Bei einer Temperatur von 330 °C besteht der Dampf vorwiegend aus Cycloheptaschwefel S7. Bei Temperaturen oberhalb von 550 °C zerfallen die Ringe in kleinere Moleküle wie S2 – 4. Oberhalb von 700 °C enthält der Dampf vornehmlich S2-Moleküle und bei 1800 °C liegt Schwefel in Form einzelner Atome vor.
Die Erhitzung des gasförmigen Schwefels ist mit intensiven Farbänderungen verbunden. Zunächst hat der Schwefeldampf die gleiche gelbe Farbe wie eine Cyclooctaschwefelschmelze. Bei weiterem Erhitzen verändert sich die Farbe von gelb über orange und dunkelrot nach dunkelrotbraun. Das ist auf das Vorliegen der linearen S2 – 4-Spezies zurückzuführen.
Geladene Schwefelmoleküle
Neutrale Schwefelmoleküle können durch Oxidation beziehungsweise Reduktion die Oxidationsstufe ändern. Schwefelmoleküle mit der Oxidationsstufe +2 sind beispielsweise die hellgelben S42+-Kationen, die roten S162+-Kationen und die S82+-Kationen. Man erhält diese geladenen Schwefelmoleküle durch Reaktion mit Arsenpentafluorid oder Antimonpentafluorid:
Die Ringstruktur der Schwefelmoleküle bleibt hierbei erhalten, wobei sich die ursprüngliche Konformation jedoch ändert.
Cyclooctaschwefel kann durch Sulfidionen zu einem offenkettigen Nonasulfidion mit der Oxidationsstufe −2 reduziert werden. Dieses geladene Schwefelmolekül ist aber nicht stabil und spaltet sich leicht in kürzere kettenförmige Polysulfide auf.
Wasserfrei lassen sich solche Schwefelanionen durch Reduktion mit unedlen Metallen herstellen. Auch in diesem Fall wird die cyclische Struktur in eine kettenförmige Struktur verwandelt.
Chemische Eigenschaften

Schwefel ist ein reaktionsfreudiges Element und reagiert bei erhöhter Temperatur mit vielen Metallen außer Platin, Iridium und Gold unter Bildung von Sulfiden. Mit Quecksilber reagiert Schwefel bereits beim Verreiben bei Raumtemperatur zu Quecksilbersulfid. Mit Halb- und Nichtmetallen reagiert Schwefel bei erhöhter Temperatur. Ausnahmen sind Tellur, molekularer Stickstoff, Iod und Edelgase.[70]
An Luft entzündet sich Schwefel ab einer Temperatur von etwa 250 °C und verbrennt mit blauer Flamme unter Bildung von Schwefeldioxid. Der Zündpunkt kann durch im Schwefel gelöste Gase wie Schwefelwasserstoff und Schwefeldioxid gesenkt werden. An feuchter Luft bildet Schwefel im Laufe der Zeit Schwefelsäure und Schwefeldioxid.
Schwefel reagiert nicht mit nicht-oxidierenden Säuren, von oxidierenden Säuren wie Salpetersäure wird Schwefel zu Sulfat oxidiert. In alkalischer Lösung reagiert Schwefel unter Disproportionierung zu Sulfid und Sulfit. In sulfidischer Lösung löst sich Schwefel unter Bildung von Polysulfiden. In sulfithaltiger Lösung reagiert Schwefel zu Thiosulfat.
In der Organischen Chemie wird elementarer Schwefel zum Beispiel in der Asinger-Reaktion zur Darstellung von 3-Thiazolinen verwendet.[71] Die Gewald-Reaktion – ebenfalls eine Mehrkomponentenreaktion – ermöglicht die Synthese substituierter 2-Aminothiophene, ausgehend von elementarem Schwefel. Mit Grignard-Verbindungen reagiert Schwefel unter Bildung von Thioethern oder Thiolen.[72] Cyclohexan wird unter Freisetzung von Schwefelwasserstoff zu Benzol dehydriert.[72]
Isotope
Von Schwefel sind 23 Isotope zwischen 26S und 49S bekannt[73], von denen vier stabil sind: 32S (95,02 %), 33S (0,75 %), 34S (4,21 %) und 36S (0,02 %). Von den radioaktiven Isotopen hat nur das 35S-Isotop eine Halbwertszeit von 87,51 Tagen, für alle anderen Isotope liegt die Halbwertszeit im Bereich von Sekunden oder Millisekunden. Das 35S-Isotop entsteht aus 40Ar durch kosmische Strahlung.
Bei der Fällung von sulfidischen Mineralien kann es je nach Temperatur und pH-Wert zu unterschiedlichen Isotopenverteilungen zwischen Feststoff und Mutterlösung kommen. Die Bestimmung der Schwefel-Isotopenverteilung im Mineral lässt daher Rückschlüsse auf die Bildungsbedingungen zu.[74] Beim Abbau von Sulfaten durch bakterielle Sulfatreduktion kommt es zu einer Isotopenfraktionierung des Schwefels. Die Untersuchung der Schwefel-Isotopenverteilung im gelösten Sulfat lässt daher Rückschlüsse auf biologische Reduktionsprozesse zu.[75]
Verwendung
Schwefel wird sowohl in der chemischen Industrie als auch in der pharmazeutischen Industrie genutzt, unter anderem zur Produktion von Schwefelsäure, Farbstoffen, Pestiziden und Kunstdüngern.
Herstellung von Schwefelsäure
Der mengenmäßig größte Teil des Schwefels, etwa 90 %, wird zur Herstellung von Schwefelsäure mittels des Kontaktverfahrens verwendet. Dabei wird im ersten Schritt durch Verbrennen von Schwefel oder durch das Rösten von Metallsulfiden Schwefeldioxid hergestellt. Dieses wird mit Luft in einer Gleichgewichtsreaktion an einem Vanadiumpentoxid-Katalysator zu Schwefeltrioxid umgesetzt.[76]
Etwa 60 % der Schwefelsäure wird zur Herstellung von Düngemitteln verwendet.[77] Beim Aufschluss von Rohphosphat mit Schwefelsäure entsteht Superphosphat, ein Gemisch aus Calciumdihydrogenphosphat (Ca(H2PO4)2) und Calciumsulfat (CaSO4 · 2H2O).
Weitere schwefelhaltige Dünger sind Ammoniumsulfat und Kaliumsulfat. Daneben dient die Schwefelsäure zum Aufschluss von Erzen, der Herstellung von Caprolactam, als Katalysator bei der Alkylierung von Olefinen, zur Herstellung anderer Säuren wie Fluorwasserstoff sowie in der Papierherstellung nach dem Sulfat-Verfahren. Daneben findet Schwefelsäure Anwendung in zahlreichen anderen Prozessen, wie etwa der Herstellung von Phenol und Aceton nach dem Cumolhydroperoxid-Verfahren.
Gasförmiges Schwefeltrioxid findet weite Verwendung bei der Herstellung von Tensiden durch Sulfonierung von Dodecylbenzol zu Dodecylbenzolsulfonsäure sowie der Sulfatierung von Fettalkoholen und deren Ethoxylaten.[78]
Vulkanisation von Kautschuk

Reiner Schwefel wird sehr häufig bei der Vulkanisation von Kautschuk verwendet. Dazu wird Rohkautschuk mit Schwefel oder schwefelhaltigen Verbindungen versetzt, ein Verfahren, das schon 1839 von Charles Goodyear entwickelt wurde. Die Kautschukpolymerketten werden dadurch unter Ausbildung von Sulfidbrücken aus einem oder mehreren Schwefelatomen vernetzt und so besonders widerstandsfähig gemacht. Der Markt für vulkanisierbare Elastomere in den Vereinigten Staaten betrug im Jahr 2001 5,7 Milliarden US-Dollar.[79]
Medizinische Anwendungen/Kosmetik
Im Europäischen Arzneibuch wird nur Schwefel zur äußeren Anwendung (Sulfur ad usum externum) geführt.[80] Der pulverförmige Schwefel bildet auf der Haut Schwefelwasserstoff und andere Sulfide, welche wiederum bakteriostatisch wirken. Bei oraler Einnahme kommt eine laxierende Wirkung hinzu. Schwefel wirkt darüber hinaus fungizid und kann Parasiten abtöten. Schwefel wurde vor allem in der Vergangenheit zur Behandlung von Acne vulgaris, von Skabies und von oberflächlichen Mykosen verwendet.[81] Die Anwendung erfolgt meist in Form von Seifen, Salben und Gelen.[82] In Kosmetikprodukten wird er in der Liste der Inhaltsstoffe als COLLOIDAL SULFUR (INCI)[83] angegeben.
Homöopathie
Sulfur (Kürzel Sulph) gilt in der Homöopathie als eine der vierzehn wichtigsten Grundsubstanzen.
Verwendung in der Stahlindustrie
In der Schwerindustrie ist Schwefel als Legierungselement für Stahl bedeutend. Automatenstähle, die für die spanenden Fertigungsverfahren wie Drehen und Bohren optimiert sind, sind oft schwefellegiert. Durch den Schwefelzusatz entstehen weiche, zeilenförmig ausgeprägte Mangansulfideinschlüsse im Stahl, die zu erhöhtem Spanbruch führen.
An Luft, besonders bei erhöhter Feuchtigkeit, entwickelt Schwefel leicht Schwefeldioxid und bei weiterer Oxidation Schwefelsäure. Das kann zu Korrosion und Schäden an Stahlkonstruktionen oder Lagertanks führen.[84]
Katalysatorgift
Schwefelspezies in Kohlenwasserstoffen sind starke Katalysatorgifte, die schon in geringer Konzentration wirksam sind. Schwefel reagiert mit den katalytisch aktiven Metall- und anderen Oberflächenzentren der Katalysatoren. Die Vergiftung kann reversibel oder irreversibel sein und der Katalysator kann dabei in seiner Selektivität verändert oder insgesamt deaktiviert werden. Einige Katalysatoren, wie Platin-Rhenium-Katalysatoren für das Katalytische Reforming, werden selektiv mit Schwefel beaufschlagt, um die Anfangsaktivität des Katalysators zu beeinflussen.[85]
Bei älteren Drei-Wege-Katalysatoren wurde als Sulfat auf dem Katalysator gespeicherter Schwefel beim Betrieb im Luftunterschuss als Schwefelwasserstoff freigesetzt.[86] Bei Fahrzeugen mit Magermix-Ottomotor und Speicher-Kat kann es durch Sulfatbildung zu einer Deaktivierung des Katalysators kommen. Zur Regeneration wird die Abgastemperatur auf 650 Grad Celsius erhöht und das gespeicherte Sulfat als Schwefeldioxid emittiert.
Sonstiges

Schwefel findet bei der Herstellung von Schwarzpulver, als Salpeterschwefel in der Feuerwerkerei, oder bei anderen Explosivstoffen Verwendung.
Beim so genannten Schwefeln handelt es sich um eine Konservierungsmethode für Lebensmittel, wie z. B. Wein oder Trockenobst, mittels Schwefeldioxid oder Schwefelsalzen, wobei deren reduktive Eigenschaften (Antioxidans) genutzt werden. Früher wurde das Schwefeln von Wein durch das Abbrennen von Schwefel in leeren Weinfässern erreicht, heute wird Kaliumpyrosulfit zugegeben, welches in saurer Lösung Schwefeldioxid freisetzt.
Als protektives Kontaktfungizid wirkt Schwefel vorbeugend durch Kontakt an der Pflanzenoberfläche, wo es langsam zu Schwefeldioxid oxidiert wird und die Sporenkeimung hemmt.[87] Verbreitet ist der Einsatz im Weinbau gegen den an der Blattoberfläche wachsenden Echten Mehltaupilz.

Der Farbstoff Ultramarin wird durch das Verbrennen eines Gemisches aus Schwefel, Kaolin, Natriumsulfat, Soda und Aktivkohle erhalten. Die tiefblaue Farbe des Ultramarins rührt von in Sodalith-Käfigen eingesperrten Polysulfid-Radikalionen des Typs •S3− her[88], die für die Farbgebung im Lapislazuli verantwortlich sind.
Eine weitere Entwicklung ist die Natrium-Schwefel-Zelle, ein wiederaufladbarer Akkumulator, der primär bei kleineren bis mittleren stationären Batterie-Speicherkraftwerken in Japan Anwendung findet. Die Zelle arbeitet bei einer Temperatur von circa 300 bis 350 °C. Als positive Elektrode dient flüssiger Schwefel, als fester Elektrolyt eine Keramik aus Natrium-β-aluminat (NaAl11O17) und als negative Elektrode flüssiges Natrium. Die elektrochemische Bruttoreaktion ist:
Schwefel oder Schwefelverbindungen werden als Schmierstoffadditive eingesetzt. Die in Drahtziehereien eingesetzten Ziehfette bestanden aus natürlichen Fetten, denen Schwefelblüte beigemischt wurde. Dieses bildet auf der Metalloberfläche eine Schicht von Metallsulfiden, bei Eisen etwa Eisen(II)-sulfid (FeS), Eisen(II)-disulfid (FeS2) oder Eisen(III)-sulfid (Fe2S3), die als Schmierstoff wirken.[89] Molybdän(IV)-sulfid ist unter dem Handelsnamen Molykote bekannt und dient auf Grund seiner graphitartigen Struktur als festes Schmiermittel. Als Extreme-Pressure-Additiv werden Schwefelverbindungen noch heute Schmierstoffen beigefügt.
Organische Chemie
In der organischen Chemie wird Schwefel zur Synthese von 3-Thiazolinen in der Asinger-Reaktion – einer Mehrkomponentenreaktion – benutzt.[90]
Physiologie
-Cystine_BLUE_Structural_Formula.png.webp)
Schwefelverbindungen kommen in allen Lebewesen vor und haben eine Vielzahl von Funktionen. Schwefel wird als Sulfid oder Sulfat von Pflanzen und Bakterien aus der Umgebung assimiliert und zu organischen Schwefelverbindungen aufgebaut, die letztlich von Tieren mit der Nahrung aufgenommen werden.
Vorkommen und Funktion in Lebewesen
Schwefel ist in den proteinogenen Aminosäuren Cystein und Methionin – und in allen darauf aufbauenden Peptiden, Proteinen, Koenzymen und prosthetischen Gruppen – in Form von Thiolgruppen (Oxidationsstufe +II) oder Thioethergruppen enthalten. Andere schwefelhaltige Aminosäuren mit biologischer Funktion sind Cystin und Homocystein. Weiterhin ist er in einigen Cofaktoren (Biotin, Thiaminpyrophosphat) in heterozyklischer Bindung enthalten. Schwefel ist damit ein essentielles Element lebender Zellen. Disulfidbrückenbindungen sind weit verbreitet und tragen einerseits zur Ausbildung und Stabilisierung von Proteinstrukturen (z. B. im Keratin menschlicher und tierischer Haare und Federn) bei, andererseits basieren viele Redoxreaktionen in Zellen auf der Umkehrbarkeit dieser Bindung (in Thioredoxin und Glutathion). In oxidierter Form spielt Schwefel in der Aminosulfonsäure Taurin (Oxidationsstufe +IV) eine biologische Rolle.
Der Gesamtschwefelgehalt des menschlichen Körpers liegt bei etwa 0,25 %, wobei der Gehalt je nach Gewebeart schwanken kann. In den Globinen von Säugetieren wurde ein Gesamtschwefelgehalt zwischen 0,37 % beim Schwein und 0,6 % beim Menschen bestimmt.[91] Zum Beispiel besteht Keratin im Horn von Pferden bis zu 5 % aus Schwefel.[92]
Schwefelhaltige Pflanzenstoffe wie die Cysteinsulfoxide Methiin, Alliin, Isoalliin und Propiin können bis zu 5 % der Trockenmassen von Pflanzen, zum Beispiel bei den als Gewürzmittel genutzten Pflanzen der Gattung Allium wie Knoblauch und Zwiebel, ausmachen.[93] Daneben entstehen durch enzymatische Aktivität oder Oxidation an Luft sekundäre Aromakomponenten wie Diallyldisulfid oder Allicin, die zum Teil für den typischen Geruch und Geschmack dieser Pflanzen verantwortlich sind.[94]
Übergangsmetallsulfide, besonders die des Eisens, bilden die aktiven Zentren einer Reihe von Enzymen. So sind die Ferredoxine eisen- und schwefelhaltige Proteine, die als Elektronenüberträger in metabolischen Reaktionen teilnehmen. Das Ferredoxin im menschlichen Metabolismus wird Adrenodoxin genannt. Komplexe Metalloenzyme wie Nitrogenase, das in der Lage ist, elementaren, molekularen Stickstoff (N2) zu reduzieren, sowie Hydrogenase und Xanthinoxidase, weisen Eisen-Schwefel-Cluster auf.
Aufnahme
Der für alle genannten Stoffe notwendige Schwefel wird von Tieren je nach Ernährung als schwefelhaltige Aminosäuren und Vitamine mit der Nahrung aufgenommen. Pflanzen und Bakterien wiederum sind in der Lage, Schwefel als Sulfid oder Sulfat zu assimilieren und die genannten Aminosäuren und Vitamine selbst zu synthetisieren.
Im Pflanzenbau werden je nach Pflanzenart etwa 15 bis 50 kg Schwefel pro Hektar in Form schwefelhaltigen Düngers benötigt. Ölpflanzen, Hülsenfrüchte, verschiedene Futterpflanzen und Gemüse benötigen dabei größere Schwefelmengen.[95]
Sulfidoxidation
Einige Untergruppen der Proteobakterien, zusammen die farblosen schwefeloxidierenden Bakterien genannt, können Schwefelverbindungen und Schwefel oxidieren und aus diesen exergonen Reaktionen Energie gewinnen; siehe dazu exemplarisch das Riesenbakterium Thiomargarita namibiensis. Außerdem sind die Grünen Schwefelbakterien in der Lage, Photosynthese zu betreiben, indem sie Schwefelwasserstoff, Schwefel oder Thiosulfat an Stelle von Wasser (H2O) als Elektronendonator für die Reduktion von CO2 verwenden. Diese Art von Photosynthese erzeugt keinen Sauerstoff („anoxygen“). Zuletzt können einige Cyanobakterien diesen Stoffwechselweg benutzen. Zwar haben Pflanzen und Tiere in ihren Mitochondrien Enzyme für die Oxidation von Sulfid, diese kommen aber nur noch zur Entgiftung des beim Abbau überschüssigen Cysteins und im Darm entstehenden Schwefelwasserstoffs zum Zuge.[96][97]
Schwefel-Assimilation in Pflanzen
Der Schwefel wird bei Gefäßpflanzen als Sulfat über die Wurzeln aufgenommen und über das Xylem in die Blätter transportiert, wo der überwiegende Teil der Assimilation gekoppelt an die Photosynthese in den Chloroplasten der Mesophyllzellen stattfindet. Die Assimilationsrate beträgt dabei nur rund fünf Prozent der Nitrat-Assimilation und ein bis zwei Promille der CO2-Assimilation. Das Grundschema gleicht dabei der Nitrat-Assimilation, der Energieverbrauch ist aber beim Schwefel wesentlich höher.[98]
Das Sulfat wird zunächst zu Sulfit reduziert, dieses dann weiter zu Schwefelwasserstoff. Dieser wird in Cystein gebunden, der ersten stabilen Verbindung der Schwefel-Assimilation:[98]
Sulfat muss im Chloroplasten zunächst aktiviert werden. Das Enzym Sulfat-Adenylyltransferase bildet aus Sulfat und ATP AMP-Sulfat (APS) und Pyrophosphat. Das Gleichgewicht dieser Reaktion liegt stark auf der Seite des ATP, die Bildung von APS ist nur möglich durch die hohe Aktivität der Pyrophosphatase in den Chloroplasten. Anschließend hängt die APS-Kinase an den Ribose-Rest der APS einen weiteren Phosphat-Rest an und bildet das 3-Phospho-AMP-Sulfat (PAPS). Das derart aktivierte Sulfat wird durch die PAPS-Reduktase unter Mitwirkung von Thioredoxin zu Sulfit reduziert, das im Zuge dieser Reaktion vom 3-Phospho-AMP abgespalten wird.[98]
Die Sulfit-Reduktase gleicht in ihrem Aufbau der Nitritreduktase, sie enthält ein Sirohäm und ein 4-Eisen-4-Schwefel-Zentrum. Unter Verbrauch von sechs reduzierten Ferredoxin bildet sie Schwefelwasserstoff. In heterotrophem Gewebe wie Wurzeln wird das reduzierte Ferredoxin nicht durch die Photosynthese bereitgestellt, sondern durch NADPH reduziert.[98]
Um den Schwefelwasserstoff an Serin binden zu können, muss dieses zunächst aktiviert werden. Das geschieht durch die Serin-Transacetylase, die einen Acetylrest von Acetyl-Coenzym A auf das Serin überträgt. Für die Bildung des Acetyl-Coenzym A werden zwei energiereiche Phosphate verbraucht. Der Schwefelwasserstoff wird schließlich durch die O-Acetylserin-(thiol)-Lyase auf das O-Acetylserin übertragen, wobei Cystein und Acetat entstehen.[98]
Umweltaspekte
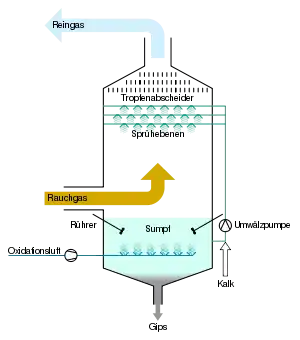
Bei der Energiegewinnung aus fossilen Brennstoffen wie Steinkohle, Braunkohle und Erdöl werden große Mengen Schwefeldioxid SO2 freigesetzt. Dieses bleibt als Gas oder im Wasser der Wolken gelöst zunächst in der Erdatmosphäre. Auch bildet es einen Bestandteil des gesundheitsgefährdenden Smogs. Abgebaut werden kann es, indem es von Sauerstoff zu Schwefeltrioxid SO3 oxidiert wird und als Schwefelsäure H2SO4 mit dem Regen ausgespült wird.[70] Daraus ergibt sich ein weiteres Problem, da diese als Bestandteil des sauren Regens zur Versauerung der Böden beiträgt.
Seit den 1970er-Jahren sind deshalb Maßnahmen zur Rauchgasentschwefelung (REA) in Deutschland gesetzlich vorgeschrieben. Das geschieht meist durch Kalkwäsche. Dabei werden die Rauchgase in einem Absorber mit Calciumhydroxid-Lösung besprüht, wodurch sich das Schwefeldioxid unter Weiteroxidation in Calciumsulfat (Gips) umsetzt.
Daneben wird seit einigen Jahren die Entschwefelung von Fahrzeugkraftstoffen forciert. Durch diese Vorschriften und ihre Umsetzungen konnten die Schwefel(dioxid)emissionen seit den 1960er-Jahren drastisch reduziert werden.
Erdgas und Kokereigas enthalten ab Quelle variierende Mengen an Schwefelwasserstoff. Niedrigsiedendes Benzin enthält von Natur aus praktisch keinen Schwefel. Höhersiedende Erdölfraktionen wie Diesel und schwerere Öle enthalten typisch mehr Schwefel, etwa als Thiole. Heizöl extraleicht, das in Wohnungen verheizt wird, und Dieseltreibstoff, der ebenfalls zivilsationsnah und auf Land verbraucht wird, wurden in Europa ab etwa 1999 im Schwefelgehalt reduziert. Heiz- und Kraftwerke setzen am Land große Mengen Schweröl mit vergleichsweise hohem Schwefelgehalt um und werden verfahrenstechnisch zweckmäßig im Rauchgas entschwefelt. Da Schiffsdiesel, die ebenfalls Schweröl verbrennen, auf See eher landfern emittieren, wurden hier erst spät, ab 2012, Emissionslimits für Schwefel (SO2) vorgeschrieben; auch hier wird erst im Abgas entschwefelt.
Durch sauberere Verfahren wurde die Produktion von Sulfitzellulose in Papierfabriken und Viskosefaser geruchsärmer. In den 1970er Jahren war kilometerweiter Geruch vom hohen Schlot des Chemiefaserwerks Lenzing noch üblich und diente Anrainern am Attersee als Schönwetter-Windrichtungsanzeiger. Geruchsträger sind hier Thiole und Schwefelwasserstoff.
Die Internationale Seeschifffahrts-Organisation (IMO) hat die Grenzwerte für Schiffsabgase von 4,5 Prozent Schwefel ab 2012 auf 3,5 Prozent und ab 2020 auf 0,5 Prozent festgelegt. Für die Nord- und Ostsee wurde ein Schwefelanteil in den Abgasen von 0,1 Prozent ab 2015 festgelegt.[99]
In Glencores Kupfermine Mopani Copper Mines ist die Situation nach wie vor dramatisch (Stand Juni 2019).[100]
Nachweis
Es existieren verschiedene Nachweisreaktionen für Schwefel.
- Schwefel wird in Verbindungen nach Reduktion durch elementares Natrium in Natriumsulfid überführt. Sulfid-Anionen werden mit Blei(II)-salzlösungen nachgewiesen, wobei ein schwarzer Niederschlag von Blei(II)-sulfid entsteht:
- Beim Ansäuern von festen, also ungelösten Sulfiden entsteht zudem ein charakteristischer Geruch nach faulen Eiern (H2S-Gasverdrängungsreaktion). Das Gas schwärzt Bleiacetatpapier.
- Durch Oxidation schwefelhaltiger Verbindungen entstehen Sulfit und Sulfat. Letzteres wird mit Barium(II)-Salzlösungen nachgewiesen. Es entsteht ein weißer Niederschlag von Bariumsulfat:
- Sulfit wird mit Kaliumhydrogensulfat nachgewiesen. Beim Verreiben der auf Sulfit zu prüfenden Substanz mit Kaliumhydrogensulfat entsteht das stechend riechende Schwefeldioxid. Für Natriumsulfit ergibt sich folgende Reaktionsgleichung:
- Zur quantitativen Bestimmung geringer Schwefelmengen eignet sich die Methode nach Wickbold.
- In der Kernspinresonanzspektroskopie wird der 33S-Kern genutzt, um Schwefel in Form von Sulfaten und Sulfiten nachzuweisen. Der Kern weist nur eine geringe Empfindlichkeit und geringes natürliches Vorkommen auf.[101]
- In der Gaschromatografie kann durch die Kombination mit Chemilumineszenz- oder Plasma-Emissionsdetektoren Schwefel selektiv bestimmt werden. Zur Bestimmung des Gesamtschwefelgehaltes von organischen Verbindungen können diese zunächst katalytisch in Schwefelwasserstoff überführt werden, welcher flammenphotometrisch detektiert wird.[102]
Verbindungen
In Verbindungen tritt Schwefel in allen Oxidationsstufen zwischen −II (Sulfide) und +VI (Sulfate, Schwefeltrioxid und Schwefelsäure) auf.
Wasserstoffverbindungen


Schwefelwasserstoff (H2S) ist ein farbloses, in geringen Konzentrationen nach faulen Eiern riechendes, giftiges Gas, das durch Reaktion von Sulfiden (MxSy) mit starken Säuren, zum Beispiel Salzsäure (HCl), entsteht. Es kommt als natürlicher Begleiter von Erdgas vor und entsteht in großen Mengen bei der Hydrodesulfurierung von Erdölfraktionen. Schwefelwasserstoff ist eine schwache Säure. Es ist brennbar, farblos und in Wasser wenig, in Alkohol etwas besser löslich. Schwefelwasserstoff und Metalloxide oder -hydroxide bilden Sulfide wie Zinnober (HgS) und Bleisulfid (PbS). Die Schwerlöslichkeit der Schwermetallsulfide wird in der analytischen Chemie im Trennungsgang zur Fällung der Metalle der Schwefelwasserstoffgruppe genutzt.
Disulfan (H2S2) ist eine unbeständige Flüssigkeit. Sie bildet jedoch viele Salze wie zum Beispiel Pyrit. Ihre Salze (Disulfide) enthalten das Anion S22−.[103] Disulfan ist das erste Glied der homologen Reihe der Polysulfane.
Oxide
Schwefeldioxid ist das Anhydrid der Schwefligen Säure und ein farbloses, schleimhautreizendes, stechend riechendes und sauer schmeckendes, giftiges Gas. Es ist sehr gut wasserlöslich und bildet mit Wasser in sehr geringem Maße Schweflige Säure.[104]
Schwefeltrioxid ist das Anhydrid der Schwefelsäure. Es bildet bei Normbedingungen farblose, nadelförmige Kristalle, die äußerst hygroskopisch sind und sehr heftig mit Wasser reagieren. Bei 44,45 °C siedet Schwefeltrioxid.
Schwefelmonoxid ist nur in verdünnter Form beständig. In konzentrierter Form wandelt es sich schnell in Dischwefeldioxid um. Es wurde im interstellaren Raum nachgewiesen.
Sauerstoffsäuren und Salze
Schwefel bildet eine Reihe von Oxosäuren, von denen die Schwefelsäure die mit Abstand größte technische Bedeutung hat. Die vorkommenden Oxidationsstufen reichen von +VI (Schwefelsäure) bis nahezu 0 (Oligosulfandisulfonsäuren, HSO3SxSO3H).[105] Die Säuren sind nicht alle in Reinform zu isolieren, bilden aber eine Reihe von Salzen und deren Hydrido-Isomeren. So ist Schweflige Säure als Reinstoff nicht zu isolieren, Sulfit- und Hydrogensulfitsalze dagegen sind als stabile Verbindungen bekannt.
| Säuren des Typus H2SOn | |||
|---|---|---|---|
| Oxidationsstufe des Schwefels | Struktur | Säuren | Salze |
| +II | Sulfoxylsäure H2SO2 | Sulfoxylate | |
| +IV | Schweflige Säure H2SO3 | Sulfite | |
| +VI |  | Schwefelsäure H2SO4 | Sulfate |
| +VI | 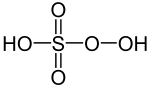 | Peroxo(mono)schwefelsäure H2SO5 | Peroxosulfate |
| Säuren des Typus H2S2On | |||
|---|---|---|---|
| Mittlere Oxidationsstufe des Schwefels | Struktur | Säuren | Salze |
| +I | Thioschwefelige Säure H2S2O2 | Thiosulfite (unbekannt) | |
| +II | 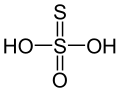 | Thioschwefelsäure H2S2O3 | Thiosulfate |
| +III | Dithionige Säure H2S2O4 | Dithionite | |
| +IV |  | Dischweflige Säure H2S2O5 | Disulfite |
| +V |  | Dithionsäure H2S2O6 | Dithionate |
| +VI | 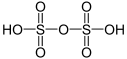 | Dischwefelsäure H2S2O7 | Disulfate |
| +VI | 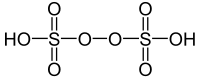 | Peroxodischwefelsäure H2S2O8 | Peroxodisulfate |
Stickstoffverbindungen
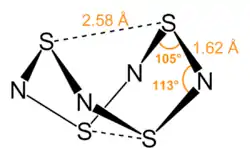
Tetraschwefeltetranitrid S4N4 ist ein goldroter Feststoff, der als Ausgangsverbindung für verschiedene Schwefel-Stickstoff-Verbindungen dient.[106][107]
Dischwefeldinitrid S2N2 liegt in Form eines viergliedrigen, rechteckig-planaren Ringes vor. Die Verbindung kann durch Reaktion von Tetraschwefeltetranitrid mit Silber gewonnen werden.
Polythiazyl (SN)x war das erste anorganische Polymer mit elektrischer Leitfähigkeit. Bei sehr niedrigen Temperaturen unterhalb von 0,26 K ist das Material supraleitend. Polythiazyl wird aus Dischwefeldinitrid gewonnen.[108]
Schwefelstickstoff (SN) wurde als Bestandteil von intergalaktischen Molekülwolken nachgewiesen. Im Labor kann es durch elektrische Entladungen in einem Stickstoff-Schwefel-Gas gewonnen werden.
Halogenverbindungen
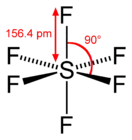
Schwefelhalogenide des Typs SXn (n = 2, 4) sind von Fluor und Chlor bekannt, Fluor bildet außerdem ein Hexafluorid. Daneben ist eine Reihe von gemischten Halogenverbindungen bekannt. Sauerstoff-Halogenverbindungen des Typs SOX2 (Thionylhalogenide), SO2X2 (Sulfurylhalogenide) und SOX4 sind bekannt. Vom Iod ist nur eine Iodpolysulfanverbindung des Typs I2Sn bekannt.[109]
Schwefelfluoride
Schwefelhexafluorid (SF6) ist ein farb- und geruchloses, ungiftiges Gas, das unbrennbar ist und sich äußerst reaktionsträge verhält. Es wird unter anderem als Isoliergas in der Mittel- und Hochspannungstechnik eingesetzt.[110] Das Gas wird als Tracer zum Nachweis der Windströmungen und bei Geruchsausbreitungsuntersuchungen eingesetzt. Wegen des hohen Treibhauspotenzials ist der Einsatz aber umstritten.[111]
Dischwefeldecafluorid (S2F10) ist eine farblose Flüssigkeit mit Geruch nach Schwefeldioxid.[112]
Schwefeltetrafluorid (SF4) ist ein farbloses, nicht brennbares Gas mit stechendem Geruch. Es zersetzt sich in Wasser unter Bildung von Fluorwasserstoff. Es wirkt als schwache Lewis-Säure und bildet zum Beispiel 1:1-Addukte mit organischen Basen wie Pyridin und Triethylamin.[113]
Schwefeldifluorid (SF2) ist ein farbloses Gas, das schnell zu Dischwefeldifluorid (S2F2) dimerisiert. Das letztere liegt in Form von zwei gasförmigen Isomeren vor, dem Thiothionylfluorid (S=SF2) und dem Difluordisulfan (FSSF).
Schwefelchloride
Dischwefeldichlorid (S2Cl2) wird durch Chlorierung von elementarem Schwefel gewonnen.[114] Dischwefeldichlorid wird zur Herstellung von Kautschuk-Vulkanisationsmitteln sowie anderen organischen Schwefelverbindungen verwendet. Es dient als Katalysator bei der Chlorierung von Essigsäure.
Schwefeldichlorid (SCl2), eine tiefrote Flüssigkeit, wird durch Umsetzung von Dischwefeldichlorid mit Chlorgas hergestellt. Es wird gelöst in Schwefelkohlenstoff (CS2) zur Kaltvulkanisation von Kautschuk verwendet. Im Ersten Weltkrieg wurde Schwefeldichlorid zur Herstellung des Kampfstoffes S-Lost verwendet.
Schwefeltetrachlorid (SCl4) wird durch direkte Chlorierung von Schwefel mit Chlor hergestellt. Es ist im festen Zustand und unter −30 °C stabil, darüber zersetzt es sich, wobei Chlor und Schwefeldichlorid entstehen.
Gemischte Schwefelhalogenide und Oxohalogenide
Schwefelpentafluorchlorid (SF5Cl), ein farbloses Gas, dient in der präparativen Chemie zur Darstellung von organischen Komponenten mit Kohlenstoff-Schwefel-Doppel- und Dreifachbindungen.[115]
Schwefelpentafluorbromid (SF5Br), ein farbloses Gas, kann aus Schwefeltetrafluorid, Silber(II)-fluorid und elementarem Brom hergestellt werden.
Die Thionylhalogenide OSX2 sind vom Fluor, Chlor und Brom bekannt, die Sulfurylhalogenide vom Fluor und Chlor.[116]
Organische Verbindungen
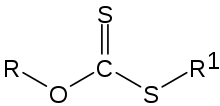
Organoschwefelverbindungen sind organische Verbindungen, die Schwefel enthalten. Die Struktur, das Vorkommen und die Anwendungen der Organoschwefelverbindungen sind vielfältig. Viele Naturstoffe, darunter zwei essentielle Aminosäuren, sind organische Schwefelverbindungen. Organische Schwefelverbindungen treten in fossilen Brennstoffen, etwa in Form von Thiolen oder Thioethern auf. Anionische Tenside sind Natrium- oder Ammoniumsalze von Sulfonsäuren oder Schwefelsäurehalbestern. In der Flotationstechnik eignen sich bestimmte Schwefelverbindungen wie Xanthogenate, Dithiophosphorsäureester, Mercaptane oder Alkylsulfonate als so genannte Sammler.
Die Kohlenstoff-Schwefel-Einfachbindung ist sowohl länger als auch schwächer als die Kohlenstoff-Kohlenstoff-Bindung. Die Bindungslängen liegen zwischen 183 pm in Methanthiol und 174 pm in Thiophen.[117] Die Dissoziationsenergie der Kohlenstoff-Schwefel-Bindung beträgt für Thiomethan 312,5 kJ/mol,[118] die Dissoziationsenergie für Dimethylsulfid und Dimethylether 305 und 322 kJ/mol.
Die organische Chemie des Schwefels ist vielfältig. Praktisch zu allen Kohlenstoff-Sauerstoff-Verbindungen bestehen die organischen Schwefel-Analoga. Diese unterscheiden sich in ihren Reaktionen oft beträchtlich von den Sauerstoffverbindungen.
Bekannte Organoschwefelverbindungen sind Thiole, die auch Mercaptane genannt werden. Thiole entstehen beispielsweise bei der Umsetzung von Kaliumhydrogensulfid mit Alkylhalogeniden. Die Alkylierung von Thioharnstoff mit Alkylhalogeniden und anschließender Umsetzung mit Natronlauge führt ebenfalls zu Thiolen und Freisetzung von Harnstoff. Thiole sind Bestandteil vieler Naturstoffe wie den Abwehrstoffen des Stinktiers (3-Methylbutanthiol) und weisen oft einen unangenehmen Geruch auf. Sie lassen sich leicht durch Oxidation in Disulfide oder über die Stufen der Sulfensäuren und Sulfinsäuren in Sulfonsäuren überführen. Disulfid-Brücken stabilisieren die Struktur von Proteinen und Peptidhormonen wie Insulin. Beim Legen einer Dauerwelle werden die Cystinbindungen im Keratin durch Reduktion mit Thioglycolsäure aufgebrochen. Danach werden die Haare in die gewünschte Form gebracht. Durch nachfolgende Oxidation der Thiolgruppen im Keratin mit Wasserstoffperoxid zu Disulfidbrücken werden die Haare in dieser neuen Form fixiert. Knoblauch, Lauch und andere Pflanzen enthalten eine Reihe von schwefelorganischen Wirkstoffen wie Alliin, die antibiotische Eigenschaften aufweisen.
Thioether lassen sich beispielsweise durch die Reaktion von Alkalisulfid mit Alkylhalogeniden oder durch die Pummerer-Umlagerung herstellen. Mit Alkylhalogenid im Überschuss entstehen Trialkylsulfoniumsalze. Thioether lassen sich leicht zu Sulfoxiden und Sulfonen oxidieren. Sulfoxide mit zwei unterschiedlichen Alkylresten sind am Schwefelatom chiral. Das freie Elektronenpaar fungiert dabei als vierter Substituent.[119]
Als heterocyclische Verbindung ist zum Beispiel Thiophen bekannt. Kohlenstoff-Schwefel-Sauerstoff-Verbindungen wie Sulfoxide, die wie Dimethylsulfoxid als Lösungsmittel verwendet werden, sind verbreitet. Sulfonsäuren beziehungsweise deren Salze, die Sulfonate, finden als Tenside Verwendung. In der organischen Synthese werden Thioacetale als Synthons zur Umpolung der Carbonylfunktion, zum Beispiel in der Corey-Seebach-Reaktion eingesetzt. In der Johnson-Corey-Chaykovsky Reaktion wird eine Carbonylfunktion mittels Schwefel-Yliden in ein Epoxid überführt.
Der Chemie der Riech- und Geschmacksstoffe sind eine Vielzahl schwefelhaltiger organoleptischer Stoffe bekannt. Sie hat etliche Stoffe aus natürlichen Quellen identifiziert und nutzt das Heteroelement zum Designen neuer Riechstoffe und zur Ermittlung olfaktorischer Struktur-Wirkungs-Beziehungen.[120] Der niedrigste Geruchsschwellenwert (10−4 ppb), der je in natürlichen Aromen gemessen wurde, stammt von dem aus der Grapefrucht isolierten Thioterpineol, dem Schwefel-Analogon des α-Terpineols.[121] Geringfügig schwächere Potenz hat das strukturell ähnliche 8-Thio-p-menth-3-on mit dem typischen Geruch der schwarzen Johannisbeere.[122] Übertroffen werden diese Stoffe vom Thiamin-Photolyten Bis(2-methyl-3-furyl)disulfid, der zu den geruchsstärksten Verbindungen der organischen Chemie gehört.[123] Im Galbanharz finden sich ausgeprägt riechende Thioester als Strukturverwandte der Senecioester.[124] Ein dem Perillen analoges monoterpenoides Thiophen ist enthalten im Hopfen. Shiitake enthält den Aromastoff 1,2,3,5,6-Pentathiepan (Lenthionin). Spargel enthält 1,2-Dithiolane. Rettich und Radieschen setzen das 4-Methylsulfinyl-3-butenyl-isothiocyanat frei.
Das farb- und geruchslose Erdgas wird mit Tetrahydrothiophen odoriert, um im Leckagefall eine leichte geruchliche Wahrnehmung zu garantieren. Ausströmendes Erdgas kann dadurch bei kleinsten Leckagen wahrgenommen werden.[125]
Schwefelhaltige Liganden
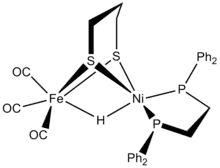
Schwefel verfügt als Ligand in der metallorganischen Chemie über mannigfaltige Koordinationsmöglichkeiten. Die Metall-Schwefel-Komplexe gelten als Modellverbindungen für das Studium von Metalloenzymen. Schwefel tritt in den Komplexen als verbrückender Mono-, Di- und Polysulfidoligand, als Sulfid, als Schwefelring verschiedener Größe oder als η2-Disulfid auf.[126]
Literatur
- Ralf Steudel, Hans-Joachim Mäusle: Flüssiger Schwefel – ein Rohstoff komplizierter Zusammensetzung. In: Chemie in unserer Zeit. 14. Jahrgang 1980, Nr. 3, S. 73–81, doi:10.1002/ciuz.19800140302.
- Ralf Steudel (Hrsg.): Elemental Sulfur and Sulfur-Rich Compounds (part I & II). In: Topics in Current Chemistry. Band 230 & 231, Springer, Berlin 2003.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Winnacker-Küchler: Chemische Technik: Prozesse und Produkte. Band 3: Anorganische Grundstoffe, Zwischenprodukte. herausgegeben von Roland Dittmeyer, Wilhelm Keim, Gerhard Kreysa, Alfred Oberholz. Wiley-VCH Verlag, 2005, ISBN 3-527-30768-0.
- Ralf Steudel, David Scheschkewitz: Chemistry of the Non-Metals: Syntheses – Structures – Bonding – Applications, 2nd ed., de Gruyter, Berlin/Boston 2020, ISBN 978-3-11-057805-8.
- Max Schmidt: Elementarer Schwefel – ein aktuelles Problem in Theorie und Praxis. In: Angewandte Chemie. 85, 1973, S. 474–484, doi:10.1002/ange.19730851103.
- Joachim Schroeter: Der Schwefel in der Medizin und in der älteren Chemie. In: Ciba Zeitschrift 9, 1945, Nr. 98 (Der Schwefel), S. 3497–3502.
Weblinks
- Mineralienatlas:Schwefel und Mineralienatlas:Mineralienportrait/Schwefel (Wiki)
- Schwefelkreislauf. In: GeoDZ.com – Das Lexikon der Erde.
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Schwefel) entnommen.
- Angegeben ist der von der IUPAC empfohlene Standardwert, da die Isotopenzusammensetzung dieses Elements örtlich schwanken kann, ergibt sich für das mittlere Atomgewicht der in Klammern angegebene Massenbereich. Siehe: Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements 2009 (IUPAC Technical Report). In: Pure Appl. Chem. 2011, S. 1, doi:10.1351/PAC-REP-10-09-14.
- CIAAW, Standard Atomic Weights Revised 2013.
- IUPAC, Standard Atomic Weights Revised 2013 (Excel-Tabelle).
- Eintrag zu sulfur in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu sulfur bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Schwefel) entnommen.
- S. J. Rettig, J. Trotter: Refinement of the Structure of Orthorhombic Sulfur, α-S8. In: Acta Crystallographica Section C. Band 43, 1987, S. 2260–2262, doi:10.1107/S0108270187088152.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-142 – 4-147. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Schwefel) entnommen.
- Eintrag zu Sulfur im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Schwefel in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. August 2016. (JavaScript erforderlich)
- Etymologisches Wörterbuch der deutschen Sprache. 1967, S. 690.
- N. Figurowski: Die Entdeckung der chemischen Elemente und der Ursprung ihrer Namen. Aulis-Verlag Deubner, Köln 1981, ISBN 3-7614-0561-8, S. 179–180.
- George Rapp: Archaeomineralogy. 2. Auflage. Springer, 2009, ISBN 978-3-540-78593-4, S. 242.
- Odyssey. book 22, lines 480–495.
- John F. Healy: Pliny the Elder on science and technology. Oxford University Press, 1999, ISBN 0-19-814687-6, S. 247–249.
- Plinius der Ältere: Naturalis historia. Aus dem Lateinischen von John Bostock & al. Band 35, Kap. 15 (englisch, Volltext).
- Fritz Seel: Geschichte und Chemie des Schwarzpulvers. Le charbon fait la poudre. In: Chemie in unserer Zeit. Band 22, 1988, S. 9–16, doi:10.1002/ciuz.19880220103.
- Franz Maria Feldhaus: Berthold (Erfinder des Schießpulvers). In: Allgemeine Deutsche Biographie (ADB). Band 55, Duncker & Humblot, Leipzig 1910, S. 617–619.
- Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 157 (Sulphur).
- Wilhelm Hassenstein, Hermann Virl: Das Feuerwerkbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdruckes aus dem Jahr 1529 mit Übertragung ins Hochdeutsche und Erläuterungen von Wilhelm Hassenstein. Verlag der Deutschen Technik, München 1941, S. 106.
- Gundolf Keil: Die „Cirurgia“ Peters von Ulm. Untersuchungen zu einem Denkmal altdeutscher Fachprosa mit kritischer Ausgabe des Textes. (= Forschungen zur Geschichte der Stadt Ulm. Band 2). Stadtarchiv, Ulm 1961 (zugleich Philosophische Dissertation Heidelberg 1960), S. 471.
- William H. Brock: Viewegs Geschichte der Chemie. Springer, 1997, ISBN 3-540-67033-5, S. 67 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. Gay-Lussax, L. J. Thenard: Prüfung der zerlegenden Untersuchungen des Hrn. Davy über die Natur des Schwefels und des Phosphors. In: Annalen der Physik. Volume 35, Issue 7, 1810, S. 292–310, doi:10.1002/andp.18100350704.
- Peter Kurzweil, Paul Scheipers: Chemie: Grundlagen, Aufbauwissen, Anwendungen und Experimente. Vieweg+Teubner; (2011), S. , ISBN 3-8348-1555-1.
- W. C. Zeise: Jahresber. Fortschr. Chem. 3, 1824, S. 80; 16, 1837, S. 302.
- Lawrie Lloyd: Handbook of Industrial Catalysts (Fundamental and Applied Catalysis). Springer US, 2011, ISBN 978-0-387-24682-6, S. 29.
- Theodore L. Brown, H. Eugene LeMay, Chemie. Ein Lehrbuch für alle Naturwissenschaftler| VCH VerlagsgesellschaftD6940 Weinheim, 1988, ISBN 3-527-26241-5, S. 919f
- Max Schmidt: Schwefel – was ist das eigentlich? In: Chemie in unserer Zeit. Band 7, Nr. 1, Februar 1973, S. 11–18, doi:10.1002/ciuz.19730070103.
- Ernst Beckmann: Kryoskopische Bestimmungen in Jod. In: Zeitschrift für anorganische Chemie. Volume 77, Issue 1, S. 200–208, 3. Oktober 1912, doi:10.1002/zaac.19120770115.
- B. E. Warren, J. T. Burwell: The Structure of Rhombic Sulphur. (Memento vom 15. Oktober 2012 im Internet Archive) In: J. Chem. Phys. 3, 6, 1935, doi:10.1063/1.1749557.
- Sulphur. Abgerufen am 3. Juli 2012.
- Mineralienatlas: Mineralienportrait Schwefel
- IMA/CNMNC List of Mineral Names. (PDF; 1,9 MB) Abgerufen am 3. Juli 2012. (englisch, PDF 1,8 MB, S. 272).
- Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. 9. Auflage. E. Schweizerbart'sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 53.
- Sulfur. (PDF; 447 kB) Abgerufen am 3. Juli 2012. (englisch, PDF 436,8 kB).
- Peter Adolphi, Bernd Ullrich: Fixierung und Reaktionsfähigkeit von Schwefel in Braunkohle. In: Proc. XXXII. Kraftwerkstechnisches Kolloquium, Nutzung schwieriger Brennstoffe in Kraftwerken, Dresden 24. und 25. Oktober 2000. S. 109–116.
- The chemical composition of seawater. Abgerufen am 3. Juli 2012.
- Ein ungewöhnliches Enzym ermöglicht die Inaktivierung von Methan. (PDF; 343 kB) Abgerufen am 3. Juli 2012.
- Wasserlexikon: Sulfat. Abgerufen am 5. Juli 2012.
- Atmospheric Aerosols: What Are They, and Why Are They So Important? Abgerufen am 2. Juli 2012.
- Alan R. Wellburn, U. Gramm (Übers.), D. Mennecke-Bühler (Übers.): Luftverschmutzung und Klimaänderung: Auswirkungen auf Flora, Fauna und Mensch. Springer, 1997, ISBN 3-540-61831-7, S. 31 u. 104 (eingeschränkte Vorschau in der Google-Buchsuche).
- Niemeier, U., & Tilmes, S. (2017). Sulfur injections for a cooler planet. Science, 357(6348), 246–248. doi:10.1126/science.aan3317
- Klima-Manipulation: Mit Technik gegen die Erderwärmung. Berliner Zeitung, 20. August 2018, abgerufen am 14. Dezember 2019.
- Tilmes, S., Müller, R., & Salawitch, R. (2008). The sensitivity of polar ozone depletion to proposed geoengineering schemes. Science, 320(5880), 1201–1204. doi:10.1126/science.1153966
- Forscher warnen vor Geo-Engineering. Heise Online, 24. April 2008, abgerufen am 14. Dezember 2019.
- Thomas Leustek, Kazuki Saito: Sulfate Transport and Assimilation in Plants. In: Plant Physiology. Band 120, Nr. 3, Juli 1999, S. 637–644, doi:10.1104/pp.120.3.637.
- Daniel C. Boice, Celine Reyle: The Nature of Diatomic Sulfur in Comets. In: Formation of Cometary Material, 25th meeting of the IAU, Joint Discussion 14, 22. Juli 2003, Sydney, Australia. bibcode:2003IAUJD..14E..38B.
- Volcanism on Io. Abgerufen am 3. Juli 2012.
- Swimming a Salty Sea. Abgerufen am 3. Juli 2012.
- C. A. Gottlieb, E. W. Gottlieb, M. M. Litvak, J. A. Ball, H. Pennfield: Observations of interstellar sulfur monoxide. In: Astrophysical Journal. 219, 1, 1978, S. 77–94. bibcode:1978ApJ...219...77G.
- M. W. Sinclair, N. Fourikis, J. C. Ribes, B. J. Robinson, R. D. Brown, P. D. Godfrey: Detection of interstellar thioformaldehyde. In: Australian Journal of Physics. Band 26, S. 85. bibcode:1973AuJPh..26...85S.
- To Find Alien Volcanic Eruptions, Look for Foul Gas. Abgerufen am 3. Juli 2012.
- An Introduction to Sulphur. Abgerufen am 3. Juli 2012.
- Sulfur. (PDF; 85 kB) Abgerufen am 3. Juli 2012.
- W. Botsch, Chemiker, Techniker, Unternehmer: Zum 150. Geburtstag von Hermann Frasch, Chemie unserer Zeit 2001, 35, 324–331.
- Die Aufbereitung von Erdgas. (PDF; 816 kB) Abgerufen am 5. Juli 2012.
- Schwefel – Eine natürliche aber unerwünschte Begleitsubstanz. (Nicht mehr online verfügbar.) Archiviert vom Original am 29. November 2011; abgerufen am 3. Juli 2012.
- B. Schreiner, Der Claus-Prozess, Chemie unserer Zeit 2008, 42, 378–392.
- Ursula Klein: Verbindung und Affinität: Die Grundlegung der neuzeitlichen Chemie an der Wende vom 17. zum 18. Jahrhundert. Birkhäuser Verlag, 1994, ISBN 3-7643-5003-2 (eingeschränkte Vorschau in der Google-Buchsuche).
- R. Dittmeyer, W. Keim, G. Kreysa, A. Oberholz: Winnacker·Küchler: Chemische Technik. Band 3: Anorganische Grundstoffe, Zwischenprodukte. 5. Auflage. Wiley-VCH, Weinheim 2005, ISBN 3-527-30768-0, S. 33–34 (Volltext; PDF; 7,9 MB).
- Flüssiger Schwefel auf der Schiene. (PDF; 2,4 MB) (Nicht mehr online verfügbar.) In: Cargo Magazin 2 / 2005. S. 17, archiviert vom Original am 9. März 2014; abgerufen am 11. Juli 2012.
- Rosickýite. (PDF; 61 kB) Abgerufen am 4. Juli 2012.
- R. Steudel, B. Eckert, Solid Sulfur Allotropes, Top. Curr. Chem., 230, 1, (2003).
- R. Engel: Compt. Rend., 112, 866 (1891).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 552.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 549.
- F. Asinger, M. Thiel: Einfache Synthesen und chemisches Verhalten neuer heterocyclischer Ringsysteme. In: Angewandte Chemie. 70, 1958, S. 667–683, doi:10.1002/ange.19580702202.
- Jerry March: Advanced Organic Chemistry. 3. Auflage. Verlag Wiley & Sons, 1985, ISBN 0-471-60180-2, S. 550 und 1053.
- G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
- Schwefel-Isotopenuntersuchungen an der Blei-Zink-Erzlagerstätte Grund (Westharz, Bundesrepublik Deutschland) Abstract
- Nachweis reduktiver Prozesse in versauerten Altkippen des Braunkohlebergbaus. (PDF; 198 kB) Abgerufen am 4. Juli 2012.
- The History of the Contact Sulfuric Acid Process. (PDF; 157 kB) Abgerufen am 1. Juli 2012.
- UN Industrial Development Organization: Fertilizer Manual. Verlag Springer Netherlands, 1998, ISBN 0-7923-5032-4.
- Tharwat F. Tadros: Applied Surfactants: Principles and Applications. Wiley-VCH Verlag, 2005, ISBN 3-527-30629-3.
- Synthetic Rubber (Vulcanizable Elastomers). Abgerufen am 4. Juli 2012.
- Pharmacopoea Europaea, 6. Ausgabe, Grundwerk 2008, Monographie 6.0/0953.
- Heinrich Bueß: Historisches zur Schwefeltherapie. In: Ciba Zeitschrift. 9, 1945, Nr. 98 (Der Schwefel), S. 3516–3525.
- Arzneibuch-Kommentar. Wissenschaftliche Erläuterungen zum Europäischen Arzneibuch und zum Deutschen Arzneibuch. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2004, ISBN 3-8047-2575-9, Monographie Schwefel zum äußerlichen Gebrauch. 23. Lieferung, 2006.
- Eintrag zu COLLOIDAL SULFUR in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. Januar 2022.
- W. Küster, H. Schlerkmann, G. Schmitt, W. Schwenk, D. Steinmetz: Korrosionsreaktionen von elementarem Schwefel mit unlegiertem Stahl in wässrigen Medien. In: Materials and Corrosion/Werkstoffe und Korrosion. 35, 1984, S. 556–565, doi:10.1002/maco.19840351204.
- Sulfur as a Catalyst Poison (PDF; 52 kB).
- Warum riechen manche Autokatalysatoren nach faulen Eiern?
- Einsatz von Pflanzenschutzmitteln und Biozid-Produkten im nicht-Land- und Forstwirtschaftlichen Bereich. (PDF; 482 kB) Abgerufen am 4. Juli 2012.
- Dreitausend Jahre Ultramarin. (Nicht mehr online verfügbar.) Archiviert vom Original am 2. Februar 2012; abgerufen am 4. Juli 2012.
- Additive. (Nicht mehr online verfügbar.) Archiviert vom Original am 20. November 2012; abgerufen am 4. Juli 2012.
- Friedrich Asinger: Über die gemeinsame Einwirkung von Schwefel und Ammoniak auf Ketone. In: Angewandte Chemie. 68, 1956, S. 413.
- Total Sulfur, Cystine, and Methione Content of blood globins of mammalian species. (PDF; 279 kB) Abgerufen am 4. Juli 2012.
- Fütterung des Hufes – biochemische Grundlagen und Beispiele zur Optimierung. (PDF; 116 kB) Abgerufen am 4. Juli 2012.
- Was macht der Schwefel in der Zwiebel? Abgerufen am 5. Juli 2012.
- Die Küchenzwiebel aus chemischer Sicht. (Nicht mehr online verfügbar.) Archiviert vom Original am 18. Januar 2012; abgerufen am 5. Juli 2012.
- How much sulphur do plants need? Abgerufen am 5. Juli 2012.
- Joseph W. Lengeler, G. Drews, Hans Günter Schlegel: Biology of the prokaryotes. Thieme, Stuttgart 1999, ISBN 3-13-108411-1, S. 245–251, 330–336.
- M. H. Stipanuk, I. Ueki: Dealing with methionine/homocysteine sulfur: cysteine metabolism to taurine and inorganic sulfur. In: Journal of inherited metabolic disease. Band 34, Nummer 1, Februar 2011, S. 17–32. doi:10.1007/s10545-009-9006-9. PMID 20162368. PMC 290177 (freier Volltext). (Review).
- Hans-Walter Heldt: Pflanzenbiochemie. Spektrum Akademischer Verlag, Heidelberg 1996, ISBN 3-8274-0103-8, S. 321–333.
- Dicke Pötte werden öko. (Nicht mehr online verfügbar.) Archiviert vom Original am 6. September 2010; abgerufen am 5. Juli 2012.
- Res Gehriger: Stichproben in Sambia - Schwefelgase von Glencores Kupferwerk gefährden Anwohner. In: srf.ch. 12. Juni 2019, abgerufen am 13. Juni 2019.
- 33Sulfur NMR. Abgerufen am 5. Juli 2012.
- T. Ubuka, T. Abe, R. Kajikawa, K. Morino: Determination of hydrogen sulfide and acid-labile sulfur in animal tissues by gas chromatography and ion chromatography. In: Journal of Chromatography B: Biomedical Sciences and Applications. 757, Nr. 1, 2001, S. 31–37, doi:10.1016/S0378-4347(01)00046-9.
- disulfane (H2S2). Abgerufen am 5. Juli 2012.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 578.
- Ralf Steudel, David Scheschkewitz: Chemistry of the Non-Metals: Syntheses – Structures – Bonding – Applications. 2. Auflage, De Gruyter, Berlin/Boston 2020, ISBN 978-3-11-057805-8, S. 564–578.
- N. N. Greenwood, A. Earnshaw: Chemical Elements. 2. Auflage. Butterworth-Heinemann, Boston, MA 1997, S. 721–725.
- T. Chivers: Guide To Chalcogen-Nitrogen Chemistry. World Scientific Publishing Company, Singapore 2004, ISBN 981-256-095-5.
- Hans P. Latscha, Helmut A. Klein: Anorganische Chemie: Chemie-basiswissen I. Band 1, S. 374 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 580.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 553.
- Informationsgewinnung und Datenbasis. (PDF; 11,8 MB) In: Handbuch Stadtklima. 2010, S. 65ff, abgerufen am 5. Juli 2012.
- Eintrag zu Dischwefeldecafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Dezember 2019. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 564.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. Band 1, Academic Press, 1963, S. 371–372.
- K. Seppelt: Sulfur/carbon double and triple bonds (PDF; 77 kB), In: Pure & Appl. Chem. Band 59, Nr. 8, 1987, S. 1057–1062.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 590.
- L. Pauling: Die Natur der chemischen Bindung. Verlag Chemie, Weinheim 1973, ISBN 3-527-25217-7, S. 286.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Molecular Structure and Spectroscopy, S. 9-77.
- Warum sollte man Eiweiß in die Steckdose stecken wollen? Abgerufen am 5. Juli 2012.
- Günther Ohloff: Riechstoffe und Geruchssinn – Die molekulare Welt der Düfte; Springer Verlag, ISBN 978-3-540-52560-8.
- Edouard Demole, Paul Enggist, Günther Ohloff: 1-p-Menthene-8-thiol: A powerful flavor impact constituent of grapefruit juice (Citrus parodisi MACFAYDEN). In: Helv. Chem. Acta. 65, 1982, S. 1785–1794; doi:10.1002/hlca.19820650614.
- Ohloff, S. 13.
- Ohloff, S. 60.
- Ohloff, S. 176.
- Sicherheitsdatenblatt Erdgas getrocknet (nach DVGW-Arbeitsblatt G 260, 2. Gasfamilie). (Nicht mehr online verfügbar.) Archiviert vom Original am 15. September 2016; abgerufen am 5. Juli 2012.
- Joachim Wachter: Synthese, Struktur und Reaktivität schwefelreicher Cyclopentadienylübergangsmetallkomplexe: Schwefelchemie aus metallorganischer Sicht. In: Angewandte Chemie. Volume 101, Issue 12, 1989, S. 1645–1658.
