Xenon
Xenon () ist ein chemisches Element mit dem Elementsymbol Xe und der Ordnungszahl 54. Im Periodensystem steht es in der 8. Hauptgruppe, bzw. der 18. IUPAC-Gruppe und zählt daher zu den Edelgasen. Wie die anderen Edelgase ist es ein farbloses, äußerst reaktionsträges, einatomiges Gas. In vielen Eigenschaften wie Schmelz- und Siedepunkt oder Dichte steht es zwischen dem leichteren Krypton und dem schwereren Radon.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Xenon, Xe, 54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Edelgase | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 18, 5, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | farblos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-172-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.338 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-Code | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 9 · 10−6 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 131,293(6)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 216 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d10 5s2 5p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 12.1298436(15) eV[4] ≈ 1170.35 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 20.975(4) eV[4] ≈ 2023.8 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 31.05(4) eV[4] ≈ 2996 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 42.20(20) eV[4] ≈ 4072 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 54.1(5) eV[4] ≈ 5220 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | gasförmig | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 5,8982 kg · m−3[7] bei 273,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −2,5 · 10−8)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 161,4 K (−111,7 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 165,2 K[9] (−108 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | (fest) 35,92 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 12,6 kJ/mol[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 2,30 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | 4,13· 106 Pa bei 273,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 169 (gasförmig) 1090 (flüssig) m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,00569 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,6[11][12] (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Xenon ist das seltenste nichtradioaktive Element auf der Erde und kommt in geringen Mengen in der Atmosphäre vor. Trotz seiner Seltenheit wird es vielfach eingesetzt, so als Füllgas von hochwertigen Isolierglaseinheiten, sowie Xenon-Gasentladungslampen, die unter anderem in Autoscheinwerfern (Xenonlicht) eingesetzt werden, und als Inhalationsanästhetikum.
Das Edelgas wurde 1898 von William Ramsay und Morris William Travers durch fraktionierte Destillation von flüssiger Luft entdeckt. Xenon ist das Edelgas mit den meisten bekannten chemischen Verbindungen. Die stabilste ist dabei das Xenon(II)-fluorid, das als starkes Oxidations- und Fluorierungsmittel eingesetzt wird.
Geschichte

Nachdem John William Strutt, 3. Baron Rayleigh, und William Ramsay 1894 das erste Edelgas Argon entdeckt und Ramsay 1895 das bislang nur aus dem Sonnenspektrum bekannte Helium aus Uranerzen isoliert hatten, erkannte dieser aus den Gesetzen des Periodensystems, dass es noch weitere derartige Elemente geben müsste. Er untersuchte daher ab 1896 zunächst verschiedene Minerale und Meteoriten und die von ihnen beim Erhitzen oder Auflösen abgegebenen Gase. Ramsay und sein Mitarbeiter Morris William Travers waren dabei jedoch erfolglos. Es wurden Helium und seltener Argon gefunden. Auch die Untersuchung heißer Gase aus Cauterets in Frankreich und aus Island brachten keine Ergebnisse.[14]
Schließlich begannen sie, 15 Liter Rohargon zu untersuchen und durch Verflüssigung und fraktionierte Destillation zu trennen. Als sie den Rückstand, der bei fast völligem Verdampfen des Rohargons übrigblieb, untersuchten, entdeckten sie das neue Element Krypton. Nachdem sie Neon entdeckt hatten, begannen Ramsay und Travers im September 1898 Krypton durch fraktionierte Destillation weiter zu untersuchen und entdeckten dabei ein weiteres Element mit einem höheren Siedepunkt als Krypton. Sie nannten es nach dem altgriechischen ξένος xénos „fremd“ Xenon.[14]
1939 entdeckte Albert R. Behnke die anästhetische Wirkung des Gases. Er untersuchte die Wirkung verschiedener Gase und Gasmischungen auf Taucher und vermutete aus den Ergebnissen, dass Xenon auch bei Normaldruck eine narkotische Wirkung haben müsse. Er konnte dies jedoch aus Mangel an Gas nicht überprüfen. Erstmals bestätigt wurde diese Wirkung 1946 von J. H. Lawrence an Mäusen, die erste Operation unter Xenon-Narkose gelang 1951 Stuart C. Cullen.[15]
Neil Bartlett entdeckte mit Xenonhexafluoroplatinat 1962 erstmals eine Xenonverbindung und damit die erste Edelgasverbindung überhaupt.[16] Nur wenige Monate nach dieser Entdeckung konnten nahezu gleichzeitig im August 1962 Xenon(II)-fluorid von Rudolf Hoppe und Xenon(IV)-fluorid von einer Gruppe um die amerikanischen Chemiker C. L. Chernick und H. H. Claassen synthetisiert werden.[17]
Vorkommen
Während Xenon im Universum nicht selten vorkommt und in seiner Häufigkeit mit der von Barium, Rubidium und Nickel vergleichbar ist,[18] zählt es auf der Erde zu den seltensten Elementen. Es ist das seltenste stabile Element; lediglich radioaktive Elemente, die überwiegend als kurzlebige Zwischenprodukte in Zerfallsreihen auftreten, sind seltener. Dass der Gehalt an Xenon in Gesteinen gering ist, wird möglicherweise dadurch verursacht, dass sich Xenon sehr viel schlechter in Magnesiumsilikat-Gesteinen des Erdmantels löst als die leichteren Edelgase.[19]
Der größte Teil des Xenons ist vermutlich in der Atmosphäre vorhanden, der Anteil beträgt etwa 0,09 ppm.[20] Aber auch die Ozeane, manche Gesteine wie Granit und Erdgas-Quellen enthalten geringe Mengen Xenon. Entstanden ist dies – wie durch die vom atmosphärischen Xenon abweichende Isotopenzusammensetzung nachweisbar – unter anderem durch Spontanzerfall von Uran und Thorium.[21]
Xenon wird als Indikator für Atomwaffentests von der CTBTO weltweit kontinuierlich gemessen – über die Anlagerung an Silberzeolithe in Xenonfallen.[22]
Meteoriten enthalten Xenon, das entweder seit Entstehung des Sonnensystems in Gesteinen eingeschlossen ist oder durch verschiedene Sekundärprozesse entstanden ist. Zu diesen zählen der Zerfall des radioaktiven Iodisotops 129I, Spallationsreaktionen und die Kernspaltung schwerer Isotope wie 244Pu. Auch auf der Erde lassen sich die Xenon-Produkte dieser Reaktionen nachweisen, was Rückschlüsse auf die Entstehung der Erde ermöglicht.[23] Auf dem Mond wurde Xenon gefunden, das durch den Sonnenwind dorthin transportiert wurde (im Mondstaub) sowie im Mondgestein solches, das durch Spallationen oder Neutroneneinfang aus dem Bariumisotop 130Ba entstanden ist.[21]
Xenon konnte auch in einem Weißen Zwerg nachgewiesen werden. Dabei wurde im Vergleich zur Sonne die 3800-fache Konzentration gemessen; die Ursache für diesen hohen Xenon-Gehalt ist noch unbekannt.[24]
Gewinnung
Die Gewinnung von Xenon erfolgt ausschließlich durch das Linde-Verfahren aus Luft. Bei der Stickstoff-Sauerstoff-Trennung reichert es sich auf Grund der hohen Dichte zusammen mit Krypton im flüssigen Sauerstoff an, der sich im Sumpf der Kolonne befindet. Dieses Gemisch wird in eine Kolonne überführt, in der es auf etwa 0,3 % Krypton und Xenon angereichert wird.[20] Dazu enthält das flüssige Krypton-Xenon-Konzentrat neben Sauerstoff noch größere Mengen Kohlenwasserstoffe wie Methan, fluorierte Verbindungen wie Schwefelhexafluorid oder Tetrafluormethan sowie Spuren an Kohlenstoffdioxid und Distickstoffmonoxid. Methan und Distickstoffmonoxid können über Verbrennung an Platin- oder Palladiumkatalysatoren bei 500 °C zu Kohlenstoffdioxid, Wasser und Stickstoff umgesetzt werden, die durch Adsorption an Molekularsieben entfernt werden können.[25] Fluorverbindungen können dagegen nicht auf diese Weise aus dem Gemisch entfernt werden. Um diese zu zerlegen und aus dem Gemisch zu entfernen, kann das Gas mit Mikrowellen bestrahlt werden, wobei die Element-Fluor-Bindungen aufbrechen und die entstehenden Fluoratome in Natronkalk aufgefangen werden können[26] oder über einen Titandioxid-Zirconiumdioxid-Katalysator bei 750 °C geleitet werden. Dabei reagieren die Fluorverbindungen zu Kohlenstoffdioxid und Fluorwasserstoff und anderen abtrennbaren Verbindungen.[25]
Anschließend werden Krypton und Xenon in einer weiteren Kolonne, die unten beheizt und oben gekühlt wird, getrennt. Während das Krypton und Sauerstoffreste am oberen Ende der Kolonne entweichen, sammelt sich Xenon am Boden und kann abgeschöpft werden. Auf Grund der Seltenheit bei gleichzeitig hoher Nachfrage ist Xenon das teuerste Edelgas. Die Gesamtproduktionsmenge 2017 lag bei 12.200 m3,[27] was etwa 71,5 Tonnen entspricht.
Eigenschaften
Physikalische Eigenschaften
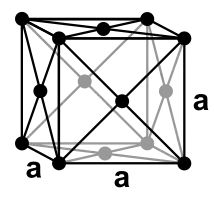
Xenon ist bei Normalbedingungen ein einatomiges, farbloses und geruchloses Gas, das bei 165,1 K (−108 °C) kondensiert und bei 161,7 K (−111,45 °C) erstarrt. Wie die anderen Edelgase außer dem Helium kristallisiert Xenon in einer kubisch dichtesten Kugelpackung mit dem Gitterparameter a = 620 pm.[28]
Wie alle Edelgase besitzt Xenon nur abgeschlossene Schalen (Edelgaskonfiguration). Dadurch lässt sich erklären, dass das Gas stets einatomig vorliegt und die Reaktivität gering ist. Jedoch ist die Ionisierungsenergie der äußersten Elektronen so niedrig, dass sie sich im Gegensatz zu den Valenzelektronen der leichteren Edelgase auch chemisch abspalten lassen und Xenonverbindungen möglich sind.
Mit einer Dichte von 5,8982 kg/m3 bei 0 °C und 1013 hPa ist Xenon deutlich schwerer als Luft. Im Phasendiagramm liegt der Tripelpunkt bei 161,37 K und 0,8165 bar,[29] der kritische Punkt bei 16,6 °C, 5,84 MPa und einer kritischen Dichte von 1,1 g/cm3.[30]
Die Wärmeleitfähigkeit ist sehr niedrig und liegt, je nach Temperatur, bei etwa 0,0055 W/mK.[31][17] Unter hohem Druck von 33 GPa und bei einer Temperatur von 32 K verhält sich Xenon wie ein Metall, es ist elektrisch leitfähig.[30]
Chemische und physikalisch-chemische Eigenschaften
Wie alle Edelgase ist Xenon reaktionsträge und reagiert kaum mit anderen Elementen. Jedoch ist Xenon zusammen mit Radon das reaktivste Edelgas, es ist eine größere Zahl Xenonverbindungen bekannt. Deren Anzahl übertrifft sogar die des schwereren Radons, da dieses zwar eine geringere Ionisierungsenergie besitzt, jedoch die starke Radioaktivität und kurze Halbwertszeit der Radonisotope bei der Bildung von Verbindungen stört.
Xenon reagiert direkt nur mit Fluor. Je nach Verhältnis von Xenon und Fluor entstehen dabei unter exothermer Reaktion bei erhöhten Temperaturen Xenon(II)-fluorid, Xenon(IV)-fluorid oder Xenon(VI)-fluorid. Verbindungen mit einigen anderen Elementen wie Sauerstoff oder Stickstoff sind ebenfalls bekannt. Sie sind aber instabil und können nur durch Reaktionen von Xenonfluoriden oder wie Xenon(II)-chlorid bei tiefen Temperaturen durch elektrische Entladungen dargestellt werden.[32]
Xenon bildet Clathrate, bei denen das Atom nur physikalisch gebunden und in einen Hohlraum des umgebenden Kristalls eingeschlossen ist. Ein Beispiel hierfür ist das Xenon-Hydrat, bei dem das Gas in Eis eingeschlossen ist. Es ist zwischen 195 und 233 K stabil.[33] In der Nähe der Raumtemperatur ist Xenon bis zu einem gewissen Maß in Wasser löslich. Als inertes Teilchen hat Xenon keine Wechselwirkung mit dem Wasser, allerdings stellt sich der sogenannte hydrophobe Effekt ein und so wird die Beweglichkeit der dem Xenon benachbarten Wassermoleküle bei 25 °C um ca. 30 % erniedrigt.[34] Befinden sich in der Xenon-Wasser-Lösung zusätzlich Salze, so lagern sich große Anionen, wie z. B. Bromid (Br−) und Iodid (I−) an das Xenon an und bilden einen Xenon-Anion-Komplex, der beim größeren Anion stärker ist.[35] Auch in Fullerenen können Xenonatome eingeschlossen sein, diese beeinflussen auch die Reaktivität des Fullerens, etwa bei der Reaktion mit 9,10-Dimethylanthracen.[36]
Isotope
Es sind insgesamt 37 Isotope sowie zwölf weitere Kernisomere des Xenons bekannt. Von diesen sind sieben, die Isotope 126Xe, 128Xe, 129Xe, 130Xe, 131Xe, 132Xe und 134Xe, stabil. Die beiden instabilen Isotope 124Xe und 136Xe haben so lange Halbwertszeiten, dass sie zusammen einen deutlichen Anteil des natürlichen Xenons ausmachen, ohne dass dieses deshalb nennenswert radioaktiv wäre. Alle anderen Isotope und Isomere haben dagegen nur kurze Halbwertszeiten zwischen 0,6 µs bei 110Xe und 36,4 Tagen bei 127Xe. Xenon ist damit nach Zinn das Element mit den meisten stabilen Isotopen. Im natürlichen Isotopengemisch besitzen 132Xe mit 26,9 %, 129Xe mit 26,4 % und 131Xe mit 21,2 % den größten Anteil. Es folgen 134Xe mit 10,4 % und 136Xe mit 8,9 %, die übrigen besitzen nur geringe Anteile.[37]
Xenonisotope entstehen bei der Kernspaltung in Kernkraftwerken. Besonders wichtig ist hierbei das kurzlebige 135Xe, das in größeren Mengen direkt als Spaltprodukt oder aus dem bei der Spaltung entstehenden 135Te über 135I gebildet wird. 135Xe besitzt einen sehr großen Einfangquerschnitt für thermische Neutronen von 2,9 · 106 Barn, wobei sich das extrem langlebige 136Xe bildet. Dieser Neutronen-Einfangprozess vermindert die Leistung des Reaktors, da die Neutronen nun nicht mehr für Kernspaltungen zur Verfügung stehen. Während des laufenden Betriebes eines Kernkraftwerkes bildet sich ein Gleichgewicht von Bildung und Zerfall von 135Xe. Wird der Reaktor dagegen abgeschaltet, bildet sich aus den schon vorhandenen Spaltprodukten weiterhin 135Xe, während der Abbau durch die fehlenden Neutronen verlangsamt abläuft. Man spricht hierbei von einer Xenonvergiftung, diese verhindert auch das direkte Wiederanfahren eines abgeschalteten Kernreaktors.[38] Der Versuch, dieses Phänomen mit unzulässigen Maßnahmen zu kompensieren, spielte eine Rolle bei der Katastrophe von Tschernobyl.[39]
133Xe wird in der Nuklearmedizin eingesetzt und dient dort unter anderem zur Untersuchung der Durchblutung von Gehirn, Muskeln, Haut und anderen Organen.[30] 129Xe wird als Sonde in der Kernspinresonanzspektroskopie zur Untersuchung von Oberflächeneigenschaften verschiedener Materialien[40] und von Biomolekülen[41] eingesetzt.
Verwendung

Xenon wird vor allem als Füllgas von Lampen eingesetzt. Dazu zählt die Xenon-Gasentladungslampe, bei der in Xenon ein Lichtbogen gezündet wird, welcher eine Temperatur von etwa 6000 K erreicht. Dabei gibt das ionisierte Gas eine Strahlung ab, die dem Tageslicht vergleichbar ist. Diese Lampen werden beispielsweise in Filmprojektoren, Blitzlichtern und für die Befeuerung von Start- und Landebahnen auf Flughäfen eingesetzt.[20] Auch in Autoscheinwerfern werden Xenon-Gasentladungslampen verwendet; dieses sogenannte Xenonlicht ist etwa 2,5-mal so lichtstark wie eine Halogenlampe gleicher elektrischer Leistung.[42] Glühlampen können mit Xenon oder Xenon-Krypton-Mischungen gefüllt werden, wodurch eine höhere Temperatur des Glühfadens und damit eine bessere Lichtausbeute erzielt wird.[30]
Xenon ist ein Lasermedium in Excimerlasern. Dabei bildet sich ein instabiles Xe2-Dimer, das unter Aussendung von Strahlung bei einer typischen Wellenlänge von 172 nm[43] im ultravioletten Spektralbereich zerfällt. Auch Laser, bei denen Xenon mit verschiedenen Halogenen gemischt wird und sich Xe-Halogen-Dimere bilden, sind bekannt. Sie besitzen andere ausgestrahlte Wellenlängen, so strahlt der Xe-F-Laser Licht einer Wellenlänge von 354 nm ab.[30]

Xenon wird in Ionenantrieben oft als Antriebsmittel (Stützmasse) verwendet. Die nur geringe Schubkräfte erzeugenden Ionentriebwerke nutzen den Antriebsmittelvorrat durch ihren hohen spezifischen Impuls wesentlich effizienter als konventionelle chemische Triebwerke und werden deshalb in manchen Satelliten für Korrekturtriebwerke oder als Hauptantrieb einiger Raumsonden verwendet, die so Ziele erreichen können, die für sie sonst nicht erreichbar wären. Xenon wird verwendet, da es als Edelgas leichter handhabbar und umweltfreundlicher ist als das ebenfalls mögliche Caesium oder Quecksilber.[44]
Xenon wird – bis zu einer Konzentration von 35 %, um nicht narkotisierend zu wirken – versuchsweise als Kontrastmittel in der Röntgendiagnostik verwendet, eventuell ergänzt durch Krypton, um die Absorption zu erhöhen. Durch Inhalation von hyperpolarisiertem 129Xe kann eine gute Darstellbarkeit der Lunge durch MRT (NMR) erreicht werden.
Die geringe Wärmeleitfähigkeit von Xenon im Vergleich zu Luft, Argon und Krypton[31] eröffnet spezielle Anwendungsmöglichkeiten im Bereich von hochisolierendem Mehrscheiben-Isolierglas.[45] Auf Grund seines hohen Preises wird Xenon als Füllgas bei Isolierglaseinheiten jedoch nur in Sonderfällen verwendet, z. B. wenn es auf besonders hohe Wärmedämmung selbst bei sehr dünnen Isolierglaseinheiten[46] mit Scheibenzwischenräumen unter 8 mm besonders ankommt (Isolierglas in denkmalgeschütztem Rahmen,[47] kleine Fenster unter hoher Klimalast).
Biologische Bedeutung
Wie die anderen Edelgase geht Xenon auf Grund der Reaktionsträgheit keine kovalenten Bindungen mit Biomolekülen ein und wird auch nicht verstoffwechselt. Über induzierte Dipole können Atome des Gases jedoch mit biologischen Systemen wechselwirken. So wirkt es beispielsweise durch einen noch nicht vollständig geklärten Mechanismus unter Beteiligung von Glutamat-Rezeptoren narkotisierend.[48][49]
Neuere Forschungen legen nahe, dass unter dem Einfluss von Xenon auch neuroprotektive und analgetische Wirkungen beobachtet werden können.[50][51]
Narkosemittel
Xenon wirkt narkotisierend und kann als Inhalationsanästhetikum verwendet werden. Es ist seit 2005 für den Einsatz bei ASA 1 und 2-Patienten in Deutschland, seit 2007 in elf weiteren Ländern zugelassen. Aufgrund der hohen Kosten (200–300 € anstelle 80–100 € bei einer zweistündigen Operation[52]) konnte es sich bis zum Jahr 2015 noch nicht im täglichen Narkosebetrieb durchsetzen.[53]
Um mit dem 15 €/Liter teuren Xenon sparsam umzugehen, wird es mit dem Ausatemgas wie bei einem Kreislauftauchgerät im Kreis geführt, indem das abgeatmete CO2 chemisch entfernt und Sauerstoff hinzugefügt wird.[52]
Aufgrund seines sehr niedrigen Blut-Gas-Verteilungskoeffizienten flutet es sehr schnell an und ab. Beim Abfluten kann wie beim Distickstoffmonoxid eine Diffusionshypoxie entstehen, es muss also mit reinem Sauerstoff ausgewaschen werden. Gegenüber dem häufig verwendeten Distickstoffmonoxid besitzt es einige Vorteile, so ist es ungefährlich im Umgang und kein Treibhausgas. Auch die Hämodynamik ist bei Xenon stabiler als bei anderen volatilen Anästhetika, d. h., es kommt nicht zum Blutdruckabfall, die Herzfrequenz steigt eher etwas an. Nachteilig ist, dass mit Xenon, weil es eine relativ hohe Konzentration in den Lungenbläschen braucht, um narkotisch zu wirken (MAC-Wert im Bereich von 60 bis 70 %), nur noch höchstens 30 oder 40 % Sauerstoff im Atemgasgemisch gegeben werden kann. Der größte Nachteil des Xenons ist sein hoher Preis.[15]
Doping
Im Umfeld der Olympischen Winterspiele 2014 in Sotschi erregte eine Recherche des WDR über den Missbrauch von Xenon als Dopingmittel die öffentliche Aufmerksamkeit.[54] Demnach sollen russische Athleten seit den Sommerspielen 2004 in Athen versuchen, ihre Leistungsfähigkeit zu steigern, indem sie während des Trainings die Hälfte des Luftsauerstoffs durch Xenongas ersetzen. Eine entsprechende Studie der Forschungs- und Entwicklungseinrichtung namens Atom-Med-Zentrum sei vom russischen Staat in Auftrag gegeben worden. Laut dieser Institution regt Xenongas im Körper die Produktion von EPO an. In Tierversuchen sei die EPO-Produktion innerhalb eines Tages auf 160 Prozent angestiegen. Ähnliche Effekte vermutet man beim Menschen. Im Mai 2014 setzte die WADA deshalb Xenon, ebenso wie Argon, auf die Dopingliste.[55] Diese Dopingmethode hinterlässt allerdings keine derzeit im Blut nachweisbare Spuren.[56]
Verbindungen

Man kennt eine größere Zahl von Verbindungen des Xenons in den Oxidationsstufen +2 bis +8. Am stabilsten sind Xenon-Fluor-Verbindungen, es sind aber auch Verbindungen mit Sauerstoff, Stickstoff, Kohlenstoff und manchen Metallen wie Gold bekannt.
Fluorverbindungen
Drei Verbindungen des Xenons mit Fluor sind bekannt: Xenon(II)-fluorid, Xenon(IV)-fluorid und Xenon(VI)-fluorid. Die stabilste hiervon und gleichzeitig die stabilste Xenonverbindung überhaupt, ist das linear aufgebaute Xenon(II)-fluorid. Es wird als einzige Xenonverbindung in geringen Mengen auch technisch genutzt. In Laborsynthesen dient es als starkes Oxidations- und Fluorierungsmittel, etwa zur direkten Fluorierung aromatischer Verbindungen.[57]
Während Xenon(II)-fluorid sich ohne Zersetzung in Wasser und Säuren löst und nur langsam hydrolysiert, hydrolysieren das quadratisch-planar aufgebaute Xenon(IV)-fluorid und das oktaedrische Xenon(VI)-fluorid schnell. Sie sind sehr reaktiv, so reagiert Xenon(VI)-fluorid mit Siliciumdioxid und kann daher nicht in Glasgefäßen aufbewahrt werden.[32]
Sauerstoffverbindungen und Oxidfluoride
Mit Sauerstoff erreicht Xenon die höchstmögliche Oxidationsstufe +8 im Xenon(VIII)-oxid und dem Oxifluorid Xenondifluoridtrioxid XeO3F2 sowie in Perxenaten der Form XeO64−. Weiterhin sind Xenon(VI)-oxid und die Oxifluoride XeO2F2 und XeOF4 in der Oxidationsstufe +6 sowie Xenon(IV)-oxid[58] und das Oxifluorid XeOF2 mit vierwertigem Xenon bekannt. Alle Xenonoxide und -oxifluoride sind instabil und viele explosiv.
Weitere Xenonverbindungen
Als weitere Xenon-Halogenverbindung ist Xenon(II)-chlorid bekannt; sie ist aber sehr instabil und nur bei tiefen Temperaturen spektroskopisch nachweisbar. Ähnlich konnten auch gemischte Wasserstoff-Halogen-Xenon-Verbindungen und die Wasserstoff-Sauerstoff-Xenonverbindung HXeOXeH durch Photolyse in der Edelgasmatrix hergestellt und spektroskopisch nachgewiesen werden.[59]
Organische Xenonverbindungen sind mit verschiedenen Liganden bekannt, etwa mit fluorierten Aromaten oder Alkinen. Ein Beispiel für eine Stickstoff-Fluor-Verbindung ist FXeN(SO2F)2.
Xenon ist unter supersauren Bedingungen in der Lage, mit Metallen wie Gold oder Quecksilber Komplexe zu bilden. Das Gold kommt dabei vorwiegend in der Oxidationsstufe +2 vor, auch Gold(I)- und Gold(III)-Komplexe sind bekannt.[60]
Einen Überblick über Xenonverbindungen gibt die Kategorie:Xenonverbindung.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 417–429.
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, doi:10.1002/14356007.a17_485.
- Eintrag zu Xenon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Xenon) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu xenon in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu xenon bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Xenon) entnommen.
- Eintrag zu Xenon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. April 2017. (JavaScript erforderlich)
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Xenon) entnommen.
- L. C. Allen, J. E. Huheey: The definition of electronegativity and the chemistry of the noble gases. In: Journal of Inorganic and Nuclear Chemistry. 42, 1980, S. 1523–1524, doi:10.1016/0022-1902(80)80132-1.
- T. L. Meek: Electronegativities of the Noble Gases. In: Journal of Chemical Education. 72, 1995, S. 17–18.
- N. Ackerman: Observation of Two-Neutrino Double-Beta Decay in ^{136}Xe with the EXO-200 Detector. In: Physical Review Letters. Band 107, Nr. 21, 2011, doi:10.1103/PhysRevLett.107.212501.
- William Ramsay: The Rare Gases of the Atmosphere. Nobelpreisrede, 12. Dezember 1904.
- T. Marx, M. Schmidt, U. Schirmer, H. Reinelt: Xenon anaesthesia. In: Journal of the Royal Society of Medicine. 93, 10, 2000, S. 513–517, (PDF) (Memento vom 27. März 2009 im Internet Archive)
- Neil Bartlett: Xenon Hexafluoroplatinate(V) Xe+[PtF]−. In: Proceedings of the Chemical Society. 1962, S. 218, doi:10.1039/PS9620000197.
- R. Hoppe: Die Valenzverbindungen der Edelgase. In: Angewandte Chemie. 76, 11, 1964, S. 455–463, doi:10.1002/ange.19640761103.
- A. G. W. Cameron: Abundances of the elements in the solar system. In: Space Science Reviews. 15, 1970, S. 121–146; (PDF)
- Svyatoslav S. Shcheka, Hans Keppler: The origin of the terrestrial noble-gas signature. In: Nature. 25. Okt 2012, S. 531–534, doi:10.1038/nature11506.
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, doi:10.1002/14356007.a17_485.
- H. Hintenberger: Xenon in irdischer und in extraterrestrischer Materie (Xenologie). In: Naturwissenschaften. 59, 7, 1972, S. 285–291, doi:10.1007/BF00593352.
- Wie das Verborgene entdeckt werden kann. ORF.at, 24. Juni 2013.
- Ichiro Kaneoka: Xenon's Inside Story. In: Science. 280, 1998, S. 851–852, doi:10.1126/science.280.5365.851b.
- Klaus Werner, Thomas Rauch, Ellen Ringat, Jeffrey W. Kruk: First detection of Krypton and Xenon in a white dwarf. In: The Astrophysical Journal. 753, 2012, S. L7, doi:10.1088/2041-8205/753/1/L7.
- Patent EP1752417: Process and apparatus for the production of krypton and/or xenon. Angemeldet am 20. September 2005, veröffentlicht am 14. Februar 2007, Anmelder: Linde AG, Erfinder: Matthias Meilinger.
- Jean-Christophe Rostaing, Francis Bryselbout, Michel Moisan, Jean-Claude Parenta: Méthode d’épuration des gaz rares au moyen de décharges électriques de haute fréquence. In: Comptes Rendus de l'Académie des Sciences - Series IV - Physics. 1, 1, 2000, S. 99–105, doi:10.1016/S1296-2147(00)70012-6.
- BGR-Studie zu Edelgasen: Helium wirklich kritisch? Markt für Xenon angespannt!
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 30, 1974, S. 193–204.
- Eintrag zu Xenon (Phase change data). In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 17. November 2019.
- Eintrag zu Xenon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- Christian Schittich, Gerald Staib, Dieter Balkow, Matthias Schuler, Werner Sobek: Glasbau Atlas. 2. Auflage. De Gruyter, 2006, ISBN 3-0346-1553-1, S. 127.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 417–429.
- T. Pietrass, H. C. Gaede, A. Bifone, A. Pines, J. A. Ripmeester: Monitoring Xenon Clathrate Hydrate Formation on Ice Surfaces with Optically Enhanced 129Xe NMR. In: J. Am. Chem. Soc. 117, 28, 1995, S. 7520–7525, doi:10.1021/ja00133a025.
- R. Haselmeier, M.Holz, W. Marbach, H.Weingärtner Water Dynamics near a Dissolved Noble Gas. In: J. Physical Chemistry. 99, 1995, S. 2243–2246.
- M. Holz: Nuclear Magnetic Relaxation as a Selective Probe of Solute – Solvent and Solute - Solute Interactions in Multi-component Mixtures. In: J. Mol. Liquids. 67, 1995, S. 175–191.
- Michael Frunzi, R. James Cross, Martin Saunders: Effect of Xenon on Fullerene Reactions. In: J. Am. Chem. Soc. 129, 43, 2007, S. 13343–13346, doi:10.1021/ja075568n.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1 MB).
- Wolfgang Demtröder: Experimentalphysik 4: Kern-, Teilchen- und Astrophysik. 3. Auflage. Springer Verlag, 2009, ISBN 978-3-642-01597-7, S. 232–233.
- Jeremy I. Pfeffer, Shlomo Nir: Modern physics: an introductory text. Imperial College Press, 2000, ISBN 1-86094-250-4, S. 421–422.
- Christopher I. Ratcliffe: Xenon Nmr. In: Annual Reports on NMR Spectroscopy. 36, 1998, S. 123–221.
- Thomas J. Lowery, Seth M. Rubin, E. Janette Ruiz, Megan M. Spence, Nicolas Winssinger, Peter G. Schultz, Alexander Pines, David E. Wemmer: Applications of laser-polarized 129xe to biomolecular assays. In: Magnetic Resonance Imaging. 21, 2003, S. 1235–1239.
- Hans-Hermann Braess, Ulrich Seiffert: Vieweg Handbuch Kraftfahrzeugtechnik. 5. Auflage. Vieweg+Teubner Verlag, 2007, ISBN 978-3-8348-0222-4, S. 674–676.
- G. Ribitzki, A. Ulrich, B. Busch, W. Krötz, J. Wieser, D. E. Murnick: Electron densities and temperatures in a xenon afterglow with heavy-ion excitation. In: Phys. Rev. E. 50, 1994, S. 3973–3979, doi:10.1103/PhysRevE.50.3973.
- Europäische Weltraumorganisation: Ionentriebwerke: Der Ritt auf geladenen Teilchen. Stand September 2003, abgerufen am 26. September 2009.
- Isoliergläser mit Gasfüllungen - WECOBIS - Ökologisches Baustoffinformationssystem des Bundesministeriums für Umwelt, Naturschutz, Bau und Reaktorsicherheit und der Bayerischen Architektenkammer. Abgerufen am 20. Oktober 2017.
- Modellierung des Energietransports durch Verglasungen. In: researchgate.net. 3. Mai 2019, abgerufen am 3. Mai 2019 (englisch).
- Glashütte Lamberts Waldsassen GmbH: Spezialisolierglas für den Denkmalschutz. Abgerufen am 20. Oktober 2017.
- B. Preckel, N. C. Weber, R. D. Sanders, M. Maze, W. Schlack: Molecular Mechanisms Transducing the Anesthetic, Analgesic, and Organ-protective Actions of Xenon. In: Anesthesiology. Vol. 105, Nr. 1, 2006, S. 187–197.
- Sicherheitsdatenblatt (Memento vom 12. Mai 2016 im Internet Archive) (Xenon; PDF-Datei; 72 kB), Linde AG, Stand 4. August 2006.
- E. Esencan, S. Yuksel, Y. B. Tosun, A. Robinot, I. Solaroglu, J. H. Zhang: XENON in medical area: emphasis on neuroprotection in hypoxia and anesthesia. In: Med Gas Res. 3(1), 1. Feb 2013, S. 4. PMID 23369273.
- M. Giacalone, A. Abramo, F. Giunta, F. Forfori: Xenon-related analgesia: a new target for pain treatment. In: Clin J Pain. 29(7), Jul 2013, S. 639–643. PMID 23328329.
- Xenon, ein fast ideales Narkosegas Deutschlandfunk Kultur, Archiv, gesendet am 9. Oktober 2011, abgerufen am 25. März 2018
- Löwenstein Medical: Narkose mit Xenon - Löwenstein Medical, abgerufen am 25. März 2018
- W. Jelkmann: Xenon Misuse in Sports – Increase of Hypoxia-Inducible Factors and Erythropoietin, or Nothing but „Hot Air“? In: Dtsch Z Sportmed. 65, 2014, S. 267–271, doi:10.5960/dzsm.2014.143.
- Doping: Xenon und Argon explizit verboten. In: Pharmazeutische Zeitung. 21. Mai 2014.
- Athletic enhancement: Breathe it in. In: The Economist. Vorabveröffentlichung vom 8. Februar 2014, abgerufen am 24. Februar 2014.
- Eintrag zu Xenon-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- David S. Brock, Gary J. Schrobilgen: Synthesis of the Missing Oxide of Xenon, XeO2, and Its Implications for Earth’s Missing Xenon. In: J. Am. Chem. Soc. 133, 16, 2011, S. 6265–6269, doi:10.1021/ja110618g.
- Leonid Khriachtchev, Karoliina Isokoski, Arik Cohen, Markku Räsänen, R. Benny Gerber: A Small Neutral Molecule with Two Noble-Gas Atoms: HXeOXeH. In: J. Am. Chem. Soc. 130, 19, 2008, S. 6114–6118, doi:10.1021/ja077835v.
- In-Chul Hwang, Stefan Seidel, Konrad Seppelt: Gold(I)- und Quecksilber(II)-Xenon-Komplexe. In: Angewandte Chemie. 115, 2003, S. 4528–4531, doi:10.1002/ange.200351208.