Kaliumsulfat
Kaliumsulfat ist das Kaliumsalz der Schwefelsäure. Es wird hauptsächlich als Düngemittel verwendet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
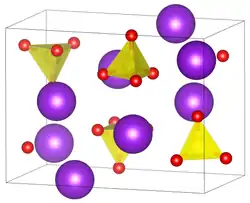 | ||||||||||||||||||||||
| _ K+ _ S6+ _ O2− | ||||||||||||||||||||||
| Kristallsystem |
orthorhombisch | |||||||||||||||||||||
| Raumgruppe |
Pmcn (Nr. 62, Stellung 5) | |||||||||||||||||||||
| Gitterparameter | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Kaliumsulfat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | K2SO4 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle oder Pulver[4] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 174,26 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
2,66 g·cm−3 [4] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
1689 °C[4] | |||||||||||||||||||||
| Löslichkeit |
111 g·l−1 bei 20 °C und 250 g·l−1 bei 100 °C[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Als Erster stellte der Apotheker und Chemiker Johann Rudolph Glauber das bereits seit dem 14. Jahrhundert bekannte Salz aus Kaliumchlorid und Schwefelsäure her.[5]
Vorkommen
In der Natur tritt reines Kaliumsulfat (K2SO4) als Mineral Arcanit auf.
Neben dem ternären Kaliumsulfat sind auch quaternäre Verbindungen mit Kalium und Sulfat sowie einem weiteren Kation – sogenannte Doppelsalze – als Minerale bekannt, wie beispielsweise Belomarinait (KNa[SO4]), Leonit (K2Mg[SO4]2·4H2O), Pikromerit (K2Mg[SO4]2·6H2O), Langbeinit (K2Mg2[SO4]3) und die Kalialaune (allgemein KMIII(SO4)2·12H2O).
Darstellung und Gewinnung
Anfangs wurde Kaliumsulfat aus dem Mineral Kainit (MgSO4 · KCl · 3 H2O) gewonnen. Diese Herstellungsweise wurde jedoch bald zu Gunsten kostengünstigerer Verfahren ausgehend vom Kaliumchlorid aufgegeben.
Eine Möglichkeit in der Herstellung von Kaliumsulfat ist die Reaktion von Kaliumchlorid mit Schwefelsäure bei einer Temperatur von 700 °C.
Alternativ ist Kaliumsulfat durch die doppelte Umsetzung mit anderen Metallsulfaten wie z. B. Magnesiumsulfat darstellbar:
Das so genannte Hargreaves-Verfahren nutzt zur Darstellung von Kaliumsulfat die Umsetzung von Kaliumchlorid mit einem Gemisch aus Schwefeldioxid, Luft und Wasser:
Kaliumsulfat fällt zudem als Nebenprodukt bei der Herstellung von Salpetersäure an.
Einfacher herzustellen ist Kaliumsulfat über die Reaktion von Kaliumhydroxid und Schwefelsäure.
Eigenschaften
Die wasserfreien Kristalle haben orthorhombische Symmetrie (Raumgruppe Pmcn (Raumgruppen-Nr. 62, Stellung 5), Gitterparameter a = 5,7704 Å, b = 10,0712 Å, c = 7,4776 Å[1]). Sie sind farblos und durchsichtig, sehr hart und äußerst stabil an der Luft. Der Geschmack von Kaliumsulfat ist bitter bis salzig. Während es sich gut in Wasser löst, ist es in Ethanol unlöslich.
Verwendung
Kaliumsulfat verwendet man zur Herstellung von Kalialaun, Kaliwasserglas, Kaliumpersulfat, Pottasche, Phlegmatisierungsmitteln, synthetischem Gummi sowie Mischdüngern. Des Weiteren findet es Anwendung bei der Weinstein- und Weinsäure-Reinigung und vielfältige Verwendung in der Farbstoff-, Sprengstoff- und pharmazeutischen Industrie.
Kaliumsulfat wird in der Lebensmitteltechnik als Festigungsmittel, Säureregulator oder Trägerstoff eingesetzt. In diätischen Lebensmitteln dient Kaliumsulfat als Kochsalz-Ersatz. Es ist in der EU als Lebensmittelzusatzstoff mit der E-Nummer E515 ohne eine Höchstmengenbeschränkung (quantum satis) für alle für Zusatzstoffe zugelassenen Lebensmittel zugelassen.
Ferner ist es Bestandteil von Kalidüngern, die zur Düngung Chlorid-empfindlicher Pflanzenkulturen zum Beispiel im Weinbau zum Einsatz kommen.
Kaliumsulfat wird auch als Wirkstoff in Löschpulvern (meist zusammen mit anderen Alkalisalzen wie Natriumhydrogencarbonat) der Brandklassen B und C eingesetzt.
Es wird auch als Homöopathisches Arzneimittel verwendet. Als Schüßler-Salz findet es dort Anwendung bei allen abschuppenden Hauterkrankungen, wie Neurodermitis und Schuppenflechte.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1179.
Einzelnachweise
- K. Ojima, Y. Nishihata, A. Sawada: Structure of potassium sulfate at temperatures from 296 K down to 15 K. In: Acta Crystallographica Section B. Band 51, 1995, S. 287–293, doi:10.1107/S0108768194013327.
- Eintrag zu E 515: Potassium sulphates in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 29. Dezember 2020.
- Eintrag zu POTASSIUM SULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- Eintrag zu Kaliumsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu Kaliumsulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. März 2019.

