Saurer Regen
Als sauren Regen bezeichnet man Niederschlag, dessen pH-Wert bei etwa 4,2–4,8 liegt und damit niedriger ist als der pH-Wert von 5,5 bis 5,7, der sich in reinem Regenwasser durch den natürlichen Kohlenstoffdioxidgehalt der Atmosphäre einstellt.[1]
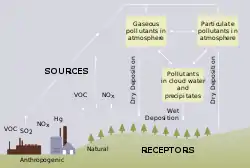
Hauptursache für den sauren Regen ist die Luftverschmutzung, insbesondere durch säurebildende Abgase. Aber auch in der Umgebung von aktiven Vulkanen kommt es zu sauren Niederschlägen. Saurer Regen schädigt Natur und Umwelt und ist ein Hauptverursacher von Waldschäden. Der Zusammenhang zwischen Umweltbelastung und Industrialisierung in Europa wurde zum Beispiel in den skandinavischen Ländern beobachtet.[2] Saurer Regen wird auch durch Transmission (Verteilung der Schadstoffemissionen in der Atmosphäre durch Wind etc.) in weit entfernte Regionen verursacht. Das bedeutet, dass Verursacher und Empfänger von saurem Regen oft verschiedene Staaten sind. Ein weiteres Beispiel ist die transnationale Umweltverschmutzung in Ostasien seit den 1990er Jahren.[3][4]
Neben dem sauren Regen muss ebenfalls die Schädigung von Pflanzen durch Nebel (saurer Nebel) in Betracht gezogen werden. Nebelwasser ist häufig deutlich saurer (hat einen niedrigeren pH-Wert) als Regenwasser, da Nebel effizienter Schadstoffe aus der Luft aufnimmt als Regen.
Ursachen
Hauptverantwortlich für sauren Regen ist die Luftverschmutzung durch Abgase. Die Schwefelverunreinigungen der Atmosphäre stammen hauptsächlich aus Verbrennungen von schwefelhaltigen fossilen Brennstoffen (Kohle, Erdöl und Erdölprodukte), die als Heiz- und Treibstoffe verwendet werden. Daneben stammen sie auch aus vulkanischen Exhalationen. Der größte Teil des Schwefels liegt in der Atmosphäre als Schwefeldioxid vor, das primäre Produkt der Oxidation schwefelhaltiger organischer Stoffe.
- (S)org + O2 → SO2
Die Schwefeldioxid-Konzentrationen in der Atmosphäre über Deutschland liegen gegenwärtig unter 25 Mikrogramm je Kubikmeter. In geringeren Konzentrationen als Schwefeldioxid ist Schwefeltrioxid in der Atmosphäre enthalten, das durch Oxidation von Schwefeldioxid mit Sauerstoff (Dioxygen, O2) gebildet wird und besonders in vulkanischen Exhalationen enthalten ist:
- 2 SO2 + O2 → 2 SO3
Sowohl Schwefeldioxid wie auch Schwefeltrioxid lösen sich in Wasser und bilden dabei Schweflige Säure (H2SO3) beziehungsweise Schwefelsäure (H2SO4):
- SO2 + H2O → H2SO3
- SO3 + H2O → H2SO4
Wolkenwasser wie auch Niederschläge enthalten diese Säuren (neben Kohlensäure) in unterschiedlichen Konzentrationen und sind deshalb schwächer oder stärker sauer (pH-Werte etwa 5,5 bis 4,2).
Weiterhin entstehen bei der Verbrennung – insbesondere bei hohen Temperaturen (siehe Zeldovich-Mechanismus) – Stickoxide (NOx) durch Umwandlung des im Brennstoff und in der Luft enthaltenen Stickstoffs. Diese bilden mit Wasser und Sauerstoff sowohl Salpetrige Säure (HNO2) als auch Salpetersäure (HNO3). Hier gibt es verschiedene chemische Reaktionen:
- 2 NO2 + H2O → HNO2 + HNO3
- N2O4 + H2O → HNO2 + HNO3
Die Schwefeloxide sind zu etwa zwei Dritteln, die Stickoxide zu etwa einem Drittel für die Versauerung der Niederschläge verantwortlich.
Auswirkung
Auf Pflanzen

Saurer Regen kann durch die Versauerung des Bodens Pflanzen schädigen und wurde ursächlich mit neuartigen Waldschäden in Verbindung gebracht. Die im Wesentlichen betroffenen Wälder liegen in Regionen mit häufigen und ergiebigen Niederschlägen, die zudem relativ niedrige Jahresdurchschnittstemperaturen aufweisen. Dies trifft in Deutschland insbesondere auf Wälder in höheren Lagen der Mittelgebirge und der Alpen zu.
Durch die Übersäuerung des Bodens wird die natürliche Zusammensetzung gestört. Es werden giftige Schwermetallionen sowie Aluminiumionen freigesetzt, die die Feinwurzeln der Bäume absterben lassen. Dadurch entstehen Störungen im Wasser- und Nährstoffhaushalt des Baumes, und seine Widerstandskraft nimmt stark ab. Die betroffenen Bäume sind anfälliger gegenüber Krankheiten und natürlichen Belastungen. Unter normalen Bedingungen harmlose Einwirkungen wie Bodenfrost oder ein Schädlingsbefall können am geschwächten Baum erhebliche Schäden anrichten. Zunächst wirkt sich die Schädigung auf die Blatt- oder Nadelkronen der Bäume aus, die Blätter oder Nadeln werden abgeworfen. Dies führt zu einer Kronenverlichtung. Außerdem kann Wipfeldürre entstehen und der Baum schließlich absterben. Durch den sauren Regen werden außerdem Jungbäume am Wachstum gehindert.
Dadurch ist saurer Regen eine der Ursachen für Waldschäden. Die aufgetretenen Krankheitsbilder sind allerdings sehr unterschiedlich. Man findet neben gesunden Beständen in vergleichbaren Lagen auch stark geschädigte. Daher werden neben den sauren Niederschlägen inzwischen auch noch andere Ursachen für die Baumschädigungen vermutet wie etwa die globale Erwärmung oder Anfälligkeit bestimmter Baumarten gegenüber Bodenversauerung. Als Ursachen nachgewiesen werden konnten Mineralienmangel, Schädigung geschwächter Bäume durch Pilze, Bakterien und forstwirtschaftliche Fehler. Der saure Regen ist einer von mehreren Faktoren, deren Auswirkungen vor allem in den 1980er Jahren unter dem Begriff Waldsterben zu einer intensiven öffentlichen Diskussion führten. Mit dem Waldzustandsbericht wird in Deutschland versucht, hierfür wissenschaftliches Material darzustellen.
Auf Gewässer
Gewässer werden zunehmend durch Säureeintrag belastet. Dabei erfolgt der Säureeintrag weniger direkt über die sauren Niederschläge als eher indirekt über die Zuflüsse. Durch den Bodenabfluss und als Folge des Säureeintrags reichern sich im Wasser Metall-Kationen, z. B. Al3+, an, die als Zellgifte wirken und zu einer Artenverarmung führen können.
Die Geologie der Einzugsgebiete von Flüssen und Seen hat weiterhin einen großen Einfluss auf die Versauerung. Stehen im Einzugsgebiet vor allem Gesteine an, die kaum neutralisierend auf den sauren Regen wirken (z. B. Granit, Gneis, Sandstein), sind diese Gewässer von der Versauerung besonders betroffen. Umgekehrt haben Gewässer, die im Einzugsgebiet große Kalksteinvorkommen haben, kaum Probleme mit der Versauerung.
Der Anstieg der CO2-Konzentration in der Atmosphäre kann darüber hinaus zu einer Versauerung der Ozeane führen und könnte so eine Bedrohung für das Fortbestehen der ozeanischen Biosphäre darstellen, da sich beispielsweise ab einem bestimmten pH-Wert die Kalkschalen von Muscheln und Schnecken auflösen, wobei gemäß folgender Gleichungen pro kg Kohlendioxid 2,27 kg Calciumcarbonat gelöst werden:
- CO2 + H2O → H2CO3 und
- CaCO3 + H2CO3 → 2 HCO3− + Ca2+
Auf Gebäude

Der schwefelsaure Regen greift insbesondere Kalksandstein und Kalkstein an, aber auch Betonkonstruktionen. Dadurch schreitet die Verwitterung von Gebäuden wesentlich schneller voran, und zahlreiche Gebäude und Kulturdenkmäler werden so stark beschädigt oder zerstört. Gelangt Fluor in die Luft – z. B aus Abgasen der Chemischen Industrie – kann der dadurch angesäuerte Regen auch Fensterglas verätzen. Am Kölner Dom konnte dieses Phänomen an einem mittelalterlichen Kirchenfenster beobachtet werden.
Auch Marmor wird angegriffen, da er aus Calciumcarbonat besteht. Wenn saurer Regen auf Marmor trifft, entstehen vielfältige Schäden. Dazu gehören angeraute Oberflächen, Abtragung von Material und Verlust von gemeißelten Feinstrukturen. Die Zerstörung kann die gesamte Fläche betreffen oder punktuell an reaktiven Stellen auftreten. Das Calciumcarbonat reagiert mit den Oxoniumionen im sauren Regen. Bei dieser Reaktion zerfällt es in Calciumionen, Kohlendioxid und Wasser:
- CaCO3 + 2 H3O+ → CO2 + 3 H2O + Ca2+
Dann reagieren die Sulfationen der Schwefelsäure mit den Calciumionen und überziehen den Marmor oder Kalkstein mit einer weißen Schicht von Gips:
- Ca2+ + SO42− → CaSO4
Der Regen trägt mit der Zeit einen Teil der Gipskruste ab. Dies führt zu kleinen Rissen und zunehmender Erosion.
Die Wiederherstellung von beschädigtem Kulturgut und Gebäuden ist sehr kostspielig. Allein für die Westminster Abbey in London wurden bis zum Jahr 1990 bis zu 10 Mio. Pfund aufgewendet, um vom sauren Regen bzw. Nebel („Smog“) verursachte Schäden zu beseitigen.
Das Taj Mahal in Indien und die Akropolis in Athen hatten ebenso unter der Säureeinwirkung zu leiden wie das kanadische Parlamentsgebäude, das Kapitol in Washington und der Kölner Dom.[5]
Viele Originalskulpturen wurden mittlerweile in Innenräume verlagert und im Außenbereich durch Kopien oder Abgüsse ersetzt.
Gegenmaßnahmen
Bekämpfung der Symptome


Als Gegenmaßnahme versucht man in vielen Gegenden Europas (in der Schweiz gesetzlich nicht geregelt[6][7]), mit Kalk die Übersäuerung zu neutralisieren. Vielerorts werden hierzu große Mengen Kalk per Hubschrauber verstreut.
In der Nähe von Kalk- oder Zementwerken mit schlechter Entstaubung kann die unbeabsichtigte Emission von Kalkstaub im Extremfall sogar zur Umkehrung des Phänomens führen und es entsteht basischer Regen. Ein solcher Effekt kann auch eintreten, wenn große Mengen Asche oder andere basische Stäube in die Luft geraten, etwa als Folge großflächiger Waldbrände oder eines Vulkanausbruches.
Bekämpfung der Ursachen
International gibt es seit den 1970er Jahren Bestrebungen zu abgestimmten Maßnahmen. Diese Bestrebungen führten schließlich zu dem Übereinkommen über weiträumige grenzüberschreitende Luftverunreinigung. Demzufolge wurde seit den 80er-Jahren dazu übergegangen, bei den großen fossilen Kraftwerken die Rauchgase zu entschwefeln. Dabei wird das SO2 aus dem Abgas entfernt und meist zu CaSO4 (Gips) umgesetzt, welches sich als REA-Gips nutzen oder deponieren lässt. Dies ist bei Verbrennungsmotoren in Autos, Flugzeugen etc. und Gas- und Ölheizungen jedoch nicht möglich. Daher wird aus Kraftstoffen wie Benzin, Diesel, Kerosin sowie Heizöl und Erdgas der Schwefel mittels spezieller Verfahren vor dem Gebrauch entfernt. Dadurch konnte bisher in den westlichen Industrieländern der Eintrag von SO2 in die Atmosphäre erheblich verringert werden. Studien von Forschern des Instituts für Weltforstwirtschaft in Hamburg zur Berechnung der Versauerung auf Basis dynamischer Modelle weisen darauf hin, dass die Grenzwerte des internationalen Kooperationsprogrammes für die Erfassung und Überwachung der Auswirkungen von Luftverunreinigungen (ICP Forests) im Jahr 2020 mit wenigen lokalen Ausnahmen voraussichtlich nicht mehr überschritten werden.[8]
Das Entfernen der Stickstoffoxide gestaltet sich dagegen erheblich schwieriger. Diese entstehen ab einer bestimmten Temperatur bei allen Verbrennungsprozessen, sofern nicht in stickstofffreier Atmosphäre gearbeitet wird. Dies ist kaum bzw. nur mit großem Aufwand möglich, da unsere Atmosphäre zu 78,09 % aus Stickstoff besteht. Deshalb müsste die Bildung von Stickstoffoxiden im Abgas verringert werden, was in Fahrzeugkatalysatoren geschieht, jedoch nicht zu 100 % möglich ist (siehe Lambda-Fenster). Stickstoffoxide zusammen mit der UV-Strahlung der Sonne sind auch die Hauptursache für das Entstehen von bodennahem Ozon. Somit braucht man entweder andere als die bisherigen Katalysatoren, oder man muss die Verbrennungsmotoren z. B. durch Elektromotoren ersetzen.
Literatur
- Gene E. Likens und F. Herbert Bormann: Acid Rain: A Serious Regional Environmental Problem. In: Science. Band 184, Nr. 4142, 1974, S. 1176–1179, doi:10.1126/science.184.4142.1176.
- Gerd Spelsberg: Rauchplage: 100 Jahre saurer Regen. Alano Verlag, Aachen 1984, ISBN 3-924007-05-5.
- Walter Jansen, Anke Block, Jürgen Knaack: Saurer Regen: Ursachen, Analytik, Beurteilung. Metzler Verlag, Stuttgart 1987, ISBN 3-476-30291-1.
- Gregory S. Wetstone, Armin Rosencranz: Weltbedrohung saurer Regen: Abwehrversuche in Europa und Nordamerika; eine Studie des Environmental Law Institute für den German Marshall Fund of the United States. Dreisam-Verlag, Freiburg i. Br. 1985, ISBN 3-921472-87-3.
- Lee, Meehye und Adeel Zafar: Managing air pollution problems in Korea. In: Adeel, Zafar (Hrsg.): East Asian experience in environmental governance: Response in a rapidly Developing region. United Nations Univ. Press 2003.
- Yamauchi, Makiko: The Japanese approach to governance of air pollution problems. In: Adeel, Zafar (Hrsg.): East Asian experience in environmental governance: Response in a rapidly Developing region. United Nations Univ. Press 2003.
Einzelnachweise
- Dipl.-Ing. (FH), BSc Frank Sprenger: Kondenswasser aus Heizkesseln und dessen Neutralisation, Sonderdruck Buderus Heiztechnik.
- Günter Fellenberg: Chemie der Umweltbelastung. 3. Auflage. Verlag B. G. Teubner, Stuttgart 1997, ISBN 3-519-23510-2, S. 63 ff.
- Meehye Lee, Zafar Adeel: Managing air pollution problems in Korea. In: Zafar Adeel (Hrsg.): East Asian experience in environmental governance: Response in a rapidly Developing region. United Nations Univ. Press, 2003.
- Reinhard Drifte: Transboundary Pollution as an Issue in Northeast Asian Regional Politics. In: Klaus Vollmer (Hrsg.): Ökologie und Umweltpolitik in Japan und Ostasien. Transnationale Perspektiven. Iudicium. München 2006, S. 65–84.
- derwesten.de
- admin.ch
- waldwissen.net
- chemie report, Hanno Hintze und Verena Sesin, SO2 – Europas Wälder nicht mehr sauer (Hrsg.): Verband der chemischen Industrie e.V., 09.2013, S. 10–11.