Peptid
Ein Peptid ist eine organische Verbindung, die Peptidbindungen[1] zwischen Aminosäuren enthält. Nach deren Anzahl werden Oligopeptide mit wenigen von Polypeptiden mit vielen Aminosäuren unterschieden. Lange Polypeptidketten werden auch als Proteine bezeichnet, insbesondere die durch Proteinbiosynthese gebildeten.
Eigenschaften
Peptide, bei denen einzelne Aminosäuren in einer definierten Reihenfolge (Sequenz) linear zu einer Kette verbunden sind, können als ein kleines Protein betrachtet werden.[2] Peptide mit zirkulär gebundenen Aminosäuren werden Cyclopeptide genannt. Peptide unterscheiden sich daneben vor allem durch ihre molaren Massen. Die Abgrenzung zu Proteinen nach Anzahl der verknüpften Aminosäuren ist fließend; bei einer Kette von mehr als ungefähr 100 verknüpften Aminosäuren, die sich zu einer bestimmten Form auffaltet, wird das Molekül gemeinhin als Protein bezeichnet. Peptide mit Glykosylierungen werden als Glykopeptide bezeichnet bzw. als Glykoproteine, Peptide mit Lipiden als Lipopeptide bzw. als Lipoproteine.
Organismen können Peptide durch Translation ausschließlich aus α-Aminosäuren der L-Form bilden, denn für diesen Prozess stehen allein die genetisch codierten Aminosäuren zur Verfügung, die an eine tRNA gebunden werden. Vereinzelt finden sich bei Lebewesen verschiedener Reiche auch D-Aminosäuren in Peptiden, diese sind jedoch Produkte spezieller Stoffwechselwege einer nichtribosomalen Peptidsynthese und nicht der Proteinbiosynthese.[3] Peptide erfüllen eine große Anzahl physiologischer Funktionen und können beispielsweise als Hormone wirken, andere zeigen entzündungshemmende oder entzündungsfördernde Wirkungen; es gibt auch antimikrobielle Peptide mit antibiotischen oder antiviralen Wirkungen. In einigen Fällen ist ihre Wirkungsweise gut erforscht.
Die Bezeichnung Peptid wurde erstmals 1902 von Emil Fischer verwendet[4] für die Ausgangsstoffe der Proteinabbauprodukte durch Pepsin im Pepton (zu griech. πεπτικός peptikos ‚verdauungsfähig‘ bzw. πεπτός peptos ‚gekocht‘), begriffen als aus Monomeren aufgebaut, analog einem Polysaccharid.
Struktur
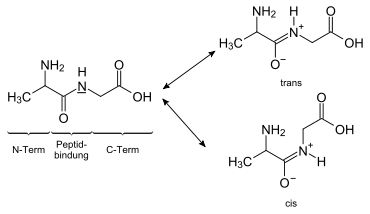
Bei der Kondensation von Aminosäuren reagiert die Carboxygruppe der einen Aminosäure formal unter Wasserabspaltung mit der Aminogruppe der anderen Aminosäure zur Säureamidgruppierung -CO-NH-, die neu geknüpfte Amidbindung zwischen dem Kohlenstoffatom der Carbonylgruppe und dem Stickstoffatom wird eine Peptidbindung. Die freie Aminogruppe an einem Ende des Peptids nennt man N-Terminus, die freie Carboxygruppe am anderen Ende wird C-Terminus genannt.
Das N-terminale Ende wird konventionell links geschrieben, das C-terminale Ende rechts. Bis auf die C-terminale Aminosäure erhalten alle linksstehenden Aminosäuren die Endung -yl an ihren Trivialnamen, lediglich der Name der rechtsstehenden Aminosäure ändert sich nicht (Beispiel: Ein Dipeptid, das sich aus zwei Alanin-Aminosäuren zusammensetzt, heißt demnach Alanyl-Alanin).
Die Peptidbindung ist nicht frei drehbar, da es zwei Resonanzstrukturen gibt. Dies spielt eine wichtige Rolle bei der Struktur von Proteinen.
Einteilung
Allgemein werden Peptide unterschieden nach Anzahl der Aminosäuren, aus denen ein Peptidmolekül besteht. Die Zahl an jeweils möglichen Kombinationen nimmt exponentiell zu, zur Basis 20 bei Beschränkung auf die 20 kanonischen Aminosäuren der Proteinbiosynthese.
| Bezeichnung | n Anzahl Aminosäuren | 20n mögliche Kombinationen |
|---|---|---|
| Dipeptide | 2 | 400 |
| Tripeptide | 3 | 8.000 |
| Tetrapeptide | 4 | 160.000 |
| Pentapeptide | 5 | 3.200.000 |
| Hexapeptide | 6 | 64.000.000 |
| Heptapeptide | 7 | 1.280.000.000 |
| Octapeptide | 8 | 25.600.000.000 |
| Nonapeptide | 9 | 512.000.000.000 |
| Oligopeptide | unter ca. 10[5] | |
| Polypeptide | über ca. 10 | |
| Makropeptide | über ca. 100 | |
Bei den meisten Peptiden bilden die miteinander verbundenen Aminosäuren Ketten; deren Enden werden als N- und C-Terminus bezeichnet, die Zahl an Aminosäuren als Kettenlänge. Bei Cyclopeptiden sind zwei oder mehr Aminosäuren ringförmig miteinander verbunden.
Proteine bestehen zumeist aus Polypeptidketten von über hundert Aminosäuren. Sie haben durch Proteinfaltung eine bestimmte räumliche Struktur, die für ihre biologische Funktion wesentlich ist und mittels Disulfidbrücken stabilisiert werden kann. Proteine können sich darüber hinaus zusammenlagern und einen Proteinkomplex bilden, so beispielsweise Hämoglobine.
Oligopeptide
Als Oligopeptide werden chemische Verbindungen bezeichnet, die aus bis zu zehn Aminosäuren bestehen, die untereinander über Peptidbindungen verknüpft sind.
Gebildet wird ein Oligopeptid, indem unter Wasserabspaltung die Aminogruppe einer ersten Aminosäure mit der Carboxygruppe einer zweiten Aminosäure reagiert. Daraufhin reagiert die freie Aminogruppe des entstandenen Dipeptids mit der Carboxygruppe einer weiteren Aminosäure. Nach diesem Muster können weitere Aminosäuren angeknüpft werden, sodass eine kurze Kette von Aminosäuren entsteht, die über Peptidbindungen miteinander verbunden sind. Werden auch die beiden Kettenenden miteinander verknüpft, entsteht ein zyklisches Peptid (siehe unten).
Oligopeptide spielen z. B. als Bestandteile von Enzymen bei Entgiftungs-, Transport- und Stoffwechselprozessen eine Rolle.
Polypeptide
Ein Polypeptid ist ein Peptid, das aus mindestens zehn durch Peptidbindungen verbundenen Aminosäuren besteht. Polypeptide können sowohl natürlichen als auch synthetischen Ursprungs sein. Polypeptidketten mit mehr als 100 Aminosäuren werden in der Regel als Proteine bezeichnet; allerdings sind für ein Protein weitere Voraussetzungen notwendig, so etwa eine bestimmte Proteinfaltung.
Makropeptide sind hochmolekulare Peptide. Sind diese durch Wasserstoff- oder Disulfidbrücken verbunden, spricht man oft von Proteinen. Doch werden manche Aminosäurenketten mit mehr als 100 Aminosäuren nur als Peptide bezeichnet.
Cyclopeptide
Zyklische Peptide bestehen aus zwei oder mehr Aminosäuren, die ringförmig angeordnet sind. Daher besitzen Cyclopeptide keine C-terminale und keine N-terminale Aminosäure. Alle zyklischen Peptide sind somit zugleich Lactame. In den ringförmigen Peptiden liegen cis-Peptidbindungen vor, während in den meisten nativen (kettenförmigen) Proteinen trans-Peptidbindungen dominieren. 2,5-Diketopiperazine sind die einfachsten zyklischen Dipeptide. Einige Antibiotika sind Cyclopeptide, z. B. Ciclosporin.[6]
Peptide mit α-Peptidbindungen und ω-Peptidbindungen sowie Isopeptide
Genau genommen entstehen Peptide durch die Verknüpfung α-ständiger Amino- und Carboxygruppen von α-Aminosäuren, die dann über α-Peptidbindungen verknüpft sind.[7]
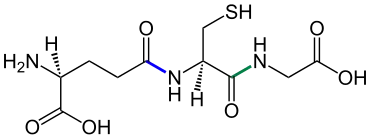
Es gibt jedoch auch α-Aminosäuren, die neben der α-Aminogruppe eine zweite Aminogruppe enthalten, z. B. L-Lysin. Ebenso gibt es α-Aminosäuren, die neben der α-Carboxygruppe eine zweite Carboxygruppe enthalten, z. B. L-Asparaginsäure und L-Glutaminsäure. Wenn nun die Verknüpfung der Aminosäuren nicht ausschließlich durch die α-ständigen Amino- und Carboxygruppen erfolgt, sondern unter Beteiligung einer end- oder seitenständigen Diaminocarbonsäuren (wie L-Lysin) und Aminodicarbonsäuren (wie L-Asparaginsäure und L-Glutaminsäure) so entstehen Peptide mit einer ω-Peptidbindung.[8]

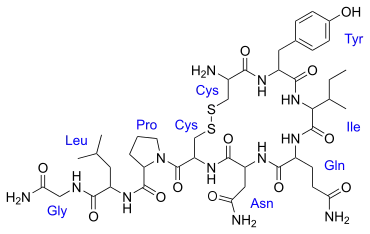
In der Natur kommen auch Mischformen vor, so enthält das Tripeptid Glutathion (γ-L-Glutamyl-L-cysteinglycin)[9] je eine α-Peptidbindung und eine ω-Peptidbindung. Die Peptidbindung zwischen der seitenständigen ε-Aminogruppe von L-Lysin und der seitenständigen Carboxygruppe von Asparaginsäure oder Glutaminsäure wird auch Isopeptidbindung genannt.
Peptidsynthese
Ribosomale Peptidsynthese
In den Zellen von Lebewesen werden an den Ribosomen einzelne Polypeptidketten aufgebaut, die anschließend zum Protein auffalten. Diese ribomosomale Peptidsynthese wird auch Proteinbiosynthese genannt.
Nichtribosomale Peptidsynthese
Daneben gibt es bei manchen Organismen auch eine nichtribosomale Peptidsynthese auf rein enzymatischem Weg mittels Nichtribosomaler Peptidsynthetasen (NRPS). Durch NRPS können auch D-Aminosäuren eingebaut werden oder Cyclopeptide entstehen als nichtribosomales Peptid (NRP). Solche NRPS kommen nicht nur in verschiedenen Mikroorganismen der drei Domänen von Bakterien, Archaeen und Eukaryoten vor, sondern beispielsweise auch bei mehrzelligen Organismen vieler Pilze und bei einigen Weichtieren.[10]
Technisch-chemische Peptidsynthese
Die technisch-chemische Synthesemethode[11] der Wahl für ein Peptid bestimmter Sequenz unterscheidet sich je nach dessen Länge:
- Kurze Peptide werden schrittweise aus der Verknüpfung von Aminosäuren aufgebaut
- Längere Peptide werden aus der Verknüpfung kürzerer Peptide aufgebaut
Wird versucht ein bestimmtes Dipeptid (z. B. Gly-Val) aus zwei verschiedenen Aminosäuren (Gly + Val) durch thermische Dehydratisierung herzustellen, entstehen eine Reihe von unerwünschten Produkten in beachtlicher Menge:[12]
Um die Selektivität zu erhöhen, werden die Carboxy- und Aminogruppen, die nicht verknüpft werden sollen, mit einer Schutzgruppe versehen (z. B. Ester, Boc, Fmoc).
Verschiedene Kopplungsreagenzien werden verwendet, welche die ungeschützte Carboxygruppe der einen Aminosäure aktivieren und so die Verknüpfung mit der Aminofunktion der zweiten Aminosäure bei milden Bedingungen ermöglichen. Es gibt verschiedene Klassen solcher Kopplungsreagenzien:[13]
- Phosphonium-Reagenzien (z. B. BOP, PyBOP)
- Uronium-Reagenzien (z. B. HBTU, HATU, TBTU)
- Immonium-Reagenzien
- Carbodiimid-Reagenzien (z. B. DCC, EDC)
- Imidazolium-Reagenzien (z. B. CDI)
- Organophosphorige Reagenzien
- Saure halogenierende Reagenzien
- Chloroformate und andere
Nachdem so die Peptidbindung geknüpft wurde, wird eine der beiden Schutzgruppen selektiv entfernt. Dann kann mit einer weiteren entsprechend geschützten Aminosäure erneut gekuppelt werden usw. Am Ende werden alle Schutzgruppen entfernt und man isoliert das gewünschte Peptid.
Die Synthese kann in flüssiger Phase oder als Festphasensynthese geschehen. Zudem können auch Enzyme zur Peptidsynthese eingesetzt werden.
Siehe auch
- Pepzym
- Peptid-Nukleinsäure (PNA)
Literatur
- S. Donadio, P. Monciardini, M. Sosio: Polyketide synthases and nonribosomal peptide synthetases: the emerging view from bacterial genomics. In: Natural Product Reports Band 24, Nummer 5, Oktober 2007, S. 1073–1109. doi:10.1039/b514050c. PMID 17898898.
Weblinks
Einzelnachweise
- Im kleinstmöglichen Peptid, einem Dipeptid aus zwei Aminosäuren, liegt nur eine Peptidbindung vor.
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 1-505, 1982, ISBN 3-527-25892-2.
- G. Kreil: D-amino acids in animal peptides. In: Annual Review of Biochemistry. 66, Nr. 1, 1997, S. 337–345. doi:10.1146/annurev.biochem.66.1.337.
- E. Fischer: Über die Hydrolyse der Proteinstoffe. In: Chemikerzeitung. Band 26, 1902, S. 939–940.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 4: M–Pk. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1985, ISBN 3-440-04514-5, S. 2894.
- Biologisch aktive Peptide. Script der Universität Leipzig, S. 16, (PDF; 3,2 MB).
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, S. 99, 1982, ISBN 3-527-25892-2.
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, S. 99, 1982, ISBN 3-527-25892-2.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 2: Cm–G. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1981, ISBN 3-440-04512-9, S. 1511.
- Hao Wang, David Fewer, Liisa Holm, Leo Rouhiainen, Kaarina Sivonena: Atlas of nonribosomal peptide and polyketide biosynthetic pathways reveals common occurrence of nonmodular enzymes. In: Proc Natl Acad Sci USA. Band 111, Nr. 25, Juni 2014, S. 9259–9264. PMC 4078802 (freier Volltext).
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 107–261, 1982, ISBN 3-527-25892-2.
- K. P. C. Vollhardt, N. E. Schore: Organische Chemie, 4. Auflage, Wiley-VCH, S. 1399–1402, 2005.
- S.Y. Han, Y.A. Kim: Tetrahedron, 60, 2004, S. 2447–2467.

