Natriumsulfat
Natriumsulfat (Na2SO4) ist ein Natriumsalz der Schwefelsäure. Das Decahydrat (Na2SO4 · 10 H2O) wird nach dem Chemiker Johann Rudolph Glauber auch Glaubersalz genannt. Auch das Karlsbader Salz, das durch Eindampfen von Karlsbader Mineralwasser gewonnen wird, besteht hauptsächlich aus Natriumsulfat-Decahydrat und wird als Abführmittel eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
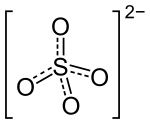 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Natriumsulfat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | Na2SO4 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 142,04 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
2,70 g·cm−3 (20 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
Zersetzung ab 890 °C[3] | |||||||||||||||||||||
| Löslichkeit |
gut in Wasser (170 g·l−1 bei 20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten |
| |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Natriumsulfat wurde 1625 von dem Chemiker und Apotheker Johann Rudolph Glauber als ein Bestandteil von Mineralwasser entdeckt. Glauber beschrieb den salzigen Geschmack des Präparates, dass es auf der Zunge schmilzt und im Gegensatz zu Salpeter nicht brennt, wenn man es in eine Flamme hält. Zudem erkannte er, dass das bei der Eindampfung erhaltene Natriumsulfat beim Erhitzen leichter wird, da es Kristallwasser enthält. Auch die wichtigste medizinische Wirkung als Abführmittel erkannte Glauber schon zu dieser Zeit.[5]
Ab 1658 experimentierte Glauber mit Kochsalz und Schwefelsäure und erhielt dabei neben Salzsäure (als Spiritus salis, Geist des Salzes bezeichnet) auch Natriumsulfat, das er nun genauer untersuchen konnte. Dabei entdeckte er insgesamt 26 verschiedene mögliche medizinische Anwendungen, aber auch Anwendungen in der Alchemie und Kunst.[5]
Nach Johann Glauber wurde das Sal mirabilis, das wundersame Salz, und später Glaubersalz genannt.
Vorkommen

Natriumsulfat kommt in der Natur als orthorhombisch kristallisierender Thénardit (α-Na2[SO4]) bzw. als Hochtemperaturmodifikation als trigonal kristallisierender Metathenardit sowie als wasserhaltiger Mirabilit (Na2[SO4] • 10H2O) vor.
Gewinnung und Darstellung
Natriumsulfat wird größtenteils aus dem natürlichen Mineral Mirabilit gewonnen. Weltweit größter Produzent mit über 70 % ist China (Stand: 2011).[6] Es fällt jedoch auch als Nebenprodukt in der chemischen Industrie bei Reaktionen an, bei denen Schwefelsäure mit Natronlauge neutralisiert wird. Eine weitere Möglichkeit zur technischen Darstellung besteht in der Umsetzung von Steinsalz mit Schwefelsäure zwecks Gewinnung von Salzsäure mit Natriumsulfat als Nebenprodukt:
- Natriumchlorid und Schwefelsäure reagieren zu Natriumsulfat und Chlorwasserstoff.
Eine Alternative ist der Hargreaves-Prozess:
- Natriumchlorid, Schwefeldioxid, Sauerstoff und Wasser reagieren zu Natriumsulfat und Chlorwasserstoff.
Natriumsulfat lässt sich im Labor durch folgende Reaktionen darstellen:
- Natriumcarbonat und Schwefelsäure reagieren zu Natriumsulfat, Wasser und Kohlenstoffdioxid.
- Bei der Neutralisation von Natronlauge mit Schwefelsäure entstehen Natriumsulfat und Wasser.
Eigenschaften

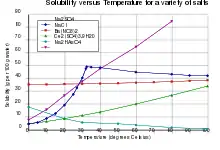
Das wasserfreie Natriumsulfat schmilzt bei 888 °C, ist hygroskopisch und gut in Wasser löslich, wobei es sich erwärmt (Lösungswärme). Dagegen löst sich das Decahydrat unter starker Abkühlung. Das Kristallwasser verlässt ab etwa 32 °C den Kristallverband, wodurch es scheint, als schmelze das Natriumsulfat. Tatsächlich löst es sich aber im frei gewordenen Wasser. Aus dieser an wasserfreiem Natriumsulfat übersättigten Lösung scheidet sich das wasserfreie Salz ab. Bei dieser Temperatur hat Natriumsulfat ein ausgeprägtes Löslichkeitsmaximum.
Verwendung
Natriumsulfat wird in Waschmitteln als Füllstoff (Stellmittel), bei der Zellstoffgewinnung (Sulfatverfahren) sowie in der Glas-, Textil- und Farbindustrie eingesetzt. Geglühtes, kristallwasserfreies Natriumsulfat wird im Labor zur Trocknung organischer Lösungsmittel verwendet. Es wird außerdem als Latentwärmespeichermaterial verwendet.
In Form des Decahydrates findet Natriumsulfat als Laxans in der Medizin Verwendung. Das Natriumsulfat-Decahydrat (Glaubersalz) wirkt exzessiv abführend aufgrund einer kompetitiven Beeinflussung des Elektrolythaushalts.
In der Lebensmitteltechnologie dient es als Festigungsmittel, Säureregulator und Trägersubstanz. Natriumsulfat und Natriumhydrogensulfat sind in der EU als Lebensmittelzusatzstoff der Nummer E 514 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.[7]
Natriumsulfat findet unter der Bezeichnung Natrium sulfuricum Verwendung als homöopathisches Arzneimittel. Zugeschriebene Wirkungen sind wissenschaftlich nicht plausibel.
Glaubersalz wird auch als mineralischer Pflanzendünger verwendet.
Einzelnachweise
- Eintrag zu E 514: Sodium sulphates in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 11. August 2020.
- Eintrag zu SODIUM SULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. August 2020.
- Eintrag zu Natriumsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu Sodium sulfate anhydrous in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- James C. Hill: Johann Glauber’s discovery of sodium sulfate – Sal Mirabile Glauberi. In: Journal of Chemical Education. 56, 1979, S. 593, doi:10.1021/ed056p593.
- ihs.com: Sodium Sulfate - Chemical Economics Handbook, Juni 2020.
- zusatzstoffe-online.de: E 514 - Natriumsulfat
