Hydrogenase
Die Hydrogenasen sind Enzyme, welche die reversible Oxidation des molekularen Wasserstoffs katalysieren:
Diese Reaktion spielt eine bedeutende Rolle bei der Stickstofffixierung und bei der Methanogenese von Biomasse zu Methan. Sowohl anaerobe (Archaeen/Bakterien) als auch einige wenige aerob lebende Mikroorganismen (Bakterien, manche Algen) enthalten Hydrogenase-Enzyme. Wasserstoffverbrauchende Methanogene leben syntroph vergesellschaftet mit wasserstoffbildenden Bakterien. Man schätzt, dass jährlich etwa 150 Millionen Tonnen Wasserstoff durch Mikroorganismen gebildet werden.[1]
Der Begriff „Hydrogenase“ wurde 1931 durch die beiden Forscher Marjory Stephenson and Leonard Hubert Stickland, den Entdecker der Stickland-Reaktion, eingeführt.[2] Das Verständnis ihrer Funktions- und Wirkungsweise kann z. B. zur Verbesserung von Wasserstoffbioreaktoren dienen.
Biochemische Klassifikation
EC 1.12.1.2 Wasserstoffdehydrogenase (Wasserstoff:NAD+ Oxidoreduktase)
EC 1.12.1.3 Wasserstoffdehydrogenase (NADP) (Wasserstoff:NADP+ Oxidoreduktase)
- H2 + NADP+ = H+ + NADPH
EC 1.12.2.1 Cytochrom-c3 Hydrogenase (Wasserstoff:Ferricytochrom-c3 Oxidoreduktase)
- 2H2 + Ferricytochrom c3 = 4H+ + Ferrocytochrom c3
EC 1.12.7.2 Ferredoxin-Hydrogenase (Wasserstoff:Ferredoxin-Oxidoreduktase)
- H2 + oxidiertes Ferredoxin = 2H+ + reduziertes Ferredoxin
EC 1.12.98.1 Coenzym F420 Hydrogenase (Wasserstoff:Coenzym F420-Oxidoreduktase)
- H2 + Coenzym F420 = reduziertes Coenzym F420
EC 1.12.5.1 Wasserstoff:Chinon-Oxidoreduktase
- H2 + Menachinon = Menaquinol
EC 1.12.98.2 5,10-Methenyltetrahydromethanopterin Hydrogenase (Wasserstoff:5,10-Methenyltetrahydromethanopterin-Oxidoreduktase)
- H2 + 5,10-Methenyltetrahydromethanopterin = H+ + 5,10-methylenetetrahydromethanopterin
EC 1.12.98.3 Methanosarcina-Phenazinhydrogenase [hydrogen:2-(2,3-dihydropentaprenyloxy)phenazin-oxidoreductase]
- H2 + 2-(2,3-Dihydropentaprenyloxy)phenazin = 2-Dihydropentaprenyloxyphenazin
Strukturelle Klassifikation
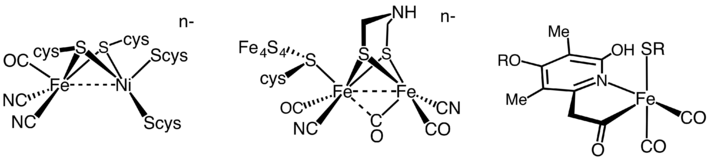
Die derzeit gültige Einteilung berücksichtigt, dass verschiedene Metalle wie Nickel oder Eisen entweder einzeln oder gemeinsam an Schwefel gebunden (meist als Cluster) oder nicht an Schwefel gebunden das katalytische Zentrum der Hydrogenasen ausmachen.
Literatur
- Thauer, RK. et al. (2010): Hydrogenases from methanogenic archaea, nickel, a novel cofactor, and H2 storage. In: Annu Rev Biochem. 79; 507–536; PMID 20235826; doi:10.1146/annurev.biochem.030508.152103
- Tamagnini, P. et al. (2007): Cyanobacterial hydrogenases: diversity, regulation and applications. In: FEMS Microbiol Rev. 31(6); 692–720. PMID 17903205; doi:10.1111/j.1574-6976.2007.00085.x.
- Vignais, PM. und Colbeau, A. (2004): Molecular biology of microbial hydrogenases. In: Curr Issues Mol Biol. 6(2); 159–188; PMID 15119826; PDF (freier Volltextzugriff, engl.)
Einzelnachweise
- Thauer, RK. et al. (2010): Hydrogenases from methanogenic archaea, nickel, a novel cofactor, and H2 storage. In: Annu Rev Biochem. 79; 507–536; PMID 20235826; doi:10.1146/annurev.biochem.030508.152103
- Stephenson, M. und Stickland, LH. (1931): Hydrogenase: a bacterial enzyme activating molecular hydrogen: The properties of the enzyme. In: Biochem J. Band 25, Nummer 1, 1931, S. 205–214, PMID 16744569, PMC 1260629 (freier Volltext).