Caesium
Caesium (nach IUPAC) [ˈʦɛːzi̯ʊm] , standardsprachlich Cäsium oder Zäsium (im amerikanischen Englisch Cesium), ist ein chemisches Element mit dem Elementsymbol Cs und der Ordnungszahl 55. Im Periodensystem steht es in der 1. Hauptgruppe, bzw. der 1. IUPAC-Gruppe und gehört zu den Alkalimetallen. Caesium ist das schwerste stabile Alkalimetall.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Caesium, Cs, 55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Alkalimetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 1, 6, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | goldgelb glänzend | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-155-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.323 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 6,5 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 132,90545196(6)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 265 (298) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 244 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 343[4] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 6s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 3.893905695(24) eV[5] ≈ 375.7 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 23.15745(6) eV[5] ≈ 2234.35 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 33.195(4) eV[5] ≈ 3202.8 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 43.0(1,7) eV[5] ≈ 4150 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 56.0(1,9) eV[5] ≈ 5400 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch-raumzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 1,90 g/cm3 (20 °C)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 0,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 5,2 · 10−6)[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 301,59 K (28,44 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 963,2 K[10] (690 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 70,94 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 66,1 kJ/mol[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 2,09 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 2,14 eV[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 4,76 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 36 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | +1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,923 V (Cs+ + e− → Cs) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 0,79 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Caesium wurde 1861 von Robert Wilhelm Bunsen und Gustav Robert Kirchhoff im Dürkheimer Mineralwasser der Maxquelle entdeckt. Aufgrund der zwei blauen Spektrallinien, mit denen das Element nachgewiesen wurde, benannten sie es nach dem lateinischen caesius für himmelblau. Das Reinelement konnte erstmals 1881 von Carl Theodor Setterberg dargestellt werden.
Caesium ist ein extrem reaktives, sehr weiches, goldfarbenes Metall. Da es sofort und sehr heftig mit Luft reagiert, wird es in abgeschmolzenen Glasampullen unter Inertgas aufbewahrt.
Eine biologische Bedeutung des nicht toxischen Elements ist nicht bekannt. Aufgrund der Ähnlichkeit zu Kalium wird es allerdings im Magen-Darm-Trakt resorbiert und analog zu Kalium vorwiegend im Muskelgewebe gespeichert. Deshalb fand das radioaktive Isotop Caesium-137 (137Cs), ein Produkt der Kernspaltung, in der Öffentlichkeit besondere Beachtung, als es infolge der Katastrophe von Tschernobyl am 26. April 1986 in größeren Mengen in die Umwelt gelangte. Durch die großflächige Verteilung – und damit vergleichsweise geringe Konzentration – im Falle Tschernobyl ist von akuter Radiotoxizität nicht auszugehen, jedoch können chronische Effekte, insbesondere durch Bioakkumulation, nicht ausgeschlossen werden. Unfälle mit größeren Mengen Caesium-137 aus unsachgemäß entsorgten Abfällen der Nuklearmedizin wie der Goiânia-Unfall haben mehrfach zu Todesfällen durch die Strahlenkrankheit geführt, da hierbei sehr hohe akute Dosen auftraten.[14][15]
Geschichte

Caesium wurde erstmals 1861 von Gustav Robert Kirchhoff und Robert Wilhelm Bunsen beschrieben. Sie untersuchten Mineralwasser aus Dürkheim und entdeckten nach der Abtrennung von Calcium, Strontium, Magnesium und Lithium zwei bisher unbekannte Linien im blauen Spektralbereich. Sie schlossen aus ihren Beobachtungen, dass es im untersuchten Mineralwasser ein weiteres, bisher unbekanntes Element geben müsse, das sie wegen der blauen Spektrallinien Caesium, nach dem lateinischen caesius für „himmelblau“, nannten.[16]
Bunsen versuchte ebenfalls Caesium von den anderen Alkalimetallen zu trennen, um weitere Eigenschaften des Elements zu erforschen. Dazu versetzte er die Lösung mit einer Platinchlorid-Lösung, um Kalium und die neuentdeckten schwereren Alkalimetalle Rubidium und Caesium als unlösliches Hexachloridoplatinat auszufällen. Das Kalium konnte durch mehrmaliges Aufkochen in wenig Wasser entfernt werden. Zur Gewinnung der reinen Chloride wurde das Platin mit Wasserstoff zum Element reduziert, so dass die nun wasserlöslichen Caesium- und Rubidiumchloride ausgelaugt werden konnten. Die Trennung von Caesium und Rubidium erfolgte unter Ausnutzung der unterschiedlichen Löslichkeit der Carbonate in absolutem Ethanol, worin Caesiumcarbonat im Gegensatz zur entsprechenden Rubidiumverbindung löslich ist. Caesiumchlorid diente Bunsen und Kirchhoff auch für eine erste Bestimmung der molaren Masse des neuen Elements, wofür sie den Wert von 123,35 g/mol fanden.[16]
Die beiden Forscher konnten kein elementares Caesium gewinnen, denn bei der Elektrolyse von geschmolzenem Caesiumchlorid entstand anstelle des Metalls eine blaue Verbindung, die sie als Subchlorid bezeichneten, bei der es sich aber wahrscheinlich um eine kolloide Mischung von Caesium und Caesiumchlorid handelte.[17] Bei der Elektrolyse einer wässrigen Lösung mit einer Quecksilberanode bildete sich das leicht zersetzbare Caesiumamalgam.[16]
Die Darstellung des elementaren Caesiums gelang schließlich 1881 Carl Theodor Setterberg, der die Probleme mit dem Chlorid vermied, indem er für die Schmelzflusselektrolyse Caesiumcyanid verwendete. Dabei störte zunächst die zum Schmelzen des Caesiumcyanids nötige relativ hohe Temperatur, die er jedoch durch das Eutektikum mit Bariumcyanid herabsetzen konnte.[18]
Vorkommen

Mit einem Gehalt von 3 ppm in der kontinentalen Erdkruste[19] ist Caesium auf der Erde ein seltenes Element. Es ist nach dem instabilen Francium das seltenste Alkalimetall. Auf Grund seiner hohen Reaktivität kommt es nicht elementar, sondern immer nur in Form von Verbindungen vor. Meist ist Caesium ein seltenes Begleitelement in Kalium- oder anderen Alkalimetallsalzen wie Lepidolith, es sind jedoch auch einige Caesiumminerale bekannt. Das häufigste Caesiummineral ist Pollucit, (Cs,Na)2Al2Si4O12 · H2O, das in größeren Vorkommen vor allem am Bernic Lake in der Nähe von Lac du Bonnet in der kanadischen Provinz Manitoba in der Tanco-Mine vorkommt. Weitere größere Vorkommen liegen in Bikita, Simbabwe und in Namibia. Die Vorkommen in der Tanco Mine bei Lac du Bonnet sind die einzigen, in denen Caesium abgebaut wird.[20] Seltenere Caesiumminerale sind beispielsweise Cesstibtantit (Cs,Na)SbTa4O12 und Pautovit CsFe2S3.
Auf Grund der Wasserlöslichkeit der meisten Caesiumverbindungen ist das Element im Meerwasser gelöst; ein Liter enthält dabei durchschnittlich 0,3 bis 4 Mikrogramm Caesium. In vergleichbaren Mengen finden sich dort auch häufigere, aber schlechter lösliche Elemente wie Nickel, Chrom oder Kupfer.[19]
Gewinnung und Darstellung

Caesium wird nur in geringem Umfang hergestellt. Im Jahr 1978 betrug die weltweit produzierte Menge an Caesium und Caesiumverbindungen etwa 20 Tonnen.[21] Ausgangsmaterial für die Gewinnung des elementaren Caesiums und aller Caesiumverbindungen ist Pollucit, der mit Säuren oder Basen aufgeschlossen werden kann. Als Säuren können Salz-, Schwefel- oder Bromwasserstoffsäure genutzt werden. Dabei entsteht jeweils eine caesium- und aluminiumhaltige Lösung, aus der durch Fällung, Ionenaustausch oder Extraktion die reinen Caesiumsalze gewonnen werden. Eine weitere Möglichkeit ist es, Pollucit mit Calcium- oder Natriumcarbonat und den entsprechenden Chloriden zu erhitzen und anschließend mit Wasser auszulaugen. Dabei entsteht eine unreine Caesiumchloridlösung.
Caesiummetall kann chemisch durch Reduktion von Caesiumhalogeniden mit Calcium oder Barium gewonnen werden. Dabei destilliert das im Vakuum flüchtige Caesiummetall ab.[21]
- Reduktion von Caesiumchlorid mit Calcium
Weitere Möglichkeiten der Caesiummetallherstellung sind die Reduktion von Caesiumhydroxid mit Magnesium und die Reduktion von Caesiumdichromat mit Zirconium.[22]
- Reaktion von Caesiumdichromat und Zirconium zu Caesium, Zirconium(IV)-oxid und Chrom(III)-oxid
Hochreines Caesium lässt sich über die Zersetzung von Caesiumazid, das aus Caesiumcarbonat gewonnen werden kann, und anschließende Destillation darstellen. Die Reaktion erfolgt bei 380 °C an einem Eisen- oder Kupferkatalysator.[23]
Eigenschaften
Physikalische Eigenschaften
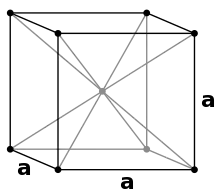

Caesium ist ein Leichtmetall mit einer Dichte von 1,873 g/cm3, das anders als die leichteren Alkalimetalle goldfarben ist. Der Grund liegt in der geringeren Bandlücke und damit an der geringeren Anregungsfrequenz, die in den blau-violetten Teil des sichtbaren Lichtspektrums reicht. Der blaue Anteil wird absorbiert, dadurch ist Caesium komplementär dazu gelb beziehungsweise goldfarben.[24] In vielen Eigenschaften steht es zwischen denen des Rubidiums und – soweit bekannt – denen des instabilen Franciums. Es besitzt mit 28,7 °C mit Ausnahme von Francium den niedrigsten Schmelzpunkt aller Alkalimetalle und hat zugleich nach Quecksilber und vergleichbar mit Gallium einen der niedrigsten Schmelzpunkte für Metalle überhaupt. Caesium ist sehr weich (Mohs-Härte: 0,2) und sehr dehnbar.
Wie die anderen Alkalimetalle kristallisiert Caesium bei Standardbedingungen im kubischen Kristallsystem mit einer kubisch-raumzentrierten Elementarzelle in der Raumgruppe Im3m (Raumgruppen-Nr. 229) mit dem Gitterparameter a = 614 pm sowie zwei Formeleinheiten pro Elementarzelle. Unter einem Druck von 41 kbar erfolgt eine Phasenumwandlung in eine kubisch-flächenzentrierte Kristallstruktur mit dem Gitterparameter a = 598 pm.[25]
Mit Ausnahme von Lithium lässt sich Caesium mit anderen Alkalimetallen beliebig mischen. Bei einem Verhältnis von 41 % Caesium, 12 % Natrium und 47 % Kalium entsteht eine Legierung mit dem bisher niedrigsten bekannten Schmelzpunkt von −78 °C.[26]
Das Caesiumatom und auch das Ion Cs+ besitzen einen großen Radius, sie sind – wiederum mit Ausnahme von Francium – die größten einzelnen Atome beziehungsweise Ionen. Dies hängt mit der besonders niedrigen effektiven Kernladung zusammen, wodurch vor allem das äußerste s-Elektron nur in geringem Maße an den Kern gebunden ist. Dies bewirkt neben dem großen Atomradius auch die geringe Ionisierungsenergie des Caesiumatoms und damit die hohe Reaktivität des Elements.[27]
Gasförmiges Caesium hat einen ungewöhnlichen Brechungsindex kleiner als eins. Das bedeutet, dass die Phasengeschwindigkeit der elektromagnetischen Welle – in diesem Fall Licht – größer als im Vakuum ist, was aber nicht im Widerspruch zur Relativitätstheorie steht.[28]
Chemische Eigenschaften
Caesium ist das Element mit der niedrigsten Ionisierungsenergie. Für die Abspaltung des äußersten Elektrons weist es die niedrigste Elektronegativität auf. Caesium gibt dieses bei Kontakt mit anderen Elementen sehr leicht ab und bildet einwertige Caesiumsalze. Da durch die Abspaltung dieses einen Elektrons die Edelgaskonfiguration erreicht ist, bildet es keine zwei- oder höherwertigen Ionen.
Reaktionen mit Caesium verlaufen in der Regel sehr heftig, so entzündet es sich beim Kontakt mit Sauerstoff sofort und bildet wie Kalium und Rubidium das entsprechende Hyperoxid.
Auch mit Wasser reagiert es sehr heftig unter Bildung von Caesiumhydroxid, diese Reaktion findet sogar mit Eis bei Temperaturen von −116 °C statt.[29]
Beim Erhitzen mit Gold bildet sich Caesiumaurid (CsAu), eine Verbindung, die – trotz Bildung aus zwei Metallen – keine Legierung ist, sondern ein Halbleiter; in flüssigem CsAu liegen Cs+- und Au−-Ionen vor.[30]
Isotope

Insgesamt sind 41 Isotope und 29 weitere Kernisomere des Caesiums bekannt. In der Natur kommt nur das Isotop 133Cs vor. Caesium ist daher ein Reinelement. Von den künstlichen Isotopen haben 134Cs mit 2,0652 Jahren, 135Cs mit 2,33 Millionen Jahren und 137Cs mit 30,08 Jahren mittlere bis sehr lange Halbwertszeiten, während die der anderen Isotope zwischen 1 µs bei 111Cs und 13,16 Tagen bei 136Cs liegen.[31]
Ein wichtiges künstliches Isotop ist 137Cs, ein Betastrahler mit einer Halbwertszeit von 30,08 Jahren.[31] 137Cs zerfällt mit einer Wahrscheinlichkeit von 94,6 % zuerst in das metastabile Zwischenprodukt 137mBa, das sich mit einer Halbwertszeit von 2,552 Minuten durch Gammazerfall in das stabile Barium-Isotop 137Ba umwandelt (vgl. Cäsium-Barium-Generator). Bei den restlichen 5,4 % gibt es einen direkten Übergang zum stabilen Barium-Isotop 137Ba. Zusammen mit weiteren Caesiumisotopen entsteht es entweder direkt bei der Kernspaltung in Kernreaktoren oder durch den Zerfall anderer kurzlebiger Spaltprodukte wie 137I oder 137Xe.
- Bildung von 137Cs bei der Kernspaltung von 235U[32]
137Cs ist neben dem Cobaltisotop 60Co eine wichtige Gammastrahlenquelle und wird in der Strahlentherapie zur Behandlung von Krebserkrankungen, zur Messung der Fließgeschwindigkeit in Röhren und zur Dickenprüfung etwa von Papier, Filmen oder Metall verwendet.[33] Daneben dient es in der Qualitätskontrolle in der Nuklearmedizin als langlebiges Nuklid in Prüfstrahlern.[34]
Größere Mengen des Isotops 137Cs gelangten durch oberirdische Kernwaffenversuche und durch die Reaktorunglücke von Tschernobyl und Fukushima in die Umwelt. Die bei allen oberirdischen Kernwaffentests freigesetzte Aktivität an 137Cs betrug 9,48·1017 Bq.[35] Die Gesamtmenge an 137Cs, das durch die Tschernobyl-Katastrophe freigesetzt wurde, hatte eine Aktivität von etwa 8,5·1016 Bq.[35] Hinzu kam eine Aktivität von etwa 4,7·1016 Bq durch 134Cs und 3,6·1016 Bq durch 136Cs.[35] Durch den Fallout wurden viele Gebiete in Europa, auch in Deutschland, mit radioaktivem Caesium belastet. Besonders reichert sich 137Cs in Pilzen an, die Lignin zersetzen können und dadurch einen leichteren Zugang zu Kalium und damit auch zu dem chemisch sehr ähnlichen Caesium haben als Pflanzen. Insbesondere der Maronen-Röhrling (Boletus badius) und der Flockenstielige Hexen-Röhrling (Boletus erythropus) reichern Caesium an, während beispielsweise der verwandte Gemeine Steinpilz (Boletus edulis) nur eine geringe Caesium-Anreicherung zeigt. Die Ursache für die hohe Caesium-Anreicherung der beiden erstgenannten Pilze ist durch deren Hutfarbstoffe Badion A und Norbadion A begründet, die Caesium komplexieren können.[36][37] Im Steinpilz sind diese beiden Derivate der Pulvinsäure nicht vorhanden.[38] Betroffen sind auch Wildtiere, die Pilze fressen.[39] Die genaue Caesiumbelastung ist abhängig von der Menge an niedergegangenem Fallout und der Bodenbeschaffenheit, da Böden Caesium unterschiedlich stark binden und damit für Pflanzen verfügbar machen können.[40]
Ein Vorfall, bei dem Menschen aufgrund der Strahlenexposition durch 137Cs starben, war der Goiânia-Unfall im Jahr 1987 in Brasilien, bei dem aus einer verlassenen Strahlenklinik zwei Müllsammler einen Metallbehälter entwendeten. Das darin enthaltene 137Cs wurde aufgrund der auffälligen fluoreszierenden Farbe an Freunde und Bekannte verteilt.[41] Beim Nuklearunfall von Kramatorsk wurde eine 137Cs-Quelle in eine Betonwand eingebaut.
Andere Radioisotope des Caesium sind im öffentlichen Bewusstsein weniger Präsent, obwohl auch sie in nennenswerter Menge in die Umwelt abgegeben wurden. Hier ist zum einen Caesium-134 zu nennen, welches durch Neutroneneinfang aus stabilem Caesium-133 entsteht, aufgrund seiner relativ kurzen Halbwertszeit um die zwei Jahre allerdings mittelfristig von weniger Relevanz ist – während 20 Jahre nach der Freisetzung noch mehr als die Hälfte des ursprünglichen Caesium-137 vorhanden ist, ist die Menge an Caesium-134 auf weniger als ein Tausendstel gesunken. Caesium-135 ist zwar relativ langlebig (Halbwertszeit über eine Million Jahre) jedoch aufgrund seiner geringen Radioaktivität von weniger Relevanz. Das Verhältnis von Caesium-135 zu anderen Caesium-Isotopen kann auch genutzt werden um herauszufinden ob der Ursprung einer radioaktiven Kontamination eine Atombombe oder ein Kernkraftwerk ist. Caesium-135 entsteht bei der Kernspaltung nicht direkt, sondern als Tochternuklid von Xenon-135. Da Xenon-135 ein starkes Neutronengift ist, wird in einem Kernkraftwerk mit (genähert) konstantem Neutronenfluss ein erheblicher Teil des Xenon-135 durch Neutroneneinfang zu Xenon-136 umgewandelt bevor es zu Caesium-135 zerfallen kann. In Atombomben ist das Xenon-135 noch gar nicht aus seinem „Vorgänger“ Jod-135 entstanden wenn durch die Explosion der Bombe der Neutronenfluss abreißt.[42][43]
Verwendung
Auf Grund der komplizierten Herstellung und hohen Reaktivität wird elementares Caesium nur in geringem Maße eingesetzt. Es hat seine Einsatzgebiete vorwiegend in der Forschung. Da Caesium eine kleine Austrittsarbeit hat, kann es als Glühkathode etwa zur Gewinnung freier Elektronen verwendet werden. Auch magnetohydrodynamische Generatoren werden mit Caesium als möglichem Plasmamaterial untersucht.[21] In der Raumfahrt wird Caesium neben Quecksilber und Xenon auf Grund seiner hohen molaren Masse, die einen größeren Rückstoß als leichtere Elemente bewirkt, als Antriebsmittel in Ionenantrieben eingesetzt.[44]
Die Sekunde als Maßeinheit der Zeit ist seit 1967 über die Frequenz eines bestimmten atomaren Übergangs im Caesium-Isotop 133Cs definiert.[45][46] Dazu passend ist Caesium das die Frequenz bestimmende Element in den Atomuhren, die die Basis für die koordinierte Weltzeit bilden.[47] Die Wahl fiel auf Caesium, weil dies ein Reinelement ist und in den 1960er Jahren der Übergang zwischen den beiden Grundzuständen mit ca. 9 GHz mit den damaligen elektronischen Mitteln bereits detektierbar war. Die Breite dieses Übergangs und damit die Unsicherheit der Messung ist nicht durch Eigenschaften des Atoms bestimmt. Durch die niedrige Verdampfungstemperatur kann mit wenig Aufwand ein Atomstrahl mit geringer Geschwindigkeitsunsicherheit erzeugt werden.
Eine Wolke von Caesiumatomen kann in magneto-optischen Fallen in der Schwebe gehalten und mit Hilfe von Lasern bis auf wenige Mikrokelvin an den absoluten Nullpunkt abgekühlt werden. Mit dieser Technik war es möglich, die Frequenzstabilität und damit die Genauigkeit der Caesium-Atomuhr deutlich zu verbessern.[48]
Daneben wird Caesium in Vakuumröhren verwendet, da es mit geringen Restspuren an Gasen reagiert und so für ein besseres Vakuum (Getter) sorgt. Dabei wird das Caesium in situ durch die Reaktion von Caesiumdichromat mit Zirconium erzeugt.[21] Caesium ist – legiert mit Antimon und anderen Alkalimetallen – ein Material für Photokathoden, die etwa in Photomultipliern eingesetzt werden.[49]
Nachweis
Zum Nachweis von Caesium können die Spektrallinien bei 455 und 459 nm[26] im Blau genutzt werden. Quantitativ lässt sich dies in der Flammenphotometrie zur Bestimmung von Caesiumspuren nutzen.
In der Polarographie zeigt Caesium eine reversible kathodische Stufe bei −2,09 V (gegen eine Kalomelelektrode). Dabei müssen als Grundelektrolyt quartäre Ammoniumverbindungen (beispielsweise Tetramethylammoniumhydroxid) verwendet werden, da andere Alkali- oder Erdalkalimetallionen sehr ähnliche Halbstufenpotentiale besitzen.[50]
Gravimetrisch lässt sich Caesium wie Kalium über verschiedene schwerlösliche Salze nachweisen. Beispiele hierfür sind das Perchlorat CsClO4 und das Hexachloridoplatinat Cs2[PtCl6].[51]
Biologische Bedeutung
Mit der Nahrung aufgenommenes Caesium wird auf Grund der Ähnlichkeit zu Kalium im Magen-Darm-Trakt resorbiert und analog zu Kalium vorwiegend im Muskelgewebe gespeichert. Die biologische Halbwertszeit, mit der Caesium vom menschlichen Körper wieder ausgeschieden wird, ist abhängig von Alter und Geschlecht und beträgt im Durchschnitt 110 Tage.[40]
Caesium ist chemisch nur in sehr geringem Maß giftig. Typische LD50-Werte für Caesiumsalze liegen bei 1000 mg/kg (Ratte, oral).[21] Von Bedeutung ist jedoch die Wirkung der ionisierenden Strahlung aufgenommener radioaktiver Caesiumisotope, die je nach Dosis die Strahlenkrankheit verursachen können. Wegen der guten Wasserlöslichkeit der meisten Caesiumsalze werden diese im Magen-Darm-Trakt vollständig resorbiert und vorwiegend im Muskelgewebe verteilt.[40] Durch die Aufnahme von radioaktivem 137Cs nach der Katastrophe von Tschernobyl im Jahr 1986 ergab sich in den ersten drei Monaten eine durchschnittliche effektive Dosis von 0,6 μSv für einen Erwachsenen der Bundesrepublik Deutschland.[40]
Sicherheitshinweise
An Luft entzündet sich Caesium spontan, weshalb es in Ampullen unter reinem Argon oder im Vakuum aufbewahrt werden muss. Wegen seiner hohen Reaktionsfähigkeit reagiert es mit Wasser explosiv. Die Explosivität kann durch die Entzündung des dabei entstehenden Wasserstoffs verstärkt werden. Brennendes Caesium muss mit Metallbrandlöschern gelöscht werden. Bei kleinen Mengen (wenige Gramm), kann trockener Sand verwendet werden. Die Entsorgung erfolgt wie bei anderen Alkalimetallen durch vorsichtiges Zutropfen von Alkoholen wie 2-Pentanol, tert-Butanol oder Octanol und anschließende Neutralisation.[13]
Verbindungen
Als typisches Alkalimetall kommt Caesium ausschließlich in ionischen Verbindungen in der Oxidationsstufe +1 vor. Die meisten Caesiumverbindungen sind gut wasserlöslich.
Halogenide
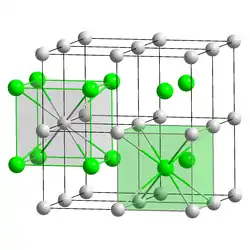
Caesium bildet mit allen Halogenen gut wasserlösliche Halogenide der Form CsX (X = Halogenid). Caesiumchlorid besitzt eine charakteristische Kristallstruktur, die einen wichtigen Strukturtyp bildet (Caesiumchloridstruktur). So kristallisieren mit Ausnahme von Caesiumfluorid auch die anderen Caesiumhalogenide. Caesiumchlorid ist Ausgangsstoff für die Gewinnung elementarem Caesiums. Da sich bei ausreichend langdauerndem Zentrifugieren automatisch ein Dichtegradient ausbildet, wird es zur Trennung und Reinigung von DNA in der Ultrazentrifuge verwendet.[21] Hochreines Caesiumiodid und Caesiumbromid werden als transparentes Szintillationsmaterial in Szintillationszählern eingesetzt.[52][53]
Sauerstoffverbindungen
Caesium bildet eine ungewöhnlich große Zahl an Sauerstoffverbindungen. Dies hängt vor allem mit der niedrigen Reaktivität des Caesiumions zusammen, so dass die Bildung von Sauerstoff-Sauerstoff-Bindungen möglich ist. Bekannt sind mehrere Suboxide wie Cs11O3 und Cs3O, bei denen ein Überschuss an Caesium vorliegt und die dementsprechend elektrische Leitfähigkeit zeigen. Daneben sind mit steigenden Sauerstoffgehalten das Oxid Cs2O, das Peroxid Cs2O2, das Hyperoxid CsO2 und das Ozonid CsO3 bekannt. Alle diese Verbindungen sind im Gegensatz zu den meisten übrigen Caesiumverbindungen farbig, die Suboxide violett oder blaugrün, die übrigen gelb, orange oder rot.
Caesiumhydroxid ist ein stark hygroskopischer, weißer Feststoff, der sich gut in Wasser löst. In wässriger Lösung ist Caesiumhydroxid eine starke Base.
Weitere Caesiumverbindungen
Caesiumcarbonat ist ein weißer Feststoff und löst sich in vielen organischen Lösungsmitteln. Es wird in verschiedenen organischen Synthesen als Base beispielsweise für Veresterungen oder für die Abspaltung spezieller Schutzgruppen eingesetzt.[54]
Caesiumnitrat findet in großem Umfang Verwendung in militärischer Pyrotechnik,[55] und zwar in NIR-Leuchtmunition[56] und Infrarottarnnebeln,[57] Während die Verwendung in NIR-Leuchtsätzen auf den intensiven Emissionslinien des Elements bei 852, 1359 und 1469 nm beruht, basiert der Einsatz in Tarnnebeln auf der leichten Ionisierbarkeit des Elements. Die beim Abbrand der pyrotechnischen Wirkmassen in der Flamme gebildeten Cs-Ionen wirken als Kondensationskeime und verstärken daher die für die Strahlungsabsorption wichtige Aerosolausbeute.
Caesiumchromat kann zusammen mit Zirconium als einfache Quelle für die Gewinnung elementaren Caesiums zur Beseitigung von Wasser- und Sauerstoffspuren in Vakuumröhren eingesetzt werden.[58]
Einen Überblick über Caesiumverbindungen gibt die Kategorie:Caesiumverbindung.
Literatur
- Manfred Bick, Horst Prinz: Cesium and Cesium Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2005 (doi:10.1002/14356007.a06_153).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Eintrag zu Caesium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Caesium) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar: Consistent van der Waals Radii for the Whole Main Group. In: J. Phys. Chem. A. 113, 2009, S. 5806–5812, doi:10.1021/jp8111556.
- Eintrag zu cesium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu caesium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Caesium) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 97.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik. Band 6: Festkörper. 2. Auflage. Walter de Gruyter, 2005, ISBN 3-11-017485-5, S. 361.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Caesium) entnommen.
- Eintrag zu Cäsium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Oktober 2020. (JavaScript erforderlich)
- http://large.stanford.edu/courses/2012/ph241/wessells1/
- https://www.cdc.gov/nceh/radiation/emergencies/isotopes/cesium.htm
- G. Kirchhoff, R. Bunsen: Chemische Analyse durch Spectralbeobachtungen. In: Annalen der Physik und Chemie. 189, 7, 1861, S. 337–381, doi:10.1002/andp.18611890702.
- Richard Zsigmondy: Colloids and the Ultramicroscope. Read books, 2007, ISBN 978-1-4067-5938-9, S. 69 (Colloids and the Ultramicroscope in der Google-Buchsuche).
- Carl Setterberg: Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst. In: Justus Liebigs Annalen der Chemie. 221, 1, 1881, S. 100–116, doi:10.1002/jlac.18822110105.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea, S. 14-18.
- U.S. Geological Survey: Caesium. (PDF-Datei; 82 kB) In: Mineral Commodity Summaries. Januar 2009.
- Manfred Bick, Horst Prinz: Cesium and Cesium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005 (doi:10.1002/14356007.a06_153).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1273.
- Fritz Blatter, Ernst Schuhmacher: Production of high purity caesium. In: Journal of the Less Common Metals. 115, 2, 1986, S. 307–313, doi:10.1016/0022-5088(86)90153-0.
- C. C. Addison: The chemistry of the liquid alkali metals. Wiley, 1984, ISBN 9780471905080, S. 7.
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. B30, 1974, S. 193–204, doi:10.1107/S0567740874002469.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1274.
- Michael Binnewies, Michael Jäckel, Helge Willner: Allgemeine und Anorganische Chemie. Spektrum Akademischer Verlag, Berlin 2003, ISBN 3-8274-0208-5, S. 49–53.
- L. J. Wang, A. Kuzmich, A. Dogariu: Gain-assisted superluminal light propagation. In: Nature. 406, 2000, S. 277–279, doi:10.1038/35018520.
- Caesium bei webelements.com, eingesehen am 5. September 2009.
- Eintrag zu Gold. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. April 2015.
- G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
- Martin Volkmer: Basiswissen Kernenergie. Informationskreis Kernenergie, Bonn 1996, ISBN 3-925986-09-X, S. 30.
- Radioisotope Brief: Cesium-137 (Cs-137). Centers for Disease Control and Prevention. Atlanta 2006, eingesehen am 25. September 2009.
- L. Geworski, Chr. Reiners. Qualitätsprüfung nuklearmedizinischer Messsysteme: Konstanzprüfung. In: L. Geworski, G. Lottes, Chr. Reiners, O. Schober. Empfehlungen zur Qualitätskontrolle in der Nuklearmedizin. Schattauer Verlag, Stuttgart/ New York 2003, ISBN 3-7945-2242-7, S. 258 und S. 263.
- UNSCEAR 2008 Report. Sources and effects of ionizing radiation. Band 2. Annex D - Health effects due to radiation from the Chernobyl accident. New York 2011, S. 49, (PDF)
- D. C. Aumann, G. Clooth, B. Steffan, W. Steglich: Komplexierung von Caesium-137 durch die Hutfarbstoffe des Maronenröhrlings (Xerocomus badius). In: Angewandte Chemie. Band 101, Nummer 4, 1989, S. 495–496, doi:10.1002/ange.19891010429.
- P. Kuad, R. Schurhammer, C. Maechling, C. Antheaume, C. Mioskowski, G. Wipff, B. Spiess: Complexation of Cs+, K+ and Na+ by norbadione A triggered by the release of a strong hydrogen bond: nature and stability of the complexes. In: Phys Chem Chem Phys. 11, 2009, S. 10299–10310, doi:10.1039/B912518C.
- B. Steffan, W. Steglich: Die Hutfarbstoffe des Maronenröhrlings (Xerocomus badius). In: Angewandte Chemie. Band 96, Nummer 6, Juni 1984, S. 435–437, doi:10.1002/ange.19840960619.
- Landesanstalt für Umwelt, Messungen und Naturschutz Baden-Württemberg: Radioaktivitätsbelastung in Wild. (Memento vom 19. Juni 2008 im Internet Archive) 2007.
- Eintrag zu Caesium 137, Caesium 134. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- IAEO: Radiological Accident in Goiânia. Wien 1988, HTML (dort PDF), eingesehen am 13. Dezember 2007.
- https://www.nature.com/articles/srep24119
- https://pubmed.ncbi.nlm.nih.gov/33076157/
- Europäische Weltraumorganisation: Ionentriebwerke: Der Ritt auf geladenen Teilchen. Stand September 2003, abgerufen am 26. September 2009.
- Resolution 9 of the 11th CGPM. Definition of the unit of time (second). Bureau International des Poids et Mesures, 1960, abgerufen am 12. April 2021 (englisch).
- Resolution 1 of the 26th CGPM. On the revision of the International System of Units (SI). Bureau International des Poids et Mesures, 2018, abgerufen am 12. April 2021 (englisch).
- Andreas Bauch: Lieferanten der Zeit. In: Physik in unserer Zeit. 25, 4, 1994, S. 188–198, doi:10.1002/piuz.19940250412.
- Andreas Bauch: Zeitmessung mit Fontänen: Atomuhren. In: Physik in unserer Zeit. 32, 6, 2001, S. 268–273, doi:10.1002/1521-3943(200111)32:6<268::AID-PIUZ268>3.0.CO;2-N.
- Norbert Schaetti: Beeinflussung der Charakteristik einer Cs-Sb-Photokathode durch Zusatz fremder Elemente. In: Zeitschrift für Angewandte Mathematik und Physik (ZAMP). 4, 5, 1953, S. 450–459, doi:10.1007/BF02067902.
- J. Heyrovský, J. Kůta: Grundlagen der Polarographie. Akademie-Verlag, Berlin 1965, S. 509.
- Caesium. In: Lexikon der Chemie. Spektrum Verlag, Heidelberg 2000.
- C. Zink u. a.: Schering Lexikon Radiologie. 3. Auflage. Abw Wissenschaftsverlag, ISBN 3-936072-20-5, S. 103.
- Wissenschaft-Online-Lexika: Eintrag zu Caesiumverbindungen im Lexikon der Chemie. abgerufen am 14. November 2009.
- Timo Flessner, Sven Doye: Cesium carbonate: A powerful inorganic base in organic synthesis. In: Journal für praktische Chemie. 341, 2, 1999, S. 186–190, doi:10.1002/(SICI)1521-3897(199902)341:2<186::AID-PRAC186>3.0.CO;2-6.
- E.-C. Koch: Special Materials in Pyrotechnics, Part II: Application of Caesium and Rubidium Compounds in Pyrotechnics. In: J. Pyrotech. 15, 2002, S. 9–24 (Abstract (Memento vom 13. Juli 2011 im Internet Archive)).
- C. W. Lohkamp: USP 3 733 223, The United States as represented by the Secretary of the Navy, USA, (1973).
- M. Weber DE 32 38 444, Pyrotechnische Fabrik F. Feistel GmbH & Co. KG, Göllheim, (1982).
- Eintrag zu Caesium-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.

