Ylide
Ein Ylid ist ein inneres Salz, bei dem ein anionisches Zentrum einer kationischen Gruppe direkt benachbart ist und durch diese stabilisiert wird.[1]
Geschichte
Die ersten Ylide wurden bereits 1894 von Michaelis und Gimborn synthetisiert, jedoch nicht als solche erkannt.[2][3][4] In der Folge erfolgte die erste bewusste Synthese und Isolierung eines Ylids 1919 durch Staudinger und Meyer.[5]
Struktur
Viele Eigenschaften von Yliden lassen sich auf die besondere elektronische Struktur der zentralen ylidischen Bindung zurückführen. Diese Bindung kann auf verschiedene Arten beschrieben werden. Zum einen als Zwitterion, mit sowohl kovalentem („-yl“) als auch ionischen („-id“) Charakter der Bindung. Das Molekül entspricht dabei einem Zwitterion mit einer Ladungstrennung zwischen einer Oniumgruppe (zum Beispiel Phosphonium) und einem direkt benachbarten anionischen Zentrum wie einem Carbanion.[1][6] Die Stabilisierung erfolgt dabei durch negative Hyperkonjugation der negativen Ladung des anionischen Zentrums in ein antibindendes σ*-Orbital der Oniumgruppe zu einem ihrer Substituenten.[7] Daraus resultiert die Beschreibung in einer mesomeren Grenzstruktur mit einem Doppelbindungscharakter zwischen der Oniumgruppe und dem anionischen Zentrum.
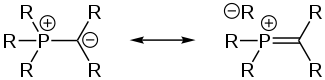
In der Vergangenheit spielte weiterhin die Beschreibung als Ylen mit alkylischem („-yl“) und kovalentem Doppelbindungscharakter („-en“) eine Rolle. In dieser Struktur wird allerdings die Oktettregel verletzt. Diese Verletzung wurde mit einer Beteiligung der d-Orbitale der Oniumgruppe erklärt. Allerdings konnten computerchemische Untersuchungen zeigen, dass diese lediglich eine untergeordnete Rolle spielt.[6][7]
In neueren Veröffentlichungen wird weiterhin die Beschreibung als phosphanstabilisiertes Carben vorgeschlagen und ausführlich diskutiert.[7][8][9][10]
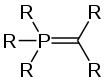 Die veraltete Beschreibung eines P-Ylids als Ylen.
Die veraltete Beschreibung eines P-Ylids als Ylen.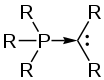 Die Beschreibung eines P-Ylids als phosphanstabilisiertes Carben.
Die Beschreibung eines P-Ylids als phosphanstabilisiertes Carben.
Synthese von Yliden
Insbesondere die Synthese von P- und S- Yliden erfolgt in der Regel durch Deprotonierung der entsprechenden Phosphonium- beziehungsweise Sulfoniumsalze in α-Position zur Oniumgruppe.[1] Es sind allerdings auch andere Syntheserouten bekannt. Beispielsweise können N-Ylide durch die Reaktion von Carbenkomplexen mit Aminen erhalten werden.[11] Die Synthese von Br-Ylide kann hingegen durch die Umsetzung von geeigneten Brom(III)-Precursoren mit Bis(perfluoaralkylsulfon)methylen erfolgen.[12] Die so erhaltenen Br-Ylide reagieren wiederum mit Arylchloriden oder -iodiden zu den entsprechenden Cl- oder I-Derivaten.[13]
Arten von Yliden
In einer Vielzahl von Yliden fungiert ein Kohlenstoffatom als anionisches Zentrum. Diese Verbindungen werden entsprechend dem Zentralatom der Oniumgruppe beispielsweise als P-, S- oder As-Ylide bezeichnet.
P-Ylide
Mit Yliden sind umgangssprachig häufig Phosphor-Ylide (auch als Phosphorane bezeichnet) gemeint. Es handelt sich dabei um phosphororganische Verbindungen, in denne das Phosphoratom die Oxidationsstufe +V hat. Anwendung finden P-Ylide insbesondere in der Wittig-Reaktion.[14][15] Meist werden sie nicht hierbei isoliert, sondern in situ hergestellt und direkt mit einem Aldehyd umgesetzt, welches schließlich die Methylen-Gruppe des Ylids erhält (d. h., aus C=O wird C=CH2). Diese Reaktion und ihre Variationen (zum Beispiel Horner-Wadsworth-Emmons-Reaktion) werden in einer Vielzahl industrieller Prozesse als Schlüsselschritt angewandt (zum Beispiel in der Vitaminsynthese).
Schmidbaur erkannte als erster, dass P-Ylide aufgrund ihrer Donoreigenschaften (negative Ladung des Carbanions) als Liganden für Metalle geeignet sind. Ihm gelang auch erstmals die Isolierung des Trimethylmethylenphosphorans (Me3P=CH2), einer extrem reaktiven Verbindung.
S-Ylide
Eine zweite wichtige Klasse an Yliden sind die S-Ylide. Diese lassen sich in Sulfonium-Ylide der Form R2S+–C-R2 mit Schwefel in der Oxidationsstufe +III und Sulfoxonium-Ylide der Form R2(O)S+–C-R2 mit einem Schwefelatom in der Oxidationsstufe +V unterteilen.[16] Insbesondere Sulfoniumylide finden Anwendung in der Johnson-Corey-Chaykovsky-Reaktion[14][15] oder treten in der Swern-Oxidation[15] als Intermediat auf.
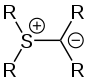 Struktur eines Sulfonium-Ylids
Struktur eines Sulfonium-Ylids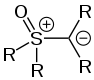 Struktur eines Sulfoxonium-Ylids
Struktur eines Sulfoxonium-Ylids
N-Ylide
Als nach den P- und S-Yliden wichtigste Art von Yliden gelten die N-Ylide.[11] Diese weisen eine große strukturelle Vielfalt auf. So ist in den Ammonium-Yliden, die strukturell den P-Yliden gleichen, der Stickstoff tetravalent und sp3-hybridisiert. Dem Gegenüber stehen die Azomethin-, Pyridinium- und Triazolium-Ylide. In diesen ist der Stickstoff trivalent und sp2-hybridisiert.[11]
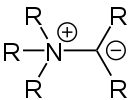 Struktur eines Ammonium-Ylids
Struktur eines Ammonium-Ylids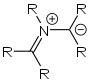 Struktur eines Azomethin-Ylids
Struktur eines Azomethin-Ylids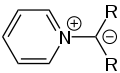 Struktur eines Pyridinium-Ylids
Struktur eines Pyridinium-Ylids
Weitere einfache Ylide
Es sind noch weitere Ylide von Hauptgruppenelementen in der Oniumgruppe bekannt, zum Beispiel mit Arsen (As-Ylide),[17][18] Antimon (Sb-Ylide),[18] Selen (Se-Ylide)[19] oder Halogenen (Halogen-Ylide).[20][21]
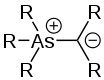 Struktur eines As-Ylids
Struktur eines As-Ylids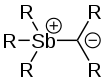 Struktur eines Sb-Ylids
Struktur eines Sb-Ylids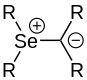 Struktur eines Se-Ylids
Struktur eines Se-Ylids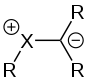
Neben diesen gibt es allerdings noch eine Vielzahl an weiteren funktionellen Gruppen, in denen ein anderes Element als Kohlenstoff das anionische Zentrum bildet. So können beispielsweise die S–O-Bindungen in Sulfoxiden oder Sulfonen als ylidisch aufgefasst werden.[22][23] Als anionische Zentren fungieren in diesen Fällen die Sauerstoffatome. Dasselbe gilt ebenfalls für Phosphanoxide.[24]
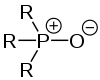 Ylidische Schreibweise eines Phosphanoxids
Ylidische Schreibweise eines Phosphanoxids Ylidische Schreibweise eines Sulfoxids
Ylidische Schreibweise eines Sulfoxids
Bisylide
Eine weitere Klasse von Yliden sind die Bisylide. Bei diesen Verbindungen ist ein zweifach negativ geladenes Carbanion mit zwei Oniumgruppen substituiert. Auch diese Verbindungen sind entsprechend neutral geladen. Handelt es sich bei beiden Oniumgruppen um Phosphoniumgruppen, werden diese Verbindungen auch als Carbodiphosphorane bezeichnet, allerdings sind auch sulfonium-[25] und phosphonium-/sulfonium gemischtsubstituierte[26] Bisylide bekannt. Auch Seloniumgruppen können zur Stabilisierung der Verbindung eingesetzt werden.[27] Weiterhin können stark gebogene Allene auch als Bisylide (Carbodicarbene) aufgefasst werden.[7][28][29]
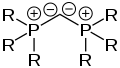 Struktur von phosphonium-substituierten Bisyliden (Carbodiphosphoranen)
Struktur von phosphonium-substituierten Bisyliden (Carbodiphosphoranen)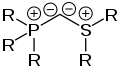 Struktur von phosphonium-/sulfonium-substiituierten Bisyliden
Struktur von phosphonium-/sulfonium-substiituierten Bisyliden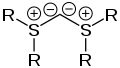 Struktur von sulfonium-substituierten Bisyliden
Struktur von sulfonium-substituierten Bisyliden Ein Allen (links) gegenüber einem gebogenen Allen in ylidischer Schreibweise (rechts)
Ein Allen (links) gegenüber einem gebogenen Allen in ylidischer Schreibweise (rechts)
Yldiide
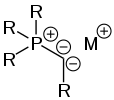
In Yldiiden, teilweise auch als metallierte Ylide bezeichnet, wird ein zweifach negativ geladenes Carbanion im Gegensatz zu Bisyliden nur durch eine Oniumgruppe stabilisiert. Diese Verbindungen sind entsprechend anionisch. Als Gegenion fungieren dabei Alkalimetallkationen.[30][31][32] Yldiide eignen sich zur Einführung von Ylidsubstituenten durch Salzmetathesereaktionen.[33][34]
Verwendung

Besondere Bekanntheit haben P-Ylide durch ihren Einsatz als Reagenzien zur C=C-Bindungsknüpfung in der Wittig-Reaktion,[35] für die ihr Entdecker Georg Wittig 1979 mit dem Nobelpreis für Chemie ausgezeichnet wurde.[36] S-Ylide werden hingegen hauptsächlich in der Johnson-Corey-Chaykovsky-Reaktion in der Synthese von Epoxiden, Aziridinen und Cyclopropanen verwendet.[37] Neben diesen Anwendungen dienen Ylide beispielsweise in ylidsubstituierten Carbenen oder deren schwereren Homologen jedoch auch als Liganden. Durch den Elektronenreichtum des ylidischen Kohlenstoffatoms werden so besonders starke σ-Donoren erhalten.[38] Auch ylidsubstituierte Phosphane zeichnen sich durch besonders starke Donorliganden aus.[39][40][41] Ebenso gibt es eine Vielzahl an Beispielen von ylidsubstituierten Übergangsmetallkomplexen.[42][43][44][45][46]
Einzelnachweise
- Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Ralf Alsfasser: Riedel Moderne Anorganische Chemie. DE GRUYTER, 2012, ISBN 978-3-11-024900-2, doi:10.1515/9783110249019.
- A. Michaelis, H. V. Gimborn: Ueber das Betaïn und Cholin des Triphenylphosphins. In: Berichte der deutschen chemischen Gesellschaft. Band 27, Nr. 1, Januar 1894, S. 272–277, doi:10.1002/cber.18940270152.
- Ali Ramazani, Ali Reza Kazemizadeh: Preparation of Stabilized Phosphorus Ylides via Multicomponent Reactions and Their Synthetic Applications. In: Current Organic Chemistry. Band 15, Nr. 23, 1. Dezember 2011, S. 3986–4020, doi:10.2174/138527211798072412.
- Fausto Ramirez, Samuel Dershowitz: Phosphinemethylenes. 1 II. Triphenylphosphineacylmethylenes. In: The Journal of Organic Chemistry. Band 22, Nr. 1, Januar 1957, ISSN 0022-3263, S. 41–45, doi:10.1021/jo01352a010.
- H. Staudinger, Jules Meyer: Über neue organische Phosphorverbindungen III. Phosphinmethylenderivate und Phosphinimine. In: Helvetica Chimica Acta. Band 2, Nr. 1, 1919, S. 635–646, doi:10.1002/hlca.19190020164.
- Steven M. Bachrach: Molecular structure of phosphonium ylides. In: The Journal of Organic Chemistry. Band 57, Nr. 16, Juli 1992, ISSN 0022-3263, S. 4367–4373, doi:10.1021/jo00042a012.
- Viktoria H. Gessner (Hrsg.): Modern Ylide Chemistry (= Structure and Bonding). Springer International Publishing, Cham 2018, ISBN 978-3-319-89544-4, doi:10.1007/978-3-319-89545-1.
- Daniel Himmel, Ingo Krossing, Andreas Schnepf: Dative Bindungen bei Hauptgruppenelementverbindungen: ein Plädoyer für weniger Pfeile. In: Angewandte Chemie. Band 126, Nr. 2, 7. Januar 2014, S. 378–382, doi:10.1002/ange.201300461.
- Gernot Frenking: Dative Bindungen bei Hauptgruppenelementverbindungen: ein Plädoyer für mehr Pfeile. In: Angewandte Chemie. Band 126, Nr. 24, 10. Juni 2014, S. 6152–6158, doi:10.1002/ange.201311022.
- Daniel Himmel, Ingo Krossing, Andreas Schnepf: Dativ oder nicht dativ? In: Angewandte Chemie. Band 126, Nr. 24, 10. Juni 2014, S. 6159–6160, doi:10.1002/ange.201403078.
- Hillary J. Dequina, Jennifer M. Schomaker: Aziridinium Ylides: Underused Intermediates for Complex Amine Synthesis. In: Trends in Chemistry. Band 2, Nr. 10, Oktober 2020, S. 874–887, doi:10.1016/j.trechm.2020.08.003, PMID 33665590.
- Masahito Ochiai, Norihiro Tada, Kentaro Murai, Satoru Goto, Motoo Shiro: Synthesis and Characterization of Bromonium Ylides and Their Unusual Ligand Transfer Reactions with N-Heterocycles. In: Journal of the American Chemical Society. Band 128, Nr. 30, 2006, S. 9608–9609, doi:10.1021/ja063492+.
- Masahito Ochiai, Norihiro Tada, Takuya Okada, Atushi Sota, Kazunori Miyamoto: Thermal and Catalytic Transylidations between Halonium Ylides and Synthesis and Reaction of Stable Aliphatic Chloronium Ylides. In: Journal of the American Chemical Society. Band 130, Nr. 7, Februar 2008, ISSN 0002-7863, S. 2118–2119, doi:10.1021/ja074624h.
- F. Volatron, O. Eisenstein: Wittig versus Corey-Chaykovsky Reaction. Theoretical study of the reactivity of phosphonium methylide and sulfonium methylide with formaldehyde. In: Journal of the American Chemical Society. Band 109, Nr. 1, Januar 1987, ISSN 0002-7863, S. 1–14, doi:10.1021/ja00235a001.
- Jie Jack Li: Name reactions : a collection of detailed reaction mechanisms. 4th ed Auflage. Springer, Berlin 2009, ISBN 978-3-642-01053-8.
- Giorgiana Denisa Bisag, Silvia Ruggieri, Mariafrancesca Fochi, Luca Bernardi: Sulfoxonium ylides: simple compounds with chameleonic reactivity. In: Organic & Biomolecular Chemistry. Band 18, Nr. 43, 2020, ISSN 1477-0520, S. 8793–8809, doi:10.1039/D0OB01822H.
- John A. Seed, Helen R. Sharpe, Harry J. Futcher, Ashley J. Wooles, Stephen T. Liddle: Nature of the Arsonium‐Ylide Ph 3 As=CH 2 and a Uranium(IV) Arsonium–Carbene Complex. In: Angewandte Chemie. Band 132, Nr. 37, 7. September 2020, ISSN 0044-8249, S. 16004–16008, doi:10.1002/ange.202004983.
- Douglas Lloyd, Ian Gosney, Raymond A. Ormiston: Arsonium ylides (with some mention also of arsinimines, stibonium and bismuthonium ylides). In: Chemical Society Reviews. Band 16, 1987, ISSN 0306-0012, S. 45, doi:10.1039/cs9871600045.
- Józef Drabowicz, Aneta Rzewnicka, Remigiusz Żurawiński: Selenonium Ylides: Syntheses, Structural Aspects, and Synthetic Applications. In: Molecules. Band 25, Nr. 10, 22. Mai 2020, ISSN 1420-3049, S. 2420, doi:10.3390/molecules25102420, PMID 32455915.
- W. H. Pirkle, G. F. Koser: Halonium ylides. I. In: Journal of the American Chemical Society. Band 90, Nr. 13, Juni 1968, ISSN 0002-7863, S. 3598–3600, doi:10.1021/ja01015a075.
- Masahito Ochiai, Norihiro Tada, Takuya Okada, Atushi Sota, Kazunori Miyamoto: Thermal and Catalytic Transylidations between Halonium Ylides and Synthesis and Reaction of Stable Aliphatic Chloronium Ylides. In: Journal of the American Chemical Society. Band 130, Nr. 7, Februar 2008, ISSN 0002-7863, S. 2118–2119, doi:10.1021/ja074624h.
- Terence P. Cunningham, David L. Cooper, Joseph Gerratt, Peter B. Karadakov, Mario Raimondi: Chemical bonding in oxofluorides of hypercoordinate sulfur. In: Journal of the Chemical Society, Faraday Transactions. Band 93, Nr. 13, 1997, S. 2247–2254, doi:10.1039/a700708f.
- Daniel Kaiser, Immo Klose, Rik Oost, James Neuhaus, Nuno Maulide: Bond-Forming and -Breaking Reactions at Sulfur(IV): Sulfoxides, Sulfonium Salts, Sulfur Ylides, and Sulfinate Salts. In: Chemical Reviews. Band 119, Nr. 14, 24. Juli 2019, ISSN 0009-2665, S. 8701–8780, doi:10.1021/acs.chemrev.9b00111, PMID 31243998.
- D. B. Chesnut, A. Savin: The Electron Localization Function (ELF) Description of the PO Bond in Phosphine Oxide. In: Journal of the American Chemical Society. Band 121, Nr. 10, März 1999, ISSN 0002-7863, S. 2335–2336, doi:10.1021/ja984314m.
- Takayoshi Fujii, Tomio Ikeda, Toshie Mikami, Tetsuya Suzuki, Toshiaki Yoshimura: Synthesis and Structure of (MeN)Ph2S–C–SPh2(NMe). In: Angewandte Chemie International Edition. Band 41, Nr. 14, 2002, ISSN 1521-3773, S. 2576–2578, doi:10.1002/1521-3773(20020715)41:14<2576::AID-ANIE2576>3.0.CO;2-8.
- Sergio Pascual, Matthew Asay, Ona Illa, Tsuyoshi Kato, Guy Bertrand: Synthesis of a Mixed Phosphonium–Sulfonium Bisylide R3P–C–SR2. In: Angewandte Chemie International Edition. Band 46, Nr. 47, 3. Dezember 2007, S. 9078–9080, doi:10.1002/anie.200704071.
- Tomohito Morosaki, Tsubasa Suzuki, Wei-Wei Wang, Shigeru Nagase, Takayoshi Fujii: Syntheses, Structures, and Reactivities of Two Chalcogen-Stabilized Carbones. In: Angewandte Chemie International Edition. Band 53, Nr. 36, 1. September 2014, S. 9569–9571, doi:10.1002/anie.201404795.
- Alois Fürstner, Manuel Alcarazo, Richard Goddard, Christian W. Lehmann: Coordination Chemistry of Ene-1,1-diamines and a Prototype “Carbodicarbene”. In: Angewandte Chemie International Edition. Band 47, Nr. 17, 14. April 2008, S. 3210–3214, doi:10.1002/anie.200705798.
- C. Adam Dyker, Vincent Lavallo, Bruno Donnadieu, Guy Bertrand: Synthesis of an Extremely Bent Acyclic Allene (A “Carbodicarbene”): A Strong Donor Ligand. In: Angewandte Chemie International Edition. Band 47, Nr. 17, 14. April 2008, S. 3206–3209, doi:10.1002/anie.200705620.
- Thomas Baumgartner, Bernd Schinkels, Dietrich Gudat, Martin Nieger, Edgar Niecke: Lithium Phosphoranylidene Ylides Mes*-P(E)C(H)Li(THF) 3 (E = NMes*, C(SiMe 3 ) 2 ): Synthesis, Crystal Structure, and Transmetalation. In: Journal of the American Chemical Society. Band 119, Nr. 50, Dezember 1997, ISSN 0002-7863, S. 12410–12411, doi:10.1021/ja9718127.
- Stéphanie Goumri-Magnet, Heinz Gornitzka, Antoine Baceiredo, Guy Bertrand: Synthetic Utility of Stable Phosphanylcarbenes: Synthesis and Crystal Structure of an α-(Lithiomethylene)phosphorane. In: Angewandte Chemie International Edition. Band 38, Nr. 5, 1999, ISSN 1521-3773, S. 678–680, doi:10.1002/(SICI)1521-3773(19990301)38:5<678::AID-ANIE678>3.0.CO;2-L.
- Thorsten Scherpf, Regina Wirth, Sebastian Molitor, Kai-Stephan Feichtner, Viktoria H. Gessner: Bridging the Gap between Bisylides and Methandiides: Isolation, Reactivity, and Electronic Structure of an Yldiide. In: Angewandte Chemie International Edition. Band 54, Nr. 29, 13. Juli 2015, S. 8542–8546, doi:10.1002/anie.201501818.
- Chandrajeet Mohapatra, Lennart T. Scharf, Thorsten Scherpf, Bert Mallick, Kai‐Stephan Feichtner: Isolation of a Diylide‐Stabilized Stannylene and Germylene: Enhanced Donor Strength through Coplanar Lone Pair Alignment. In: Angewandte Chemie International Edition. Band 58, Nr. 22, 27. Mai 2019, ISSN 1433-7851, S. 7459–7463, doi:10.1002/anie.201902831, PMID 30901140, PMC 6563488 (freier Volltext).
- Chandrajeet Mohapatra, Heidar Darmandeh, Henning Steinert, Bert Mallick, Kai‐Stephan Feichtner: Synthesis of Low‐Valent Dinuclear Group 14 Compounds with Element–Element Bonds by Transylidation. In: Chemistry – A European Journal. Band 26, Nr. 66, 26. November 2020, ISSN 0947-6539, S. 15145–15149, doi:10.1002/chem.202004242, PMID 32954596, PMC 7756224 (freier Volltext).
- Adalbert Maercker: The Wittig Reaction. In: Organic Reactions. John Wiley & Sons, Inc., Hoboken, NJ, USA 2011, ISBN 978-0-471-26418-7, S. 270–490, doi:10.1002/0471264180.or014.03.
- The Nobel Prize in Chemistry 1979. Abgerufen am 6. August 2021 (amerikanisches Englisch).
- Corey-Chaykovsky reaction. In: Name Reactions. Springer Berlin Heidelberg, Berlin, Heidelberg 2006, ISBN 978-3-540-30030-4, S. 157–159, doi:10.1007/3-540-30031-7_70.
- Abir Sarbajna, V. S. V. S. N. Swamy, Viktoria H. Gessner: Phosphorus-ylides: powerful substituents for the stabilization of reactive main group compounds. In: Chemical Science. Band 12, Nr. 6, 2021, ISSN 2041-6520, S. 2016–2024, doi:10.1039/D0SC03278F, PMID 34163963, PMC 8179322 (freier Volltext).
- Thorsten Scherpf, Christopher Schwarz, Lennart T. Scharf, Jana-Alina Zur, Andreas Helbig: Ylide-Functionalized Phosphines: Strong Donor Ligands for Homogeneous Catalysis. In: Angewandte Chemie International Edition. Band 57, Nr. 39, 24. September 2018, S. 12859–12864, doi:10.1002/anie.201805372, PMID 29862622, PMC 6174943 (freier Volltext).
- Philip Weber, Thorsten Scherpf, Ilja Rodstein, Dominik Lichte, Lennart T. Scharf: A Highly Active Ylide‐Functionalized Phosphine for Palladium‐Catalyzed Aminations of Aryl Chlorides. In: Angewandte Chemie International Edition. Band 58, Nr. 10, 4. März 2019, ISSN 1433-7851, S. 3203–3207, doi:10.1002/anie.201810696.
- Christopher Schwarz, Jens Handelmann, Daniel M. Baier, Alina Ouissa, Viktoria H. Gessner: Mono- and diylide-substituted phosphines (YPhos): impact of the ligand properties on the catalytic activity in gold( i )-catalysed hydroaminations. In: Catalysis Science & Technology. Band 9, Nr. 23, 2019, ISSN 2044-4753, S. 6808–6815, doi:10.1039/C9CY01861A.
- John A. Seed, Helen R. Sharpe, Harry J. Futcher, Ashley J. Wooles, Stephen T. Liddle: Nature of the Arsonium‐Ylide Ph 3 As=CH 2 and a Uranium(IV) Arsonium–Carbene Complex. In: Angewandte Chemie International Edition. Band 59, Nr. 37, 7. September 2020, ISSN 1433-7851, S. 15870–15874, doi:10.1002/anie.202004983.
- Tim Oswald, Malte Fischer, Niclas Struckmann, Marc Schmidtmann, Rüdiger Beckhaus: Reaction of Pentafulvene Titanium and Zirconium Complexes with Phosphorus Ylides: Stoichiometric Reactions and Catalytic Intramolecular Proton Shuttles. In: Organometallics. Band 38, Nr. 4, 25. Februar 2019, ISSN 0276-7333, S. 829–843, doi:10.1021/acs.organomet.8b00831.
- Alice Johnson, Isabel Marzo, M. Concepción Gimeno: Ylide Ligands as Building Blocks for Bioactive Group 11 Metal Complexes. In: Chemistry – A European Journal. Band 24, Nr. 45, 9. August 2018, ISSN 0947-6539, S. 11693–11702, doi:10.1002/chem.201801600.
- Xiao-Qiang Hu, Dominik Lichte, Ilja Rodstein, Philip Weber, Ann-Katrin Seitz: Ylide-Functionalized Phosphine (YPhos)–Palladium Catalysts: Selective Monoarylation of Alkyl Ketones with Aryl Chlorides. In: Organic Letters. Band 21, Nr. 18, 20. September 2019, ISSN 1523-7060, S. 7558–7562, doi:10.1021/acs.orglett.9b02830.
- Rachid Taakili, Cécile Barthes, Amel Goëffon, Christine Lepetit, Carine Duhayon: NHC Core Phosphonium Ylide-based Palladium(II) Pincer Complexes: The Second Ylide Extremity Makes the Difference. In: Inorganic Chemistry. Band 59, Nr. 10, 18. Mai 2020, ISSN 0020-1669, S. 7082–7096, doi:10.1021/acs.inorgchem.0c00561.