Cyclohexan
Cyclohexan (auch Hexahydrobenzol, Hexamethylen, Naphthen) ist eine farblose Flüssigkeit. Es ist ein Cycloalkan mit der Summenformel C6H12, das im Erdöl vorkommt und als Lösungsmittel und Grundstoff in der Synthese genutzt wird.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
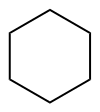 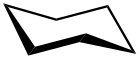 | |||||||||||||||||||
| Skelettformel (links) und Sesselkonformation (rechts) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cyclohexan | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C6H12 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit charakteristischem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 84,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,78 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
81 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (0,06 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,42623[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Die großtechnische Herstellung von Cyclohexan erfolgt durch katalytische Hydrierung von Benzol bei Temperaturen von 170–230 °C und Drücken von 20–50 bar an Raney-Nickel-Katalysatoren in der Flüssigphase.[7][8]
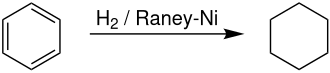
Als Reaktoren eignen sich kaskadierte Blasensäulen- oder Festbettreaktoren.[7] Daneben ist auch die Hydrierung in der Gasphase bei 400–600 °C und Drücken von 20–50 bar an Nickel, Platin oder Palladium-Katalysatoren auf Aluminiumoxid als Trägersubstanz durchführbar.[8]
Des Weiteren kann Cyclohexan auch durch fraktionierte Destillation aus Rohbenzinschnitten isoliert werden. Dies führt jedoch nur zu einer Reinheit von ca. 85 %. Die USA sind Haupthersteller von Cyclohexan, jährlich werden in den USA etwa eine Million Tonnen Cyclohexan produziert, dies entspricht etwa 34 Prozent der weltweiten Produktion. Die Gesamtproduktion von Cyclohexan in Europa beträgt jährlich zwischen 835.000 und 925.000 Tonnen. Rund 11,4 % des weltweiten Benzolmarktes entfielen 2010 auf die Produktion von Cyclohexan.[9]
Die Produktionskapazitäten für Cyclohexan betrugen 1999 weltweit etwa 5,5 Millionen Jahrestonnen.[7]
Eigenschaften
Cyclohexan schmilzt bei 6,7 °C und siedet unter Normaldruck bei 80,7 °C. Es riecht benzinartig, die Geruchsschwelle liegt bei 1,4 bis 88 mg·m−3, die Flüssigkeit ist leicht flüchtig. In Wasser ist Cyclohexan unlöslich, in organischen Stoffen, wie den Alkoholen, Kohlenwasserstoffen, Ethern oder Chlorkohlenwasserstoffen ist es gut löslich, Cyclohexan selbst ist ein Lösungsmittel für viele organische Stoffe. Die Oktanzahl des Cyclohexans ist 77. Cyclohexan ist leichtentzündlich und wassergefährdend.
Konformationen
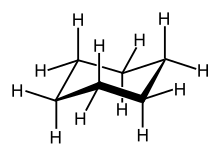
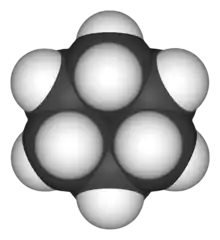
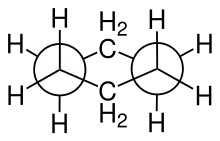
Cyclohexan spielte eine zentrale Rolle in der Entwicklung der organischen Stereochemie (Hermann Sachse, Ernst Mohr, Sachse-Mohrsche Theorie).[10] Das Molekül kann in zwei Konformationen vorliegen, der Sessel- und der Twist-Konformation. Bei Raumtemperatur liegen ca. 99 Prozent der Cyclohexanmoleküle in der Sesselkonformation vor. Ein ebenes (planares) Cyclohexan-Molekül hätte einen C-C-C-Valenzwinkel von 120° und zahlreiche ekliptische Wechselwirkungen der C–H-Bindungen, also eine hohe Winkelspannung (Baeyer-Spannung) und Torsionsspannung. In der Sessel-Konformation (engl. chair conformation) können jedoch alle C–H-Bindungen einen Torsionswinkel um 60° ausbilden, und der Valenzwinkel nähert sich dem Tetraeder-Winkel (109,4°). Daher ist diese Form energetisch günstiger und wurde lange Zeit als spannungsfrei betrachtet (siehe Artikel Spannungsenergie). Die Sesselkonformation ist also auch frei von Winkelspannung.
Aus der Sesselkonformation wird bei Zufuhr thermischer Energie die Twist-Konformation erreicht; dazu müssen Valenzwinkel verzerrt, und eine Energiebarriere muss überwunden werden. Ihr Maximum wird einer „Halbsessel“-Anordnung zugeordnet. Hierfür muss ein relativ hoher Energiebetrag (ca. 45 kJ mol−1; 10–11 kcal mol−1) aufgewendet werden.

Die Twist-Konformation ist flexibler als die Sesselform. Die früher diskutierte Boot-Konformation – im Deutschen zuerst Wannen-Konformation genannt – ist ebenfalls frei von Winkelspannung; bei ihr treten aber ekliptische Wechselwirkungen der C–H-Bindungen an den „Seiten des Bootes“ auf, was Torsionsspannung erzeugt. Die räumliche Nähe zweier Wasserstoffatome am „Bug“ und „Heck“ des Bootes führt auch zu beträchtlicher van der Waals-Spannung. Die Twist-Konformation kann über die Boot-Anordnung (Maximum der potentiellen Energie) leicht in eine neue Twistform übergehen (Energiebarriere ca. 6,3 kJ mol−1, 1,5 kcal mol−1). Die Twistformen gehen durch Pseudorotation ineinander über. Nach heutigem Wissen sind also Halbsessel- und Boot-Anordnung Maxima der potentiellen Energie, mit anderen Worten keine „stabilen“ Konformationen. Über die Twist-Konformation kann schließlich der sesselförmige Cyclohexanring in eine andere Sesselkonformation „umschnappen“ („flippen“); dies wird als „Invertieren“ des Rings bezeichnet (Ringinversion).
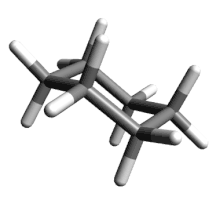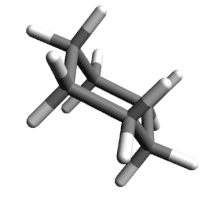
Die Wechselwirkung der C–H-Bindungen bzw. Wasserstoffatome ist also von entscheidender Bedeutung für die Energie der verschiedenen Konformationen. Was die stabilste Sesselkonformation betrifft, liegen hier zwei Sätze von C–H-Bindungen vor: sechs stehen parallel zur sechszähligen Drehspiegelachse (S6) des Moleküls, drei nach oben und drei nach unten; die anderen sechs richten sich nach einer auf dieser Achse senkrecht stehend gedachten „Äquatorebene“ aus. Nach einem Vorschlag von Derek H. R. Barton werden diese Bindungen als äquatorial (engl. equatorial, abgekürzt „eq“ oder „e“, im Bild blau), jene als axial (ax oder a, im Bild rot) bezeichnet. Bei der Ringinversion tauschen die beiden Sätze ihre Plätze: Aus axialen C–H-Bindungen werden äquatoriale und umgekehrt.

Die Strukturbestimmung durch Elektronenbeugung zeigte aber, dass dieses Modell etwas vereinfacht ist. Im Vergleich zur idealen Sesselkonformation ist das Molekül etwas abgeflacht (engl. flattened). Der Torsionswinkel beträgt nicht 60°, sondern 55°, wodurch die axialen C–H-Bindungen nicht ganz parallel verlaufen, sondern um ca. 7° „nach außen“ gedreht sind. Die mittlere C–C-Bindungslänge ist 153,6 pm, der C-C-C-Valenzwinkel 111,4°, und die C–H-Bindungslänge im Mittel 112,1 pm.[11]
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich im Temperaturbereich von 303 K bis 343 K nach Antoine entsprechend
- log10(P) = A − B / (T + C)
mit P in bar, T in K und A = 3,99200, B = 1216,930 und C = −48,621.[12]
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−156,2 kJ·mol−1[13] −123,1 kJ·mol−1[13] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −3919,6 kJ·mol−1[14] | als Flüssigkeit |
| Wärmekapazität | cp | 156,9 J·mol−1·K−1 (25 °C)[15] | als Flüssigkeit |
| Kritische Temperatur | Tc | 553,8 K[16] | |
| Kritischer Druck | pc | 40,8 bar[16] | |
| Kritisches Volumen | Vc | 0,308 l·mol−1[16] | |
| Kritische Dichte | ρc | 3,24 mol·l−1[16] | |
| Azentrischer Faktor | ωc | 0,20805[17] | |
| Schmelzenthalpie | ΔfH0 | 2,732 kJ·mol−1[3] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH0 | 29,97 kJ·mol−1[18] | beim Normaldrucksiedepunkt |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich im Temperaturbereich zwischen 298 K und 380 K entsprechend der Gleichung
- ΔVH0 = A exp(−αTr) (1 − Tr)β
mit ΔVH0 in kJ/mol, Tr = T/Tc als reduzierter Temperatur und A = 43,42 kJ/mol, α = −0,1437, β = 0,4512 und Tc = 553,4 K beschreiben.[18]
 Dampfdruckfunktion von Cyclohexan
Dampfdruckfunktion von Cyclohexan Temperaturabhängigkeit der Verdampfungsenthalpie von Cyclohexan
Temperaturabhängigkeit der Verdampfungsenthalpie von Cyclohexan
Sicherheitstechnische Kenngrößen
Cyclohexan bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von −18 °C. Der Explosionsbereich liegt zwischen 1,0 Vol.‑% (35 g/m3) als untere Explosionsgrenze (UEG) und 9,3 Vol.‑% (326 g/m3) als obere Explosionsgrenze (OEG).[19] Die Explosionsgrenzen sind druckabhängig. Eine Erniedrigung des Druckes führt zu einer Verkleinerung des Explosionsbereiches. Die untere Explosionsgrenze ändert sich bis zu einem Druck von 100 mbar nur wenig und steigt erst bei Drücken kleiner als 100 mbar an. Die obere Explosionsgrenze verringert sich mit sinkendem Druck analog.[20]
| Explosionsgrenzen unter reduziertem Druck (gemessen bei 100 °C)[20] | ||||||||||||
| Druck | in mbar | 1013 | 800 | 600 | 400 | 300 | 250 | 200 | 150 | 100 | 50 | 25 |
| Untere Explosionsgrenze (UEG) | in Vol.‑% | 0,9 | 0,9 | 0,9 | 1,0 | 1,0 | 1,1 | 1,1 | 1,1 | 1,3 | 1,7 | 3,3 |
| in g·m−3 | 31 | 32 | 32 | 34 | 35 | 37 | 39 | 40 | 45 | 60 | 116 | |
| Obere Explosionsgrenze (OEG) | in Vol.‑% | 9,3 | 8,8 | 8,4 | 8,0 | 7,8 | 7,6 | 7,5 | 7,5 | 7,4 | 6,2 | 4,0 |
| in g·m−3 | 325 | 307 | 293 | 281 | 272 | 266 | 263 | 262 | 258 | 218 | 140 | |
Der maximale Explosionsdruck sowie die Sauerstoffgrenzkonzentration sind druck- und temperaturabhängig.[20] Die Grenzspaltweite wurde mit 0,94 mm bestimmt.[19] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[19] Mit einer Mindestzündenergie von 1,38 mJ sind Dampf-Luft-Gemische extrem zündfähig.[21][22] Die Zündtemperatur beträgt 260 °C.[19] Der Stoff fällt somit in die Temperaturklasse T3. Die elektrische Leitfähigkeit ist mit 4,0·10−15 S·m−1 sehr gering.[23]
| Sauerstoffgrenzkonzentration und maximaler Explosionsdruck unter reduziertem Druck (gemessen bei 20 °C und 100 °C)[20] | ||||||||||||
| Druck in mbar | 1013 | 600 | 400 | 300 | 200 | 150 | 100 | |||||
| Sauerstoffgrenzkonzentration (SGK) in Vol % | 20 °C | 9,3 | 9,3 | 10,0 | 10,5 | 14,0 | ||||||
| 100 °C | 8,5 | 8,4 | 9,0 | 9,4 | 10,5 | |||||||
| Maximaler Explosionsdruck (pmax) in bar | 20 °C | 9,5 | 5,5 | 3,6 | 1,8 | 1,3 | 0,9 | |||||
| 100 °C | 7,6 | 4,6 | 3,1 | 1,5 | 0,8 | |||||||
Verwendung
Cyclohexan wird zur Produktion von Kunstfasern wie Nylon verwendet.[24] Außerdem wird es als Lösungsmittel eingesetzt. Cyclohexan kommt im Erdöl vor, es ist ein wichtiger Ausgangsstoff für organische Synthesen. Ungefähr 39 Prozent des hergestellten Cyclohexans werden in Europa verbraucht, Europa ist der größte Abnehmer für Cyclohexan.
Gesundheitsgefahren
Inhalation und Verschlucken der Flüssigkeit führen zu Kopfschmerzen, Übelkeit und Schwindel. Die Augen und die Haut werden gerötet und es kommt zu einer Reizung der Atemwege. Eine Langzeitexposition gegenüber Cyclohexan kann zu Dermatitis führen, einer entzündlichen Reaktion der Haut.
Literatur
- Siegfried Hauptmann: Organische Chemie. 1. Auflage. Verlag Harri Deutsch, Thun-Frankfurt am Main 1985, ISBN 3-87144-902-4.
- Hans Rudolf Christen, Fritz Vögtle: Organische Chemie. Von den Grundlagen zur Forschung. 1. Auflage. Band 1, Salle, Frankfurt am Main 1988, ISBN 3-7935-5397-3, S. 92ff. (auch: Sauerländer, Aarau 1988, ISBN 3-7941-3001-4)
- Marye Anne Fox, James K. Whitesell: Organische Chemie. 1. Auflage. Spektrum Akademischer Verlag, Heidelberg u. a. O., 1995, ISBN 3-86025-249-6, S. 193.
Weblinks
Einzelnachweise
- Eintrag zu CYCLOHEXANE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Mai 2020.
- Eintrag zu Cyclohexan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. März 2021. (JavaScript erforderlich)
- R. H. Stokes, R. P. Tomlins: Thermodynamic functions of melting for cyclohexane. In: J. Chem. Thermodynamics. 6, 1974, S. 379–386.
- CRC Handbook of Tables for Organic Compound Identification. 3. Auflage. 1984, ISBN 0-8493-0303-6.
- Eintrag zu Cyclohexane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 110-82-7 bzw. Cyclohexan), abgerufen am 25. September 2019.
- Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 384 f.
- Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. 2. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2013, ISBN 978-3-527-33072-0, S. 605.
- Marktstudie Benzol. auf: Ceresana. Juli 2011.
- Zur Geschichte siehe unter anderem: Ernest L. Eliel, Samuel H. Wilen: Organische Stereochemie. übersetzt und bearbeitet von Henning Hopf. Wiley-VCH, Weinheim u. a. O., 1998.
- O. Bastiansen, L. Fernholt, H. M. Seip, H. Kambara, K. Kuchitsu: Structure of cyclohexane determined by two independent gas electron-diffraction investigations. In: Journal of Molecular Structure. 18, 1973, S. 163.
- W. J. Gaw, F. L. Swinton: Thermodynamic Properties of Binary Systems Containing Hexafluorobenzene. Part 3: Excess Gibbs Free Energy of the System Hexafluorobenzene + Cyclohexane. In: Transactions of the Faraday Society. 64, 1968, S. 637–647.
- E. J. Prosen, W. H. Johnson, F. D. Rossini: Heats of formation and combustion of the normal alkylcyclopentanes and cyclohexanes and the increment per CH2 group for several homologous series of hydrocarbons. In: J. Res. NBS. 37, 1946, S. 51–56.
- G. E. Moore, M. L. Renquist, G. S. Parks: Thermal data on organic compounds. XX. Modern combustion data for two methylnonanes, methyl ethyl ketone, thiophene and six cycloparaffins. In: J. Am. Chem. Soc. 62, 1940, S. 1505–1507.
- A. Lainez, M. M. Rodrigo, E. Wilhelm, J.-P. E. Grolier: Excess volumes and excess heat capacities of some mixtures with trans,trans,cis-1,5,9-cyclododecatriene at 298.15 K. In: J. Chem. Eng. Data. 34, 1989, S. 332–335, doi:10.1021/je00057a021.
- T. E. Daubert: Vapor-Liquid Critical Properties of Elements and Compounds. 5. Branched Alkanes and Cycloalkanes. In: J. Chem. Eng. Data. 41, 1996, S. 365–372.
- J. Schmidt: Auslegung von Sicherheitsventilen für Mehrzweckanlagen nach ISO 4126-10. In: Chem. Ing. Techn. 83, 2011, S. 796–812, doi:10.1002/cite.201000202.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- D. Pawel, E. Brandes: Abschlussbericht zum Forschungsvorhaben Abhängigkeit sicherheitstechnischer Kenngrößen vom Druck unterhalb des atmosphärischen Druckes. (Memento vom 2. Dezember 2013 im Internet Archive), Physikalisch-Technische Bundesanstalt (PTB), Braunschweig 1998.
- J. B. Fenn: Lean flammability limit and minimum spark ignition energy. In: Ind. Eng. Chem. 43, 1951, S. 2865–2869.
- H. F. Calcote, C. A. Gregory, C. M. Barnett, R. B. Gilmer: Spark Ignition – Effect of Molecular Structure. In: Ind. Eng. Chem. 44, 1952, S. 2656–2662.
- Technische Regel für Betriebssicherheit – TRBS 2153, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen. Stand April 2009, Jedermann-Verlag, Heidelberg.
- Bertram Philipp, Peter Stevens: Grundzüge der Industriellen Chemie. VCH Verlagsgesellschaft, 1987, ISBN 3-527-25991-0, S. 179.




