Natrium-Schwefel-Akkumulator
Ein Natrium-Schwefel-Akkumulator, abgekürzt NaS-Akku, NaS-Batterie ist ein Akkumulator, eine sogenannte Sekundärzelle. Gegenüber anderen Akkumulatortypen werden statt eines flüssigen Elektrolyten ein fester Elektrolyt und flüssige Elektroden eingesetzt und für den Betrieb werden hohe Betriebstemperaturen im Bereich von 270 bis 350 °C benötigt. Der NaS-Akku zählt damit zu der Gruppe der Thermalbatterien. Entwickelt wurde dieser Akkutyp Ende der 1970er Jahre[1]; bis Anfang 2014 waren weltweit gut 180 NaS-Batterie-Speicherkraftwerke mit einer Leistung von 334 MW installiert.[2]
Allgemeines
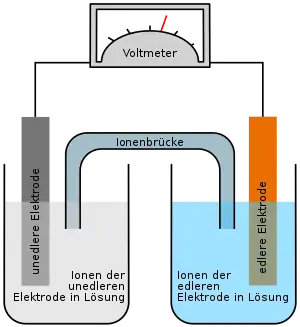
Die Anode besteht aus geschmolzenem Natrium, die Kathode aus einem mit flüssigem Schwefel getränkten Graphitgewebe.[3][4] Als Elektrolyt kommt ein natriumhaltiges Aluminiumoxid zum Einsatz. Da Natrium heftig mit Wasser reagiert, muss der Akkumulator gut gegenüber Umwelteinflüssen geschützt werden. Natrium-Schwefel-Akkumulatoren haben, neben dem Vorteil, dass die wesentlichen Grundmaterialien wie Natrium, Schwefel und Aluminium leicht verfügbar sind, eine vergleichsweise hohe Speicherdichte im Bereich knapp über 200 Wh/kg.[1]
Experimentelle Anwendungen waren in den 1980er bis Mitte der 1990er Jahre Antriebssystem für Elektroautos und Energiespeicher in Kommunikationssatelliten. Aktuelle Anwendungen sind kleine bis mittlere stationäre Batterie-Speicherkraftwerke in Japan, welche der Lieferung von Spitzenlast und zur Netzstabilisierung im öffentlichen Stromnetz dienen.[5][6][7] In Deutschland betreibt seit 2010 das Berliner Unternehmen Younicos gemeinsam mit Vattenfall einen 1-MW-NaS-Akku als Pilotprojekt zum Ausgleich volatiler Erneuerbarer Energien.[8] Im gleichen Jahr wurde in Texas ein noch größerer NaS-Akku zur Steigerung der Versorgungssicherheit einer ganzen Kleinstadt installiert.[9] In Anwendungsbereichen wie Elektroautos und auch als Stromversorgungssysteme in Weltraumanwendungen sind NaS-Zellen durch andere, jeweils geeignetere Energiespeichersysteme ersetzt worden.
Als Hersteller von NaS-Akkus sind weltweit nur japanische Produzenten von Bedeutung. Mit Stand 2010 größter und dominanter Hersteller in diesem Segment ist NGK Insulators, welcher gemeinsam mit dem Energienetzbetreiber Tōkyō Denryoku (Tokyo Electric Power, TEPCO) seit Anfang der 1990er Jahre NaS-Zellen im Rahmen von kleineren, stationären Batterie-Speicherkraftwerken einsetzt. Weitere Hersteller sind die japanischen Firmen Hitachi und GS Yuasa. Ehemalige Hersteller von NaS-Zellen für mobile Anwendungen waren unter anderem Asea Brown Boveri (Elektroauto), Silent Power Ltd. in England (Elektroauto) und Ford Aerospace in den USA.[10]
Funktionsweise
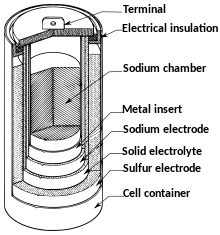
Die NaS-Zelle ist eine Hochtemperatur-Sekundärzelle. Im Gegensatz zu vielen anderen Akkumulatoren besitzt sie eine sehr geringe elektrochemische Selbstentladung, der Wirkungsgrad zwischen Ladung und Entladung liegt im Bereich um die 70 bis 85 %. Die praktisch nicht vorhandene elektrochemische Selbstentladung wird allerdings dadurch relativiert, dass die Zelle zum Aufrechterhalten der Funktionsfähigkeit in einem hohen Temperaturbereich von ca. 300 bis 350 °C gehalten werden muss, was neben einer entsprechenden thermischen Isolierung zur kühleren Umgebung zusätzliche Heizsysteme erfordert. Wird diese für den Betrieb nötige Heizenergie der Selbstentladung zugerechnet bzw. die Heizleistung dem Akkusystem entnommen, liegt bei kleinen Systemen wegen der hohen spezifischen Oberfläche eine hohe Gesamtselbstentladung vor.
Wie bei allen Systemen, bei denen thermische Verluste vermindert werden sollen, gilt:
- Kleine NaS-Akkus eignen sich daher nur zum kurzfristigen Speichern von Energie.
- Superisolierte oder sehr große NaS-Zellen können aber wegen der reziproken Proportionalität der Oberfläche zum Volumen und damit der theoretisch möglichen geringen thermischen Verluste diese soweit minimieren, dass die Effizienz stark verbessert wird.
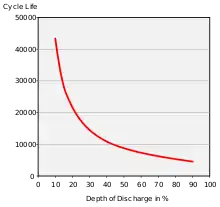
Die Anzahl der Lade- und Entladezyklen ist zwar im Vergleich zu anderen Akkutypen groß, aber, wie in nebenstehender Abbildung dargestellt, stark von der Entladetiefe abhängig. Wird der Akkumulator in jedem Zyklus nur sehr gering entladen, dies entspricht einer deutlichen Reduktion der effektiven Kapazität, sind einige 10.000 Ladezyklen möglich. Wird hingegen vor einer erneuten Ladung immer eine Entladung bis auf 10 % vorgenommen, reduziert sich die Anzahl auf einige 1000 Zyklen bis zu einem Ausfall. Der Verschleiß dieser gegen Tiefentladung empfindlichen Akkus ist eine Folge von thermischen Prozessen in der Zelle, dazu zählt insbesondere bei Tiefentladung das thermische Durchgehen.[11]
Die hohe Temperatur ist notwendig, da Schwefel und Natrium in flüssiger Form vorliegen müssen. Die jeweiligen Erstarrungstemperaturen müssen weit überschritten werden, damit ein ausreichender Energiefluss zwischen den Elektroden zustande kommen kann. Während die Elektroden bei hoher Temperatur in flüssiger Form vorliegen, liegt der Elektrolyt in NaS-Zellen immer in fester Form vor. Er besteht aus einer Natriumionen leitenden Keramik, die gleichzeitig für Elektronen ein Isolator ist. Wesentlicher Bestandteil der Keramik ist Natrium-β-Aluminat (NaAl11O17), bei dem ab einer Temperatur von 270 °C die Natriumionen so beweglich werden, dass eine ausreichende Leitfähigkeit besteht.[12] Weitere mögliche Materialien sind beispielsweise Natriumoxid oder Magnesiumoxid.
Die US-amerikanische Firma Ceramatec entwickelt (2009) in Utah eine Version, die auch bei niedrigeren Temperaturen funktioniert. Bei der Verwendung einer neuen NaSICON-Membran kann der Akkumulator bei 90 °C betrieben werden. Dabei bleiben alle Komponenten fest.[13]
Elektrochemie
Während der Entladung oxidiert Natrium am Natrium-β-Aluminat und bildet positiv geladene Natriumionen. Diese Ionen wandern durch den Elektrolyten und reduzieren an der positiven Elektrode den Schwefel zu Natriumpentasulfid (Na2S5):
An der negativen Elektrode wird flüssiges Natrium oxidiert:
Bei der Ladung laufen die Vorgänge in Gegenrichtung ab. Die Gesamtreaktion lautet dann:
Die elektrochemische Reaktion hängt von Faktoren wie Zelldesign und Temperatur ab, der Innenwiderstand beträgt ca. 35 mΩ und ist nahezu unabhängig vom Ladezustand der Zelle. Die Leerlaufspannung einer geladenen NaS-Zelle beträgt 2,076 V, wobei diese Spannung bei überwiegend vorhandenen Natriumpentasulfid (Na2S5) annähernd bis zu 65 % Entladung konstant bleibt.
Nach dem Verbrauch von Schwefel reduziert sich im Bereich der Tiefentladung ein Teil des Natriumpentasulfids zu verschiedenen Formen des Natriumpolysulfids (Na2S5-x}).
Danach, bei zunehmender Bildung der verschiedenen Natriumpolysulfide, sinkt die Zellenspannung bis zur Entladeschlussspannung von 1,78 bzw. 1,9 V annähernd linear ab. Bei einer Entladeschlussspannung von 1,9 V liegt primär Na2S4 vor, bei 1,78 V liegt Na2S3 vor. Bei weiterer, für den Akkumulator schädlicher Tiefentladung, bildet sich in der Zelle Na2S2, welches unerwünscht ist, da es zu einem hohen Innenwiderstand und damit großen thermischen Verlusten in der Zelle führt. Die thermische Belastung kann zur Beschädigung der Zelle führen.[10]
Technische Daten
In folgender Tabelle sind die technischen Daten einiger aktuell am Markt erhältlicher NaS-Zellen aus japanischer Fertigung zusammengestellt. Die Bauform ist ausschließlich eine längliche, zylindrische Form.[10]
| Hersteller | Typ | Kapazität [Ah] | Durchmesser [mm] | Länge [mm] | Gewicht [kg] | Spez. Energie [Wh/kg] |
|---|---|---|---|---|---|---|
| NGK Insulators | T4.1 | 160 | 62 | 375 | 2 | 160 |
| NGK Insulators | T4.2 | 248 | 68 | 390 | 2,4 | 202 |
| NGK Insulators | T5 | 632 | 91 | 515 | 5,4 | 226 |
| GS Yuasa | 176 | 64 | 430 | 2,7 | 120 | |
| Hitachi | 280 | 75 | 400 | 4 | 133 |
Literatur
- Michael Sterner, Ingo Stadler (Hrsg.): Energiespeicher. Bedarf, Technologien, Integration. 2. Auflage, Berlin Heidelberg 2017, ISBN 978-3-662-48893-5.
- Bernhard Hauck: Elektronische Überwachungs- und Steuergeräte zum Erhalt der aktuellen Qualität vielzelliger elektrochemischer Speichersysteme. Kaiserslautern 2003, DNB 969874197, urn:nbn:de:bsz:386-kluedo-16560 (Habilitationsschrift, TU Kaiserslautern).
- Jeffrey W. Braithwaite, William L. Auxer: Handbook of Batteries. Hrsg.: David Linden. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 40: Sodium-Beta Batteries.
Nachweise
- Patent US3982959: Sodium-sulphur battery cells. Veröffentlicht am 28. September 1976, Erfinder: Bernard Austin Partridge, Thomas Rhys Jenkins, Michael McGuire.
- Katja Buß et al.: Global Distribution of Grid-connected Electrical Energy Storage Systems. In: International Journal of Sustainable Energy Planning and Management. Band 9, 2016, S. 31–56, doi:10.5278/ijsepm.2016.9.4.
- Natrium-Schwefel-Batterie. Heidjann GmbH, abgerufen am 15. April 2018.
- Natrium-Schwefel-Akkumulator. Spektrum der Wissenschaft Verlagsgesellschaft mbH, abgerufen am 15. April 2018 (Lexikon der Chemie).
- K. Takashima u. a.: The Sodium Sulfur Battery for a 1 MW, 8 MWh Load Leveling System. Proceedings if the International Conference on Batteries for Utility Energy Storage, März 1991, S. 333–349.
- A. A. Koenig, J. R. Rasmussen: Development of a high specific power sodium sulfur cell. In: IEEE (Hrsg.): Proceedings of the 34th International Power Sources Symposium. 1990, S. 30–33, doi:10.1109/IPSS.1990.145783.
- William Auxer: The PB sodium sulfur cell for satellite battery applications. In: Proceedings of the 32. International Power Sources Symposium. 1986, S. 49–54, bibcode:1986poso.symp...49A.
- Younicos – Kurzzeitspeicher für Systemstabilität
- Texas Town Installs a Monster Battery For Backup Power. auf: popsci.com, 4. Mai 2010.
- Jeffrey W. Braithwaite, William L. Auxer: Handbook of Batteries. 2. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 40: Sodium-Beta Batteries, S. 40.1–40.31.
- Sodium Sulfur Battery Energy Storage (Memento vom 18. April 2011 im Internet Archive). Xcel Energy Fund, 2010.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- American Ceramic Society: Ceramatec