Enzym
Ein Enzym, früher Ferment, ist ein Stoff, der aus biologischen Riesenmolekülen besteht und als Katalysator eine chemische Reaktion beschleunigen kann. Die meisten Enzyme sind Proteine (Eiweißkörper), eine Ausnahme bildet die katalytisch aktive RNA (Ribozym), wie z. B. snRNA oder (natürlich nicht-vorkommende, künstlich hergestellte) katalytisch aktive DNA (Desoxyribozym). Ihre Bildung in der Zelle erfolgt daher, wie auch bei anderen Proteinen, über Proteinbiosynthese an den Ribosomen. Enzyme haben wichtige Funktionen im Stoffwechsel von Organismen: Sie steuern den überwiegenden Teil biochemischer Reaktionen – von der Verdauung bis hin zur Transkription (RNA-Polymerase) und Replikation (DNA-Polymerase) der Erbinformationen.
Wortherkunft und Geschichte der Enzymforschung
Menschen nutzen seit mehreren tausend Jahren die Wirkung von Enzymen wie jener von Hefen und Bakterien; so ist bekannt, dass die Sumerer bereits 3000 v. Chr. Bier brauten, Brot backten und Käse herstellten. Für den Gebrauch von Bier- oder Backhefe, wie beim Maischen oder im Hefeteig, und die damit eingeleiteten Vorgänge der Gärung entstand die Bezeichnung „Fermentation“, noch ohne Kenntnis der Existenz von Bakterien (bzw. der mikrobiellen Hefepilze) und ihrer Wirkung durch Enzyme.
Die Wörter Fermentation und Ferment hielten im 15. Jahrhundert Einzug in die deutsche Sprache, sie gehen auf das lateinische Wort fermentum zurück. Diesen Ausdruck verwendet Columella etwa 60 n. Chr. auch für das Auflockern und Quellen des Bodens, während Seneca etwa gleicher Zeit in seinen Epistulae damit einen Gärungsvorgang bezeichnet, den er für die Bildung von Honig als nötig ansah.[1] Mit dieser Bedeutung als „Gärungsmittel“ oder „Sauerteig“ wurde das Wort Ferment aus dem Lateinischen entlehnt, und davon fermentieren, Fermentation sowie Fermenter abgeleitet.[2]
Die ersten Gärungsprozesse beschrieben Paracelsus und Andreas Libavius. Die ersten Versuche zur Erklärung kamen von Johann Baptist van Helmont und Georg Ernst Stahl.[1] Nachdem René Réaumur 1752 die Verdauung bei Vögeln untersucht und herausgestellt hatte, dass Greifvögel keinen Körner zerkleinernden Muskelmagen haben, sondern im Magen eine Flüssigkeit absondern, konnte Lazzaro Spallanzani 1783 belegen, dass allein deren Magensaft schon hinreicht Fleisch zu verflüssigen. Damit war die Theorie eines nur mechanischen Verdauungsprozesses widerlegt.[1]
Die erste unmittelbare Nutzung von Enzymen ohne die Mitbeteiligung von Mikroorganismen erfolgte durch den deutschen Apotheker Constantin Kirchhoff im Jahre 1811, als er entdeckte, dass man durch Erhitzen von Stärke unter Beigabe von Schwefelsäure größere Mengen Zucker herstellen kann. Der französische Chemiker Anselme Payen verfeinerte 1833 den Prozess; da man zu dieser Zeit annahm, dass man den Zucker lediglich von der Stärke trenne, bezeichnete man diesen Prozess als „Diastase“ (griechisch für trennen); heute wird der Begriff „Diastase“ synonym zu Amylase verwendet. Es folgte die Entdeckung von Erhard Friedrich Leuchs im Jahre 1831, dass der menschliche Mundspeichel Stärke scheinbar verzuckere. 1833 wurde von Eilhard Mitscherlich der Begriff „Ferment“ im Zusammenhang mit einem Stoff gebraucht, der bei einer Reaktion nicht verwandelt wird, aber zum Kontakt für eine Reaktion erforderlich ist. 1835 wurde die Diastase vom schwedischen Chemiker Jöns Jakob Berzelius als chemischer Prozess mit der Einwirkung von katalytischen Kräften vermutet.
1837 entdeckten die drei Wissenschaftler Charles Cagniard de la Tour, Theodor Schwann und Friedrich Traugott Kützing unabhängig voneinander, dass Hefe aus Mikroorganismen besteht. Louis Pasteur wies 1862 nach, dass Mikroorganismen für die Fermentation verantwortlich sind; er schlussfolgerte, dass die Fermentation durch eine vitale Kraft erfolge, die in der Schimmelzelle vorhanden sei, welche er „Fermente“ nannte, die nicht mit dem Tod der Schimmelzelle an Wirkung verlieren.
1878 führte Wilhelm Friedrich Kühne das heutige neoklassische Kunstwort Enzym (altgriechisch ἔνζυμον énzymon) ein, abgeleitet von ἐν- en-, „in-“, und ζύμη zýmē, welches ebenfalls „der Sauerteig“ oder „die Hefe“ bedeutet,[2] der Sinn ist daher „das in Sauerteig/Hefe Enthaltene“ (nämlich der die Gärung auslösende oder beeinflussende Stoff). Dieser Begriff hielt dann Einzug in die internationale Wissenschaft und ist nun auch Bestandteil der neugriechischen Sprache.[3]
Kühne grenzte den Begriff Enzyme als Bezeichnung für außerhalb lebender Zellen wirksame Biokatalysatoren jedoch von Fermenten ab, die ihre Wirkung nach Pasteurs Auffassung nur innerhalb lebender Zellen entfalten könnten.[4]
Einen weiteren Meilenstein stellen die Untersuchungen zur Enzymspezifität von Emil Fischer dar. Er postulierte um 1890, dass Enzyme und ihr Substrat sich wie ein Schloss und der passende Schlüssel verhalten. 1897 entdeckte Eduard Buchner anhand der alkoholischen Gärung, dass Enzyme auch ohne die lebende Zelle katalytisch wirken können; 1907 erhielt er für den Nachweis einer Zell-freien Fermentation den Nobelpreis. 1903 schafften Eduard Buchner und Jakob Meisenheimer es, Mikroorganismen, die Milch- und Essigsäuregärung auslösten, abzutöten, ohne ihre Enzymwirkung zu beeinflussen.[1] Der deutsche Chemiker Otto Röhm isolierte 1908 erstmals Enzyme und entwickelte Verfahren zur enzymatischen Ledergerbung, Fruchtsaftreinigung sowie eine Reihe diagnostischer Anwendungen.
Anfang des 20. Jahrhunderts war die chemische Komposition von Enzymen noch unbekannt. Man vermutete, dass Enzyme aus Protein bestehen und ihre enzymatische Aktivität mit ihrer Struktur assoziiert sei. Andere Wissenschaftler wie Richard Willstätter argumentierten jedoch, dass Proteine nur Träger der „echten Enzyme“ wären und von sich aus unfähig wären eine katalytische Reaktion einzuleiten. James B. Sumner zeigte 1926, dass das Enzym Urease ein pures Protein ist, und war fähig es zu kristallisieren. Die letzten Zweifel zur Komposition von Enzymen wurden von John H. Northop und Wendell M. Stanley ausgeräumt, als diese 1930 nachwiesen, dass Pepsin, Trypsin und Chymotrypsin aus purem Protein bestehen. Northrop und Stanley erhielten dafür 1946 den Nobelpreis für Chemie.[5]
Die Erkenntnis, wie man Enzyme kristallisiert, erlaubte es den Forschern nun durch Kristallstrukturanalyse die Struktur und die Funktionsweise von Enzymen auf atomarem Level aufzuklären. In den Jahren 1930 bis 1939 konnten die Kristallstrukturen von elf weiteren Enzymen aufgedeckt werden.[1] Die erste Aminosäuresequenz, die von einem Enzym komplett entschlüsselt war, ist die der Ribonuklease. Dieser Schritt gelang Stanford Moore und William Howard Stein. 1969 synthetisierte Robert Bruce Merrifield dann die gesamte Sequenz der Ribonuklease mit der nach ihm benannten Technik (Merrifield-Synthese). Gleichzeitig schafften dies auch R. G. Denkewalter und R. Hirschmann.[1]
In den 1980er Jahren wurden katalytische Antikörper von Richard Lerner entdeckt, die eine Enzymaktivität aufwiesen, nachdem gegen ein dem Übergangszustand nachempfundenes Molekül immunisiert wurde.[6][7] Linus Pauling hatte bereits 1948 vermutet, dass Enzyme dem Übergangszustand ähnliche Moleküle besonders gut binden.[8] Ende der 1980er Jahre wurde entdeckt, dass auch RNA im Organismus katalytische (enzymatische) Aktivität entfalten kann (Ribozym). 1994 wurde das erste Desoxyribozym, GR-5, entwickelt.[9]
Forscher wie Leonor Michaelis und Maud Menten leisteten Pionierarbeit in der Erforschung der Enzymkinetik mit der Formulierung der Michaelis-Menten-Theorie.
Nomenklatur und Klassifikation nach IUPAC und IUBMB
Nomenklatur
Die IUPAC und die IUBMB haben zusammen eine sogenannte Nomenklatur der Enzyme erarbeitet, die diese homogene und zahlreiche Vertreter enthaltende Gruppe der Moleküle klassifiziert. Hierzu erarbeitete die IUPAC Prinzipien der Nomenklatur:
- Enzymnamen haben die Endung (oder das Suffix) „-ase“, wenn das betreffende Enzym chemische oder organische Verbindungen auftrennt oder spaltet (wie beispielsweise die „Hydrolasen“ oder „Proteasen“)[10] oder neuverbindet (wie beispielsweise die „Oxidasen“ oder „Telomerase“).
- Der Enzymname soll erklärend sein, also die Reaktion, die das Enzym katalysiert, beschreiben. (Beispiel: Cholinesterase: Ein Enzym, das die Estergruppe im Cholin-Molekül hydrolysiert.)
- Der Enzymname soll seine Klassifikation (siehe unten) enthalten. (Beispiel: Cholinesterase)
Außerdem wurde ein Codesystem, das EC-Nummern-System, entwickelt, in dem die Enzyme unter einem Zahlencode aus vier Zahlen eingeteilt werden. Die erste Zahl bezeichnet eine der sieben Enzymklassen. Listen aller erfassten Enzyme gewährleisten ein schnelleres Auffinden des angegebenen Enzymcodes, z. B. bei BRENDA. Zwar orientieren sich die Codes an Eigenschaften der Reaktion, die das Enzym katalysiert, in der Praxis erweisen sich Zahlencodes jedoch als unhandlich. Häufiger gebraucht werden systematische, nach den oben genannten Regeln konzipierte Namen. Probleme der Nomenklatur ergeben sich etwa bei Enzymen, die mehrere Reaktionen katalysieren. Für sie existieren deshalb manchmal mehrere Namen. Einige Enzyme tragen Trivialnamen, die nicht erkennen lassen, dass es sich bei der genannten Substanz um Enzyme handelt. Da die Namen traditionell eine breite Verwendung fanden, wurden sie teilweise beibehalten (Beispiele: die Verdauungsenzyme Trypsin und Pepsin des Menschen).
Klassifikation
Enzyme werden entsprechend der von ihnen katalysierten Reaktion in sieben Enzymklassen eingeteilt:
- EC 1: Oxidoreduktasen, die Redoxreaktionen katalysieren.
- EC 2: Transferasen, die funktionelle Gruppen von einem Substrat auf ein anderes übertragen.
- EC 3: Hydrolasen, die Bindungen unter Einsatz von Wasser spalten.
- EC 4: Lyasen, die die Spaltung oder Synthese komplexerer Produkte aus einfachen Substraten katalysieren, allerdings ohne Verbrauch von Adenosintriphosphat (ATP) oder eines anderen Nukleosidtriphosphats (NTP).
- EC 5: Isomerasen, die die Umwandlung von chemischen Isomeren beschleunigen.
- EC 6: Ligasen oder Synthetasen, die Additionsreaktionen mithilfe von ATP (oder eines anderen NTP) katalysieren.[11] Eine Umkehrreaktion (Spaltung) ist meist energetisch ungünstig und findet nicht statt.
- EC 7: Translokasen, den Transport von Stoffen an oder durch Zellmembranen.[12]
Manche Enzyme sind in der Lage, mehrere, zum Teil sehr unterschiedliche Reaktionen zu katalysieren. Ist dies der Fall, werden sie mehreren Enzymklassen zugerechnet.
Aufbau
Enzyme lassen sich anhand ihres Aufbaus unterscheiden. Während viele Enzyme aus nur einer Polypeptidkette bestehen, so genannte Monomere, bestehen andere Enzyme, die Oligomere, aus mehreren Untereinheiten/Proteinketten. Einige Enzyme lagern sich mit weiteren Enzymen zu sogenannten Multienzymkomplexen zusammen und kooperieren oder regulieren sich gegenseitig. Umgekehrt gibt es auch einzelne Proteinketten, welche mehrere, verschiedene Enzymaktivitäten ausüben können (multifunktionelle Enzyme). Eine weitere mögliche Einteilung hinsichtlich ihres Aufbaus berücksichtigt das Vorhandensein von Kofaktoren:
- Reine Protein-Enzyme bestehen ausschließlich aus Proteinen. Das aktive Zentrum wird nur aus Aminosäureresten und dem Peptidrückgrat gebildet. Zu dieser Gruppe gehören beispielsweise das Verdauungsenzym Chymotrypsin und die Triosephosphatisomerase (TIM) der Glykolyse.
- Holoenzyme (altgr. ὅλος holos „ganz“, „vollständig“ und -enzym) bestehen aus einem Proteinanteil, dem Apoenzym, sowie aus einem Kofaktor, einem niedermolekularen Molekül (kein Protein). Beide zusammen sind für die Funktion des Enzyms wichtig. Organische Moleküle als Kofaktoren werden Koenzyme genannt. Sind sie kovalent an das Apoenzym gebunden, nennt man sie prosthetische Gruppen, andernfalls auch zutreffender Kosubstrat, da sie in äquivalenten Mengen bei der enzymatischen Reaktion mit dem Substrat umgesetzt werden. Kosubstrate sind zum Beispiel Adenosintriphosphat (ATP) und Nicotinamidadenindinukleotid (NAD). ATP wird oft als Energiequelle für die Reaktion von Proteinkinasen genutzt. NAD wird von Enzymen, wie der Alkoholdehydrogenase, als Elektronenakzeptor verwendet. Benötigt ein Enzym Metallionen (Eisen-, Zink- oder Kupferionen), spricht man von einem Metalloenzym. Die Lipoxygenase zum Beispiel enthält Eisen und die Carboanhydrase enthält Zink.
Eine spezielle Gruppe bilden die Protein-RNA-Komplexe bzw. Protein-Ribozym-Komplexe, Beispiele hierfür sind die Telomerasen. Auch die Ribosomen sind solche Komplexe.
Funktion
Enzyme sind Biokatalysatoren. Sie beschleunigen biochemische Reaktionen, indem sie die Aktivierungsenergie herabsetzen, die überwunden werden muss, damit es zu einer Stoffumsetzung kommt. Damit wird die Reaktionsrate erhöht (siehe Theorie des Übergangszustandes). Theoretisch ist eine enzymatische Umsetzung reversibel, d. h., die Produkte können wieder in die Ausgangsstoffe umgewandelt werden. Die Ausgangsstoffe (Edukte) einer Enzymreaktion, die Substrate, werden im so genannten aktiven Zentrum des Enzyms gebunden, es bildet sich ein Enzym-Substrat-Komplex. Das Enzym ermöglicht nun die Umwandlung der Substrate in die Reaktionsprodukte, die anschließend aus dem Komplex freigesetzt werden. Wie alle Katalysatoren liegt das Enzym nach der Reaktion wieder in der Ausgangsform vor. Enzyme zeichnen sich durch hohe Substrat- und Reaktionsspezifität aus, unter zahlreichen Stoffen wählen sie nur die passenden Substrate aus und katalysieren genau eine von vielen denkbaren Reaktionen.
Energetische Grundlagen der Katalyse
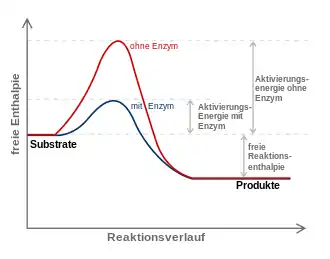
Die meisten biochemischen Reaktionen würden ohne Enzyme in den Lebewesen nur mit vernachlässigbarer Geschwindigkeit ablaufen. Wie bei jeder spontan ablaufenden Reaktion muss die freie Reaktionsenthalpie () negativ sein. Das Enzym beschleunigt die Einstellung des chemischen Gleichgewichts – ohne es zu verändern. Die katalytische Wirksamkeit eines Enzyms beruht einzig auf seiner Fähigkeit, in einer chemischen Reaktion die Aktivierungsenergie zu senken: das ist der Energiebetrag, der zunächst investiert werden muss, um die Reaktion in Gang zu setzen. Während dieser wird das Substrat zunehmend verändert, es nimmt einen energetisch ungünstigen Übergangszustand ein. Die Aktivierungsenergie ist nun der Energiebetrag, der benötigt wird, um das Substrat in den Übergangszustand zu zwingen. Hier setzt die katalytische Wirkung des Enzyms an: Durch nicht-kovalente Wechselwirkungen mit dem Übergangszustand stabilisiert es diesen, so dass weniger Energie benötigt wird, um das Substrat in den Übergangszustand zu bringen. Das Substrat kann wesentlich schneller in das Reaktionsprodukt umgewandelt werden, da ihm gewissermaßen ein Weg „geebnet“ wird.
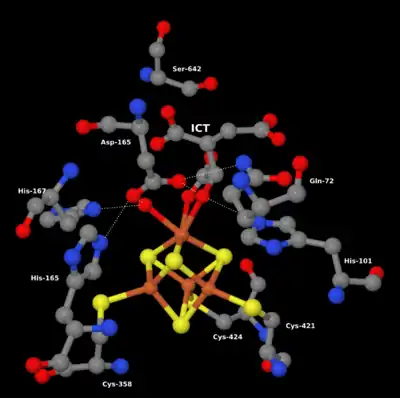
Das aktive Zentrum – strukturelle Grundlage für Katalyse und Spezifität
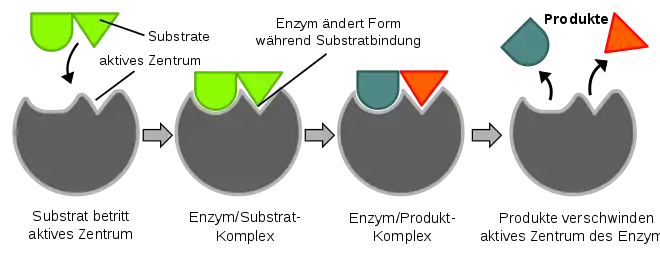
Für die katalytische Wirksamkeit eines Enzyms ist das aktive Zentrum (katalytisches Zentrum) verantwortlich. An dieser Stelle bindet es das Substrat und wird danach „aktiv“ umgewandelt. Das aktive Zentrum besteht aus gefalteten Teilen der Polypeptidkette oder reaktiven Nicht-Eiweiß-Anteilen (Kofaktoren, prosthetische Gruppen) des Enzymmoleküls und bedingt eine Spezifität der enzymatischen Katalyse. Diese Spezifität beruht auf der Komplementarität der Raumstruktur und der oberflächlich möglichen Wechselwirkungen zwischen Enzym und Substrat. Es kommt zur Bildung eines Enzym-Substrat-Komplexes.
Die Raumstruktur des aktiven Zentrums bewirkt, dass nur ein strukturell passendes Substrat gebunden werden kann. Veranschaulichend passt ein bestimmtes Substrat zum entsprechenden Enzym wie ein Schlüssel in das passende Schloss (Schlüssel-Schloss-Prinzip). Dies ist der Grund für die hohe Substratspezifität von Enzymen. Neben dem Schlüssel-Schloss-Modell existiert das nicht starre Induced fit model: Da Enzyme flexible Strukturen sind, kann das aktive Zentrum durch Interaktion mit dem Substrat neu geformt werden.
Bereits kleine strukturelle Unterschiede in Raumstruktur oder Ladungsverteilung des Enzyms können dazu führen, dass ein dem Substrat ähnlicher Stoff nicht mehr als Substrat erkannt wird. Glucokinase beispielsweise akzeptiert Glucose als Substrat, deren Stereoisomer Galactose jedoch nicht. Enzyme können verschieden breite Substratspezifität haben, so bauen Alkohol-Dehydrogenasen neben Ethanol auch andere Alkohole ab und Hexokinase IV akzeptiert neben der Glucose auch andere Hexosen als Substrat.
Die Erkennung und Bindung des Substrats gelingt durch nicht-kovalente Wechselwirkungen (Wasserstoffbrücken, elektrostatische Wechselwirkung oder hydrophobe Effekte) zwischen Teilen des Enzyms und des Substrats. Die Bindung des Enzyms muss stark genug sein, um das oft gering konzentrierte Substrat (mikro- bis millimolare Konzentrationen) zu binden, sie darf jedoch nicht zu stark sein, da die Reaktion nicht mit der Bindung des Substrates endet. Wichtig ist eine noch stärkere Bindung des Übergangszustandes der Reaktion und damit dessen Stabilisierung. Nicht selten nehmen zwei Substrate an einer Reaktion teil, das Enzym muss dann die richtige Orientierung der Reaktionspartner zueinander garantieren. Diese letzteren mechanistischen Eigenheiten einer enzymatischen Reaktion sind die Grundlage der Wirkungsspezifität eines Enzyms. Es katalysiert immer nur eine von vielen denkbaren Reaktionen der Substrate. Die Aktivität von Enzymen wird teilweise durch Pseudoenzyme (Varianten von Enzymen ohne Enzymaktivität) reguliert.
Katalytische Mechanismen
Obwohl die Mechanismen enzymatischer Reaktionen im Detail vielgestaltig sind, nutzen Enzyme in der Regel eine oder mehrere der folgenden katalytischen Mechanismen.
- Bevorzugte Bindung des Übergangszustandes
- Die Bindung des Übergangszustandes ist stärker als die Bindung der Substrate und Produkte, daraus resultiert eine Stabilisierung des Übergangszustandes.
- Orientierung und Annäherung von Substraten
- Die Bindung zweier Substrate in der passenden Orientierung und Konformation kann die Reaktionsgeschwindigkeit erheblich erhöhen, da die reaktiven Gruppen der Moleküle in die richtige Lage zueinander kommen und für die Reaktion günstige Konformationen der Moleküle stabilisiert werden.
- Allgemeine Säure-Basen-Katalyse
- Aminosäurereste beispielsweise von Histidin reagieren als Säure oder Base, indem sie während einer Reaktion Protonen (H+-Ionen) aufnehmen oder abgeben.
- Kovalente Katalyse
- Aminosäurereste oder Koenzyme gehen kovalente Bindungen mit einem Substrat ein und bilden ein kurzlebiges Zwischenprodukt. In der Regel sind bei solchen Reaktionen nukleophile Aminosäure-Seitenketten (beispielsweise Lysin-Seitenketten mit Aminogruppe) oder Koenzyme wie Pyridoxalphosphat beteiligt.
- Metallionen-Katalyse
- Metallionen können als strukturstabilisierende Koordinationszentren, Redox-Partner (oft Eisen- oder Kupfer-Ionen) oder als Lewis-Säuren (häufig Zink-Ionen) die Katalyse unterstützen. Sie können negative Ladungen stabilisieren bzw. abschirmen oder Wassermoleküle aktivieren.
Enzymkinetik
Die Enzymkinetik beschäftigt sich mit dem zeitlichen Verlauf enzymatischer Reaktionen. Eine zentrale Größe hierbei ist die Reaktionsgeschwindigkeit. Sie ist ein Maß für die Änderung der Substratkonzentration mit der Zeit, also für die Stoffmenge Substrat, die in einem bestimmten Reaktionsvolumen pro Zeiteinheit umgesetzt wird (Einheit: mol/(l·s)). Neben den Reaktionsbedingungen wie Temperatur, Salzkonzentration und pH-Wert der Lösung hängt sie von den Konzentrationen des Enzyms, der Substrate und Produkte sowie von Effektoren (Aktivatoren oder Inhibitoren) ab.
Im Zusammenhang mit der Reaktionsgeschwindigkeit steht die Enzymaktivität. Sie gibt an, wie viel aktives Enzym sich in einer Enzym-Präparation befindet. Die Einheiten der Enzymaktivität sind Unit (U) und Katal (kat), wobei 1 U definiert ist als diejenige Menge Enzym, welche unter angegebenen Bedingungen ein Mikromol Substrat pro Minute umsetzt: 1 U = 1 µmol/min. Katal wird selten benutzt, ist jedoch die SI-Einheit der Enzymaktivität: 1 kat = 1 mol/s. Eine weitere wichtige Messgröße bei Enzymen ist die spezifische Aktivität (Aktivität pro Masseneinheit, U/mg). Daran kann man sehen, wie viel von dem gesamten Protein in der Lösung wirklich das gesuchte Enzym ist.
Die gemessene Enzymaktivität ist proportional zur Reaktionsgeschwindigkeit und damit stark von den Reaktionsbedingungen abhängig. Sie steigt mit der Temperatur entsprechend der RGT-Regel an: eine Erhöhung der Temperatur um ca. 5–10 °C führt zu einer Verdoppelung der Reaktionsgeschwindigkeit und damit auch der Aktivität. Dies gilt jedoch nur für einen begrenzten Temperaturbereich. Bei Überschreiten einer optimalen Temperatur kommt es zu einem steilen Abfallen der Aktivität durch Denaturierung des Enzyms. Änderungen im pH-Wert der Lösung haben oft dramatische Effekte auf die Enzymaktivität, da dieser die Ladung einzelner für die Katalyse wichtiger Aminosäuren im Enzym beeinflussen kann. Jenseits des pH-Optimums vermindert sich die Enzymaktivität und kommt irgendwann zum Erliegen. Ähnliches gilt für die Salzkonzentration bzw. die Ionenstärke in der Umgebung.
Michaelis-Menten-Theorie
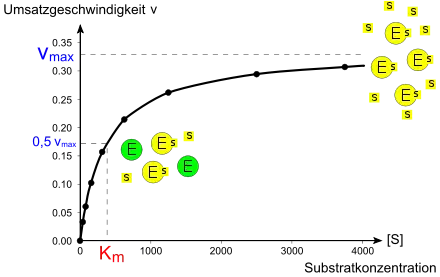
Ein Modell zur kinetischen Beschreibung einfacher Enzymreaktionen ist die Michaelis-Menten-Theorie (MM-Theorie). Sie liefert einen Zusammenhang zwischen der Reaktionsgeschwindigkeit v einer Enzymreaktion sowie der Enzym- und Substratkonzentration [E0] und [S]. Grundlage ist die Annahme, dass ein Enzym mit einem Substratmolekül einen Enzym-Substrat-Komplex bildet und dieser entweder in Enzym und Produkt oder in seine Ausgangsbestandteile zerfällt. Was schneller passiert, hängt von den jeweiligen Geschwindigkeitskonstanten k ab.
Das Modell besagt, dass mit steigender Substratkonzentration auch die Reaktionsgeschwindigkeit steigt. Das geschieht anfangs linear und flacht dann ab, bis eine weitere Steigerung der Substratkonzentration keinen Einfluss mehr auf die Geschwindigkeit des Enzyms hat, da dieses bereits mit Maximalgeschwindigkeit Vmax arbeitet. Die MM-Gleichung lautet wie folgt:
Die Parameter Km (Michaeliskonstante) und kcat (Wechselzahl) sind geeignet, Enzyme kinetisch zu charakterisieren, d. h., Aussagen über ihre katalytische Effizienz zu treffen. Ist Km beispielsweise sehr niedrig, heißt das, das Enzym erreicht schon bei niedriger Substratkonzentration seine Maximalgeschwindigkeit und arbeitet damit sehr effizient. Bei geringen Substratkonzentrationen ist die Spezifitätskonstante kcat/ Km ein geeigneteres Maß für die katalytische Effizienz. Erreicht sie Werte von mehr als 108 bis 109 M−1 s−1, wird die Reaktionsgeschwindigkeit nur noch durch die Diffusion der Substrat- und Enzymmoleküle begrenzt. Jeder zufällige Kontakt von Enzym und Substrat führt zu einer Reaktion. Enzyme, die eine solche Effizienz erreichen, nennt man „katalytisch perfekt“.
Kooperativität und Allosterie
Einige Enzyme zeigen nicht die hyperbolische Sättigungskurve, wie sie die Michaelis-Menten-Theorie vorhersagt, sondern ein sigmoides Sättigungsverhalten. So etwas wurde erstmals bei Bindeproteinen wie dem Hämoglobin beschrieben und wird als positive Kooperativität mehrerer Bindungsstellen gedeutet: die Bindung eines Liganden (Substratmolekül) beeinflusst weitere Bindungsstellen im gleichen Enzym (oft aber in anderen Untereinheiten) in ihrer Affinität. Bei positiver Kooperativität hat ein Bindeprotein mit vielen freien Bindungsstellen eine schwächere Affinität als ein größtenteils besetztes Protein. Bindet derselbe Ligand an alle Bindungszentren, spricht man von einem homotropen Effekt. Die Kooperativität ist bei Enzymen eng mit der Allosterie verknüpft. Unter Allosterie versteht man das Vorhandensein weiterer Bindungsstellen (allosterischen Zentren) in einem Enzym, abgesehen vom aktiven Zentrum. Binden Effektoren (nicht Substratmoleküle) an allosterische Zentren, liegt ein heterotroper Effekt vor. Die Allosterie ist zwar begrifflich von der Kooperativität zu unterscheiden, dennoch treten sie oft gemeinsam auf.
Mehrsubstrat-Reaktionen
Die bisherigen Überlegungen gelten nur für Reaktionen, an denen ein Substrat zu einem Produkt umgesetzt wird. Viele Enzyme katalysieren jedoch die Reaktion zweier oder mehrerer Substrate bzw. Kosubstrate. Ebenso können mehrere Produkte gebildet werden. Bei reversiblen Reaktionen ist die Unterscheidung zwischen Substrat und Produkt ohnehin relativ. Die Michaelis-Menten-Theorie gilt für eines von mehreren Substraten nur, wenn das Enzym mit den anderen Substraten gesättigt ist.
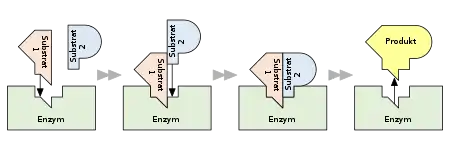
Für Mehrsubstrat-Reaktionen sind folgende Mechanismen vorstellbar:
- Sequenzieller Mechanismus
- Die Substrate binden nacheinander an das Enzym. Haben alle Substrate gebunden, liegt ein zentraler Komplex vor. In diesem findet die Umwandlung der Substrate zu den Produkten statt, welche anschließend der Reihe nach aus dem Komplex entlassen werden. Man unterscheidet dabei zwischen:
- Zufalls-Mechanismus (engl. random): Die Reihenfolge der Substratbindung ist zufällig.
- Geordneter Mechanismus (engl. ordered): Die Reihenfolge der Bindung ist festgelegt.
- Ping-Pong-Mechanismus
- Die Bindung von Substrat und die Freisetzung von Produkt erfolgen abwechselnd. Erst bindet Substrat A an das Enzym und wird als erstes Produkt P abgespalten. Dabei wird das Enzym modifiziert. Dann wird das zweite Substrat B aufgenommen und reagiert zu einem zweiten Produkt Q. Das Enzym hat wieder seine Ausgangsgestalt.
Enzymhemmung
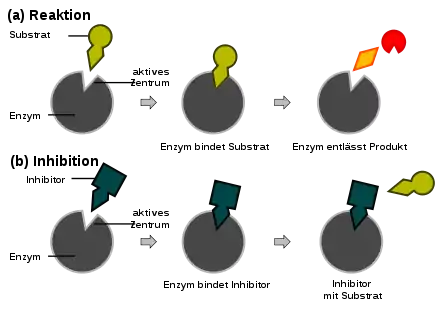
Als Enzymhemmung (Inhibition) bezeichnet man die Herabsetzung der katalytischen Aktivität eines Enzyms durch einen spezifischen Hemmstoff (Inhibitor). Grundlegend unterscheidet man die irreversible Hemmung, bei der ein Inhibitor eine unter physiologischen Bedingungen nicht umkehrbare Verbindung mit dem Enzym eingeht (so wie Penicillin mit der D-Alanin-Transpeptidase), von der reversiblen Hemmung, bei der der gebildete Enzym-Inhibitor-Komplex wieder in seine Bestandteile zerfallen kann. Bei der reversiblen Hemmung unterscheidet man wiederum zwischen
- kompetitiver Hemmung – das Substrat konkurriert mit dem Inhibitor um die Bindung an das aktive Zentrum des Enzyms. Der Inhibitor ist aber nicht enzymatisch umsetzbar und stoppt dadurch die Enzymarbeit, indem er das aktive Zentrum blockiert;
- allosterische Hemmung (auch nicht-kompetitive Hemmung) – der Inhibitor bindet am allosterischen Zentrum und verändert dadurch die Konformation des aktiven Zentrums, sodass das Substrat dort nicht mehr binden kann;
- unkompetitive Hemmung – der Inhibitor bindet an den Enzym-Substrat-Komplex und verhindert dadurch die katalytische Umsetzung des Substrates zum Produkt.
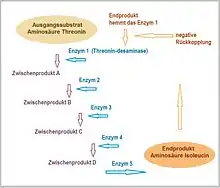
- Endprodukthemmung – das Endprodukt einer Reihe von enzymatischen Umsetzungen blockiert das Enzym 1 und beendet so die Umwandlung des Ausgangssubstrates in das Produkt.[14] Diese negative Rückkopplung sorgt bei einigen Stoffwechselprozessen für mengenmäßige Begrenzung der Produktion.
Regulation und Kontrolle der Enzymaktivität im Organismus
Enzyme wirken im lebenden Organismus in einem komplexen Geflecht von Stoffwechselwegen zusammen. Um sich schwankenden inneren und äußeren Bedingungen optimal anpassen zu können, ist eine feine Regulation und Kontrolle des Stoffwechsels und der zugrundeliegenden Enzyme nötig. Unter Regulation versteht man Vorgänge, die der Aufrechterhaltung stabiler innerer Bedingungen bei wechselnden Umweltbedingungen (Homöostase) dienen. Als Kontrolle bezeichnet man Veränderungen, die auf Grund von externen Signalen (beispielsweise durch Hormone) stattfinden. Es gibt schnelle/kurzfristige, mittelfristige sowie langsame/langfristige Regulations- und Kontrollvorgänge im Stoffwechsel:
Kurzfristige Anpassung
Schnelle Veränderungen der Enzymaktivität erfolgen als direkte Antwort der Enzyme auf veränderte Konzentrationen von Stoffwechselprodukten, wie Substrate, Produkte oder Effektoren (Aktivatoren und Inhibitoren). Enzymreaktionen, die nahe am Gleichgewicht liegen, reagieren empfindlich auf Veränderungen der Substrat- und Produktkonzentrationen. Anhäufung von Substrat beschleunigt die Hinreaktion, Anhäufung von Produkt hemmt die Hinreaktion und fördert die Rückreaktion (kompetitive Produkthemmung). Allgemein wird aber den irreversiblen Enzymreaktionen eine größere Rolle bei der Stoffwechselregulation und Kontrolle zugeschrieben.
Von großer Bedeutung ist die allosterische Modulation. Substrat- oder Effektormoleküle, die im Stoffwechsel anfallen, binden an allosterische Zentren des Enzyms und verändern seine katalytische Aktivität. Allosterische Enzyme bestehen aus mehreren Untereinheiten (entweder aus gleichen oder auch aus verschiedenen Proteinmolekülen). Die Bindung von Substrat- oder Hemmstoff-Molekülen an eine Untereinheit führt zu Konformationsänderungen im gesamten Enzym, welche die Affinität der übrigen Bindungsstellen für das Substrat verändern. Eine Endprodukt-Hemmung (Feedback-Hemmung) entsteht, wenn das Produkt einer Reaktionskette auf das Enzym am Anfang dieser Kette allosterisch hemmend wirkt. Dadurch entsteht automatisch ein Regelkreis.
Mittelfristige Anpassung
Eine häufige Form der Stoffwechselkontrolle ist die kovalente Modifikation von Enzymen, besonders die Phosphorylierung. Wie durch einen molekularen Schalter kann das Enzym beispielsweise nach einem hormonellen Signal durch phosphat-übertragende Enzyme (Kinasen) ein- oder ausgeschaltet werden. Die Einführung einer negativ geladenen Phosphatgruppe zieht strukturelle Änderungen im Enzym nach sich und kann prinzipiell sowohl aktive als auch inaktive Konformationen begünstigen. Die Abspaltung der Phosphatgruppe durch Phosphatasen kehrt diesen Vorgang um, so dass eine flexible Anpassung des Stoffwechsels an wechselnde physiologische Anforderungen möglich ist.
Langfristige Anpassung
Als langfristige Reaktion auf geänderte Anforderungen an den Stoffwechsel werden Enzyme gezielt abgebaut oder neugebildet. Die Neubildung von Enzymen wird über die Expression ihrer Gene gesteuert. Eine solche Art der genetischen Regulation bei Bakterien beschreibt das Operon-Modell von Jacob und Monod. Der kontrollierte Abbau von Enzymen in eukaryotischen Zellen kann durch Ubiquitinierung realisiert werden. Das Anheften von Polyubiquitin-Ketten an Enzyme, katalysiert durch spezifische Ubiquitin-Ligasen, markiert diese für den Abbau im Proteasom, einem „Müllschlucker“ der Zelle.
Biologische Bedeutung
Enzyme haben eine hohe biologische Bedeutung, sie spielen die zentrale Rolle im Stoffwechsel aller lebenden Organismen. Nahezu jede biochemische Reaktion wird von Enzymen bewerkstelligt und kontrolliert. Bekannte Beispiele sind Glycolyse und Citrat-Zyklus, Atmungskette und Photosynthese, Transkription und Translation sowie die DNA-Replikation. Enzyme wirken nicht nur als Katalysatoren, sie sind auch wichtige Regulations- und Kontrollpunkte im Stoffwechselgeschehen.
Die Bedeutung der Enzyme beschränkt sich jedoch nicht auf den Stoffwechsel, auch bei der Reizaufnahme und -weitergabe sind sie wichtig. An der Signaltransduktion, also der Vermittlung einer Information innerhalb einer Zelle, sind häufig Rezeptoren mit enzymatischer Funktion beteiligt. Auch Kinasen, wie die Tyrosinkinasen und Phosphatasen spielen bei der Weitergabe von Signalen eine entscheidende Rolle. Die Aktivierung und Deaktivierung der Träger der Information, also der Hormone, geschehen durch Enzyme.
Weiterhin sind Enzyme an der Verteidigung des eigenen Organismus beteiligt, so sind zum Beispiel diverse Enzyme wie die Serinproteasen des Komplementsystems Teil des unspezifischen Immunsystems des Menschen.
Fehler in Enzymen können fatale Folgen haben. Durch solche Enzymdefekte ist die Aktivität eines Enzyms vermindert oder gar nicht mehr vorhanden. Manche Enzymdefekte werden genetisch vererbt, d. h., das Gen, das die Aminosäuresequenz des entsprechenden Enzyms codiert, enthält eine oder mehrere Mutationen oder fehlt ganz. Beispiele für vererbbare Enzymdefekte sind die Phenylketonurie und Galaktosämie.
Artifizielle Enzyme (beispielsweise in Brotteig, die beim Backvorgang nicht denaturiert werden[15]) bergen das Risiko, Allergien auszulösen[16]
Verwendung und Auftreten im Alltag
Enzyme sind wertvolle Werkzeuge der Biotechnologie. Ihre Einsatzmöglichkeiten reichen von der Käseherstellung (Labferment) über die Enzymatik bis hin zur Gentechnik. Für bestimmte Anwendungen entwickeln Wissenschaftler heute gezielt leistungsfähigere Enzyme durch Protein-Engineering. Zudem konstruierte man eine neuartige Form katalytisch aktiver Proteine, die katalytischen Antikörper, die aufgrund ihrer Ähnlichkeit zu den Enzymen Abzyme genannt wurden. Auch Ribonukleinsäuren (RNA) können katalytisch aktiv sein; diese werden dann als Ribozyme bezeichnet.
Enzyme werden unter anderem in der Industrie benötigt. Waschmitteln und Geschirrspülmitteln fügt man Lipasen (Fett spaltende Enzyme), Proteasen (Eiweiß spaltende Enzyme) und Amylasen (Stärke spaltende Enzyme) zur Erhöhung der Reinigungsleistung hinzu, weil diese Enzyme die entsprechenden Flecken in Kleidung oder Speisereste am Geschirr zersetzen.
Enzyme werden auch zur Herstellung einiger Medikamente und Insektenschutzmittel verwendet. Bei der Käseherstellung wirkt das Labferment mit, ein Enzym, das aus Kälbermägen gewonnen wurde.
Viele Enzyme können heute mit Hilfe von gentechnisch veränderten Mikroorganismen hergestellt werden.
Die in rohen Ananas, Kiwifrüchten und Papayas enthaltenen Enzyme verhindern das Erstarren von Tortengelatine, ein unerwünschter Effekt, wenn beispielsweise ein Obstkuchen, der rohe Stücke dieser Früchte enthält, mit einem festen Tortengelatinebelag überzogen werden soll. Das Weichbleiben des Übergusses tritt nicht bei der Verwendung von Früchten aus Konservendosen auf, diese werden pasteurisiert, wobei die eiweißabbauenden Enzyme deaktiviert werden.[17]
Beim Schälen von Obst und Gemüse werden pflanzliche Zellen verletzt und in der Folge Enzyme freigesetzt. Dadurch kann das geschälte Gut (bei Äpfeln und Avocados gut ersichtlich) durch enzymatisch unterstützte Reaktion von Flavonoiden oder anderen empfindlichen Inhaltsstoffen mit Luftsauerstoff braun werden. Ein Zusatz von Zitronensaft wirkt dabei als Gegenmittel. Die im Zitronensaft enthaltene Ascorbinsäure verhindert die Oxidation oder reduziert bereits oxidierte Verbindungen (Zusatz von Ascorbinsäure als Lebensmittelzusatzstoff).
In der Medizin spielen Enzyme eine wichtige Rolle. Viele Arzneimittel hemmen Enzyme oder verstärken ihre Wirkung, um eine Krankheit zu heilen. Prominentester Vertreter solcher Arzneistoffe ist wohl die Acetylsalicylsäure, die das Enzym Cyclooxygenase hemmt und somit unter anderem schmerzlindernd wirkt.
Enzyme in der Technik
Die folgende Tabelle gibt einen Überblick über die Einsatzgebiete von Enzymen. Zur Herstellung siehe Protein.
| technischer Prozess | Enzyme | Wirkung |
|---|---|---|
| Stärkeverarbeitung | α-Amylase, Glucoamylase | Stärkehydrolyse |
| Racematspaltung | L-Acylase | Herstellung von Aminosäuren |
| Waschmittel | Proteasen, Lipasen | Hydrolyse von Eiweißen, Fetten |
| Käseproduktion | Proteasen | Milchgerinnung |
| Brennerei-Produkte | α-Amylase, Glucoamylase | Stärkeverzuckerung |
| Brauereiindustrie | α-Amylase, Glucoamylase, Proteasen | Maischprozess |
| Fruchtsaftverarbeitung | Pektinasen, α-Amylase | Hydrolyse der Pektine bzw. von Stärke |
| Backwarenherstellung | α-Amylase, Proteasen, Pentosanase | teilweise Hydrolyse von Mehl- und Teiginhaltsstoffen |
| Lederverarbeitung | Proteasen | Weichen, Enthaaren von Leder |
| Textilindustrie | α-Amylase | Stärkehydrolyse, Entschlichten |
Einsatz von Enzymen für Plastikrecycling
Enzyme kommen auch für das Recycling von Plastik zum Einsatz. Diese müssen ausreichend hitzestabil sein, d. h., sie müssen Temperaturen um die 70 Grad aushalten.[18] Die französische Firma Carbios hat ein Enzym gefunden, das Polyethylenterephthalat (PET) in seine Monomere (Ethylenglycol und Terephthalsäure) zerlegt. Die Flaschen müssen vor dem Erhitzen zuerst verkleinert werden. Am Ende des Prozesses steht ein Plastikgranulat, das für neue PET-Produkte verwendet werden kann.[19] Trotz des relativ hohen Aufwands wird das Verfahren als lohnend bewertet, da die Ausgaben sich nur auf etwa 4 % der Kosten belaufen, die für die Produktion neuer Plastikflaschen aus Rohöl anfallen.[20][21]
Bedeutung von Enzymen in der medizinischen Diagnostik
Die Diagnostik verwendet Enzyme, um Krankheiten zu entdecken. In den Teststreifen für Diabetiker befindet sich zum Beispiel ein Enzymsystem, das unter Einwirkung von Blutzucker einen Stoff produziert, dessen Gehalt gemessen werden kann. So wird indirekt der Blutzuckerspiegel gemessen. Man nennt diese Vorgehensweise eine „enzymatische Messung“. Sie wird auch in medizinischen Laboratorien angewandt, zur Bestimmung von Glucose (Blutzucker) oder Alkohol. Enzymatische Messungen sind relativ einfach und preisgünstig anzuwenden. Man macht sich dabei die Substratspezifität von Enzymen zu Nutze. Es wird also der zu analysierenden Körperflüssigkeit ein Enzym zugesetzt, welches das zu messende Substrat spezifisch umsetzen kann. An der entstandenen Menge von Reaktionsprodukten kann man dann ablesen, wie viel des Substrats in der Körperflüssigkeit vorhanden war.
Im menschlichen Blut sind auch eine Reihe von Enzymen anhand ihrer Aktivität direkt messbar. Die im Blut zirkulierenden Enzyme entstammen teilweise spezifischen Organen. Es können daher anhand der Erniedrigung oder Erhöhung von Enzymaktivitäten im Blut Rückschlüsse auf Schädigungen bestimmter Organe gezogen werden. So kann eine Bauchspeicheldrüsenentzündung durch die stark erhöhte Aktivität der Lipase und der Pankreas-Amylase im Blut erkannt werden.
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg – Berlin 2003, ISBN 3-8274-1303-6.
- David Fell: Understanding the Control of Metabolism. Portland Press Ltd, London 1997, 2003, ISBN 1-85578-047-X.
- Alfred Schellenberger (Hrsg.): Enzymkatalyse. Einführung in die Chemie, Biochemie und Technologie der Enzyme. Gustav Fischer Verlag, Jena 1989, ISBN 3-540-18942-4.
- Donald Voet, Judith G. Voet: Biochemistry. 3. Auflage. John Wiley & Sons Inc., London 2004, ISBN 0-471-39223-5.
- Maria-Regina Kula: Enzyme in der Technik. Chemie in unserer Zeit, 14. Jahrg. 1980, Nr. 2, S. 61–70, doi:10.1002/ciuz.19800140205
- Brigitte Osterath, Nagaraj Rao, Stephan Lütz, Andreas Liese: Technische Anwendung von Enzymen: Weiße Wäsche und Grüne Chemie. Chemie in unserer Zeit 41(4), S. 324–333 (2007), doi:10.1002/ciuz.200700412
- Otto Westphal, Theodor Wieland, Heinrich Huebschmann: Lebensregler. Von Hormonen, Vitaminen, Fermenten und anderen Wirkstoffen. Societäts-Verlag, Frankfurt am Main 1941 (= Frankfurter Bücher. Forschung und Leben. Band 1), insbesondere S. 57–64 (Geschichte der Fermentforschung).
Weblinks
- IUBMB – Verzeichnis und Nomenklatur der Enzyme
- BRENDA umfangreiche Enzymdatenbank
- ExploreEnz – The Enzyme Database
- Enzymdatenbank mit Suchmaschine
- KEGG Metabolic Pathway Database (graphische Darstellungen der biochemischen Reaktionen mit den dazugehörigen, systematisch identifizierten Enzymen)
- Auswahl von Enzymen, die Brotteig zugesetzt werden
Einzelnachweise
- Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarbeitete und erweiterte Auflage. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2005, ISBN 978-3-8047-2113-5, S. 106.
- Kluge Etymologisches Wörterbuch der deutschen Sprache, 24. Auflage.
- Dictionary bei in.gr, Eintrag Enzyme. Abgerufen am 29. Mai 2013.
- Wolf-Dieter Müller-Jahncke: Enzyme. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 356 f., hier: S. 356.
- The Nobel Prize in Chemistry 1946. In: nobelprize.org, abgerufen am 19. November 2016.
- A. Tramontano, K. D. Janda, R. A. Lerner: Catalytic antibodies. In: Science. Band 234, Nummer 4783, Dezember 1986, S. 1566–1570. PMID 3787261.
- R. A. Lerner, S. J. Benkovic, P. G. Schultz: At the crossroads of chemistry and immunology: catalytic antibodies. In: Science. Band 252, Nummer 5006, Mai 1991, S. 659–667. PMID 2024118.
- L. Pauling: Chemical achievement and hope for the future. In: American scientist. Band 36, Nummer 1, Januar 1948, S. 51–58. PMID 18920436.
- Ronald R. Breaker, Gerald F. Joyce: A DNA enzyme that cleaves RNA. In: Chem Biol. Band 1, Nr. 4, Dezember 1994, S. 223–229, doi:10.1016/1074-5521(94)90014-0, PMID 9383394.
- -ase – Duden, 2016
- JCBN/NC-IUB Newsletter 1984: Synthases and Ligases (englisch).
- Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB) Enzyme Nomenclature. Recommendations: EC 7. Translocases (englisch)
- Archivierte Kopie (Memento des Originals vom 24. Februar 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Ulrich Weber (Hrsg.): Biologie Oberstufe Gesamtband, Cornelsen Verlag Berlin 2001, ISBN 3-464-04279-0, S. 72.
- Funktionelle Enzyme (im Brotteig)
- Artifizielle Enzyme könnten Allergien auslösen
- Robert Ebermann, Ibrahim Elmadfa: Lehrbuch der Lebensmittelchemie und Ernährung. 2. Auflage. Springer-Verlag Wien New York, 2008 und 2011, ISBN 978-3-7091-0210-7, S. 594, Seite online bei Google Books.
- Künstliches Enzym kann Plastik zerlegen. Deutschlandfunk Nova, abgerufen am 27. Januar 2021.
- Mutiertes Enzym zerlegt Plastik in Rekordzeit. ingenieur.de, abgerufen am 27. Januar 2021.
- Mutiertes Enzym zerlegt Plastik in wenigen Stunden. t-online.de, abgerufen am 27. Januar 2021.
- Das Enzym, das Plastik frisst. Frankfurter Rundschau, abgerufen am 27. Januar 2021.