Nomenklatur (Anorganische Chemie)
Durch die Nomenklatur chemischer Verbindungen ist es möglich, die Zusammensetzung oder Struktur einer chemischen Verbindung durch einen Namen sicher und eindeutig zu beschreiben. Umgekehrt ist die Nomenklatur aber nicht eineindeutig, da es für die gleiche Verbindung in der Regel mehrere, teils historische, Namen gibt. Die Namen von anorganischen chemischen Verbindungen sollten dabei den IUPAC Empfehlungen für Anorganische Substanzen folgen, welche sich von den IUPAC Empfehlungen für organische Substanzen teilweise unterscheiden. Soweit nicht anders erwähnt, bezieht sich der folgende Artikel auf die aktuelle deutschsprachige IUPAC-Nomenklatur.
Trivialnamen
Historisch war die Namensfindung chemischer Verbindungen oft mehr oder weniger willkürlich, da die genaue Zusammensetzung zumeist unbekannt war. Oft benannten Entdecker eine Substanz daher mit unsystematischen Trivialnamen z. B. aufgrund des Herstellungsweges, basierend auf der (lateinischen) Bezeichnung eines Ausgangsstoffes, seiner Verwendung oder einer Eigenschaft. Auch erhielten Substanzen oft den Namen des Entdeckers.
- Vitriolöl, hergestellt aus Vitriol
- Kakodyl, unangenehm riechend
- Brillantgrün, aufgrund der Farbe
- Gerbsäure, aufgrund der Verwendung beim Gerben
- Glaubersalz, entdeckt von Johann Rudolph Glauber
- Zeise-Salz, zuerst hergestellt von William Christopher Zeise
Aufgrund der fehlenden Systematik mussten alle Namen einzeln erlernt werden. Ein weiterer Nachteil war, dass ein anderer Chemiker, wenn er den Namen nicht kannte, aufgrund des Trivialnamens nicht auf die Zusammensetzung oder Struktur einer Verbindung schließen konnte. Zudem konnte die gleiche Verbindung mehrere Trivialnamen haben. Die Verwendung von Trivialnamen wird daher von der IUPAC grundsätzlich nicht empfohlen und soll auf wenige Ausnahmen (Wasser, Ammoniak etc.) beschränkt werden.
Nomenklatursysteme
Neben den historischen Trivialnamen, gibt es systematische Namen auf der Basis verschiedener Nomenklatursysteme, und darauf aufbauend semisystematische Namen und Sondernamen. Diese Nomenklatursysteme haben jeweils eigene Regeln und verschiedenen Vor- und Nachteile. Etablierte Nomenklatursysteme in der Anorganischen Chemie sind
- Binärnomenklatur (de Morveau, 1787)
- Koordinationsnomenklatur (Alfred Werner, 1893)
- Substitutionsnomenklatur (Jean-Baptiste Dumas, 1838)
- Hantzsch-Widman-Nomenklatur (Arthur Hantzsch, Oskar Widman und Austin M. Patterson, 1888)
- Additionsnomenklatur
- Subtraktionsnomenklatur
- Austauschnomenklatur
- Anellierungsnomenklatur
- Konjunktionsnomenklatur (Chemical Abstracts)
- Sondernomenklaturen (z. B. bei Oxosauren, Borverbindungen oder Clustern)
Alle Nomenklatursysteme basieren auf Morphemen. D. h. die systematischen Namen oder Namensbestandteile werden aus Elementnamen und verschiedenen Bausteinen, wie Vorsilben (Präfixe), Einfügungen (Infixe) und Nachsilben (Suffixe) zusammengesetzt. Diese werden mit Ziffern und Interpunktionszeichen zum vollständigen Namen komplettiert. Präfixe werden insbesondere zur Beschreibung der Anzahl der Atome oder Atomgruppen (...dichlorid..., ...tetraoxid...) oder deren räumliche Anordnung (cis, trans, cyclo, η) hinzugefügt. Suffixe können z. B. Auskunft über die Ladung (...chlorid..., ...sulfid..., bromido...) oder eine Stammverbindung (Silan, Plumban, ...silyl..) geben und werden üblicherweise dem Namensstamm angehängt.[1]
In den IUPAC Empfehlungen für anorganische Verbindungen werden insbesondere die Binär-, Koordinations- und Substitutionsnomenklatur verwendet. In der folgenden Tabelle sind die Namen, die sich aus den drei Systemen ergeben, am Beispiel von SiCl4 und IF5 gegenübergestellt:
Substanz Strukturformel Nomenklatursystem Binär Koordination Substitution SiCl4 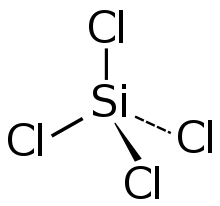
Siliciumtetrachlorid Tetrachloridosilicium Tetrachlorsilan IF5 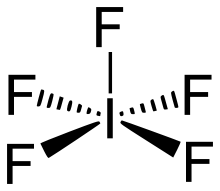
Iodpentafluorid Pentafluoridoiod Pentafluoriodan
Alle drei Systeme können alternativ verwendet werden, wenn auch nicht alle für eine Substanz gleich gut geeignet sind. Die Namensbildung muss aber immer komplett aus einem System erfolgen, eine Vermischung ist nicht erlaubt. Entsprechend sind Namen wie Siliciumtetrachlor oder Tetrachloridorsilan falsch und unzulässig. In der Regel sind die Endvokale der Morpheme im Namen immer zu verwenden. Das Weglassen von Vokalen ist nur in wenigen Ausnahmen, nach vorgegebenen Regeln, erlaubt, um die Aussprache zu vereinfachen. Beispiele Oxazol (nicht Oxaazaol), Disilan (nicht Disilaan), aber Tetraaqua und Tetraammin.[2]
Binärnomenklatur
In der Binärnomenklatur (englisch compositional nomenclature) werden die einzelnen Elemente und Gruppen nach einfachen Regeln hintereinander gestellt. Es handelt sich im Wesentlichen um eine stöchiometrische Nomenklatur, welche meist keine Rückschlüsse auf die Molekülstruktur oder -geometrie zulässt. Entsprechend wird die Binärnomenklatur bevorzugt für salzartige (binäre) Verbindungen verwendet oder wenn die Struktur einer Verbindung unbekannt oder nicht von Interesse ist. Die Reihenfolge der Nennung der Elemente und Gruppen erfolgt von elektropositiv zu elektronegativ. Zusätzlich werden Zahlenpräfixe vorangestellt und die Ladung eines Elements oder einer Gruppe durch Modifizierung des Namensstamm kenntlich gemacht.
Namensbildung:
Zahlenpräfix1 + Kation1 + Zahlenpräfix2 + Kation2 + ... + Zahlenpräfixn + Anionn + Zahlenpräfixn+1 + Anionn+1
Beispiele: AlCl3 Aluminiumtrichlorid; KMgCl(SO4) Kaliummagnesiumchloridsulfat
Kationennamen
Bei einkernigen Kationen entspricht der Kationenname dem Elementnamen. Existieren mehrere Oxidationsstufen für ein Metallatom, so wird die in einer Verbindung vorliegende Oxidations- oder Ladungszahl durch eine, in Klammern gesetzte, nachgestellte arabische und römische Ziffern angegeben, Beispiele Eisen(II)-oxid = FeO oder Eisen(III)-oxid = Fe2O3. Kationen (auch nur formale) behalten grundsätzlich den Elementnamen. Wasserstoff wird als Hydrogen bezeichnet.
Anionennamen
Die Namen der Anionen werden durch die Suffixe -id, -at und -it gebildet.
- Für einatomige Anionen oder polymere Einheiten aus den gleichen Atomen wird an den Namensstamm die Endung -id angehängt. Einige wichtige sind:
Gruppe 14 Gruppe 15 Gruppe 16 Gruppe 17 Namen Carbid (C4−)
Silicid (Si4−)Nitrid (N3−)
Phosphid (P3−)
Arsenid (As3−)Oxid (O2−)
Peroxid ((O2)2−)
Sulfid (S2−)
Selenid (Se2−)Fluorid (F−)
Chlorid (Cl−)
Bromid (Br−)
Iodid (I−)Beispiele SiC Siliciumcarbid Na3N Natriumnitrid Na2S Natriumsulfid CaF2 Calciumdifluorid
- Koordinationseinheiten und polymere Einheiten mit verschiedenen Atomen erhalten die Endung -at, Beispiele Hexacyanidoferrat, Sulfat.
- Die Endung -it wird weiterhin für einige Trivialnamen verwendet, Beispiele Nitrit, Sulfit.
Koordinationsnomenklatur
Diese für Komplexe entwickelte, prinzipiell additive Nomenklatur (englisch additive nomenclature) geht von einer Molekülstruktur mit einem Zentralatom aus, welches – entsprechend seiner Bindigkeit – mit mehreren Liganden verknüpft ist.
Namensbildung:
Zahlenpräfix1 + Ligand1 + Zahlenpräfix2 + Ligand2 + ... + Zahlenpräfixn + Ligandn + Elementname Zentralatom
Beispiel: [PtCl2(NH3)2] Dichloridodiamminplatin
Die Namen der Liganden werden je nach Ladung unterschiedlich gebildet:[3]
- Der Name anionischer Liganden ergibt sich aus dem Namen des Anions mit der Endung -o, Beispiele Hydrid → Hydrido, Borid → Borido, Cyanid → Cyanido. Es gab bis zur Revision der IUPAC-Nomenklatur im Jahr 2005 in der deutschen Schreibweise eine Reihe von zugelassenen Ausnahmen: Fluoro (F-),Chloro (Cl-), Bromo (Br-), Iodo (I-), Oxo (O2-), Peroxo ((O2)2-), Hydroxo (HO-), Hydrogenperoxo ((HO2)-), Cyano (CN-), Thio (S2-) und Mercapto oder Hydrosulfido (HS-). Diese Ausnahmen sind durch die Überarbeitung nun weggefallen.[4]
- Der Name kationischer Liganden entspricht den Elementnamen bzw. wird bei heteropolyatomigen Kationen durch Anfügen der Endung -ium gebildet, Beispiel Hydrazin → Hydrazinium.
- Neutral Liganden werden wie die Verbindung benannt, Beispiel Triphenylphosphan → Triphenylphosphan.
Substitutionsnomenklatur
Die Substitutionsnomenklatur (englisch substitutive nomenclature) ist, in Analogie zur Substitutionsnomenklatur bei organischen Substanzen, besonders geeignet für anorganische Verbindungen, welche sich von einer Element-Wasserstoff-Verbindung (Stammhydrid) ableiten lassen. Sie kann überall angewendet werden, wo sie geeignet ist. Die Verbindungsnamen leiten sich von einer Stammverbindung ab, die gebundenen Substituenten (Atome oder Atomgruppen) werden analog der Nomenklatur in der organischen Chemie vorangestellt, in Ausnahmen angehängt.[5]
Namensbildung:
Zahlenpräfix1 + Substituent1 + Zahlenpräfix2 + Substituent2 + ... + Zahlenpräfixn + Substituentn + Stammname
Beispiele: Cl2SiH-SiH2OH 1,1-Dichlor-2-hydroxydisilan oder 1,1-Dichlordisilan-2-ol
Hantzsch-Widman-Nomenklatur
Die Hantzsch-Widman-Nomenklatur befasst sich mit der Benennung von heterocyclischen chemischen Verbindungen.
Systematik
Zahlenpräfixe
In chemischen Namen werden Zahlenpräfixe verwendet, um anzugeben, wie viele gleiche Atomen oder Atomgruppen in einem Molekül vorkommen, Beispiel Calciumdichlorid, Pentacarbonyleisen.[1] Das Präfix Mono wird üblicherweise nicht verwendet, es sei denn, der Verbindungsname ist sonst mehrdeutig oder speziell darauf besonders hingewiesen werden soll.
Namensstamm
Der Namensstamm entspricht in der Regel entweder dem Elementnamen oder dessen Kurzform.
Arabische und römische Ziffern
Arabische und römische Ziffern werden in Formeln und Namen für verschiedene Zwecke verwendet.[6]
| Ziffer | Wo | Verwendung | Beispiel |
|---|---|---|---|
| Arabisch | Formel: | als Index zur Angabe der Anzahl (≠1) | Fe3(PO4)2 |
| als linker Exponent zur Angabe der Massenzahl | |||
| als linker Index zur Angabe der Ordnungszahl | |||
| Formel: Namen: | zur Angabe der Haptizität | Fe(η5-C5H5)2 | |
| Bis(η5-cyclopentadienyl)eisen | |||
| zur Angabe der Ladungszahl/Ewens-Bassett-Zahl (positiv: 2+; negativ: 2-) | Fe2+ | ||
| Eisen(2+)-sulfat | |||
| als Faktor in Additionsverbindungen | CuSO4·5H2O | ||
| Kupfersulfat–Wasser (1/5) | |||
| Namen: | zur Angabe der Position in einer Stammverbindung (Lokanten) | 1,1-Dichlordisilan | |
| zur Angabe der verbrückten Zentralatome | Tris(μ2-carbonyl)hexacarbonyldieisen | ||
| zur Angabe der Wasserstoffatome in Borverbindungen | Hexaboran(12) = B6H12 | ||
| zur Angabe der Bindungszahl eines Zentralatoms | λ6–Sulfan | ||
| Römisch | Formeln: Namen: | zur Angabe der Oxidationszahl/Stock-Zahl (positiv: III; negativ: -II) | K4[FeII(CN)4] |
| Kaliumhexacyanidoferrat(II) | |||
Griechische Buchstaben
Griechische Buchstaben werden unter anderem wie folgt verwendet:
- α, β, γ zur Angabe von relativen Positionen und relativen Abständen, oder zur Unterscheidung von Modifikationen oder Phasen, Beispiel γ-Aminobuttersäure, α,β-Quarz
- β, γ, δ, ε zur Angabe der Ringgröße von Lactonen
- η zur Beschreibung der Haptizität (Hapto-Konvention), Beispiel Be(C5H5)2 Bis(η1,η5-cyclopentadienyl)beryllium(II)
- μ als Kennzeichnung eines verbrückten Ligandens, Beispiel Tris(μ2-carbonyl)hexacarbonyldieisen
- κ zur Bezeichnung der gebundenen Atome eines (mehrzähnigen) Liganden (Kappa-Konvention)
- λ zur Angabe der Bindungszahl eines Zentralatoms (Lambda-Konvention), Beispiel SH6 λ6–Sulfan
- σ, π, zur Angabe der Art einer Bindung (sigma- oder pi-Bindung)
Deskriptoren
Deskriptoren sind Präfixen in systematischen Substanznamen, die die Konfiguration oder die Stereochemie des Moleküls beschreiben, Beispiele cis, trans und cyclo, aber auch die oben beschriebenen griechischen Buchstaben η, μ, κ und λ. Verschiedene Deskriptoren entsprechen nicht den aktuellen IUPAC Empfehlungen und sollten daher nicht mehr verwendet werden.
Klammerungen
Um eindeutige Formeln und Namen zu erhalten, werden Namensteile und spezielle Angaben in Klammern gefasst. Drei Arten von Klammern werden verwendet: runde ( ), eckige [ ] und geschweifte { }.[7] Eckigen Klammern werden dabei in der Anorganischen Chemie und der Organischen Chemie unterschiedlich verwendet.
Klammer-
typWo Verwendung Beispiel [ ] Formel: Koordinationseinheiten sind immer in eckigen Klammern [Fe(C5H5)2], [Pt(NH3)2Cl2] isotopenmarkierte Verbindungen H2[15N]-NH2 [15N]Hydrazin ( ) Formel: Zusammenfassung gleicher Gruppen/Einheiten Fe3(PO4)2 Abgrenzung und um Mehrdeutigkeit zu vermeiden Si(C6H5)(CH3)3, Tl(I3) Namen: Zusammenfassung gleicher Gruppen/Einheiten Dichloridobis(dimethylamin)kupfer(II) Vermeidung von Mehrdeutigkeit (Thiosulfato) oder (Thio)(sulfato) Angabe von Oxidations- oder Ladungszahl Dichloridobis(dimethylamin)kupfer(II) { } Formel:
Namen:ausschließlich in verschachtelten Klammerungen
Werden Klammern in Formeln oder Namen verschachtelt, so werden die verschiedenen Klammertypen wechselweise verwendet:
- In Formeln werden runde, eckige und geschweifte Klammern folgendermaßen gesetzt: ( ), [ ( ) ], [ { ( ) } ], [ { [ ( ) ] } ], [ { { [ ( ) ] } } ].[8]
- Im Namen werden Klammern von innen nach außen wie folgt verwendet: { { { [ ( ) ] } } }.
Leerzeichen, Bindestriche, lange Striche und Schrägstriche
An fast allen Stellen, wo im Englischen Leerzeichen zwischen den Worten eines Namen verwendet werden, stehen im Deutschen Bindestriche. Ausnahmen sind:[9]
- Um am Ende des Namens einer mehrkernigen Verbindung die arabischen Ziffern von den kursiv geschriebenen Symbolen der Zentralatome zwischen runden Klammem zu trennen. Beispiel: cyclo-Tris(tetracarbonylosmium)(3 Os-Os)
- Um die Angabe der Mengenverhältnisse in Additionsverbindungen vom Rest des Namens zu trennen. Beispiel: Cadmiumsulfat–Wasser (3/8)
- Um die Bezeichnung des Strukturtyps vom Namen von Doppeloxiden bzw. -hydroxiden zu trennen. Beispiel: Magnesium-titan-trioxid (Ilmenit-Typ)
Bindestriche werden in FORMELN und in NAMEN verwendet:[10]
- Um Lokanten von Worten oder Morphemen des Namens zu trennen. Beispiel: But-2-en
- Um einen Stereodeskriptor von einem Namen zu trennen. Beispiel: (E)-But-2-en
- Um in Namen von binären Verbindungen den elektropositiven Teil des Namens vom elektronegativen zu unterscheiden. Enthält der Name eine (in Klammern eingeschlossene) Oxidations- oder Ladungszahl, so wird die Verwendung eines Bindestrichs nach der Klammer dringend empfohlen. Beispiel: Eisen(III)-chlorid
- Um Symbole wie µ vom Rest der Formel oder des Namens zu trennen.
- Um Strukturdeskriptoren wie cyclo, catena, triangulo, quadro, tetrahedro, octahedro, closo, nido, arachno, cis und trans sowie z. B. Λ und α vom Rest der Formel oder des Namens zu trennen. In den Bezeichnungen von Aggregaten oder Clustern werden Lokanten in gleicher Weise getrennt.
- Um das Symbol des markierenden Nuklids von seinem Lokanten in der Formel einer selektiv-markierten Verbindung zu trennen.
- Um zu verschiedenen Namensteilen gehörende, zusammenstehende Lokanten zu trennen. Klammern sollten jedoch bevorzugt werden.
- Um den Namen eines Brückenliganden vom Rest des Namens zu trennen.
Es darf an keinem Ende des Bindestrichs ein Leerzeichen stehen.
Lange Striche werden in Namen an Stelle von Bindestrichen verwendet um:[10]
- Metall-Metall-Bindungen anzugeben. Beispiel: [Mn2(CO)10] Bis(pentacarbonylmangan)(Mn–Mn)
- Zur Trennung der Bestandteile von Additionsverbindungen. Beispiel: 3CdSO4·8H2O Beispiel: Cadmiumsulfat–Wasser (3/8)
Der Schrägstrich "/" wird in Namen von Additionsverbindungen verwendet, um die Zahlen zu trennen, die die Anzahl der Einzelmoleküle der Verbindung angeben. Beispiel: Bortrifluorid-Wasser (1/2)[10]
Säuren, Oxosäuren und Oxoanionen
Die Namen der binären Säuren deren Anionen auf -id enden werden nach der Binärnomenklatur als Wasserstoffverbindungen gebildet, Beispiel Hydrogenfluorid, Hydrogenchlorid oder Hydrogensulfid. Die traditionellen Namen dieser Verbindungen, die auf -säure enden, wie Flusssäure, Salzsäure, sollen nur für die wässrigen Systeme verwendet werden und nicht für die Halogenwasserstoff-Verbindung selbst.
Traditionelle Namen (nicht IUPAC konform)
Die heute in der Chemie nach wie vor gebräuchlichen Namen der Sauerstoffsäuren werden nach einer Nomenklatur gebildet, welche von Lavoisier um 1789 eingeführt wurde. Danach erhielten die Oxosäuren einen zweiteiligen auf -säure endenden Namen, wobei im ersten Namensteil das Element und der Sauerstoffgehalt erkennbar sein sollte, Beispiel Schwefelsäure. Die Anionen werden aus dem Namensstamm durch anhängen der Endung -at gebildet, Beispiel Sulfat. Jedoch weiß man heute, dass bei gleichen Endungen die Oxidationsstufen nicht gleich sind. So ist die Oxidationsstufe von Schwefel in der Schwefelsäure VI, von Phosphor in Phosphorsäure dagegen V.
Nachdem weitere Elementsauerstoffsäuren bekannt wurden, wurden nach Bedarf die Vorsilben Hypo- und Per- hinzugefügt. Die Vorsilben Ortho-, Pyro- und Meta- wurden schließlich zur Unterscheidung von gleichen Säuren mit unterschiedlichem Wassergehalt eingeführt.[11] Perelementsäuren haben ein zusätzliches Sauerstoffatom, wodurch sich die Oxidationsstufe des Elements gegenüber der Elementsäure erhöht. Die Namen der Anionen werden aus dem Präfix Per, dem Namensstamm und der Endung -at gebildet, Beispiel Perchlorat. Heute sollte die Verwendung der Vorsilbe Per auf Elementsauerstoffsäuren der Gruppen 7 und 17 beschränkt werden. Elementige Säuren oder Elementigsäuren haben ein Sauerstoffatom weniger als die Elementsäuren. Die Anionennamen werden aus dem Namensstamm durch anhängen der Endung -it gebildet, Beispiel chlorit. Hypoelementigsäuren haben zwei Sauerstoffatome weniger und entsprechend eine wiederum niedrigere Oxidationsstufe. Die Namen der Anionen werden aus dem Präfix Hypo, dem Namensstamm durch anhängen der Endung -it gebildet, Beispiel Hypochlorit. Die Vorsilbe Hypo- sollte heute nur noch auf Elementsauerstoffsäuren der Gruppen 7 angewendet werden. Entsprechend heißt S(OH)2 Sulfoxylsäure und nicht Hyposchwefligsäure.[11]
Der Präfix Sub- (lateinisch: unter) wurde früher in unsystematischen chemischen Stoffbezeichnungen für Bestandteile verwendet, deren Gehalt niedriger als normal ist. Zum Beispiel enthält Kohlenstoffsuboxid (C3O2) weniger Sauerstoff als die normalen Kohlenstoffoxide CO und CO2. In den Bismutsubnitraten Bi(O)NO3 und Bi5O(OH)9(NO3)4 ist weniger Nitrat enthalten als in Bismutnitrat [Bi(NO3)3].[12] Subacetate, Subcarbonate, Subnitrate, Subphosphate und ähnliche enthalten weniger der Basisverbindung als normal, sind also die basischen Varianten. Subchloride (wie zum Beispiel Bismutsubchlorid) und andere Subhalogenverbindungen enthalten mehr des Elementes bzw. weniger des Halogens als normal.[13]
| Name | Gruppe | ||||
|---|---|---|---|---|---|
| 13 | 14 | 15 | 16 | 17 | |
| Perelementsäure (Anion mit -at) | HXO4 | ||||
| Elementsäure (Anion mit Endung -at) | H3XO3 | H2XO3 | H3XO4 | H2XO4 | HXO3 |
| Elementige Säure oder Elementigsäure (Anion mit -it) | H3XO3 | H2XO3 | HXO2 | ||
| Hypoelementige Säure oder Hypoelementigsäure (Anion mit -it) | HXO | ||||
Säurenomenklatur nach IUPAC
Die Namen von Säuren nach der IUPAC-konformen Nomenklatur werden aus zwei Teilen gebildet. Der erste Teil beschreibt die Zusammensetzung des komplexen Anions, angehängt wird die Endung -säure[11]
Namensbildung:
Zahlenpräfix1 + Ligand1 + Zahlenpräfix2 + Ligand2 + ...+ Zahlenpräfix + Elementname des Zentralatoms (+ Oxidations- oder Ladungszahl in Klammern) + "säure"
Beispiele: H2SO4 Tetraoxoschwefelsäure; H2S2O6 Hexaoxodischwefelsäure; HMnO4 Tetraoxomangan(VII)-säure oder Tetraoxomangan(-1)-säure
Diese Nomenklatur ist streng auf die Säuren der Elemente Bor, Kohlenstoff, Silicium, Stickstoff, Phosphor, Arsen, Schwefel, Chlor, Iod, Chrom und Mangan beschränkt. Die Angabe der Oxidations- oder Ladungszahl ist nicht zwingend erforderlich. Anionen werden als Koordinationseinheiten behandelt und erhalten die Endung -at, Beispiel Tetraoxomanganat(VII) [MnO4]-.
Hydrogennomenklatur
Die im Deutschen nicht gebräuchliche, wenn auch von der IUPAC empfohlene Nomenklatur, ist die Hydrogennomenklatur. Diese Nomenklatur ist auf die Hauptgruppenelement begrenzt. Die Wasserstoffatome werden dabei als Kationen einer salzartigen Verbindung behandelt, das Anion wird entsprechend der Koordinationsnomenklatur benannt.
Namensbildung:
(Zahlenpräfix +) "Hydrogen" + Zahlenpräfix1 + Ligand1 + Zahlenpräfix2 + Ligand2 + ... + Namensstamm Zentralatom + "at" (+ Oxidations- oder Ladungszahl in Klammern)
Beispiele: H2SO4 Dihydrogentetraoxosulfat oder Hydrogentetraoxosulfat(VI) oder Hydrogentetraoxosulfat(2-) H5IO6 Pentahydrogenhexaoxoiodat(5-)
Der Zahlenpräfix und die Oxidations- oder Ladungszahlwerden können alternativ verwendet werden und können bei Redundanz weggelassen werden.
Gegenüberstellung
Die folgende Tabelle enthält die traditionellen Namen und deren korrespondierende Anionen, die IUPAC Säurenamen und die Namen nach der Hydrogennomenklatur einiger Oxosäuren.
| Formel | traditioneller Name | Anion | IUPAC Säurenomenklatur | Hydrogennomenklatur |
|---|---|---|---|---|
| H3BO3 | Borsäure | Borat | Trioxoborsäure | Trihydrogentrioxoborat |
| (HBO2)n | Metaborsäure | Metaborat | Polydioxoborsäure | Poly[monohydrogendioxoborat] |
| H2CO3 | Kohlensäure | Carbonat | Trioxokohlensäure | Dihydrogentrioxocarbat |
| H4SiO4 | Orthokieselsäure | Orthosilikat | Tetraoxokieselsäure | Tetrahydrogentetraoxosilicat |
| HOCN | Cyansäure | Cyanat | Nitridooxokohlensäure | Monohydrogennitridooxocarbat |
| HNO3 | Salpetersäure | Nitrat | Trioxosalpetersäure | Monohydrogentrioxonitrat |
| HNO2 | Salpetrige Säure | Nitrit | Dioxosalpetersäure | Monohydrogendioxonitrat |
| H3PO4 | Phosphorsäure | Phosphat | Tetraoxophosphorsäure | Trihydrogentetraoxophosphat |
| H3PO3 | Phosphorige Säure | Phosphit | Trioxophosphor(3-)-säure | Trihydrogentrioxophosphat |
| H2SO4 | Schwefelsäure | Sulfat | Tetraoxoschwefelsäure | Dihydrogentetraoxosulfat |
| H2SO3 | Schweflige Säure | Hydrogensulfit (HSO3−) und Sulfit (SO32−) | Trioxoschwefelsäure | Dihydrogentrioxosulfat |
| HClO4 | Perchlorsäure | Perchlorat | Tetraoxochlorsäure | Monohydrogentetraoxochlorat |
| HClO3 | Chlorsäure | Chlorat | Trioxochlorsäure | Monohydrogentrioxochlorat |
| HClO2 | Chlorige Säure | Chlorit | Dioxochlorsäure | Monohydrogendioxochlorat |
| HClO | Hypochlorige Säure | Hypochlorit | Monooxochlorsäure | Monohydrogenmonooxochlorat |
| HIO4 | Periodsäure | Periodat | Tetraoxoiodsäure | Monohydrogentetraoxoiodat |
| HIO3 | Iodsäure | Iodat | Trioxoiodsäure | Monohydrogentrioxoiodat |
| H5IO6 | Orthoperiodsäure | Orthoperiodat | Hexaoxoiod(5-)säure | Pentahydrogenhexaoxoiodat |
Neutralmoleküle
Neutralmoleküle werden insbesondere nach Substitutions- oder Koordinationsnomenklatur benannt. Eine Sonderstellung haben die Organometall-Verbindungen. Borane (Borhydride) und Clusterverbindungen des Bors haben eine komplett eigene Sondernomenklatur.
Substitutionsnomenklatur
Die Namen der Element-Wasserstoff-Verbindungen und deren Derivate werden hierbei aus den Stammnamen nach der Substitutionsnomenklatur gebildet.
Stammnamen
Die Stammnamen der gesättigten einkernigen Element-Wasserstoffverbindungen der Gruppen 13 bis 17 werden aus dem Namensstamm durch Anhängen der Endung –an gebildet (Hydridnamen).[14] In der deutschen Nomenklatur wird empfohlen, diese Namen nur für die Elemente B, C, Si, Ge, Sn, Pb, N, P, As, Sb, Bi, 0, S, Se, Te und Po anzuwenden.[15]
Gruppe 13 Gruppe 14 Gruppe 15 Gruppe 16 Gruppe 17[A 1] BH3 Boran CH4[A 2] Methan NH3 Azan H2O Oxidan[A 3] HF Fluoran AlH3 Aluman[A 3] SiH4 Silan PH3 Phosphan[A 4] H2S Sulfan[A 3] HCl Chloran GaH3 Gallan GeH4 German AsH3 Arsan[A 4] H2Se Selan[A 3] HBr Broman InH3 Indigan[A 5] SnH4 Stannan SbH3 Stiban[A 4] H2Te Tellan[A 3] HI Iodan TlH3 Thallan PbH4 Plumban BiH3 Bismuthan[A 3] H2Po Polan[A 3] HAt Astatan
Anmerkungen A:
- Die unsubstituierten Verbindungen können auch Hydrogenfluorid, Hydrogenchlorid, etc. benannt werden, jedoch nicht als Stammname.
- Der analoge Name Carban wird aufgrund der universellen Verwendung von Methan nicht empfohlen.
- Die Namen Aluminan, Bisman, Oxan, Thian, Selenan, Telluran und Polonan können nicht verwendet werden da sie bereits für die sechskernigen Heteromonocyclen im Hantzsch-Widman-System genutzt werden.
- Die Namen Phosphin, Arsin und Stibin sollen nicht länger verwendet werden, da sie mit den entsprechenden mehrkernigen ungesättigten Verbindungen (s. u.) verwechselt werden können.
- Der analoge Name Indan wird bereits anderweitig verwendet.
Die Verbindungsgruppen werden entsprechend Borane, Silane, Arsane, Phosphane usw. genannt. Die Namen der mehrkernigen Verbindungen werden durch Voranstellen der oben genannten Zahlenpräfixe gebildet, z. B. Monogerman (GeH4), Diphosphan (H2P-PH2) oder Tetrasilan (H3Si-SiH2-SiH2-SiH3). Daneben sind eine ganze Reihe von Trivialnamen weiterhin zulässig, Beispiele, Ammoniak, Hydrazin oder Wasser.
Bindungszahl
Für den Fall, dass die Bindungsanzahl von der Standardbindungsanzahl (drei für Gruppe 13, vier für Gruppe 14, drei für Gruppe 15, zwei für Gruppe 16) abweicht, wird dies durch das Voranstellen des griechischen Buchstabens λ und der entsprechenden hochgestellten Zahl gekennzeichnet, Beispiele SnH2 λ2–Stannan, SH6 λ6–Sulfan. Anderer Stammnamen, wie z. B. Phosphoran, Arsoran oder Sulfuran für λ5-Phosphan, λ5-Arsan, oder λ6–Sulfan sind nicht allgemein anwendbar und werden daher nicht empfohlen.[15]
Die Namen der ungesättigten Verbindungen können in der Regel durch Anwendung der entsprechenden Regeln für organische Substanzen (Doppelbindung -en, Dreifachbindung -in) gebildet werden (Beispiel: H2N-N=NH Triazen). Dabei muss aber berücksichtigt werden, dass es dadurch nicht zu Verwechselungen mit existierenden chemischen Namen kommt, Beispiel Arsen oder Selen.
Derivate
Die Namen der substituierten Elementorganischen-Verbindungen der Gruppe 13 bis 16 leiten sich von den entsprechenden Element-Wasserstoff-Verbindungen ab.[16] Diesen wird, wie bei den organischen Verbindungen, der Name des Substituenten vorangestellt. Gibt es mehrere Substituenten, so werden diese in alphabetischer Reihenfolge genannt, Beispiele Sn(CH3)4 Tetramethylstannan, GeCl2Me2 Dichlordimethylgerman, H3C-NH-N=N-CH3 1,3-Dimethyltriazen.
Koordinationsnomenklatur
Die Koordinationsnomenklatur ist gegenüber traditionellen Namen insbesondere bei den Substanzen zu bevorzugen, bei denen der kovalente Bindungsanteil überwiegt. Bei diesen vermitteln die historischen, üblicherweise auf der binäre Nomenklatur basierenden Namen den falschen Eindruck es handele sich um salzartige Verbindungen. So ist BBr3 bevorzugt als Tribromidobor (oder Tribromboran) anstatt Bortribromid oder PCl3 als Trichloridophosphor (oder Trichlorphosphan) und nicht als Phosphortrichlorid zu bezeichnen. Bei vorwiegend ionischen Verbindungen sollte die Koordinationsnomenklatur dagegen nicht benutzt werden. So ist der Name für MgBr2 nicht Dibromidomagnesium, sondern Magnesiumdibromid.
Die Namensbildung folgt den oben angegebenen Regeln zu Koordinationsnomenklatur. Die Nennung der Liganden erfolgt in alphabetischer Reihenfolge, wobei Zahlenpräfixe hierbei unberücksichtigt bleiben, Beispiel Tetraammindihydroxidokupfer(II).
Einzelnachweise
- Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 32–40 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 50–52 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 127–150 (eingeschränkte Vorschau in der Google-Buchsuche).
- Karl-Heinz Hellwich: Mehr Systematik: Nomenclature of Inorganic Chemistry. Hrsg. von der International Union of Pure and Applied Chemistry. RSC Publishing, Cambridge/UK, 2005. XII + 366 S., geb., 49,95 . ISBN 0-85404-438-8. In: Nachrichten aus der Chemie. 54, 2006, S. 807–808, doi:10.1002/nadc.20060540725.
- Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 153–158 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 41–44 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 55–60 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Liebscher, GDCh: Nomenklatur der Anorganischen Chemie. John Wiley & Sons, 2009, ISBN 3-527-62545-3, S. 15 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 63–66 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Liebscher, Ekkehard Fluck: Die Systematische Nomenklatur Der Anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 210–233 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jürgen Falbe, Manfred Regitz: RÖMPP Lexikon Chemie, 10. Auflage, 1996-1999 Band 5: Pl - S. Georg Thieme Verlag, 2014, ISBN 3-13-200051-5, S. 274 (eingeschränkte Vorschau in der Google-Buchsuche).
- Thomas Stedman: Stedman's Medical Dictionary. Dalcassian Publishing Company, 1920, S. 962 (eingeschränkte Vorschau in der Google-Buchsuche).
- Neil G. Connelly, Ture Damhus, Richard M. Hartshorn, Alan T. Hutton: Nomenclature of Inorganic Chemistry - IUPAC Recommendations 2005. 2005. Auflage. RSC Publishing, ISBN 0-85404-438-8, S. 84–85. IUPAC Red Book. (PDF; 4,1 MB).
- Wolfgang Liebscher, Ekkehard Fluck: Die Systematische Nomenklatur Der Anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 158–175 (eingeschränkte Vorschau in der Google-Buchsuche).
- Neil G. Connelly, Ture Damhus, Richard M. Hartshorn, Alan T. Hutton: Nomenclature of Inorganic Chemistry - IUPAC Recommendations 2005. 2005. Auflage. RSC Publishing, ISBN 0-85404-438-8, S. 230–85.