Thorium
Thorium (nach dem germanischen Gott Thor) ist ein chemisches Element mit dem Elementsymbol Th und der Ordnungszahl 90. Im Periodensystem steht es in der Gruppe der Actinoide (7. Periode, f-Block).
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Thorium, Th, 90 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Actinoide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | Ac, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-139-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.308 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 11 ppm[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 232,0377(4)[3][4] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius | 180 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 206 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Rn] 6d2 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 6.30670(25) eV[5] ≈ 608.5 kJ/mol[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 12.10(20) eV[5] ≈ 1167 kJ/mol[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 18.32(5) eV[5] ≈ 1768 kJ/mol[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 28.648(25) eV[5] ≈ 2764.1 kJ/mol[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 58.0(1,9) eV[5] ≈ 5600 kJ/mol[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 11,724 g/cm3[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 3,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 8,4 · 10−5)[9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 2028[8] K (1755 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 5061 K[8] (4788 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 19,80 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 530 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 16 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 2490 m·s−1 bei 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 6,67 · 106 A·V−1·m−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 54 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 4,3,2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,3 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Radioaktiv | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Geschichte
Hans Morten Thrane Esmark fand 1828 auf der norwegischen Insel Løvøya (Løvø), in der Nähe der Ortschaft Brevik im Langesundsfjord ein schwarzes Mineral. Er übergab diese Probe seinem Vater Jens Esmark, einem führenden norwegischen Professor für Geologie. Esmark konnte diese Probe keinem bisher bekannten Mineral zuordnen und sandte die Probe, in der er eine unbekannte Substanz vermutete, an den schwedischen Chemiker Jöns Jakob Berzelius. Der stellte dann im gleichen Jahr fest, dass dieses Mineral (Thorit) zu nahezu 60 % aus einem neuen Oxid (Thoriumdioxid) bestand. Das dem Oxid zugrunde liegende Metall benannte er nach dem Gott Thor Thorium.[13][14] Die Entdeckung des neuen Minerals veröffentlichte Berzelius 1829.[15]
Berzelius besaß bereits 1815 eine Gesteinsprobe, die er für ein neues Mineral hielt. Er ordnete dieses Mineral einem neuen Oxid zu und nannte das dazugehörige Metall nach dem germanischen Gott des Donners Thor. 1824 stellte sich jedoch heraus, dass es sich bei diesem vermeintlich neuen Mineral um Xenotim (Yttriumphosphat) handelte.[14]
1898 entdeckten Marie Curie[16] und Gerhard Schmidt (1865–1949)[17] zeitgleich die Radioaktivität von Thorium.[18]
1914 gelang Lely und Hamburger erstmals die Reindarstellung des Metalls.[19][20]
Vorkommen

Thoriumverbindungen finden sich häufig in Monazitsanden (Ce, La, Nd, Th) [PO4] + 4...12% ThO2, im mit Zirkon isomorphen Mineral Thorit ThSiO4 sowie in Thorianit (Th,U)O2. Auch Titanit und Zirkon selbst enthalten geringere Mengen Thorium.
In der Erdkruste kommt Thorium mit einer Häufigkeit von 7 bis 13 mg pro kg vor; damit ist es doppelt bis dreimal so häufig wie Uran. Generell ist das Element aufgrund seines lithophilen Charakters in geringen Mengen in fast allen silikatischen Gesteinen vertreten.[21]
Die weltweit jährlich für die Stromerzeugung verwendete Kohle enthält unter anderem etwa 10.000 t Uran und 25.000 t Thorium, die entweder in die Umwelt gelangen oder sich in Kraftwerksasche und Filterstäuben anreichern.[22]
Das radioaktive Metall wird in Australien, Norwegen, Sri Lanka, Kanada, USA, Indien, Lappland und Brasilien abgebaut. Stille Vorkommen von ca. 800.000 Tonnen liegen in der Türkei, überwiegend in der Provinz Eskişehir im Landkreis Sivrihisar. Menschliche Knochen enthalten zwischen 2 und 12 µg Thorium pro kg Knochenmasse. Durch Nahrung und Wasser werden täglich zwischen 0,05 und 3 µg aufgenommen.[23]
Eigenschaften

Reines Thorium ist ein silberweißes Metall, das an der Luft bei Raumtemperatur stabil ist und seinen Glanz einige Monate behält. Ist es mit seinem Oxid verschmutzt, läuft es langsam an der Luft an und wird grau und schließlich schwarz.
Die physikalischen Eigenschaften von Thorium hängen stark von seiner Verschmutzung durch sein Oxid ab. Viele „reine“ Sorten enthalten oft einige Promille Thoriumdioxid. Es ist aber auch hochreines Thorium verfügbar. Reines Thorium ist weich und sehr dehnbar, es kann kalt gewalzt und gezogen werden.
Thorium ist polymorph mit zwei bekannten Modifikationen. Bei über 1400 °C wandelt es sich von einer kubisch-flächenzentrierten zu einer kubisch-raumzentrierten Struktur um.
Von Wasser wird Thorium nur sehr langsam angegriffen, es löst sich auch in den meisten verdünnten Säuren (Fluss-, Salpeter-, Schwefelsäure) und in konzentrierter Salz- und Phosphorsäure nur langsam. In rauchender Salpetersäure und Königswasser löst es sich gut. Pulverförmiges Thorium wirkt bei feiner Verteilung pyrophor. Thorium verbrennt an der Luft mit weißer, hell leuchtender Flamme.
Darstellung
Erzverarbeitung
Thorium kommt in primären und sekundären Lagerstätten vor. Bei Erzaufbereitung werden die Erze der primären Lagerstätte gebrochen und gemahlen. Die Anreicherung geschieht in der Regel durch Flotation. Begleitende Erdalkalikarbonate werden durch eine Salzsäure-Behandlung gelöst. Bei den sekundären Lagerstätten wird in der Regel zuerst eine Schwerkrafttrennung der Mineralfraktionen durchgeführt, gefolgt von einer magnetischen Separation. Der Monazit kann durch seinen Paramagnetismus so von den ferromagnetischen Mineralien und unmagnetischen Mineralien getrennt werden.
Durch Eindickung, Filtration und Kalzinierung wird dann ein Konzentrat aus Thorium- und Seltene-Erden-Verbindungen erzeugt.
Erzaufschluss und Thoriumgewinnung
Monazit ist ein halbwegs inertes Mineral. Das einfachste Verfahren ist der Aufschluss mit heißer Schwefelsäure bei über 200 °C mit anschließender Fällung durch Verdünnung mit Wasser. Die Probleme des Verfahrens sind dabei die langsame Lösung der Körner sowie die Komplexierung der gelösten Metall-Ionen durch Phosphate und Sulfate und die damit verbundenen kleinen Prozessfenster. Daher wurde ein alkalischer Aufschluss mit heißer Natronlauge entwickelt, der eine Abtrennung der Phosphat-Ionen erlaubt. Allerdings setzte sich dieser Prozess nicht durch.
Ab etwa 1950 stieg das Interesse an Thorium höherer Reinheit (Nuclear Grade). Dies führte zu einer Erweiterung des Schwefelsäure-Prozesses um eine Fällung mit Oxalaten, die im Anschluss zu Thorium-Hydroxid umgesetzt werden. Dieses ist noch mit Seltenen Erden verunreinigt. Daher wurden die Hydroxide mit Salpetersäure in Form von Nitraten gelöst. Aus der Lösung wurde mittels Lösemittelextraktion – Tri-n-butyl-phosphat (TBP) in Kerosin – das Thorium extrahiert, zur Funktionsweise siehe auch PUREX-Prozess.[24][25][26][27]
Reduktion
Da Thorium eine geringe Elektronegativität besitzt, kann eine direkte Reduktion seiner Verbindungen nicht mit Hilfe von Kohlenstoff oder Wasserstoff erfolgen, es würden sich z. B. hochschmelzende Thorium-Carbide oder -hydride bilden.
Eine Möglichkeit ist die Elektrolyse von Thorium-Haliden in Salzschmelzen, üblich sind z. B.:[28]
- KThF5 in NaCl
- ThF4 in NaCl – KCl
- ThCl4 in NaCl – KCl
bzw. die Umsetzung mit unedlen Metallen:
- ThO2 mit Ca
- ThCl4 mit Mg (Kroll-Prozess)
- ThF4 mit Ca
oder über einen Gasphasentransport:
- thermische Zersetzung von ThI4 (Van-Arkel-de-Boer-Verfahren)
Das so gewonnene Pulver oder der Metallschwamm werden unter Schutzgas oder im Vakuum zu massivem Material umgeschmolzen.
Isotope und Zerfallsreihe
In der Natur kommt fast nur das Isotop mit der längsten Halbwertszeit 232Th vor. Thorium trägt durch seinen Zerfall zur Erdwärme bei. Weil 232Th lange für den Anfang einer der natürlich vorkommenden Zerfallsreihen gehalten wurde, ist diese nach ihm benannt worden. Die Zerfallsprodukte des natürlich vorkommenden Thoriums-232 sind in folgender Reihenfolge:
- Radium 228Ra (Halbwertszeit 5,75 a),
- Actinium 228Ac (6,15 h),
- Thorium 228Th (1,9116 a),
- Radium 224Ra (3,66 d),
- Radon 220Rn (55,6 s),
- Polonium 216Po (0,145 s),
- Blei 212Pb (10,6 h),
- Bismut 212Bi (60,55 min),
- daraus zu 64 % Polonium 212Po (3·10−7 s) und
- zu 36 % Thallium 208Tl (3,053 min),
- aus beiden stabiles Blei 208Pb.
Für die komplette Zerfallsreihe bis zu ihrem Anfang siehe: Thorium-Reihe.
Verwendung
Glühlicht
Thorium wurde in Form seines Oxides für die Herstellung von Glühstrümpfen verwendet. Diese Glühstrümpfe stellte man her, indem man Stoffgewebe mit einer Lösung aus 99 % Thoriumnitrat und 1 % Cernitrat tränkte. Beim ersten Anzünden verbrannte das organische Gewebe, und das Thoriumnitrat zersetzte sich in Thoriumdioxid und nitrose Gase. Hierbei blieb eine zerbrechliche Struktur zurück, die in der Gasflamme ein weißes Licht abgab. Dieses Leuchten hatte nichts mit der sehr schwachen Radioaktivität des Thoriums zu tun, sondern ist gewöhnliches Glühen durch die Hitze der Gasflamme. Aufgrund der Radioaktivität ist man inzwischen zu anderen Materialien übergegangen.
Kernenergie
Thorium kann zur Herstellung des spaltbaren Uranisotops 233U verwendet werden. Anders als im Uran-Plutonium-Brutreaktor (dem schnellen Brüter) ist dies auch in einem Reaktor möglich, in dem die Kernspaltung durch thermische Neutronen erfolgt. Das liegt am besonders hohen Wirkungsquerschnitt von 232Th für den Einfang eines thermischen Neutrons. Die erreichbaren Brutraten sind bei einem solchen thermischen Brüter aber geringer als beim schnellen Brüter.
Aus Thorium 232Th wird durch Neutronenbestrahlung 233Th erbrütet; dieses zerfällt über Protactinium 233Pa in Uran 233U.
- Die Zeitangaben sind Halbwertszeiten.
Versuche mit Thorium in MOX-Brennelementen waren schon in den 1970er Jahren in Lingen durchgeführt worden.[29] Als thermischer Brüter war der Leichtwasserreaktor Shippingport von 1977 bis 1982 in Betrieb. Die frühen Hochtemperaturreaktoren (HTR) mit Thoriumverwendung, z. B. der THTR-300, erbrüteten weniger 233U als sie an Spaltstoff verbrauchten, waren also keine Brutreaktoren. Nur etwa 4 % des Thoriuminventars konnten zur Energieerzeugung genutzt werden. Diese HTR waren neben Thoriumzugabe also auf ständige Spaltstoffzufuhr in hochangereicherter, waffenfähiger Form (93 % 235U) angewiesen, was sich aus Gründen der Proliferationssicherheit bald als inakzeptabel erwies, sodass neuere HTR-Konzepte sich auf den klassischen U/Pu-Zyklus mit niedrig angereichertem Uran, d. h. ohne Thorium, konzentrieren. Der deutsche THTR-300 wurde nach 423 Tagen Volllastbetrieb und vielen Problemen 1989 stillgelegt. 2002 fanden in Obrigheim[30] Tests mit Thorium statt. Eine neue, auf fünf Jahre angelegte Versuchsreihe zur Verwendung von Thorium in MOX-Brennelementen läuft seit April 2013 im norwegischen Forschungsreaktor Halden. Ziel ist es, das Verfahren in kommerziellen Kernkraftwerken anzuwenden und auch das Plutonium abzubauen.[31][32] Als aktuelles Konzept für einen thermischen Brüter auf Thoriumbasis ist der Flüssigsalzreaktor zu nennen.[33] Ein solcher thermischer Brüter zeigt aber Sicherheitsprobleme; deshalb wird das Konzept eines schnellen Flüssigsalzbrüters diskutiert. Auch das Konzept des beschleunigergetriebenen Rubbiatron-Reaktors basiert auf Thorium.
Da Thorium in größeren Mengen als Uran vorhanden ist, könnte es nach der zu erwartenden Abnahme der weltweiten Uranvorräte möglicherweise in Zukunft eine wichtige Energiequelle sein.[34] Speziell im angelsächsischen Raum gibt es Anfang der 2010er Jahre eine intensive Kampagne für eine Thoriumnutzung zur angeblichen Lösung fast aller Energieprobleme.[35][36] Kritiker dieser Kampagne sprechen von Thorium-Hype[37] oder sogar von Astroturfing. Studien für die norwegische und die britische Regierung warnen vor hohen Erwartungen bzgl. Thoriumnutzung.[38][39] Neuere Studien weisen zudem darauf hin, dass eine Nukleartechnik unter Einbeziehung von Thorium erhebliche Proliferationsrisiken birgt.[40] Ein weiterer sicherheitstechnischer Nachteil der Thoriumanwendung besteht darin, dass bei der Spaltung von Uran-233 um etwa 60 % weniger verzögerte Neutronen entstehen als bei der Uran-235-Spaltung;[41] das erhöht das Risiko von Kritikalitätsstörfällen.
Zurzeit wird vor allem in Indien Forschung zur Nutzung von Thorium in Kernkraftwerken betrieben, da in diesem Land die weltweit größten Thoriumvorkommen zu finden sind. Die Fertigstellung des Prototype Fast Breeder Reactor (Prototyp schneller Brutreaktor, PFBR) verzögert sich allerdings seit Jahren. Dieser PFBR soll eine Leistung von 500 MW haben, mit Plutonium als Spaltstoff arbeiten und im Brutmantel Thorium enthalten, das in 233U für andere Anwendungen umgewandelt wird.[42]
Der Whistleblower Rainer Moormann veröffentlichte 2018 eine kritische Stellungnahme zur Thoriumnutzung und wies vor allem auf erhöhte Proliferationsrisiken durch den auch für Terroristen leicht möglichen Bau einer Atombombe aus 233U hin.[43][44]
Thorotrast
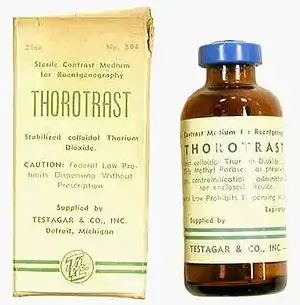
Eine stabilisierte Suspension von kolloidalem Thoriumdioxid wurde von 1931 beginnend unter diesem Handelsnamen bis Ende der 1940er Jahre als Röntgenkontrastmittel für die Angiographie verwendet. Es reichert sich jedoch im retikulohistiozytären System an und kann aufgrund örtlich erhöhter Strahlenbelastung zu Krebs führen. Klare Assoziationen bestehen zwischen Thorotrast und dem Gallengangs-Karzinom; außerdem kann ein Angiosarkom der Leber, ein sonst sehr seltener bösartiger Tumor der Leber, durch Thorotrast induziert sein. Karzinome der Nasennebenhöhlen nach der Verabreichung von Thorotrast sind beschrieben. Typischerweise treten die Erkrankungen 30–35 Jahre nach der Exposition auf.
An Stelle von Thorotrast werden heute Bariumsulfat und deutlich verbesserte aromatische Iodderivate als Röntgenkontrastmittel verwendet.
Andere Anwendungen
Zur Verbesserung der Zündeigenschaften der beim Wolfram-Inertgas-Schweißen (WIG-Schweißen) eingesetzten Elektroden wurde Thoriumdioxid in der Größenordnung von 1 bis 4 % beigemischt. Diese Verwendung ist inzwischen wegen der Strahlenbelastung durch Dämpfe und Schleifstaub nahezu eingestellt worden. Moderne WIG-Elektroden arbeiten mit Cer-Zusätzen.
Als Glühelektrodenwerkstoff eingesetzter Wolframdraht wird zur Verringerung der Elektronen-Austrittsarbeit mit etwa 1–3 % Thoriumdioxid dotiert. Dies ermöglicht die Reduzierung der zu einer vergleichbaren Emission notwendigen Temperatur in Elektronenröhren und verbessert das Startverhalten von Entladungslampen. Im Lampenbau wird Thorium ferner als Getter in Form von Thoriumdioxid-Pillen oder Thoriumfolie eingesetzt.

Thoriumdioxid wurde dem Glas für hochwertige optische Linsen zugesetzt, um Linsen mit sehr großem optischen Brechungsindex bei kleiner optischer Dispersion zu produzieren.[45] Optische Geräte aus der Zeit des Zweiten Weltkriegs (z. B. das Aero-Ektar von Kodak) bzw. der frühen Nachkriegsjahre (z. B. einige Summicron-Objektive von Leitz) enthalten gelegentlich Thoriumglas. Thoriumhaltige Linsen haben einen leichten, sich mit der Zeit verstärkenden Gelbstich, der durch intensive Bestrahlung mit UV-Licht zumindest teilweise entfernt werden kann. Wegen der vom Thorium ausgehenden Strahlung wird thoriumhaltiges Glas heute nicht mehr kommerziell hergestellt. Lanthan-haltige Gläser (z. B. LaK9) können Thoriumglas ersetzen.[46]
Das Isotop Th-229 hat die einzigartige Eigenschaft, dass sein Atomkern nur 8,28 eV über dem Grundzustand einen angeregten Zustand (Kernisomer) besitzt (neue Messungen der LMU München, September 2019; ENSDF-Daten stammen aus den Jahren 1994 und 2007). Dies entspricht ultraviolettem Licht mit Wellenlängen von 149,7 nm.[47][48] Daher könnte es möglich sein, diesen Zustand mit Laserlicht anzuregen und eine Atomkernuhr zu konstruieren.[49] Hierfür wird ein Forschungsprojekt, an dem die PTB, die Technische Universität Wien, die University of Delaware, die Ludwig-Maximilians-Universität, das Max-Planck-Institut für Kernphysik und das Fraunhofer-Institut für Lasertechnik beteiligt sind, vom ERC mit 13,7 Millionen Euro gefördert.[50]
Sicherheitshinweise
Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen, die eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielt. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Chemische Toxizität
Die akute chemische Toxizität von Thorium wird als gering eingeschätzt und im Wesentlichen auf die Radioaktivität zurückgeführt. Dies hängt mit der schlechten Wasserlöslichkeit von 0,0001 μg pro Liter des reinen Metalls sowie des meist vorkommenden Thoriumdioxids zusammen. Lediglich in sehr saurem Milieu ab einem pH-Wert von 4 löst sich Thorium besser. Auch Oxalate und andere Komplexbildner erhöhen die Wasserlöslichkeit.[21]
Radiotoxizität
Das Thoriumisotop 232Th ist mit seiner Halbwertszeit von 14,05 Mrd. Jahren noch wesentlich schwächer radioaktiv (geringere Dosisleistung) als Uran-238, da durch die längere Halbwertszeit weniger Zerfälle pro Sekunde stattfinden und auch die Konzentration der kurzlebigen Zerfallsprodukte geringer bleibt. Thorium ist ein α-Strahler und aufgrund dieser Strahlungsart gefährlich bei Inhalation und Ingestion. Metall-Stäube und vor allem -Oxide sind aufgrund ihrer Lungengängigkeit radiotoxisch besonders gefährlich und können Krebs verursachen. Beim Lagern von und Umgang mit Thorium und seinen Verbindungen ist auch die dauernde Anwesenheit der Elemente aus der Zerfallsreihe zu beachten. Besonders gefährlich sind starke Beta- und die mit einem hohen 2,6-MeV-Anteil sehr energiereichen und durchdringungsfähigen Gammastrahlen. Ferner entsteht in der Zerfallsreihe als Ergebnis eines Alphazerfalls das auch als Thoron bekannte Radonisotop 220Rn, das wiederum in einem Alphazerfall zu Polonium-216 und Blei-212 zerfällt.[51] Bei gleicher Aktivitätskonzentration ergibt sich aus den Thoron-Folgeprodukten eine 14-fach höhere Strahlenbelastung als aus den Folgeprodukten des 222Rn.[52]
Thoriumverbindungen
In Übereinstimmung mit seiner Stellung im Periodensystem tritt Thorium in seinen Verbindungen normalerweise in der Oxidationsstufe +4 auf; Thorium(III)- und Thorium(II)-Verbindungen sind seltener. Eine Besonderheit bilden die Carbide der Actinoide ohne feste Stöchiometrie.
- Thoriumdioxid, Thorium(IV)-oxid (ThO2) hat mit 3300 °C einen der höchsten Schmelzpunkte aller Metalloxide. Nur einige wenige Metalle, wie Wolfram, und einige Verbindungen, wie Tantalcarbid, besitzen höhere Schmelzpunkte.
- Thoriumnitrat, Thorium(IV)-nitrat (Th(NO3)4) ist eine farblose, leicht in Wasser und Alkohol lösliche Verbindung. Das Nitrat ist ein wichtiges Zwischenprodukt bei der Darstellung von Thorium(IV)-oxid sowie von Thoriummetall und wird auch bei der Erzeugung von Gasglühkörpern eingesetzt.
- Thoriumnitrid, Thorium(IV)-nitrid (Th3N4) entsteht beim Glühen von Thorium in Stickstoffatmosphäre und hat einen messingfarbenen Glanz. Thoriumnitrid ist hygroskopisch und zerfällt innerhalb weniger Stunden durch Luftfeuchte.
- Thoriumcarbid, ThC2 bildet gelbe, monokline Kristalle mit einem Schmelzpunkt von 2655 °C. Das Carbid wird bei etwa 9 K supraleitend. In Form des Mischcarbids (Th, U)C2 wird Thoriumcarbid als Brennstoff in gasgekühlten Hochtemperaturreaktoren eingesetzt. Die Darstellung des Carbidgemisches erfolgt durch Umsetzung der Thorium- und Uranoxide mit Kohlenstoff bei 1600 bis 2000 °C.
- Thorium(IV)-chlorid, ist ein weißer, hygroskopischer, kristalliner Feststoff. Berzelius stellte durch dessen Reduktion mit Kalium zum ersten Mal metallisches Thorium her.[53]
Historische Bezeichnungen
„Thorium-G“
Bei der auch als Weltvernichtungsmaschine titulierten „Cobalt-Thorium-G“-Bombe in Stanley Kubricks Film Dr. Seltsam oder: Wie ich lernte, die Bombe zu lieben handelt es sich in erster Linie um eine Kobaltbombe. Verwendet man im Bombendesign Thorium (möglicherweise anstelle von Uran in der Fissionsstufe oder im Mantel), so entsteht bei der Explosion u. a. radioaktives, giftiges und langlebiges Protactinium-231, was das Kontaminationspotential des Fallouts beträchtlich steigern würde. Die Halbwertszeit von Protactinium-231 beträgt allerdings 32760 Jahre und weicht somit von der im Film genannten (93,7 bzw. 100 Jahre) deutlich ab.
„Thorium-X“
Unter der Bezeichnung Thorium-X wurden vor allem in der 1. Hälfte des 20. Jahrhunderts verschiedene Lösungen gehandelt, die Thorium- und andere radioaktive Nuklide enthielten. In den USA kam z. B. eine Tinktur dieses Namens bis etwa 1960 in der Radiotherapie von Hautkrankheiten zur Anwendung. In Deutschland gab es um 1930 Badezusätze und Ekzemsalben der Marke „Thorium-X“, die wegen der offenkundigen Gesundheitsgefahren allerdings kurz darauf aus dem Handel genommen wurden. Des Weiteren gab es eine Thorium-X-haltige Zahnpasta mit dem Namen Doramad. Ferner wurde in den 1960ern in der Universitätsklinik Münster (Hüfferstiftung) Thorium-X bei Morbus-Bechterew-Patienten gegen eine weitere Versteifung der Wirbelsäule eingesetzt. Der Patient erhielt während eines circa dreimonatigen stationären Aufenthaltes einmal pro Woche eine Thorium-X-Injektion. Die fortschreitende Versteifung wurde dadurch für ca. 15 Jahre weitgehend gestoppt.
„Ionium“
Als Ionium wurde in der Kernphysik das Isotop 230-Th bezeichnet. In der Altersdatierung wird der Begriff Ionium-Methode immer noch für die 230-Th/232-Th-Datierung verwendet.
Literatur
- Mathias S. Wickleder, Blandine Fourest, Peter K. Dorhout: Thorium. In: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements. Springer Netherlands, Dordrecht 2008, ISBN 978-1-4020-3555-5, Thorium, S. 52–160, doi:10.1007/1-4020-3598-5_3 (radchem.nevada.edu [PDF]).
- Robert J. Schwankner, Alexander Brummeisl, Christian Feigl, Peter Schöffl: Frühe Verwendungsgeschichte von Thorium. In: Geowissenschaften. 12, 3, 1994, S. 66–73. doi:10.2312/geowissenschaften.1994.12.66.
Weblinks
- Eintrag zu Thorium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- Seth H. Grae: Thorium, Chemical & Engineering News, 2003
- International Thorium Energy Organisation – www.IThEO.org
- USA: Nutzung von Thorium soll strahlenden Müll reduzieren
- Thorium: Human Health Fact Sheet (Memento vom 9. Februar 2012 im Internet Archive) (engl.) (PDF-Datei; 49 kB)
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus webelements.com (Thorium) entnommen.
- IUPAC, Standard Atomic Weights Revised v2 (Memento vom 3. März 2016 im Internet Archive).
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu thorium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu thorium bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus webelements.com (Thorium) entnommen.
- Eintrag zu CAS-Nr. 7440-29-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5. April 2008. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Magnetic Susceptibility of the Elements and Inorganic Compounds, S. 4-147. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus webelements.com (Thorium) entnommen.
- Varga et al.: Determination of the 229Th half-life In: Phys. Rev. C. 89, 064310 (2014); doi:10.1103/PhysRevC.89.064310.
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieses Element entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- The Elements: Names and Origins - O-Z. auf: bbc.co.uk, abgerufen am 11. Dezember 2007.
- Thorium – History & Etymology. auf: elements.vanderkrogt.net, abgerufen am 11. Dezember 2007.
- J. J. Berzelius: Untersuchung eines neuen Minerals und einer darin enthaltenen zuvor unbekannten Erde. In: Annalen der Physik und Chemie. 92, 1829, S. 385–415; doi:10.1002/andp.18290920702.
- M. Curie: Rayons émis par les composés de l'uranium et du thorium. In: Comptes rendus de l’Académie des sciences. 126, 1898, S. 1101–1103.
- L. Badash: The discovery of thorium’s radioactivity. In: Journal of Chemical Education. 43, 1966, S. 219–220.
- J. B. Hedrick: Thorium. 1999. (PDF; 36 kB)
- A. E. van Arkel, J. H. de Boer: Darstellung von reinem Titanium-, Zirkonium-, Hafnium- und Thoriummetall. In: Zeitschrift für anorganische und allgemeine Chemie. 148 (1), 1925, S. 345–350; doi:10.1002/zaac.19251480133.
- D. Lely Jr., L. Hamburger: Herstellung der Elemente Thorium, Uran, Zirkon und Titan. In: Zeitschrift für anorganische und allgemeine Chemie. 87 (1), 1914, S. 209–228; doi:10.1002/zaac.19140870114.
- B. Merkel, G. Dudel u. a.: Untersuchungen zur radiologischen Emission des Uran-Tailings Schneckenstein. (Memento vom 11. Juni 2007 im Internet Archive) (PDF; 4,0 MB), TU Bergakademie Freiberg und TU Dresden 1988.
- world-nuclear.org: Naturally Occurring Radioactive Materials NORM.
- J. Emsley: The Elements. Clarendon Press, Oxford 1992.
- D. J. Crouse, K. B. Brown: Recovery of Thorium, Uranium and Rare Earths from Monazite sulfate liquors by the Amin Extraction (Amex) Process. (Memento vom 8. Dezember 2015 im Internet Archive) (PDF). Oak Ridge National Laboratory, 1959.
- Taishi Kobayashi, Takayuki Sasaki, Ikuji Tagaki, Hirotake Moriyama: Solubility of Thorium(IV) in the Presence of Oxalic and Malonic Acids.] In: Journal of Nuclear Science and Technology. Volume 46, Issue 11, 2009. doi:10.1080/18811248.2009.9711619
- Enver Oktaya, Ahmet Yaylib: Physical properties of thorium oxalate powders and their influence on the thermal decomposition. In: Journal of Nuclear Materials. Volume 288, Issue 1, Januar 2001, S. 76–82.
- Englische Seite mit Bildern zur Aufreinigung im Labor.
- Ullmann's Encyclopedia of industrial chemistry. 8. Auflage. 2015.
- NEA, OECD: Advanced Reactors With Innovative Fuels: Second Workshop Proceedings 2002. S. 227 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Thorium. In: world-nuclear.org. Abgerufen am 3. Januar 2015.
- S. Peggs u. a.: Thorium Energy Futures. 2012. PDF.
- Thorium test begins. Bei: world-nuclear.org.
- Kun Chen from Chinese Academy of Sciences on China Thorium Molten Salt Reactor TMSR Program auf YouTube.
- Thorium as a nuclear fuel. Bei: world-nuclear.org.
- R. Martin: Super-Fuel: Thorium, the Green Energy Source for the Future. 2012. (About the Book Super-Fuel by Richard Martin. (Memento vom 12. Mai 2012 im Internet Archive) Bei: superfuelbook.com.)
- Is Thorium the Biggest Energy Breakthrough Since Fire? Possibly. Bei: forbes.com.
- Noel Wauchope: Don’t believe thorium nuclear reactor hype. In: independentaustralia.net. 27. Januar 2013, abgerufen am 13. Dezember 2015.
- Thorium Report 2008. Oslo (regjeringen.no PDF).
- Comparison of thorium and uranium fuel cycles. 2012. (decc.gov.uk PDF).
- Stephen F. Ashley, Geoffrey T. Parks, William J. Nuttall, Colin Boxall, Robin W. Grimes: Thorium fuel has risks. In: Nature. Band 492, Nr. 7427, 6. Dezember 2012, S. 31–33, doi:10.1038/492031a.
- fissilematerials.org (PDF; 992 kB).
- India Delays Completion of its Indigenous Nuclear Reactor, abgerufen am 22. Februar 2017.
- strahlentelex.de
- wiseinternational.org
- Thorium in Kameraobjektiven (Memento vom 30. Januar 2013 im Internet Archive) (engl.)
- Zusammenfassung einschlägiger Literatur in einem Beitrag von Nutzer „Ill“ im Leica User Forum Permalink (Memento vom 19. Januar 2012 im Internet Archive) (abgerufen am 6. April 2011).
- Energy of the 229Th nuclear clock transition, Benedict Seiferle et al., Nature 573, 243–246 (2019)
- X-ray pumping of the 229Th nuclear clock isomer Takahiko Masudo et al., Nature 573, 238–242 (2019)
- Nadja Podbregar: Erster Schritt zur Atomkernuhr. In: scinexx.de. 13. September 2019, abgerufen am 18. September 2019.
- Millionenförderung für Uhrenprojekt. 20. Juni 2017, abgerufen am 6. November 2019.
- Zerfallsgesetz. In: LEIFIphysik. Abgerufen am 8. Januar 2021..
- Imke Frischmuth: Endlich genaue Messung von radioaktivem Thoron möglich. (Memento vom 25. März 2016 im Internet Archive) Bei: PTB.de. 28. Februar 2011, abgerufen am 7. April 2016.
- B. K. Sharma: Nuclear and Radiation Chemistry. S. 158 (eingeschränkte Vorschau in der Google-Buchsuche).