Ionisierungsenergie
Die Ionisierungsenergie (auch Ionisationsenergie, Ionisierungspotential, Ionisierungsenthalpie) ist die Energie, die benötigt wird, um ein in der Gasphase befindliches Atom oder Molekül zu ionisieren, d. h., um ein Elektron vom Atom oder Molekül zu trennen. Die benötigte Energie kann durch Strahlung, durch hohe Temperaturen oder durch chemische Reaktionen geliefert werden. In der Atomphysik wird die Ionisierungsenergie auch als Bindungsenergie bezeichnet.
Allgemeines
Nach der Ionisierung hat ein vorher elektrisch neutrales Atom oder Molekül eine positive elektrische Ladung. Die vorher ausgeglichene Ladungsdifferenz zwischen Atomkern(en) und Elektronenhülle ist durch das Entfernen eines Elektrons aufgehoben. Gebildet hat sich ein positiv ionisiertes Atom bzw. Molekül, das als Kation bezeichnet wird und gekennzeichnet ist durch ein nachfolgend hochgestelltes '+'-Zeichen; z. B. wird ein Natriumkation als Na+ gekennzeichnet (Na ist das Elementsymbol für Natrium). Die für die Ionisierung benötigte Energie nennt man die Erste Ionisierungsenergie.
Solange ein Kation noch Elektronen besitzt, kann es durch weitere Energiezufuhr erneut ionisiert werden. Die dafür erforderliche Energie nimmt aber mit jeder zusätzlichen Ionisierung zu. Allgemein ist die n-te Ionisierungsenergie die Energie, die benötigt wird, um das n-te Elektron zu entfernen. Ein mehrfach ionisiertes Kation wird durch eine vor das '+'-Zeichen gestellte Zahl gekennzeichnet; z. B. wird ein 3-fach ionisiertes Aluminiumkation als Al3+ dargestellt.
Einheit
Für ein einzelnes Elektron wird die Ionisierungsenergie in eV /Atom angegeben, für die Stoffmenge 1 mol aber besser in kJ / mol. Der Umrechnungsfaktor ergibt sich aus der Umrechnung zwischen eV und J, also der Elementarladung e; dem Faktor 1000, da nicht J, sondern kJ verwendet wird; sowie der Avogadro-Konstante zur Umrechnung in Mol. Es ergibt sich also gerade ein Tausendstel der Faraday-Konstanten , die seit der Revision des SI von 2019 in SI-Einheiten ausgedrückt eine exakte Konstante ist:
- 1 eV/Atom = 96.4853321233100184 kJ/mol,
wobei auf der linken Seite das „pro Atom“ meist weggelassen wird.
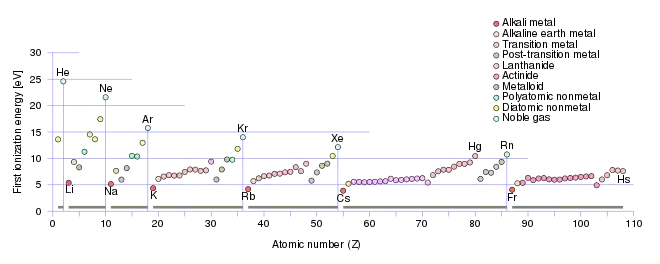
Erste Ionisierungsenergie und Periodensystem
Die erste Ionisierungsenergie hängt von der Anziehungskraft zwischen dem Atomkern und dem zu entfernenden Elektron ab, welche sich nach der Coulomb-Formel berechnet:
mit
- Ordnungs- bzw. Kernladungszahl
- Elementarladung
- Abstand des Elektrons vom Kern
- Coulomb-Konstante
Die Ionisierungsenergie oder Bindungsenergie ist die Summe aus potentieller Energie und kinetischer Energie des Elektrons . Da im stabilen Orbit laut dem Virialsatz immer gilt: , ist die Ionisierungsenergie betragsmäßig immer gleich der kinetischen Energie oder der halben potentiellen Energie: . Somit ergibt sich die Ionisierungsenergie für Wasserstoff im niedrigsten Energieniveau, auch Rydberg-Energie genannt:
mit
- Bohrradius
- Elektronenmasse
- Bahngeschwindigkeit im ersten Orbital
- Feinstrukturkonstante
- Lichtgeschwindigkeit
- Reduziertes Plancksches Wirkungsquantum
In höheren angeregten Bahnen sinkt die Ionisierungsenergie und steigt mit höherer Protonenzahl im Kern, wie sich aus der Bindungskraft ergibt. Allgemein beträgt die Bindungsenergie daher nach dem Bohrschen Atommodell für ein einzelnes Elektron:
mit
Innerhalb einer Periode steigt die erste Ionisierungsenergie stark an, wenn auch die Zunahme von links nach rechts unstetig verläuft. Grund für die Zunahme ist die steigende Kernladungszahl und die dadurch bedingte stärkere Anziehung der Elektronen durch den Kern. Zwar nimmt auch die Elektronenzahl der Hülle innerhalb der Periode von links nach rechts in gleichem Maß zu, das jeweils hinzukommende Elektron wird jedoch immer in dieselbe Schale eingebaut, die Außenschale. Die dort schon vorhandenen Elektronen können das jeweils hinzukommende Elektron deshalb nicht so stark von der Kernladung abschirmen, weil sie denselben Kernabstand besitzen wie das hinzugekommene Elektron. Die Zunahme der Kernladung kann also nicht durch die Zunahme der Ladung der Elektronenhülle kompensiert werden, sodass die Ionisierungsenergie zunimmt. Der unstetige Charakter der Zunahme zeigt sich besonders stark beim Übergang vom Stickstoff zum Sauerstoff. Hier nimmt die Ionisierungsenergie von links nach rechts sogar ab. Die Gründe für solche Unstetigkeiten lassen sich mit dem Atomorbitalmodell deuten. So besitzt Stickstoff mit seiner halb besetzten p-Unterschale eine energiearme, stabile Elektronenkonfiguration. Für die Entfernung eines Elektrons wird deshalb besonders viel Energie benötigt. Insgesamt stellen die Ionisierungsenergien der Alkalimetalle jeweils das Minimum und die Ionisierungsenergien der Edelgase jeweils das Maximum der Periode dar. Diese Extrema werden innerhalb einer Gruppe von oben nach unten geringer, da sich das zu entfernende Elektron nach dem Schalenmodell des Atoms auf einer neuen Schale befindet, somit sein Abstand vom Kern ansteigt und weniger Energie aufgewendet werden muss, um es aus der Anziehungskraft des Kerns zu lösen. Entsprechend nimmt die erste Ionisierungsenergie beim Übergang von einer Periode zur nächsten, z. B. vom Neon zum Natrium, schlagartig ab.