Germanium
Germanium (von lateinisch Germania ‚Deutschland‘, nach dem Land, in dem es zuerst gefunden wurde[15]) ist ein chemisches Element mit dem Elementsymbol Ge und der Ordnungszahl 32. Im Periodensystem steht es in der 4. Periode und in der 4. Hauptgruppe (14. IUPAC-Gruppe, p-Block und Kohlenstoffgruppe). Es wurde erstmals 1886 im Mineral Argyrodit nachgewiesen.[16]
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Germanium, Ge, 32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Halbmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 14, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | gräulich weiß | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-164-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.331 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 5,6 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 72,630(8)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 125 (125) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 122 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 211[4] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d10 4s2 4p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 7.899435(12) eV[5] ≈ 762.18 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 15.934610(25) eV[5] ≈ 1537.46 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 34.0576(12) eV[5] ≈ 3286.1 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 45.7155(12) eV[5] ≈ 4410.9 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 90.500(19) eV[5] ≈ 8732 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | Diamantstruktur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 5,323 g/cm3 (20 °C)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 6,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −7,1 · 10−5)[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1211,4 K (938,3 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3106 K[10] (2830 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 13,63 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 330 kJ·mol−1[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 31,8 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 5400 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 308,3[1] J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 5,0 eV[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | (Eigenleitung) 2 A·V−1·m−1 bei 300 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 60 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −4, 2, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 0,247 V (Ge2+ + 2 e− → Ge) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,01 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Geschichte

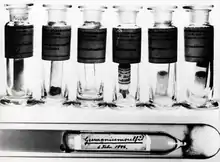
Oben: Die zur Weltausstellung 1904 in St. Louis gezeigten Präparate
Unten: Germaniumsulfid vom 6. Februar 1886
Als 1871 Dmitri Mendelejew das Periodensystem entwarf, stieß er auf eine Lücke unterhalb des Siliciums und postulierte ein bis dahin unbekanntes Element, das er als Eka-Silicium bezeichnete. Mendelejew machte Vorhersagen über die Eigenschaften des Eka-Siliciums und dessen Verbindungen, die von der Wissenschaft jedoch abgelehnt wurden.
1885 fand Clemens Winkler (1838–1904), ein Chemiker an der Bergakademie Freiberg, als er mit dem neu entdeckten Mineral Argyrodit arbeitete, dass dessen quantitative Analyse stets einen Fehlbetrag von rund sieben Prozent lieferte. So oft die Analyse wiederholt wurde, blieb der Fehlbetrag etwa konstant und Winkler vermutete schließlich, dass das Mineral ein bis dahin unbekanntes Element enthielt. Nach vier Monaten Arbeit gelang ihm schließlich am 6. Februar 1886 die Isolierung eines weißen Sulfid-Niederschlages, der sich im Wasserstoffstrom zu einem metallischen Pulver reduzieren ließ. In Anlehnung an den zuvor entdeckten Planeten Neptun wollte Winkler das neue Element zunächst Neptunium nennen. Da dieser Name jedoch bereits für ein anderes vermutetes Element verwendet worden war, nannte er es nach dem Entdeckungsort Germanium.[15][17][18] Winkler vermutete zunächst, dass es sich beim Germanium um das von Mendelejew postulierte Eka-Stibium[19] handelte, während Mendelejew es zunächst eher als Eka-Cadmium[19] und nicht als Eka-Silicium einstufen wollte. Nachdem weitere Eigenschaften ermittelt worden waren, bestätigte sich, dass es sich wohl um das vorhergesagte Element Eka-Silicium handelte.[20] Mendelejew hatte dessen Eigenschaften aus seinem Periodensystem abgeleitet, so dass dieser Fund zur Anerkennung des Periodensystems beitrug:[15]
| Eigenschaft | Eka-Silicium (vorhergesagt) | Germanium (bestimmt) |
|---|---|---|
| Atomgewicht | 72 | 72,32 |
| Spezifisches Gewicht | 5,5 | 5,47 |
| Atomvolumen | 13 | 13,22 |
| Wertigkeit | IV | IV |
| Spezifische Wärme | 0,073 | 0,076 |
| Spezifisches Gewicht des Dioxids | 4,7 | 4,703 |
| Molekularvolumen des Dioxids | 22 | 22,16 |
| Siedepunkt des Tetrachlorids | unter 100 °C | 86 °C |
| Spezifisches Gewicht des Tetrachlorids | 1,9 | 1,87 |
| Molekularvolumen des Tetrachlorids | 113 | 113,35 |
Die Herkunft und Etymologie des Namens Germanium könnte auch aus einem semantischen Missverständnis in Zusammenhang mit seinem Vorgängerelement Gallium herrühren, denn für die Namensgebung von Gallium gibt es zwei Theorien. Nach der Ersten benannte der französische Chemiker Paul Émile Lecoq de Boisbaudran das Element nach Gallien, der lateinischen Bezeichnung seines Heimatlandes Frankreich.[18] Die Zweite gibt das ebenfalls lateinische Wort gallus (Hahn) als Quelle des Namens an, das im Französischen le coq („der Hahn“) heißt. Paul Émile Lecoq de Boisbaudran hätte das neue Element demnach nach seinem eigenen Namen benannt. Winkler nahm an, dass das vorherige Element Gallium nach der Staatsangehörigkeit des französischen Entdeckers benannt wurde. So nannte er das neue chemische Element „Germanium“ zu Ehren seines Landes (lateinisch Germania für Deutschland).
Vorkommen

Germanium ist weit verbreitet, kommt aber nur in sehr geringen Konzentrationen vor. Der Clarke-Wert, also der Durchschnittsgehalt in der Erdkruste beträgt etwa 1,5 g/t. In der Natur kommt es meist in Form von Sulfiden bzw. Thiogermanaten vor und wird oft als Begleiter in Kupfer- und Zinkerzen gefunden, unter anderem im Mansfelder Kupferschiefer.[21] Die wichtigsten Minerale sind Argyrodit (Ag8GeS6),[21] Canfieldit, Germanit (Cu6FeGe2S8)[21] und Renierit. Einige Pflanzen reichern Germanium an. Diese Eigenschaft führt zu höchst umstrittenen Thesen bezüglich der Physiologie von Pflanzen („pflanzlicher Abwehrstoff gegen Viren“), mit denen auch Anwendungen in der Homöopathie begründet werden.
Gewinnung und Herstellung
Laut USGS lag die Jahresproduktion 2014 bei geschätzten 165 t, davon 120 t in China. Der Preis für 1 kg Germanium betrug 2014 ca. 1.900 USD.[22] Laut EU lag der Preis 2003 bei 300 USD je kg und stieg bis 2009 auf 1.000 USD.[23]
Zur Darstellung von Germanium sind insbesondere die Germaniumoxid (GeO2) enthaltenden Rauchgase der Zinkerzaufbereitung geeignet. Angereichert wird das Germanium aus dem Rauchgas durch das Lösen des Flugstaubs in Schwefelsäure. Nach Fällung des gelösten GeO2 und ZnO erfolgt die weitere Aufarbeitung durch Destillation der Metallchloride. Die Hydrolyse führt dann wieder zum Oxid, welches mit Wasserstoff zum Germanium reduziert wird. Die Darstellung von hochreinem Germanium kann z. B. durch das Zonenschmelzverfahren erfolgen.[21]
Eigenschaften

Germanium steht im Periodensystem in der Serie der Halbmetalle, wird aber nach neuerer Definition als Halbleiter klassifiziert. Elementares Germanium ist sehr spröde und an der Luft bei Raumtemperatur sehr beständig. Erst bei starkem Glühen in einer Sauerstoff-Atmosphäre wird es zu Germanium(IV)-oxid (GeO2) oxidiert. GeO2 ist dimorph und wird bei 1033 °C von der Rutil-Modifikation (CN = 6) in die β-Quarz-Struktur (CN = 4) überführt. In Pulverform kann es leicht entzündet werden und brennt nach Entfernen der Zündquelle weiter. In kompakter Form ist es nicht brennbar.
Germanium kann zwei- oder vierwertig sein. Germanium(IV)-Verbindungen sind am beständigsten. Von Salzsäure, Kalilauge und verdünnter Schwefelsäure wird Germanium nicht angegriffen. In alkalischen Wasserstoffperoxid-Lösungen, konzentrierter heißer Schwefelsäure und konzentrierter Salpetersäure wird es dagegen unter Bildung von Germaniumdioxidhydrat aufgelöst. Gemäß seiner Stellung im Periodensystem steht es in seinen chemischen Eigenschaften zwischen Silicium und Zinn.
Germanium zeigt als einer von wenigen Stoffen eine Dichteanomalie. Seine Dichte in festem Zustand ist niedriger als in flüssigem. Seine Bandlücke beträgt bei Zimmertemperatur ca. 0,67 eV.
Wafer aus Germanium sind erheblich zerbrechlicher als Wafer aus Silicium.
Verwendung
Elektronik
Als Halbleiter war Germanium in Einkristall-Form das führende Material in der Elektronik bis in die 1970er Jahre, vor allem zur Herstellung der ersten am Markt erhältlichen Dioden und Bipolartransistoren, bis es von Silicium in diesen Bereichen verdrängt wurde. Anwendungen finden sich heute in der Hochfrequenztechnik (z. B. als Siliciumgermanium-Verbindungshalbleiter) und Detektortechnologie (z. B. als Röntgendetektor). Für Solarzellen aus Galliumarsenid (GaAs) werden zum Teil Wafer aus Germanium als Trägermaterial verwendet. Die Gitterkonstante von Germanium ist der von Galliumarsenid sehr ähnlich, so dass GaAs epitaktisch auf Germanium-Einkristallen aufwachsen kann.
Gläser und Fasern
Germanium wird für Infrarotoptiken in Form von Fenstern und Linsen aus monokristallinem Germanium eingesetzt. Einsatzgebiete für Germaniumlinsen sind Nachtsichtgeräte und Wärmebildkameras. Die früher übliche Verwendung als Fokussierlinse für die Laser-Materialbearbeitung mittels Kohlendioxid-Lasern sowie deren Austrittsfenster ist jedoch durch Zinkselenid abgelöst worden.
Mit seinem hohen Brechungsindex von etwa 4 wird einkristallines Germanium auch in der FTIR/ATR-Spektroskopie (ATR-Infrarotspektroskopie) eingesetzt.[24] Optische Gläser mit Infrarotdurchlässigkeit (Chalkogenidglas für Lichtwellenleiter) sind eine weitere Anwendung für Germanium als Bestandteil.
Eine weitere Verwendung ist die Herstellung von Lichtwellenleitern: mit Hilfe von Germaniumtetrachlorid wird bei der chemischen Gasphasenabscheidung eine Anreicherung von Germaniumdioxid im inneren Faserkern erzeugt, wodurch im Vergleich zum Fasermantel ein höherer Brechungsindex im Kern gewährleistet wird.
Bei der Polyester-Herstellung kommt Germaniumdioxid als Katalysator bei der Fertigung von Polyesterfasern und -granulaten zum Einsatz, speziell für PET-Flaschen.
Nuklearmedizin und Kerntechnik
68Ge wird beim Gallium-68-Generator als Mutternuklid zur Herstellung von Gallium-68 verwendet. Ebenso findet 68Ge als Quelle zur Detektorkalibration bei der Positronen-Emissions-Tomographie Anwendung.[25]
Als hochreiner Einkristall wird Germanium als Strahlendetektor eingesetzt.
Germanium in Nahrungsergänzungsmitteln
Die Substanz Bis(carboxyethyl)germaniumsesquioxid (Ge-132) ist als Nahrungsergänzungsmittel zur Anwendung bei einer Reihe von Erkrankungen einschließlich Krebs, chronischem Müdigkeitssyndrom, Immunschwäche,[26] AIDS, Bluthochdruck, Arthritis und Lebensmittelallergien angepriesen worden. Positive Wirkungen auf den Krankheitsverlauf wurden bisher wissenschaftlich nicht nachgewiesen.
Gemäß der europäischen Richtlinie 2002/46/EG zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über Nahrungsergänzungsmittel soll Germanium nicht in Nahrungsergänzungsmitteln verwendet werden. In vielen Ländern der EU, die ihre nationalen Rechtsvorschriften bereits angeglichen haben, so auch Deutschland und Österreich, ist daher der Zusatz von Germanium als Mineralstoffquelle in Nahrungsergänzungsmitteln nicht erlaubt.
Die zuständigen Behörden warnen ausdrücklich vor dem Verzehr von Ge-132, da schwere Gesundheitsschäden und Todesfälle nicht auszuschließen sind.[27][28]
Arzneiliche Verwendung von Germanium
Eine therapeutische Wirksamkeit der antineoplastischen Substanz Spirogermanium bei Krebserkrankungen wurde nicht nachgewiesen. Zugelassene Fertigarzneimittel mit dem Wirkstoff Spirogermanium gibt es nicht. In Deutschland gelten germaniumhaltige Arzneimittelanfertigungen (Rezepturen), abgesehen von homöopathischen Verdünnungen ab D4, als bedenklich. Ihre Herstellung und ihre Abgabe sind daher verboten.[29] Germanium metallicum gibt es in Form homöopathischer Arzneimittel. Als Bestandteil homöopathischer Zubereitungen wird di-Kalium-Germanium-citrat-lactat beschrieben.[30]
Physiologie
Germanium und seine Verbindungen weisen eine relative geringe akute Toxizität auf. Spuren von Germanium sind in den folgenden Nahrungsmitteln enthalten: Bohnen, Tomatensaft, Austern, Thunfisch und Knoblauch. Es ist nach dem Stand der Wissenschaft kein essentielles Spurenelement. Es ist keine biologische Funktion für Germanium bekannt.[31] Es sind keine Germanium-Mangelerkrankungen bekannt.[31]
Toxizität
Gesundheitsschäden durch Germanium traten bei Menschen mehrfach[32][33][31] nach längerer Einnahme von Germaniumverbindungen als Nahrungsergänzungsmittel auf. Dabei kommt es zu Funktionsstörungen der Niere bis hin zum (irreversiblen[32]) Nierenversagen,[33] das für den Patienten letal sein kann.[34] Periphere Neuropathie und andere neurologische Schäden als Folgeerkrankung sind ebenfalls berichtet.[35][31]
Aus Tierversuchen ist bekannt, dass Germanium eine geringe akute orale Toxizität hat. Bei Ratten liegt der LD50-Wert (die Dosis, bei der die Hälfte der Versuchstiere sterben) bei 3700 mg pro Kilogramm Körpergewicht.[36]
Nach derzeit vorliegenden Daten aus Tierversuchen ist Germanium nicht fruchtschädigend oder kanzerogen.[37]
Der Mechanismus der Toxizität von Germanium ist noch nicht vollständig geklärt. Spezifische pathologische Effekte an den Mitochondrien von verschiedenen Zellen wurden jedoch beobachtet.[38][39]
Wechselwirkungen
Es wird ebenfalls diskutiert, ob Germanium evtl. Wechselwirkungen mit Silicium im Knochen-Metabolismus zeigt. Es kann die Wirkung von Diuretika blockieren und die Aktivität einer Reihe von Enzymen herabsetzen bzw. blockieren, wie beispielsweise Dehydrogenasen. Im Tierversuch zeigen Mäuse eine erhöhte Hexabarbital-induzierte Schlafdauer, wenn sie zusätzlich mit Germaniumverbindungen behandelt wurden. Dies lässt darauf schließen, dass die Cytochrom-P450-Aktivität ebenfalls eingeschränkt wird. Es gibt Berichte über organische Germaniumverbindungen, welche das Entgiftungsenzym Glutathion-S-Transferase blockieren.[40]
Bioverfügbarkeit und Metabolismus
Germanium wird bei oraler Aufnahme sehr leicht vom Körper aufgenommen. Es verteilt sich dabei über das gesamte Körpergewebe, vornehmlich in den Nieren und der Schilddrüse.[41][42] Organogermane akkumulieren dabei im Gegensatz zu anorganischen Germaniumverbindungen nicht im menschlichen Körper. Allerdings gibt es nur wenige Studien über den Germanium-Metabolismus.
Es wird im Wesentlichen über den Urin ausgeschieden.[41] Ausscheidung über Galle und Fäzes findet ebenso statt.
Verbindungen
Germanium bildet Ge(II)- u. beständigere Ge(IV)-Verbindungen, nur wenige besitzen technische Bedeutung.
Von den Germaniumhalogeniden sind ebenfalls Ge(II)- u. Ge(IV)-Vertreter bekannt. Germaniumtetrachlorid, (GeCl4), eine Flüssigkeit mit einem Siedepunkt von 83 °C, bildet sich bei Einwirkung von Chlorwasserstoff auf Germaniumoxide und ist ein wichtiges Zwischenprodukt bei der Germanium-Gewinnung. Hochreines GeCl4 wird bei der Herstellung von Lichtwellenleitern aus Quarzglas eingesetzt, um auf der Innenseite der Quarzfasern eine hochreine Germanium(IV)-oxid Schicht zu erzeugen. Zur Erzeugung von hochreinen Germaniumschichten kann auch die Disproportionierung von Germanium(II)-iodid unter Bildung von Germanium und Germanium(IV)-iodid eingesetzt werden:
Germanate sind Verbindungen des Germaniums, die sich von dessen Oxid ableiten. In fast allen Germanium-haltigen Mineralien liegt das Germanium als Germanat vor.
Germane werden die Wasserstoffverbindungen des Germaniums genannt, die eine homologe Reihe verschieden langer Kettenmoleküle bilden. Monogerman oder Germaniumhydrid (GeH4) ist ein Gas und wird in der Halbleiterindustrie zur Epitaxie und zum Dotieren verwendet.
Literatur
- Mike Haustein: Die Lücke im Periodensystem: Germanium. In: Chemie in unserer Zeit. Band 45, Heft 6 (2011), S. 398–405 (doi:10.1002/ciuz.201100549).
Weblinks
- Food Standards Agency UK: Dokument über Germanium (Memento vom 12. Januar 2012 im Internet Archive) (englisch, PDF, 47 KiB)
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Germanium) entnommen.
- IUPAC, Standard Atomic Weights Revised 2013.
- Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar: Consistent van der Waals Radii for the Whole Main Group. In: J. Phys. Chem. A. 113, 2009, S. 5806–5812, doi:10.1021/jp8111556.
- Eintrag zu germanium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu germanium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Germanium) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 482.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-142 – 4-147. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik. Band 6: Festkörper. 2. Auflage. Walter de Gruyter, Berlin 2005, ISBN 3-11-017485-5, S. 361.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Germanium) entnommen.
- J. Phys. G: Nucl. Part. Phys. 40 (2013) 035110 doi:10.1088/0954-3899/40/3/035110
- Eintrag zu Germanium, Pulver in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. April 2017. (JavaScript erforderlich)
- O. Brunck: Clemens Winkler. In: Berichte der deutschen chemischen Gesellschaft. Band 39, Nr. 4, November 1906, S. 4491–4548, doi:10.1002/cber.190603904164.
- Klaus Volke: Clemens Winkler– zum 100. Todestag. In: Chemie in unserer Zeit. Band 38, Nr. 5, Oktober 2004, S. 360, doi:10.1002/ciuz.200490078.
- Clemens Winkler: Germanium, Ge, ein neues, nichtmetallisches Element. In: Berichte der deutschen chemischen Gesellschaft. Band 19, Nr. 1, Januar 1886, S. 210, doi:10.1002/cber.18860190156.
- Clemens Winkler: Mittheilungen über das Germanium. In: Journal für Praktische Chemie. Band 34, Nr. 1, 14. August 1886, S. 177, doi:10.1002/prac.18860340122.
- Bei Eka-Cadmium und Eka-Stibium handelt es sich um zwei von Mendelejew postulierte Elemente zwischen Cadmium und Quecksilber und zwischen Antimon und Bismut, die man heutzutage als not-so-famous blanks meistens unter den Tisch fallen lässt.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Wiberg, Egon., Wiberg, Nils,: Lehrbuch der anorganischen Chemie. 102., stark umgearbeitete und verb. Auflage. De Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1003.
- MINERAL COMMODITY SUMMARIES 2015. (PDF 2,3 MB, S. 68(65)) USGS, abgerufen am 5. September 2015 (englisch).
- Germanium. setis.ec.europa.eu, archiviert vom Original am 5. März 2016; abgerufen am 5. September 2015 (englisch).
- Was ist Infrarot- und FT-IR-Spektroskopie? Wo ist der Unterschied? Firmenschrift „FT-IR Spektroskopie Grundlagen“ der Firma Bruker, abgerufen am 14. Juli 2021
- Produktkatalog der Fa. Eckert & Ziegler S. 15. (Memento vom 3. Januar 2007 im Internet Archive)
- Bundesamt für Sicherheit im Gesundheitswesen, AGES PharmMed: „Nahrungsergänzungsmittel“ mit toxischer Wirkung. (Memento vom 20. Juli 2012 im Webarchiv archive.today)
- Bundesinstitut für Risikobewertung: BgVV warnt vor dem Verzehr von ‚Germanium-132-Kapseln‘ der österreichischen Firma Ökopharm. 8. September 2000.
- Österreichische Agentur für Gesundheit und Ernährungssicherheit (AGES) warnt: Produkt enthält gesundheitsschädliche Konzentration an Germanium (Memento vom 28. Juli 2013 im Internet Archive) 17. Oktober 2008.
- Arzneimittelkommission der deutschen Apotheker: Bedenkliche Rezepturarzneimittel (PDF; 187 kB).
- Germanium-Citrate-Lactat bei DailyMed, abgerufen am 16. September 2012.
- Nephrotoxicity and neurotoxicity in humans from organogermanium compounds and germanium dioxide. PMID 1726409.
- Tubulointerstitial nephropathy persisting 20 months after discontinuation of chronic intake of germanium lactate citrate. PMID 8488824.
- Germanium poisoning: clinical symptoms and renal damage caused by long-term intake of germanium. PMID 1650857.
- Hazard assessment of germanium supplements. doi:10.1006/rtph.1997.1098.
- Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (Hrsg.): Germanium und Germaniumdioxid. Mai 2018, S. 7 ff. (baua.de [PDF; 447 kB; abgerufen am 4. August 2019]).
- Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (Hrsg.): Germanium und Germaniumdioxid. Mai 2018, S. 7 (baua.de [PDF; 447 kB; abgerufen am 4. August 2019]).
- Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (Hrsg.): Germanium und Germaniumdioxid. Mai 2018, S. 14 ff. (baua.de [PDF; 447 kB; abgerufen am 4. August 2019]).
- Germanium dioxide induces mitochondria-mediated apoptosis in Neuro-2A cells. doi:10.1016/j.neuro.2006.05.018.
- The pathogenesis of experimental model of mitochondrial myopathy induced by germanium dioxide. PMID 12899328.
- Roy A. Henry, Keith H. Byington: Inhibition of glutathione-S- aryltransferase from rat liver by organogermanium, lead and tin compounds. In: Biochemical Pharmacology. Band 25, Nr. 20, 1976, S. 2291–2295, doi:10.1016/0006-2952(76)90012-5.
- Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (Hrsg.): Germanium und Germaniumdioxid. Mai 2018, S. 4 ff. (baua.de [PDF; 447 kB; abgerufen am 18. Januar 2020]).
- BgVV warnt vor dem Verzehr von ‚Germanium-132-Kapseln‘ der österreichischen Firma Ökopharm. In: Bundesinstitut für Risikobewertung. 8. September 2000, abgerufen am 18. Januar 2020.
