Sulfate
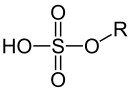
Sulfate sind Salze oder Ester der Schwefelsäure. Die Salze enthalten das Sulfat-Anion [SO4]2− bzw. das Hydrogensulfat-Anion [HSO4]−. Die Ester der Schwefelsäure haben die allgemeine Formel R–O–SO2–O–R', dabei sind R und/oder R' organische Reste.
monoester
Nomenklatur
Primäre und sekundäre Sulfate
Die Salze der zweibasigen Säure Schwefelsäure (H2SO4) lassen sich in Sulfate und Hydrogensulfate einteilen (auch als primäre und sekundäre Sulfate bezeichnet). Bei einwertigen Kationen MI gelten die Summenformeln MIHSO4 und MI2SO4:
| Hydrogensulfate (primäre Sulfate) | sekundäre Sulfate | |
|---|---|---|
| Synonyme | saure Sulfate Hydrogensulfate Bisulfate | neutrale Sulfate normale Sulfate |
| Beispiele | Natriumhydrogensulfat, NaHSO4 Calciumhydrogensulfat, Ca(HSO4)2 | Natriumsulfat, Na2SO4 Calciumsulfat, CaSO4 |
Alaune und Vitriole
Alaune sind Doppelsalze aus ein- und dreiwertigen Kationen mit der allgemeinen Summenformel MIMIII(SO4)2 · 12 H2O, Hauptvertreter der Gruppe der Alaune ist das Kaliumaluminiumsulfat (Kalialaun). Vitriole hingegen sind die kristallwasserhaltigen Sulfate zweiwertiger Nebengruppen-Metalle (Kupfervitriol, Eisenvitriol etc.).
Sulfatkomplexe
Sulfatgruppen können in Komplexen als Liganden auftreten. Die Liganden werden in diesem Fall als [Tetraoxosulfato(−2)] oder [Sulfato(−2)] bezeichnet. Nach Empfehlungen zur Nomenklatur tragen auch Sulfitgruppen (SO3)2− das Suffix -sulfat und werden als Trioxosulfat bzw. [Trioxosulfat(IV)] bezeichnet.
Ester der Schwefelsäure

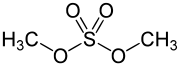
Schwefelsäureester werden gelegentlich auch als Sulfate bezeichnet, da die Namen häufig auf -sulfat enden. Einfache Ester wie Dimethylsulfat sind kräftige Alkylierungsmittel. Ester mit längeren Kohlenwasserstoffresten sowie Sulfonsäure-Salze sind in der Regel Tenside. Zu diesen Estern gehören auch die anwendungstechnisch wichtigen Fettalkoholsulfate.
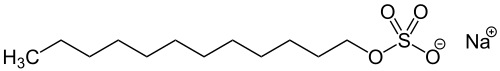
- Monoester; Beispiel: Natriumlaurylsulfat, ein Tensid, das in Shampoos verwendet wurde.
- Diester; Beispiel: Dimethylsulfat, ein Reaktant, der in Labor und Technik zur Methylierung verwendet wird.
Eigenschaften
Allgemeines
Die meisten Sulfate sind in Wasser löslich. Ausnahmen bilden die wenig oder schwerlöslichen Sulfate der Erdalkalimetalle Calciumsulfat, Strontiumsulfat, Bariumsulfat und Radiumsulfat sowie Blei(II)-sulfat. Das Radiumsulfat ist dabei das schwerlöslichste Sulfat, das man kennt.[1]
Besonders die Alkali- und Erdalkalisulfate sind thermisch äußerst stabil. Sulfate dreiwertiger Metallkationen zersetzen sich in der Wärme zu den entsprechenden Oxiden und Schwefeltrioxid:
Hydrogensulfate sind als Salze der Alkalimetalle bekannt. Sie sind löslich in Wasser. Beim Erhitzen dieser Salze bilden sich Disulfate, Salze der Dischwefelsäure.
Anionen und pH-Wert
Schwefelsäure ist eine starke zweiprotonige Säure. In einer einmolaren, wässrigen Lösung der Säure liegen so gut wie keine H2SO4-Moleküle, sondern im Wesentlichen HSO4−-Ionen vor. Nur gut 1 % der HSO4−-Ionen deprotonieren zu SO42−. Das Hydrogensulfat-Anion (HSO4−) kann sowohl als Säure als auch als Base wirken, es ist also amphoter. Der pKS-Wert des Hydrogensulfat-Ions liegt bei 1,89.
Löst man ein Hydrogensulfatsalz in Wasser, bildet sich in einer Gleichgewichtsreaktion eine Mischung von Hydrogensulfat- und Sulfationen. Daher kann man Hydrogensulfate als mittelstarke Säure einsetzen, wobei die Säurestärke erheblich höher ist als die von Essigsäure (pKS = 4,76). Aufgrund dieser Eigenschaften können Hydrogensulfate auch in Pufferlösungen verwendet werden. Der Pufferbereich liegt im stark sauren Bereich. Wegen ihrer sauren Reaktion in Wasser werden sie beispielsweise in WC-Reinigern eingesetzt.
| Gleichgewichtsreaktionen | Gleichgewichtskonstante bei 25 °C | 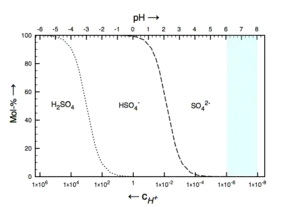 | |
|---|---|---|---|
| (1) | |||
| (2) |
Vorkommen

Viele Metallsulfate kommen in der Natur in Form von Mineralen vor. Das mit Abstand häufigste ist Calciumsulfat (CaSO4), das in mehreren Mineralvarietäten auftritt. Mit Kristallwasseranteil wird es als Gips (CaSO4 · 2 H2O) oder Bassanit (CaSO4 · ½ H2O) bezeichnet, ohne als Anhydrit. Die reinweiße und extrem feinkörnige Gipsvariante wird Alabaster genannt, transparente Gips-Einkristalle bilden das Marienglas. Die bedeutendsten Gips- bzw. Anhydritvorkommen in Mitteleuropa befinden sich in der sogenannten Zechsteinserie, meist tief im Untergrund Nord- und Mitteldeutschlands sowie Polens.[2] An den Rändern der variszischen Gebirgsrümpfe reichen die Zechstein-Anhydrite teilweise bis an die Erdoberfläche und werden dort in Steinbrüchen abgebaut. Ein weltberühmtes Gipsvorkommen befindet sich in Mexiko in den durch die Mine von Naica erschlossenen Höhlen. Weitere wichtige Sulfatminerale sind Baryt (Schwerspat, BaSO4), Coelestin (SrSO4) und Anglesit (PbSO4).[3]
Eine biologische Quelle für Sulfate ist die Umwandlung von Sulfiden und schwefelhaltigen Biomasse-Bestandteilen (z. B. Proteinen) durch schwefeloxidierende Bakterien.
Sulfate kommen in unterschiedlichen Mengen im Grundwasser vor. Für daraus gewonnenes Trinkwasser gilt in Deutschland nach Nr. 17 der Anlage 3 (zu § 7 und § 14 Absatz 3) der Trinkwasserverordnung ein Grenzwert von 250 mg/l.
Struktur des Sulfations
.PNG.webp)
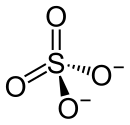
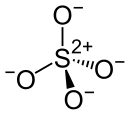
Das Sulfation ist tetraedrisch gebaut, die S-O-Bindungen sind alle gleichwertig und gleich lang. Die Bindungsverhältnisse können entweder durch mesomere Grenzstrukturen mit delokalisierten π-Bindungen und zwei negativ geladenen Sauerstoffatomen oder durch Ladungstrennung mit zweifach positiv geladenem Schwefelatom und negativer Ladung an jedem Sauerstoffatom beschrieben werden. Es ist isoelektronisch mit dem Perchloration. Aus dem Molekülorbitaldiagramm geht hervor, wie die Bindung und die Hypervalenz erklärt werden kann. Es wird ein zweifach positiv geladenes Schwefelatom mit vier einfach besetzten Atomorbitalen angenommen. Diese Orbitale werden mit vier einfach besetzten 2p-Orbitalen aus den einfach negativ geladenen Sauerstoffatomen kombiniert. Es entstehen vier bindende und vier antibindende σ-Orbitale, von denen nur die bindenden vollständig aufgefüllt sind, und damit das tetraedrische Molekülgerüst mit vier lokalisierten Einfachbindungen. Die unbesetzten antibindenden σp*-Orbitale werden anschließend mit je einem voll besetzten p-Orbital dreier Sauerstoffatome kombiniert, es entstehen drei bindende und drei antibindende π-Orbitale, wovon wieder nur die bindenden Orbitale besetzt sind. Es resultieren drei π-Bindungen, die über das gesamte Molekül, also über das Schwefelatom und alle vier Sauerstoffatome, delokalisiert sind.
Nachweis
Sulfate werden chemisch mit Bariumchlorid oder Bariumhydroxidlösung in Salzsäure nachgewiesen. Dabei entsteht ein schwerlöslicher Niederschlag aus weißem Bariumsulfat:
- Sulfat-Ionen bilden mit Barium-Ionen einen weißen, säureunlöslichen Niederschlag von Bariumsulfat.
Die Säure wird zur Entstörung zugesetzt, da andere Anionen wie Carbonat oder Sulfit mit Barium in Wasser ebenfalls schwerlösliche, aber in Säuren lösliche Salze bilden.
In der Wasseranalytik finden für die quantitative Bestimmung auch titrimetrische Verfahren Anwendung.
Beispiele


| ||||||||||||||||||||||||||||||||||||||||||||||||||
Weitere Beispiele:
- Alaune (Kaliumaluminiumsulfat, KAl(SO4)2 · 12 H2O, und andere Verbindungen der Zusammensetzung MIMIII(SO4)2·12 H2O, wie z. B. Ammoniumeisen(III)-sulfat-Dodecahydrat, NH4Fe(SO4)2 · 12H2O, oder Chromalaun, KCr(SO4)2 · 12 H2O)
- Aluminit (Al2[(OH)4SO4] · 7 H2O, ein Mineral)
- Ammoniumeisen(II)-sulfat, Mohr’sches Salz, ein hellgrünes Doppelsalz aus Ammonium- und Eisen(II)-sulfat
- Baryt (Schwerspat, BaSO4, ein Mineral)
- Blei(II)-sulfat (PbSO4, bildet sich durch Schwefelsäure-Einwirkung auf den Bleiplatten in Autobatterien, weiß, wasserunlöslich, natürlich Vorkommend als Anglesit)
- Calciumaluminatsulfat (Ca6Al2[(OH)12|(SO4)3]·26 H2O, wird als Weißpigment u. a. in Anstrichmitteln genutzt)
- Cobalt(II)-sulfat (CoSO4 · 7 H2O, ein Vitriol)
- Eisen(II)-sulfat (FeSO4, Grünsalz, kristallwasserhaltig auch als Eisenvitriol bezeichnet)
- Kaliumhydrogensulfat (KHSO4, als saurer Abflussreiniger im Handel)
- Levosalbutamol·Sulfat (CAS-Nr. 148563-16-0, das Salz eines basischen Amins)
- Magnesiumsulfat (MgSO4, kristallwasserhaltig auch als Bittersalz bezeichnet und in Form von Kieserit als Mineral in Evaporiten auftretend)
- Mangan(II)-sulfat (MnSO4, kristallwasserhaltig auch als Manganvitriol bezeichnet, blassrosa)
- Natriumhydrogensulfat (NaHSO4)
- Nickelsulfat (NiSO4, kristallwasserhaltig auch als Nickelvitriol bezeichnet, grün)
- Polyhalit (kristallwasserhaltiges Evaporit-Mineral aus Kalium-, Magnesium- und Calciumsulfat, K2SO4 · MgSO4 · 2 CaSO4 · 2 H2O)
- Zinksulfat (ZnSO4 · 7 H2O, Zinkvitriol)
Weblinks
Einzelnachweise
- Gmelins Handbuch der Anorganischen Chemie: Radium, System Nummer 31, Achte Auflage, Verlag Chemie GmbH, Berlin 1927, Seite 61–62.
- Gerhard Richter-Bernburg: Zechstein-Anhydrite – Fazies und Genese. Geologisches Jahrbuch, Reihe A. Heft 85, Bundesanstalt für Geowissenschaften und Rohstoffe, Hannover 1985, ISBN 978-3-510-96409-3.
- Martin Okrusch, Siegfried Matthes: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 8. Auflage, Springer, Berlin/Heidelberg 2009, ISBN 978-3-540-78200-1, S. 107 ff.







