Biotin
Biotin, auch als Vitamin B7 oder Vitamin H (auch Vitamin I) bezeichnet, ist ein wasserlösliches Vitamin aus dem B-Komplex. Es spielt als prosthetische Gruppe von Enzymen im Stoffwechsel eine bedeutende Rolle, ist aber auch im Zellkern wichtig für die epigenetische Regulation der Genfunktion.[6][7]
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
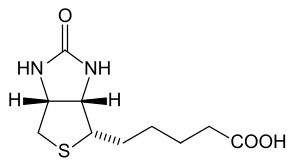 | |||||||||
| Allgemeines | |||||||||
| Trivialname |
| ||||||||
| Andere Namen |
| ||||||||
| Summenformel | C10H16N2O3S | ||||||||
| CAS-Nummer | 58-85-5 | ||||||||
| ATC-Code |
A11HA05 | ||||||||
| Kurzbeschreibung | farblose Nadeln[2] | ||||||||
| Vorkommen | Prokaryoten und Eukaryoten[3] | ||||||||
| Physiologie | |||||||||
| Funktion |
| ||||||||
| Täglicher Bedarf | |||||||||
| Folgen bei Mangel | Entzündungen der Haut und Zunge, Haarausfall, Blutarmut, Depressionen, Müdigkeit, Ohnmacht, Appetitlosigkeit, Gliederschmerzen, erhöhte Gesamtcholesterinwerte, Unterzuckerung | ||||||||
| Überdosis | nicht bekannt | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 244,31 g·mol−1 | ||||||||
| Aggregatzustand | fest | ||||||||
| Schmelzpunkt |
232–233 °C[2] | ||||||||
| Löslichkeit | löslich in Wasser (220 mg·l−1 bei 25 °C), in Ethanol 96 % (800 mg·l−1 bei 25 °C); besser löslich in heißem Wasser, in verdünnten Alkalien; unlöslich in anderen, gebräuchlichen organischen Lösungsmitteln[2] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Die französische Nomenklatur benennt Biotin häufig als Vitamin B8, während sich in der angelsächsischen und auch in der deutschen Literatur die „Adenylsäure“ (Adenosinmonophosphat) als Vitamin B7 findet; zuweilen werden auch das Inositol, welches kein Vitamin ist, bzw. die Folsäure, die ebenfalls dem Vitamin-B-Komplex angehört, als Vitamin B8 bezeichnet. Der von der IUPAC empfohlene Name ist jedoch einzig Biotin.
Der Name "Biotin" leitet sich von dem griechischen Wort "bios" (leben) und der Endung "-in" ab, eine übliche Endung in der organischen Chemie.[8]
Geschichte
Die Entdeckung der Substanz verlief in mehreren Schritten:
- 1898 – Steinitz – Vitamin H (von Haut)[9]
- 1901 – Eugene Wildiers und Manile Ide – „Bios“: ein wässriger Extrakt aus Hefen enthält eine Substanz, die für das Wachstum von Hefen notwendig ist
- 1927 – M. A. Boas – Beschreibung des „Eiweiß-Verletzungs-Syndroms“, eine Form der Dermatitis: Verursacht durch ein im Eiklar enthaltenes Protein (Avidin), das Biotin sehr fest bindet und seine biologische Verfügbarkeit vermindert.
- 1931 – Paul György – Vitamin H
- 1936 – Fritz Kögl und Benno Tönnis – Erstmalige Isolierung von 1,1 mg Biotin aus 250 kg getrocknetem Eidotter
- 1940 – György – Feststellung, dass Biotin identisch mit Vitamin H und Coenzym R ist
- 1942 – Vincent du Vigneaud – Aufklärung der chemischen Struktur
- 1943 – Harris et al. – chemische Synthese von Biotin[10]
Vorkommen und Ernährung
Biotin ist in sehr vielen Nahrungsmitteln enthalten, jedoch meistens nur im einstelligen Mikrogramm-Bereich. Folgende Tabelle zeigt Beispiele verschiedener Lebensmittel:
| Lebensmittel[11] | μg/100 g |
|---|---|
| Hefe | 200 |
| Pfifferling (getrocknet) | 146 |
| Steinpilz (getrocknet) | 105 |
| Rinderleber (gegart) | 103 |
| Erdnußbutter | 67 |
| Eigelb | 50 |
| Weizenkleie | 44 |
| Soja | 30 |
| Haferflocken | 20 |
| Walnüsse | 19 |
| Champignons (frisch) | 16 |
| Reis (ungeschält) | 12 |
| Weizen-Vollkornmehl | 8 |
| Fisch | 7 |
| Spinat | 6 |
| Rind- und Schweinefleisch | 5 |
| Bananen | 5 |
| Kuhmilch | 3 |
| Äpfel | 1 |
Seit den 1940er Jahren ist bekannt, dass Bakterien, die in der normalen Darmflora enthalten sind, neben anderen B-Vitaminen auch Biotin produzieren und in Abhängigkeit von der Bakterienart und der zur Verfügung stehenden Zeit ihre Umgebung in unterschiedlichem Maße damit anreichern.[12] Eine Folge ist, dass die Ausscheidungen mehr Biotin enthalten als die zuvor konsumierte Nahrung.[13] Es gilt als sehr wahrscheinlich, dass aus dieser Quelle stammendes Biotin in gewisser Menge vom Organismus verwertet wird. Bezüglich der Höhe dieses Beitrags herrscht aber Unsicherheit.[14]
Die Deutsche Gesellschaft für Ernährung nennt 30–60 μg/Tag als Schätzwert für die angemessene Zufuhr bei gesunden Erwachsenen. In der Schwangerschaft und Stillzeit gilt die gleiche Empfehlung. Für Säuglinge wird die benötigte Biotinmenge mit 5–10 μg/Tag angenommen.[15]
Die europäische RDA nennt als wünschenswerte Biotinzufuhr für gesunde Erwachsene 50 μg/Tag, vor einigen Jahren wurden noch 150 μg/Tag angegeben.[16]
Der genaue Bedarf ist nicht bekannt, da es an aussagekräftigen experimentellen Studien fehlt. Das macht es notwendig, die Angaben zum Biotinbedarf auf Plausibilitätsüberlegungen zu stützen. Bei Säuglingen wird beispielsweise der durchschnittliche Biotingehalt der Muttermilch und die tägliche Trinkmenge der Abschätzung zugrunde gelegt.[17][18]
Herstellung
Es gibt zahlreiche vielstufige Verfahren zur chemischen Synthese von (+)-Biotin. Bei den technisch relevanten Synthesen wird Fumarsäure, die Aminosäure (R)-Cystein oder Tetronsäure als Ausgangsstoff eingesetzt.[19] (+)-Biotin ist ein wirtschaftlich bedeutendes Erzeugnis der chemischen Industrie.
Eigenschaften
Das chirale Biotin besitzt drei stereogene Zentren, so dass acht Stereoisomere denkbar sind. Allerdings besitzt nur das natürliche (+)-Biotin mit (3aS,4S,6aR)-Konfiguration die volle biologische Aktivität.[20]
Physikalische und chemische Eigenschaften
Biotin ist eine in farblosen Nadeln kristallisierende, bei Zimmertemperatur feste Substanz. Die Verbindung löst sich wenig in kaltem Wasser, Ethanol oder verdünnten Säuren, ist jedoch in heißem Wasser und Laugen besser löslich. In den meisten organischen Lösungsmitteln ist Biotin unlöslich.[4]
Das Vitamin ist beständig gegen Luftsauerstoff oder erhöhte Temperaturen; bei 232–233 °C schmilzt Biotin. Starke Basen oder Säuren, Oxidationsmittel und UV-Licht zersetzen die Verbindung. Wässrige, neutrale Lösungen des Biotin in Wasser sind bis etwa 100 °C beständig. Bei richtiger Lagerung und Zubereitung betragen die Verluste beim Kochen pflanzlicher und tierischer Lebensmittel unter 20 %.[4]
Physiologische und biochemische Grundlagen
Biotinstoffwechsel
Biotin ist die prosthetische Gruppe mehrerer Carboxylase-Enzyme, die wichtige Aufgaben im Eiweiß-, Fett- und Kohlenhydratstoffwechsel erfüllen. Um die in der Nahrung enthaltenen, relativ geringen Mengen an Biotin effektiv zu nutzen, hat sich ein Recycling-Mechanismus entwickelt. Der Einbau des Biotins in die Carboxylasen erfolgt, indem ein spezieller Lysinrest der noch funktionsunfähigen Apocarboxylasen durch das Enzym Holocarboxylase-Synthetase mit einem Biotinmolekül verbunden wird, wodurch funktionsfähige Holocarboxylasen entstehen. (Siehe auch Apo- und Holoenzym.) Wenn diese biotinhaltigen Carboxylasen durch Proteolyse wieder abgebaut werden, bleibt Biocytin übrig, eine Verbindung aus Biotin und der Aminosäure Lysin. Im nächsten Schritt wird Biocytin durch das Enzym Biotinidase gespalten und so Biotin zurückgewonnen.[17]
Dieser Biotin-Kreislauf ist allerdings nicht völlig geschlossen, da sowohl Biotin als auch Biocytin in den Urin gelangen und auf diese Weise ausgeschieden werden können. Außerdem kann die Seitenkette des Biotins der β-Oxidation zum Opfer fallen. Die so entstehenden Abbauprodukte sind nicht biologisch aktiv und werden ebenfalls mit dem Urin ausgeschieden. Ein Ausgleich dieser Verluste ist beim gesunden Menschen mit normaler Ernährung aber kein Problem. Da der überwiegende Teil des in der Nahrung enthaltenen Biotins nicht in freier Form, sondern proteingebunden vorkommt, ist selbst nach vollständiger Proteolyse von Nahrungsproteinen die Wirkung der Biotinidase für die Freisetzung und Aufnahme von Biotin erforderlich. Daneben kommt der Biotinidase innerhalb des Blutkreislaufs noch eine speichernde Funktion zu, da sie Biotin in gewissem Maße an sich bindet und so vor Ausscheidung durch die Niere schützt. Für die Aufnahme des Biotins aus dem Darm und dessen Weitergabe in die Körpergewebe sind Transporterproteine verantwortlich, von denen aber bislang nur der natriumabhängige Multivitamintransporter (SMVT) allgemein als identifiziert gilt. Bei Biotinmangel kann durch vermehrte Bildung des SMVT die Aufnahme aus dem Darm wie auch die Rückgewinnung aus den Nierentubuli intensiviert werden. Auf die Existenz weiterer Transporter gibt es Hinweise.[18][21]
Biotin als prosthetische Gruppe
Biotin ist die prosthetische Gruppe von Carboxylasen, genauer der Carboxy-Transferasen. Durch deren Aktion kann auch im tierischen Organismus Kohlendioxid fixiert werden. Beispiele sind:
- die Pyruvat-Carboxylase, ein Schlüsselenzym der Gluconeogenese, das Pyruvat in einen Metaboliten des Citratzyklus umwandelt;
- die Acetyl-CoA-Carboxylase, welche das Malonyl-CoA für den Startschritt der Polyketid- und Fettsäurebiosynthese liefert.
- die Propionyl-CoA-Carboxylase, welche für den Abbau der Aminosäuren Valin, Isoleucin, Methionin und Threonin sowie ungeradzahliger und verzweigter Fettsäuren nötig ist.
- die Methylcrotonoyl-CoA-Carboxylase, die für den Abbau der Aminosäure Leucin notwendig ist.
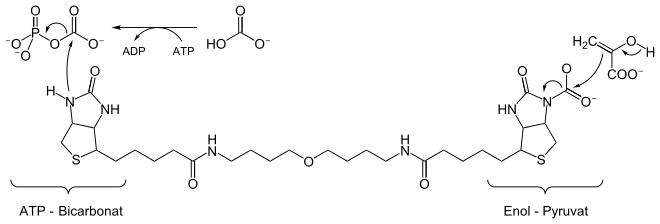
Die Abbildung zeigt die Funktion des Biotins als prosthetische Gruppe in der durch die Pyruvat-Carboxylase katalysierten Reaktion. Vor der Addition an den Stickstoff des Biotins wird das Kohlendioxid, welches als Hydrogencarbonat vorliegt, mit ATP in eine aktive Form, das Carboxyphosphat, ein gemischtes Anhydrid der Phosphor- und Kohlensäure, überführt. Als prosthetische Gruppe ist Biotin fest an einen Lysinrest des Enzyms gebunden. Die Einheit (auch Biocytin genannt) fungiert als eine Art Drehscheibe (Propeller-Prinzip), über welche die Pyruvatbindungsstelle bedient werden kann. Das Pyruvat ist dort in seiner Enolform gebunden, was direkt die unmittelbare Übernahme des CO2-Restes ermöglicht. Die Reaktion zeigt beispielhaft den Einsatz und die Regenerierung einer prosthetischen Gruppe an ein und demselben Enzym.
Funktion im Zellkern
Biotin spielt auch im Zellkern eine Rolle, wo es Histone modifizieren kann. Es ist bekannt, dass mehrere Lysinreste der Histone H2A, H3 und H4 biotinyliert vorkommen können. Durch diese Histonmodifikation hat Biotin Einfluss auf die Struktur des Chromatins und die momentane Ablesbarkeit der genetischen Information (Gen-Silencing). Biotin ist an der Regulation der Expression einer großen Anzahl von Genen, wahrscheinlich mehr als 2000, beteiligt. Es gibt Hinweise darauf, dass die Enzyme Holocarboxylase-Synthetase und Biotinidase Biotin auf Histone übertragen können, wobei die Biotinidase wohl auch in der Lage ist, Histone zu debiotinylieren. Wie diese Vorgänge im Detail verlaufen, ist Gegenstand der aktuellen Forschung.[6][7]
Biotinmangel
Ein Biotinmangel wirkt sich auf den Kohlenhydrat-, den Eiweiß- und den Fettstoffwechsel aus. Diese Folgen resultieren vor allem aus einer Funktionseinschränkung der biotinabhängigen Carboxylasen. Das Krankheitsbild wird deshalb allgemein als multipler Carboxylasemangel bezeichnet. Neben einem eigentlichen Biotinmangel kommen aber auch Gendefekte im Bereich des Biotinstoffwechsels als Auslöser dafür infrage.[22][21]
Symptome
Als Folge eines Biotinmangels wurden beim Menschen folgende Symptome beobachtet: Hautstörungen, Depressionen, extreme Mattigkeit, Schläfrigkeit, Muskelschmerzen, Überempfindlichkeit, lokale Fehlempfindungen, Halluzinationen, Appetitlosigkeit, Übelkeit, Haarausfall, Farbveränderungen der Haare, brüchige Nägel, erhöhte Cholesterinwerte, abnorm hohe Spiegel an ungeradzahligen Fettsäuren, Störungen der Herzfunktion, Blutarmut, grau-blasse Hautfarbe, Bewegungsstörungen (Ataxie), sowie Hypotonie (erniedrigter Blutdruck), auch eine erhöhte Anfälligkeit für Infektionen (Kandidose, Keratokonjunktivitis, Glossitis).[17][18][13] wurde festgestellt.
Bei Tieren wurden außerdem noch weitere Effekte festgestellt, wie metabolische Veränderungen und Verfettung des Herzmuskels, Fettleber, plötzlicher Tod durch Unterzuckerung bei körperlicher Belastung, Beeinträchtigung des Immunsystems und eine schlechtere Wundheilung. Bei Hühnern senkte Biotinmangel den Biotingehalt der Eier wesentlich, was zu einer verringerten Schlupfrate und häufigen Missbildungen der Küken führte, obwohl die Anzahl der gelegten Eier noch unverändert blieb. Auch bei einigen Säugetierarten wurden fruchtschädigende Wirkungen des Biotinmangels beschrieben.[24]
Ursachen
- Avidin, ein im Hühnereiklar enthaltenes Protein, ist in der Lage, Biotin sehr fest zu binden. Außerdem wird Avidin von Verdauungsenzymen nicht angegriffen. Erhitzen denaturiert das Avidin und macht es so unschädlich. Dagegen kann bei genügend großem Verzehr von rohem Eiklar sämtliches Biotin im Darm von Avidin gebunden werden.[17] Das bedeutet, sowohl das in der Nahrung enthaltene als auch das von der Darmflora gebildete Biotin werden für den Organismus unerreichbar. Sobald sich die körpereigenen Reserven erschöpfen, prägen sich die Symptome des Biotinmangels aus. Im Rahmen eines Experiments mit freiwilligen Versuchspersonen begann dies nach drei bis vier Wochen.[13] Generell nutzt man diese Eigenschaft des Avidins, um zu experimentellen Zwecken bei Menschen oder Tieren relativ schnell und zuverlässig einen Biotinmangel zu erzeugen.
- Patienten mit Kurzdarmsyndrom, die auf intravenöse Ernährung angewiesen sind, entwickeln innerhalb von Monaten oder auch Jahren Mangelsymptome, falls die Infusionen kein Biotin enthalten. Bei Säuglingen geschieht das deutlich schneller.[18] Außer Verkürzungen des Dünndarms gehören auch Schädigungen der Darmflora zu den Risikofaktoren. Schon die längerfristige Einnahme von Antibiotika kann zu einem Biotinmangel führen. Chronischer Alkoholismus geht ebenfalls oft mit einer Verarmung des Körpers an Biotin einher.[17]
- Ein Biotinmangel, der lediglich durch biotinarme Kost verursacht wird, ist beim Menschen kaum beschrieben. Eine Ausnahme bildeten Säuglinge, die über längere Zeit eine aus Einzelnährstoffen zusammengestellte Fertignahrung erhielten, in der Biotin nicht enthalten war.[18] Bei manchen Tieren wie Hühnern oder Truthühnern kann ein Biotinmangel dagegen relativ leicht auch durch biotinarmes Futter eintreten.[24]
- Bei manchen Nierenkranken, die sich über längere Zeit einer Dialyse-Behandlung unterziehen mussten, wurde Biotinmangel gefunden.[17]
- Antikonvulsiva scheinen den Biotinhaushalt zu beeinflussen, sodass sich dadurch ein mehr oder weniger starker Biotinmangel ausprägt.[18]
- In der Schwangerschaft findet man bei ungefähr einem Drittel der Frauen biochemische Veränderungen, die auf einen leichten Biotinmangel hindeuten. Äußerlich in Erscheinung tretende Symptome entstehen dadurch normalerweise nicht. Man vermutet, dass Biotin in der Schwangerschaft schneller abgebaut wird, da im Urin von Schwangeren weniger Biotin, aber erhöhte Konzentrationen seiner Metaboliten gemessen werden.[18][14]
Überdosierung
Bisher sind beim Menschen keine schädlichen Wirkungen von Biotin in Erscheinung getreten. Alles spricht dafür, dass die therapeutische Breite sehr groß ist.[17] Bei Patienten mit verschiedenen Störungen des Biotinstoffwechsels existieren langjährige Beobachtungen zur Einnahme von täglich bis zu 10 mg Biotin pro Kilogramm Körpergewicht. Negative Auswirkungen der hohen Biotindosis wurden nicht beobachtet. Ein Teil der Patienten weist allerdings irreversible Schäden auf, weil die Behandlung mit Biotin zu spät einsetzte.[22][25] Die Übertragung solcher Ergebnisse von Stoffwechselkranken auf Gesunde ist empirisch nicht ohne weiteres möglich.
Aufgrund der unzureichenden Datenlage wird bisher von offizieller Seite kein LOAEL-Wert angegeben.[26] (Das ist die niedrigste Dosis, die negative Effekte nach sich ziehen kann.) Es existieren nur wenige Studien an Tieren, bei denen Biotinmengen verabreicht wurden, die groß genug waren, um negative Auswirkungen zu erzeugen. Beispielsweise wurde in einem mehrwöchigen Versuch an jungen Ratten festgestellt, dass bei einer über das Futter zugeführten täglichen Biotindosis von ungefähr 80 mg pro Kilogramm Körpergewicht deren Futteraufnahme und Wachstum beeinträchtigt wurden, was sich bei weiter steigender Dosis noch verstärkte.[27] Umgerechnet auf einen durchschnittlich schweren Menschen von 65 kg ergäbe das eine tägliche Einnahmemenge von mehr als 5 g Biotin, was dem 100.000-fachen physiologischen Bedarf entspricht.
Obwohl Biotin von Ratten in 5000- bis 10.000-facher Normaldosis ohne Beeinträchtigungen vertragen wurde, trat bei trächtigen Rattenweibchen nach Injektionen von mehr als 1 mg Biotin pro Kilogramm Körpergewicht eine Resorption von Föten, verbunden mit einer Störung der Östrogenbildung auf.[17]
Biotin kann Laborwerte verfälschen, die mit immunologischen Verfahren bestimmt werden, die auf der Biotin-Streptavidin-Wechselwirkung beruhen. Je nach Testaufbau kann es dabei zu falsch hohen oder falsch niedrigen Resultaten kommen. Diese Störungen können schon bei üblichen Biotin-Dosierungen auftreten.[28]
Verwendung
Biotin als Medikament
Biotinpräparate werden zur Behandlung und Prophylaxe eines Biotinmangels eingesetzt. Zur Prophylaxe sind 0,2 mg/Tag ausreichend. Um einen bestehenden Mangel innerhalb kurzer Zeit sicher auszugleichen, kann aber eine wesentlich höhere Dosis erforderlich sein.[17] Oft ist Biotin Bestandteil der Multivitaminpräparate, die Infusionslösungen zugegeben werden, wenn Patienten über einen längeren Zeitraum parenteral, also unter Umgehung des Magen-Darm-Trakts, ernährt werden müssen.[29]
Bei folgenden genetisch bedingten seltenen Stoffwechselkrankheiten ist eine lebenslange Behandlung mit sehr hoch dosiertem Biotin die gängige und eine äußerst wirksame Therapie:[22][25]
Aktuell wird Biotin in hoher Dosis unter der Bezeichnung MD1003 gegen progressive Multiple Sklerose in Pilotstudien erprobt.[30]
Biotin in der molekularen Biotechnologie
Biotin kann zur Markierung verschiedener Moleküle verwendet werden (Biotinylierung). Zum Nachweis nutzt man die Wechselwirkung zwischen Biotin und Avidin bzw. Streptavidin.[31]
Siehe auch
Weblinks
- Hans-Georg Zoch: Datenblätter Naturstoffe: Biotin, Umweltwissenschaften und Schadstoff-Forschung, doi:10.1007/BF03038288
- Sandra Göbel: Vitamin H auf www.apotheken.de
- Höchstmengenvorschläge für Biotin in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: Bundesinstitut für Risikobewertung. 2021, abgerufen am 6. Januar 2022.
Einzelnachweise
- Eintrag zu BIOTIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; ISBN 978-0-911910-00-1.
- David E. Metzler, Carol M. Metzler: Biochemistry: The Chemical Reactions of Living Cells, Volume 1. ISBN 978-0-080-92470-0, 2001, S. 724.
- Eintrag zu Biotin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. April 2012.
- Datenblatt Biotin, ≥99% (TLC), lyophilized powder bei Sigma-Aldrich, abgerufen am 16. März 2013 (PDF).
- Y. I. Hassan, J. Zempleni: Epigenetic regulation of chromatin structure and gene function by biotin. In: J. Nutr. 136(7); 2006 Jul: S. 1763–5 PMID 16772434 (freier Volltextzugriff).
- Matthias Weider: Identifizierung von cis- und trans-Komponenten der biotinabhängigen Transkriptionsregulation in Saccharomyces cerevisiae. (PDF; 17,26 MB) Dissertation an der Friedrich-Alexander-Universität Erlangen-Nürnberg, 2006.
- biotin | Origin and meaning of biotin by Online Etymology Dictionary (en) In: www.etymonline.com. Abgerufen am 14. November 2020.
- Steinitz, Franz: Über das Verhalten phosphorhaltiger Eiweisskörper im Stoffwechsel. In: Arch Ges Physiol. 72, 1898, S. 75–104. doi:10.1007/BF01662124.
- Harris,J.A.;Wolf,D.E.;Mozingo,R.;Folkers,K.: Synthetic biotin. In: Science. 97, 1943, S. 447. doi:10.1126/science.97.2524.447.
- Nährstoffdatenbank der Universität Hohenheim (abgerufen am 28. Februar 2021).
- P. R. Burkholder, I. McVeigh: Synthesis of Vitamins by Intestinal Bacteria. In: Proceedings of the National Academy of Sciences. Band 28, Nummer 7, Juli 1942, S. 285–289, PMID 16578052, PMC 1078469 (freier Volltext).
- K. S. Roth: Biotin in clinical medicine–a review. In: The American journal of clinical nutrition. Band 34, Nummer 9, September 1981, S. 1967–1974, PMID 6116428 (Review).
- H. M. Said: Biotin: the forgotten vitamin. In: The American journal of clinical nutrition. Band 75, Nummer 2, Februar 2002, S. 179–180, PMID 11815306 (Review).
- Referenzwerte für die Nährstoffzufuhr bei der DGE (Stand 2008). Tabelle für Biotin (abgerufen am 1. November 2009).
- Richtlinie 2008/285/EG (PDF) der Kommission vom 28. Oktober 2008 zur Änderung der Richtlinie 90/496/EWG (PDF) des Rates über die Nährwertkennzeichnung von Lebensmitteln hinsichtlich der empfohlenen Tagesdosen, der Umrechnungsfaktoren für den Energiewert und der Definitionen.
- K. Pietrzik, I. Golly, D. Loew: Handbuch Vitamine. Urban & Fischer Verlag, Elsevier GmbH, München 2008; S. 147–154, 416; ISBN 978-3-437-55361-5
- D. M. Mock: Biotin In: J. Zempleni, R. B. Rucker, D. B. McCormick, J. W. Suttie (Editors): Handbook of Vitamins. 4th Edition. CRC Press, 2007; S. 361–384; ISBN 0-8493-4022-5.
- Bernd Schäfer: Naturstoffe der chemischen Industrie. Elsevier, Spektrum Verlag, 2007, ISBN 978-3-8274-1614-8, S. 455–465.
- Bernd Schäfer: Naturstoffe der chemischen Industrie. 2007, S. 449.
- R. Mardach, J. Zempleni, B. Wolf, M. J. Cannon, M. L. Jennings, S. Cress, J. Boylan, S. Roth, S. Cederbaum, D. M. Mock: Biotin dependency due to a defect in biotin transport. In: The Journal of clinical investigation. Band 109, Nummer 12, Juni 2002, S. 1617–1623, doi:10.1172/JCI13138, PMID 12070309, PMC 151007 (freier Volltext).
- E. R. Baumgartner, T. Suormala: Multiple carboxylase deficiency: inherited and acquired disorders of biotin metabolism. In: International journal for vitamin and nutrition research. Band 67, Nummer 5, 1997, S. 377–384, PMID 9350481 (Review).
- A. Taniguchi, T. Watanabe: Roles of biotin in growing ovarian follicles and embryonic development in domestic fowl. In: Journal of nutritional science and vitaminology. Band 53, Nummer 6, Dezember 2007, S. 457–463, PMID 18202531 (Review).
- P. T. Ozand, G. G. Gascon, M. Al Essa, S. Joshi, E. Al Jishi, S. Bakheet, J. Al Watban, M. Z. Al-Kawi, O. Dabbagh: Biotin-responsive basal ganglia disease: a novel entity. In: Brain : a journal of neurology. Band 121 ( Pt 7), Juli 1998, S. 1267–1279, PMID 9679779.
- Zusammenstellung von tolerierbaren oberen Zufuhrmengen für Makro- und Mikronährstoffe (Stand: März 2006; abgerufen: August 2009) bei der DGE. (PDF, 608 kB)
- H. Sawamura, T. Fukuwatari, K. Shibata: Effects of excess biotin administration on the growth and urinary excretion of water-soluble vitamins in young rats. In: Bioscience, biotechnology, and biochemistry. Band 71, Nummer 12, Dezember 2007, S. 2977–2984, doi:10.1271/bbb.70381, PMID 18071266.
- Gesundheitsfalle „Vitamin H“
- Leitlinie Parenterale Ernährung der DGEM, Kapitel 7: Wasser, Elektrolyte, Vitamine und Spurenelemente (PDF, 139 kB) (Memento vom 10. Juli 2007 im Internet Archive); Gedruckt: H. K. Biesalski, S. C. Bischoff, H.-J. Böhles, A. Mühlhofer: 7 Wasser, Elektrolyte, Vitamine und Spurenelemente. In: Aktuel. Ernahrungsmed. 32(Suppl. 1); Mai 2007: S. S30–S34.
- A. Tourbah, C. Lebrun-Frenay u. a.: MD1003 (high-dose biotin) for the treatment of progressive multiple sclerosis: A randomised, double-blind, placebo-controlled study. In: Multiple sclerosis. Band 22, Nummer 13, November 2016, S. 1719–1731, doi:10.1177/1352458516667568, PMID 27589059, PMC 5098693 (freier Volltext).
- Thomas Boenisch (Herausgeber): Handbuch Immunchemische Färbemethoden, 3. Auflage 2003, DakoCytomation GmbH, Hamburg, Deutschland.