Krypton
Krypton (altgriechisch κρυπτός kryptós „verborgen“) ist ein chemisches Element mit dem Elementsymbol Kr und der Ordnungszahl 36. Im Periodensystem steht es in der 8. Hauptgruppe, also der 18. IUPAC-Gruppe und zählt daher zu den Edelgasen. Wie die anderen Edelgase ist es ein farbloses, äußerst reaktionsträges, einatomiges Gas. In vielen Eigenschaften wie Schmelz- und Siedepunkt oder Dichte steht es zwischen dem leichteren Argon und dem schwereren Xenon.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Krypton, Kr, 36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Edelgase | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 18, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | farblos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-098-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.271 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-Code |
V09EX01 (81mKr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 1,9 · 10−5 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 83,798(2)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 116 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 202 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d10 4s2 4p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 13.9996053(20) eV[4] ≈ 1350.76 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 24.35984(12) eV[4] ≈ 2350.37 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 35.838(20) eV[4] ≈ 3457.8 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 50.85(11) eV[4] ≈ 4906 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 64.69(20) eV[4] ≈ 6242 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | gasförmig | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 3,7491 kg · m−3[7] bei 273,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −1,6 · 10−8)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 115,79 K (−157,36 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 121,2 K[9] (−152 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | (fest) 27,99 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 9,03 kJ/mol[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 1,64 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 1120 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,00949 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 3,00[11][12] (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Krypton zählt zu den seltensten Elementen auf der Erde und kommt nur in geringen Mengen in der Atmosphäre vor.
Das Edelgas wurde 1898 von William Ramsay und Morris William Travers durch fraktionierte Destillation flüssiger Luft entdeckt. Krypton wird auf Grund seiner Seltenheit nur in geringen Mengen, vor allem als Füllgas von Glühlampen, verwendet. Eine geringe Anzahl an Kryptonverbindungen ist bekannt, von denen Kryptondifluorid eines der stärksten Oxidationsmittel ist, das bekannt ist.
Geschichte

1894 war Argon als erstes Edelgas von John William Strutt, 3. Baron Rayleigh und William Ramsay entdeckt worden, ein Jahr darauf wurde das bislang nur aus dem Sonnenspektrum bekannte Helium von Ramsay aus Uranerzen isoliert. Aus den Gesetzen des Periodensystems erkannte Ramsay, dass es noch weitere derartige Elemente geben müsste. Er untersuchte daher ab 1896 zunächst verschiedene Minerale und Meteoriten und die von ihnen beim Erhitzen oder Lösen abgegebenen Gase. Er und sein Mitarbeiter Morris William Travers waren dabei jedoch nicht erfolgreich, es wurden nur Helium und seltener Argon gefunden. Auch die Untersuchung heißer Gase aus Cauterets in Frankreich und aus Island brachten keine Ergebnisse.[13]
Schließlich untersuchten sie 15 Liter verflüssigtes Rohargon und trennten es mittels fraktionierter Destillation. In dem Rückstand fanden sie bislang unbekannte gelbe und grüne Spektrallinien, also ein neues Element. Nach dem altgriechischen κρυπτός kryptós („verborgen“) wurde es Krypton genannt. Nach Reinigung durch weitere Destillation konnten Ramsay und Travers auch die molare Masse von etwa 80 g/mol bestimmen. Nach dieser Entdeckung fanden sie in einer anderen, niedriger siedenden Fraktion das Element Neon, und schließlich, durch Trennung des Rohkryptons, das Element Xenon.[13]
1924 behauptete Andreas von Antropoff, eine erste Kryptonverbindung in Form eines roten stabilen Feststoffes aus Krypton und Chlor synthetisiert zu haben. Später stellte sich jedoch heraus, dass diese Verbindung kein Krypton enthielt, sondern Stickstoffmonoxid und Chlorwasserstoff. Größere Anstrengungen in der Synthese von Kryptonverbindungen wurden nach der Entdeckung der ersten Xenonverbindungen 1962 unternommen. Als erster stellte Aristid von Grosse eine Kryptonverbindung dar. Er hielt sie zunächst für Kryptontetrafluorid; sie wurde nach weiteren Versuchen aber als Kryptondifluorid identifiziert.[14]
Die Wellenlänge einer elektromagnetischen Strahlung, die vom Kryptonisotop 86Kr ausgestrahlt wird, wurde 1960 als Grundlage für die Definition des Meters gewählt. Sie löste damit die zu ungenaue Definition über das Urmeter aus einer Platin-Iridium-Legierung ab. Ein Meter wurde als das 1.650.763,73-fache der Wellenlänge der vom Nuklid 86Kr beim Übergang vom 5d5 in den 2pl0-Zustand ausgesandten und sich im Vakuum ausbreitenden Strahlung definiert.[15] 1983 wurde diese Festlegung schließlich ersetzt durch eine Definition, die auf der Strecke beruht, die Licht im Vakuum in einem bestimmten Bruchteil einer Sekunde zurücklegt.[16]
Vorkommen
Krypton zählt zu den seltensten Elementen auf der Erde. Seltener sind lediglich Xenon sowie radioaktive Elemente, die entweder wie Plutonium zum größten Teil schon zerfallen sind oder nur als kurzlebiges Zwischenprodukt von Zerfallsreihen vorkommen. Der Anteil des Kryptons an der Erdhülle beträgt 1,9 · 10−5 ppm,[1] der größte Teil des Gases befindet sich dabei in der Atmosphäre, die zu 1,14 ppm aus Krypton besteht.[17]
Im übrigen Universum kommt Krypton in höherem Anteil vor, vergleichbar mit dem von Lithium, Gallium und Scandium.[18] Das Verhältnis von Krypton und Wasserstoff ist im Universum weitgehend konstant. Daraus lässt sich schließen, dass die interstellare Materie reich an Krypton ist.[19] Krypton konnte auch in einem Weißen Zwerg nachgewiesen werden. Dabei wurde im Vergleich zur Sonne die 450-fache Menge gemessen, der Grund für diesen hohen Krypton-Gehalt ist jedoch noch unbekannt.[20]
Gewinnung
Die Gewinnung von Krypton erfolgt ausschließlich im Rahmen des Linde-Verfahrens aus der Luft. Bei der Stickstoff-Sauerstoff-Trennung reichert es sich auf Grund der hohen Dichte zusammen mit Xenon im flüssigen Sauerstoff an, der sich im Sumpf der Kolonne befindet. Dieses Gemisch wird in eine Kolonne überführt, in der es auf etwa 0,3 % Krypton und Xenon angereichert wird.[21] Dazu enthält das flüssige Krypton-Xenon-Konzentrat neben Sauerstoff noch eine größere Menge Kohlenwasserstoffe wie Methan, fluorierte Verbindungen wie Schwefelhexafluorid oder Tetrafluormethan sowie Spuren an Kohlenstoffdioxid und Distickstoffmonoxid. Methan und Distickstoffmonoxid können über Verbrennung an Platin- oder Palladiumkatalysatoren bei 500 °C zu Kohlenstoffdioxid, Wasser und Stickstoff umgesetzt werden, die durch Adsorption an Molekularsieben entfernt werden können.[22] Fluorverbindungen können dagegen nicht auf diese Weise aus dem Gemisch entfernt werden. Um diese zu zerlegen und aus dem Gemisch zu entfernen, kann das Gas mit Mikrowellen bestrahlt werden, wobei die Element-Fluor-Bindungen aufbrechen und die entstehenden Fluoratome in Natronkalk aufgefangen werden können[23] oder über einen Titandioxid-Zirconiumdioxid-Katalysator bei 750 °C geleitet werden. Dabei reagieren die Fluorverbindungen zu Kohlenstoffdioxid und Fluorwasserstoff und anderen Verbindungen, die abgetrennt werden können.[22]
Anschließend werden Krypton und Xenon in einer weiteren Kolonne, die unten beheizt und oben gekühlt wird, getrennt. Während sich Xenon am Boden sammelt, bildet sich oben ein Gasstrom, in dem zunächst Sauerstoff, nach einiger Zeit auch Krypton aus der Kolonne entweicht. Letzteres wird durch Oxidation von noch vorhandenen Sauerstoffspuren befreit und in Gasflaschen gesammelt.[21]
Eigenschaften
Physikalische Eigenschaften
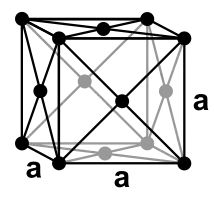

Krypton ist ein bei Normalbedingungen einatomiges, farbloses und geruchloses Gas, das bei 121,2 K (−152 °C) kondensiert und bei 115,79 K (−157,36 °C) erstarrt. Wie die anderen Edelgase außer dem Helium kristallisiert Krypton in einer kubisch dichtesten Kugelpackung mit dem Gitterparameter a = 572 pm.[24]
Wie alle Edelgase besitzt Krypton nur abgeschlossene Schalen (Edelgaskonfiguration). Dadurch lässt sich erklären, dass das Gas stets einatomig vorliegt und die Reaktivität gering ist.
Mit einer Dichte von 3,749 kg/m³ bei 0 °C und 1013 hPa ist Krypton schwerer als Luft, es sinkt also ab. Im Phasendiagramm liegt der Tripelpunkt bei 115,76 K und 0,7315 bar,[25] der kritische Punkt bei −63,75 °C, 5,5 MPa sowie einer kritischen Dichte von 0,909 g/cm³.[26]
In Wasser ist Krypton etwas löslich, in einem Liter Wasser können sich bei 0 °C maximal 110 ml Krypton lösen.[26]
Chemische Eigenschaften
Wie alle Edelgase ist Krypton sehr reaktionsträge. Es kann lediglich mit dem elektronegativsten Element, dem Fluor, unter speziellen Bedingungen reagieren und bildet dabei Kryptondifluorid. Im Gegensatz zu den Xenonfluoriden ist Kryptondifluorid thermodynamisch instabil, die Bildung ist daher endotherm und muss bei niedrigen Temperaturen stattfinden. Die für eine Reaktion nötigen Fluorradikale können über Bestrahlung mit UV-Strahlung, Beschießen mit Protonen oder elektrische Entladungen dargestellt werden.[14]
Mit verschiedenen Verbindungen bildet Krypton Clathrate, bei denen das Gas physikalisch in einen Hohlraum eingeschlossen und so gebunden ist. So bilden Wasser und Wasser-Chloroform-Mischungen bei −78 °C ein Clathrat,[27] ein Clathrat mit Hydrochinon ist so stabil, dass Krypton sich über längere Zeit darin hält.[26] Auch eine Einschlussverbindung des Kryptons im Oligosaccharid α-Cyclodextrin ist bekannt.[28]
Isotope
Insgesamt sind 32 Isotope sowie 10 weitere Kernisomere des Kryptons bekannt. Fünf Isotope sind stabil: 80Kr, 82Kr, 83Kr, 84Kr und 86Kr. Sie kommen zusammen mit dem extrem langlebigen 78Kr (Halbwertszeit 2 · 1021 Jahre) in der Natur vor. Den größten Anteil am natürlichen Isotopengemisch hat dabei 84Kr mit 57 %, gefolgt von 86Kr mit 17,3 %; 82Kr kommt zu 11,58 % und 83Kr zu 11,49 % vor. Dagegen sind die Isotope 80Kr mit 2,28 % und 78Kr mit 0,35 % Anteil selten.[29] Das nach 78Kr langlebigste der instabilen Isotope ist mit einer Halbwertszeit von 229.000 Jahren 81Kr.[29] Es entsteht in Spuren in der oberen Atmosphäre durch Reaktionen stabiler Krypton-Isotope mit kosmischer Strahlung und kommt somit ebenfalls natürlich in der Luft vor.[30] Aufgrund seiner Entstehung in der Atmosphäre und seiner Langlebigkeit wird 81Kr für die Datierung fossilen Grundwassers verwendet.[31]
Auch das radioaktive Isotop 85Kr mit 10,756 Jahren Halbwertszeit (Betastrahler, max. 687 keV) kommt in Spuren in der Atmosphäre vor. Es entsteht zusammen mit anderen (kurzlebigen) Isotopen bei der Kernspaltung von Uran und Plutonium. Durch Kernexplosionen oder während der Wiederaufarbeitung von Brennelementen gelangt es in die Umgebungsluft und ist durch die unterschiedliche Verteilung der Emissionsquellen auf der Nordhalbkugel häufiger als auf der Südhalbkugel. Nachdem die Belastung der Atmosphäre mit 85Kr nach dem Ende der atmosphärischen Kernwaffentests in den 1960ern abnahm,[30] stieg sie in einer Messstation in Gent zwischen 1979 und 1999 – verursacht durch die Wiederaufarbeitungsanlage La Hague – deutlich an.[32]
Als einziges stabiles Krypton-Isotop ist 83Kr NMR-aktiv. Hyperpolarisiertes 83Kr wurde im Tierversuch an Ratten in der Magnetresonanztomographie zur Untersuchung der Lunge eingesetzt.[33]
Verwendung
Der größte Teil des Kryptons wird als Füllgas für Glühlampen verwendet. Durch das Gas ist die Abdampfrate des Glühfadens aus Wolfram geringer, das ermöglicht eine höhere Glühtemperatur. Diese bewirkt wiederum eine höhere Lichtausbeute der Lampe. Auch Halogen- und Leuchtstofflampen können Krypton enthalten. Weiterhin dient es in Geigerzählern, Szintillationszählern und elektronischen Geräten als Füllgas.[21] Auch in Isolierglasscheiben wird es trotz des hohen Preises statt des normalerweise benutzten Argons als Füllgas eingesetzt, wenn man bei gleicher Scheibendicke eine deutlich bessere Isolierung erreichen will.
Zusammen mit Fluor wird Krypton im Krypton-Fluorid-Laser eingesetzt. Dieser zählt zu den Excimerlasern und hat eine Wellenlänge von 248 nm im ultravioletten Spektralbereich.[34] Auch Edelgas-Ionen-Laser mit Krypton, bei denen das aktive Medium ein- oder mehrfach geladene Kryptonionen sind, sind bekannt.[35]
Wie Xenon absorbiert Krypton – allerdings in geringerem Maß – Röntgenstrahlung. Deshalb wird untersucht, ob Xenon-Krypton-Mischungen in der Computertomographie als Kontrastmittel eingesetzt werden können. Sie könnten einen besseren Kontrast als reines Xenon erreichen, da dessen Anteil am Kontrastmittel auf Grund der narkotisierenden Wirkung beim Einsatz am Menschen auf maximal 35 Prozent beschränkt ist.[36]
Flüssiges Krypton wird als Material für Kalorimeter in der Teilchenphysik verwendet. Es ermöglicht eine besonders genaue Bestimmung von Ort und Energie.[37] Ein Beispiel für einen Teilchendetektor, der ein Flüssig-Krypton-Kalorimeter nutzt, ist das NA48-Experiment am CERN.[38]
Das betastrahlende 85Krypton wird zur Vorionisation in Leuchtstofflampen-Glimmstartern verwendet.[39] Auch Ionisationsrauchmelder enthielten früher dieses Gas.
In der Raumfahrt wird Krypton als Stützmasse in Ionenantrieben genutzt.[40]
Biologische Bedeutung
Wie die anderen Edelgase hat Krypton auf Grund der Reaktionsträgheit keine biologische Bedeutung und ist auch nicht toxisch. In höheren Konzentrationen wirkt es durch Verdrängung des Sauerstoffs erstickend.[41] Bei einem Druck von mehr als 3,9 bar wirkt es narkotisierend.[42]
Verbindungen

Nur eine kleine Anzahl an Kryptonverbindungen ist bekannt. Die wichtigste und stabilste davon ist Kryptondifluorid. Es zählt zu den stärksten bekannten Oxidations- und Fluorierungsmitteln und ist beispielsweise in der Lage, Xenon zu Xenonhexafluorid oder Iod zu Iodpentafluorid zu oxidieren. Reagiert Kryptondifluorid mit Fluoridakzeptoren wie Antimonpentafluorid, bilden sich die Kationen KrF+ und Kr2F3+, die die stärksten bekannten Oxidationsmittel sind.
Auch Verbindungen mit anderen Liganden als Fluor sind bekannt. Dazu zählen unter anderem Kryptonbis(pentafluororthotellurat) Kr(OTeF5)2, die einzig bekannte Sauerstoff-Krypton-Verbindung, RCNKrF+AsF6− (R=H, CF3, C2F5 oder n-C3F7) mit einer Krypton-Stickstoff-Bindung und HKrCCH, bei der ein Ethin-Ligand am Krypton gebunden ist.[43]
Literatur
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, doi:10.1002/14356007.a17_485.
- Eintrag zu Krypton. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 417–429.
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Krypton) entnommen.
- IUPAC, Standard Atomic Weights Revised 2013.
- Eintrag zu krypton in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu krypton bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Krypton) entnommen.
- Eintrag zu Kryton in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. April 2017. (JavaScript erforderlich)
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Krypton) entnommen.
- L. C. Allen, J. E. Huheey: The definition of electronegativity and the chemistry of the noble gases. In: Journal of Inorganic and Nuclear Chemistry. 42, 1980, S. 1523–1524, doi:10.1016/0022-1902(80)80132-1.
- T. L. Meek: Electronegativities of the Noble Gases. In: Journal of Chemical Education. 72, 1995, S. 17–18.
- William Ramsay: The Rare Gases of the Atmosphere. Nobelpreisrede, 12. Dezember 1904.
- John F. Lehmann, Hélène P. A. Mercier, Gary J. Schrobilgen: The chemistry of krypton. In: Coordination Chemistry Reviews. 233/234, 2002, S. 1–39, doi:10.1016/S0010-8545(02)00202-3.
- K. Clusius: Zur Geschichte des Metermasses. In: Cellular and Molecular Life Sciences. 19, 4, 1963, S. 169–177, doi:10.1007/BF02172293.
- Internationales Büro für Maß und Gewicht: The BIPM and the evolution of the definition of the metre. Eingesehen am 10. Dezember 2009.
- David R. Williams: Earth Fact Sheet. NASA, Greenbelt, Stand 20. Mai 2009.
- A. G. W. Cameron: Abundances of the elements in the solar system. In: Space Science Reviews. 15, 1970, S. 121–146; (PDF)
- Stefan I. B. Cartledge, J. T. Lauroesch, David M. Meyer, Ulysses J. Sofia, Geoffrey C. Clayton: Interstellar Krypton Abundances: The Detection of Kiloparsec-scale Differences in Galactic Nucleosynthetic History. In: The Astrophysical Journal. 687, 2008, S. 1043–1053, doi:10.1086/592132.
- Klaus Werner, Thomas Rauch, Ellen Ringat, Jeffrey W. Kruk: First detection of Krypton and Xenon in a white dwarf. In: The Astrophysical Journal. 753, 2012, S. L7, doi:10.1088/2041-8205/753/1/L7.
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, doi:10.1002/14356007.a17_485.
- Patent EP1752417: Process and apparatus for the production of krypton and/or xenon. Angemeldet am 20. September 2005, veröffentlicht am 14. Februar 2007, Anmelder: Linde AG, Erfinder: Matthias Meilinger.
- Jean-Christophe Rostaing, Francis Bryselbout, Michel Moisan, Jean-Claude Parenta: Méthode d’épuration des gaz rares au moyen de décharges électriques de haute fréquence. In: Comptes Rendus de l'Académie des Sciences – Series IV – Physics. 1, 1, 2000, S. 99–105, doi:10.1016/S1296-2147(00)70012-6.
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 30, 1974, S. 193–204.
- Eintrag zu Krypton (Phase change data). In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 17. November 2019.
- Eintrag zu Krypton. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- R. M. Barrer, D. J. Ruzicka: Non-stoichiometric clathrate compounds of water. Part 4: Kinetics of formation of clathrate phases. In: Transactions of the Faraday Society. 58, 1962, S. 2262–2271, doi:10.1039/TF9625802262.
- Wolfram Saenger, Mathias Noltemeyer: Röntgen-Strukturanalyse des α-Cyclodextrin-Krypton-Einschlußkomplexes: Ein Edelgas in organischer Matrix. In: Angewandte Chemie. 86, 16, 1972, S. 594–595, doi:10.1002/ange.19740861611.
- G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
- Dan Snyder: Resources on Isotopes – Periodic Table--Krypton. United States Geological Survey, Stand Januar 2004.
- R. Purtschert, R. Yokochi, N. C. Sturchio: Krypton-81 dating of old groundwater. S. 91–124 in: A. Suckow, P. K. Aggarwal, L. Araguas-Araguas (Hrsg.): Isotope Methods For Dating Old Groundwater. Internationale Atomenergiebehörde, Wien 2013 (PDF 18 MB; komplettes Buch)
- P. Cauwels, J. Buysse, A. Poffijn, G. Eggermont: Study of the atmospheric 85Kr concentration growth in Gent between 1979 and 1999. In: Radiation Physics and Chemistry. 61, 2001, S. 649–651, doi:10.1016/S0969-806X(01)00361-9.
- Zackary I. Cleveland, Galina E. Pavlovskaya, Nancy D. Elkins, Karl F. Stupic, John E. Repine, Thomas Meersmann: Hyperpolarized 83Kr MRI of lungs. In: Journal of Magnetic Resonance. 195, 2008, 2, S. 232–237, doi:10.1016/j.jmr.2008.09.020.
- Thomas H. Johnson, Allen M. Hunter: Physics of the krypton fluoride laser. In: J. Appl. Phys. 51, 1980, S. 2406–2420, doi:10.1063/1.328010.
- Eintrag zu Edelgas-Ionen-Laser. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- Deokiee Chon, Kenneth C. Beck, Brett A. Simon, Hidenori Shikata, Osama I. Saba, Eric A. Hoffman: Effect of low-xenon and krypton supplementation on signal/noise of regional CT-based ventilation measurements. In: J. Appl. Physiol. 102, 2007, S. 1535–1544, doi:10.1152/japplphysiol.01235.2005.
- V. M. Aulchenko, S. G. Klimenko, G. M. Kolachev, L. A. Leontiev, A. P. Onuchin, V. S. Panin, Yu. V. Pril, V. A. Rodyakin, A. V. Rylin, V. A. Tayursky, Yu. A. Tikhonov, P. Cantoni, P. L. Frabetti, L. Stagni, G. Lo Bianco, F. Palombo, P. F. Manfredi, V. Re, V. Speziali: Investigation of an electromagnetic calorimeter based on liquid krypton. In: Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 289, 1990, S. 468–474, doi:10.1016/0168-9002(90)91518-G.
- E. Mazzucato: Status of the NA48 experiment at the CERN SPS. In: Nuclear Physics B – Proceedings Supplements. 59, 1997, S. 174–181, doi:10.1016/S0920-5632(97)00440-4.
- energieverbraucher.de: Radiologische Beurteilung von Startern für Leuchtstofflampen mit Kr-85-haltigem Füllgas, 1/2002.
- Stephen Clark: SpaceX releases new details on Starlink satellite design. In: Spaceflight Now. 15. Mai 2019, abgerufen am 24. Mai 2019.
- Sicherheitsdatenblatt Krypton (PDF; 73 kB), Air Liquide, abgerufen am 21. Juli 2019.
- Walter J. Moore, Dieter O. Hummel: Physikalische Chemie. 4. Auflage. de Gruyter, 1986, ISBN 3-11-010979-4, S. 284.
- Leonid Khriachtchev, Hanna Tanskanen, Arik Cohen, R. Benny Gerber, Jan Lundell, Mika Pettersson, Harri Kiljunen, Markku Räsänen: A Gate to Organokrypton Chemistry: HKrCCH. In: Journal of the American Chemical Society. 125, 23, 2003, S. 6876–6877, doi:10.1021/ja0355269.


