Atom
Atome (von altgriechisch ἄτομος átomos „unteilbar“) sind die Bausteine, aus denen alle festen, flüssigen oder gasförmigen Stoffe bestehen. Alle Materialeigenschaften dieser Stoffe sowie ihr Verhalten in chemischen Reaktionen werden durch die Eigenschaften und die räumliche Anordnung ihrer Atome festgelegt. Jedes Atom gehört zu einem bestimmten chemischen Element und bildet dessen kleinste Einheit. Zurzeit sind 118 Elemente bekannt, von denen etwa 90 auf der Erde natürlich vorkommen. Atome verschiedener Elemente unterscheiden sich in ihrer Größe und Masse und vor allem in ihrer Fähigkeit, mit anderen Atomen chemisch zu reagieren und sich zu Molekülen oder festen Körpern zu verbinden. Die Durchmesser von Atomen liegen im Bereich von 6 · 10−11 m (Helium) bis 5 · 10−10 m (Cäsium), ihre Massen in einem Bereich von 1,7 · 10−27 kg (Wasserstoff) bis knapp 5 ·10−25 kg (die derzeit schwersten synthetisch hergestellten Kerne).


Atome sind nicht unteilbar, wie zum Zeitpunkt der Namensgebung angenommen, sondern zeigen einen wohlbestimmten Aufbau aus noch kleineren Teilchen. Sie bestehen aus einem Atomkern und einer Atomhülle. Der Atomkern hat einen Durchmesser von etwa einem Zehn- bis Hunderttausendstel des gesamten Atomdurchmessers, enthält jedoch über 99,9 Prozent der Atommasse. Er besteht aus positiv geladenen Protonen und einer Anzahl von etwa gleich schweren, elektrisch neutralen Neutronen. Diese Nukleonen sind durch die starke Wechselwirkung aneinander gebunden. Die Hülle besteht aus negativ geladenen Elektronen. Sie trägt mit weniger als 0,06 Prozent zur Masse bei, bestimmt jedoch die Größe des Atoms. Der positive Kern und die negative Hülle sind durch elektrostatische Anziehung aneinander gebunden. In der elektrisch neutralen Grundform des Atoms ist die Anzahl der Elektronen in der Hülle gleich der Anzahl der Protonen im Kern. Diese Zahl legt den genauen Aufbau der Hülle und damit auch das chemische Verhalten des Atoms fest und wird deshalb als chemische Ordnungszahl bezeichnet. Alle Atome desselben Elements haben die gleiche chemische Ordnungszahl. Sind zusätzliche Elektronen vorhanden oder fehlen welche, ist das Atom negativ bzw. positiv geladen und wird als Ion bezeichnet.
Die Vorstellung vom atomaren Aufbau der Materie existierte bereits in der Antike, war jedoch bis in die Neuzeit umstritten. Der endgültige Nachweis konnte erst Anfang des 20. Jahrhunderts erbracht werden und gilt als eine der bedeutendsten Entdeckungen in Physik und Chemie. Einzelne Atome sind selbst mit den stärksten Lichtmikroskopen nicht zu erkennen. Eine direkte Beobachtung einzelner Atome ist erst seit Mitte des 20. Jahrhunderts mit Feldionenmikroskopen möglich, seit einigen Jahren auch mit Rastertunnelmikroskopen und hochauflösenden Elektronenmikroskopen. Die Atomphysik, die neben dem Aufbau der Atome auch die Vorgänge in ihrem Inneren und ihre Wechselwirkungen mit anderen Atomen erforscht, hat entscheidend zur Entwicklung der modernen Physik und insbesondere der Quantenmechanik beigetragen.
Erforschungsgeschichte
Die Vorstellung vom atomaren Aufbau der Materie existierte bereits in der Antike, allerdings nur in Form von philosophischen Überlegungen. Noch Anfang des 20. Jahrhunderts war ihre Existenz umstritten. Aufgrund ihrer extrem geringen Größe sind einzelne Atome selbst mit den stärksten Lichtmikroskopen nicht zu erkennen. Der endgültige Nachweis ihrer Existenz gilt als eine der bedeutendsten Entdeckungen in Physik und Chemie. Einen entscheidenden Beitrag lieferte Albert Einstein 1905, indem er die bereits seit langem bekannte, im Mikroskop direkt sichtbare Brownsche Bewegung kleiner Körnchen quantitativ dadurch erklärte, dass sie von zufällig gehäuften Stößen von Atomen oder Molekülen aus der Umgebung herrührte. Erst seit wenigen Jahrzehnten erlauben Feldionenmikroskope und Rastertunnelmikroskope, seit einigen Jahren zudem auch Elektronenmikroskope, einzelne Atome direkt zu beobachten.
Philosophische Überlegungen
Das Konzept des Atomismus, nämlich dass Materie aus Grundeinheiten aufgebaut ist – „kleinsten Teilchen“, die nicht immer weiter in kleinere Stücke zerteilt werden können – existiert seit Jahrtausenden, genauso wie das Gegenkonzept, Materie sei ein beliebig teilbares Kontinuum. Doch diese Ideen beruhten zunächst ausschließlich auf philosophischen Überlegungen und nicht auf empirischer experimenteller Untersuchung. Dabei wurden den Atomen verschiedene Eigenschaften zugeschrieben, und zwar je nach Zeitalter, Kultur und philosophischer Schule sehr unterschiedliche.
Eine frühe Erwähnung des Atomkonzepts in der Philosophie ist aus Indien bekannt. Die Nyaya- und Vaisheshika-Schulen entwickelten ausgearbeitete Theorien, wie sich Atome zu komplexeren Gebilden zusammenschlössen (erst in Paaren, dann je drei Paare).[1]
In der griechischen Philosophie ist die Atomvorstellung erstmals im 5. Jahrhundert v. Chr. bei Leukipp überliefert. Sein Schüler Demokrit systematisierte sie und führte den Begriff átomos (ἄτομος) ein, was etwa „das Unzerschneidbare“ bedeutet, also ein nicht weiter zerteilbares Objekt. Diese Bezeichnung wurde Ende des 18. Jahrhunderts für die damals hypothetischen kleinsten Einheiten der chemischen Elemente der beginnenden modernen Chemie übernommen, denn mit chemischen Methoden lassen sich Atome in der Tat nicht „zerschneiden“.
Experimentell arbeitende Naturwissenschaftler machten sich Ende des 18. Jahrhunderts die Hypothese vom Atom zu eigen, weil diese Hypothese im Rahmen eines Teilchenmodells der Materie eine elegante Erklärung für neue Entdeckungen in der Chemie bot.[2] Doch wurde gleichzeitig die gegenteilige Vorstellung, Materie sei ein Kontinuum, von Philosophen und auch unter Naturwissenschaftlern noch bis ins 20. Jahrhundert hinein aufrechterhalten.[3]
Naturwissenschaftliche Erforschung
Im Rahmen der wissenschaftlichen Erforschung konnte die Existenz von Atomen bestätigt werden. Es wurden viele verschiedene Atommodelle entwickelt, um ihren Aufbau zu beschreiben. Insbesondere das Wasserstoffatom als das einfachste aller Atome war dabei wichtig. Einige der Modelle werden heute nicht mehr verwendet und sind nur von wissenschaftsgeschichtlichem Interesse. Andere gelten je nach Anwendungsbereich als noch heute brauchbare Näherung. In der Regel wird das einfachste Modell genommen, welches im gegebenen Zusammenhang noch ausreicht, um die auftretenden Fragen zu klären.
Viele der im Folgenden genannten Entdeckungen (sofern nach 1900) wurden mit dem Nobelpreis für Physik oder Chemie ausgezeichnet.
Bestätigung der Atomhypothese
Robert Boyle vertrat 1661 in seinem Werk The Sceptical Chymist die Meinung, die Materie sei aus diversen Kombinationen verschiedener corpuscules aufgebaut und nicht aus den vier Elementen der Alchemie: Wasser, Erde, Feuer, Luft.[4] Damit bereitete er die Überwindung der Alchemie durch den Element- und Atombegriff der modernen Chemie vor.
Daniel Bernoulli zeigte 1740, dass der gleichmäßige Druck von Gasen auf die Behälterwände, insbesondere das Gesetz von Boyle und Mariotte, sich durch zahllose Stöße kleinster Teilchen erklären lässt. Damit wurde seine Forschung zum Vorläufer der kinetischen Gastheorie und statistischen Mechanik.
Ab Ende des 18. Jahrhunderts wurde die Vorstellung von Atomen genutzt, um die wohlbestimmten Winkel an den Kanten und Ecken der Edelsteine auf die verschiedenen möglichen Schichtungen von harten Kugeln zurückzuführen.[5]
Nachdem Antoine Lavoisier 1789 den heutigen Begriff des chemischen Elements geprägt und die ersten Elemente richtig identifiziert hatte,[6] benutzte 1803 John Dalton das Atomkonzept, um zu erklären, wieso Elemente immer in Mengenverhältnissen kleiner ganzer Zahlen miteinander reagieren (Gesetz der multiplen Proportionen). Er nahm an, dass jedes Element aus gleichartigen Atomen besteht, die sich nach festen Regeln miteinander verbinden können und so Stoffe mit anderen Materialeigenschaften bilden.[7][8] Außerdem ging er davon aus, dass alle Atome eines Elements die gleiche Masse hätten, und begründete damit den Begriff Atomgewicht.[9]
Die Beobachtungen zum chemischen und physikalischen Verhalten von Gasen konnte Amedeo Avogadro 1811 dahingehend zusammenfassen, dass zwei ideale Gase bei gleichen Werten von Volumen, Druck und Temperatur des Gases immer aus gleich vielen identischen Teilchen („Molekülen“) bestehen. Die Moleküle bestehen bei elementaren Gasen wie Wasserstoff, Sauerstoff oder Stickstoff immer aus zwei Atomen des Elements (Avogadrosches Gesetz).
1866 konnte Johann Loschmidt die Größe der Luftmoleküle bestimmen, indem er mit einer von James C. Maxwell aus der kinetischen Gastheorie gewonnenen Formel die von George Stokes gemessenen Werte für die innere Reibung in Luft auswertete.[10] Damit konnte er das Gewicht eines Luftmoleküls bestimmen. Außerdem erhielt er die nach ihm benannte Loschmidtsche Zahl als Anzahl der Luftmoleküle pro Kubikzentimeter (unter Normalbedingungen).
Infolge der Arbeiten von Avogadro und Stanislao Cannizzaro wurde angenommen, dass Atome nicht als einzelne Teilchen auftreten, sondern nur als Bestandteile von Molekülen aus mindestens zwei Atomen. Doch 1876 gelang August Kundt und Emil Warburg der erste Nachweis eines einatomigen Gases. Sie bestimmten den Adiabatenexponenten von Quecksilber-Dampf bei hoher Temperatur und erhielten einen Wert, wie er nach der kinetischen Gastheorie nur für Teilchen in Gestalt echter Massepunkte auftreten kann. Ab 1895 kamen entsprechende Beobachtungen an den neu entdeckten Edelgasen hinzu.[3]
Nach Erscheinen seiner Dissertation über die Bestimmung von Moleküldimensionen[11] schlug Albert Einstein im selben Jahr 1905 ein Experiment vor, um die Hypothese von der Existenz der Atome anhand der Zitterbewegung kleiner Partikel in Wasser quantitativ zu prüfen. Nach seiner Theorie müssten die Partikel aufgrund der Unregelmäßigkeit der Stöße durch die Wassermoleküle kleine, aber immerhin unter dem Mikroskop sichtbare Bewegungen ausführen.[12][13][14] Es war Einstein dabei zunächst nicht bekannt, dass er damit die seit 1827 bekannte Brownsche Bewegung von Pollen quantitativ erklärt hatte, für deren Ursache schon 1863 Christian Wiener erstmals Molekularstöße angenommen hatte.[15] Nach Einsteins Formeln hängt die Stärke der Zitterbewegung von der Masse der stoßenden Moleküle ab, und auf dieser Grundlage bestimmte der französische Physiker Jean Perrin die Molekülmasse experimentell und fand ähnliche Ergebnisse wie Loschmidt.[16] Diese Arbeiten trugen entscheidend zur allgemeinen Anerkennung der bis dahin so genannten „Atomhypothese“ bei.
Teilbarkeit und Aufbau der Atome
Joseph John Thomson entdeckte 1897, dass die Kathodenstrahlen aus Teilchen bestimmter Ladung und Masse bestehen, und dass deren Masse kleiner als ein Tausendstel der Atommasse ist. Diese Teilchen wurden als Elektronen bezeichnet und erwiesen sich als ein Bestandteil aller Materie, was dem Konzept des Atoms als unzerteilbarer Einheit widersprach.[17] Thomson glaubte, dass die Elektronen dem Atom seine Masse verliehen und dass sie im Atom in einem masselosen, positiv geladenen Medium verteilt seien wie „Rosinen in einem Kuchen“ (Thomsonsches Atommodell).
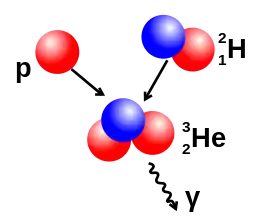
Die kurz zuvor von Henri Becquerel entdeckte Radioaktivität wurde von Marie Curie als eine Strahlung direkt aus den einzelnen Atomen angesehen und 1903 von Ernest Rutherford und Frederick Soddy mit Umwandlungen verschiedener Atomsorten ineinander in Verbindung gebracht. Rutherford und Soddy konnten 1908 nachweisen, dass aus den α-Teilchen, die die Alphastrahlung bilden, Helium-Atome werden.
Zusammen mit seiner Forschergruppe beschoss Ernest Rutherford 1909 eine Goldfolie mit α-Teilchen. Er stellte fest, dass die meisten der Teilchen die Folie fast ungehindert durchdrangen, einige wenige aber um sehr viel größere Winkel abgelenkt wurden, als nach Thomsons Modell möglich wäre. Rutherford schloss daraus, dass fast die ganze Masse des Atoms in einem sehr viel kleineren, elektrisch geladenen Volumen in der Mitte des Atoms konzentriert sei und schuf damit das seitdem gültige Rutherfordsche Atommodell mit dem grundlegenden Aufbau des Atoms aus Atomkern und Atomhülle. Die stark abgelenkten α-Teilchen waren diejenigen, die einem Kern zufällig näher als etwa ein Hundertstel des Atomradius gekommen waren.[18] Die Ladungszahl des Atomkerns entpuppte sich als die chemische Ordnungszahl des betreffenden Elements, und α-Teilchen erwiesen sich als die Atomkerne des Heliums.
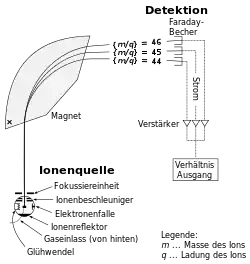
Der Chemiker Frederick Soddy stellte 1911 fest, dass manche der natürlichen radioaktiven Elemente aus Atomen mit unterschiedlichen Massen und unterschiedlicher Radioaktivität bestehen mussten.[19] Der Begriff Isotop für physikalisch verschiedene Atome desselben chemischen Elements wurde 1913 von Margaret Todd vorgeschlagen.[20] Da die Isotope desselben Elements an ihrem chemischen Verhalten nicht zu unterscheiden waren, entwickelte der Physiker J.J. Thomson ein erstes Massenspektrometer zu ihrer physikalischen Trennung. Damit konnte er 1913 am Beispiel von Neon nachweisen, dass es auch stabile Elemente mit mehreren Isotopen gibt.[21]
1918 fand Francis William Aston mit einem Massenspektrometer von erheblich größerer Genauigkeit heraus, dass fast alle Elemente Gemische aus mehreren Isotopen sind, wobei die Massen der einzelnen Isotope immer (nahezu) ganzzahlige Vielfache der Masse des Wasserstoffatoms sind.[22] Rutherford wies 1919 in der ersten beobachteten Kernreaktion nach, dass durch Beschuss mit α-Teilchen aus den Kernen von Stickstoffatomen die Kerne von Wasserstoffatomen herausgeschossen werden können. Diesen gab er den Namen Proton und entwickelte ein Atommodell, in dem die Atome nur aus Protonen und Elektronen bestehen, wobei die Protonen und ein Teil der Elektronen den kleinen, schweren Atomkern bilden, die übrigen Elektronen die große, leichte Atomhülle. Die Vorstellung von Elektronen im Atomkern stellte sich jedoch als problematisch heraus und wurde 1932 endgültig fallengelassen, nachdem von James Chadwick das Neutron als ein neutraler Kernbaustein mit etwa gleicher Masse wie das Proton nachgewiesen wurde.[23] Damit entstand das heutige Atommodell: Der Atomkern ist zusammengesetzt aus so vielen Protonen wie die Ordnungszahl angibt, und zusätzlich so vielen Neutronen, dass die betreffende Isotopenmasse erreicht wird; die Atomhülle besteht aus so vielen Elektronen, dass das ganze Atom neutral wird.
Aufbau der Atomhülle

Die beobachteten Eigenschaften (wie Größe, Stabilität, Reaktionsweisen) der Atomhülle konnten im Rahmen der klassischen Physik keine Erklärung finden. Erst unter Einbeziehung von neuartigen Quantisierungsregeln mithilfe des Planckschen Wirkungsquantums konnte Niels Bohr 1913 erklären, wie es in den optischen Spektren reiner Elemente zu den Spektrallinien kommt, die für das jeweilige Element absolut charakteristisch sind (Spektralanalyse nach Robert Wilhelm Bunsen und Gustav Robert Kirchhoff 1859). Im Franck-Hertz-Versuch konnte die quantisierte Energieaufnahme und -abgabe an Quecksilberatomen experimentell bestätigt werden. Das Bohrsche Atommodell war zwar nur für Systeme mit lediglich einem Elektron (damals nur Wasserstoff und ionisiertes Helium) gültig, bildete jedoch im Laufe des folgenden Jahrzehnts das Fundament für eine Reihe von Verfeinerungen. Sie führten im Schalenmodell zu einem ersten Verständnis des Aufbaus der Elektronenhüllen aller Elemente und damit auch zum physikalischen Verständnis des chemischen Periodensystems. Damit wurde das Bohrsche Atommodell zur Grundlage des populären Bildes vom Atom als einem kleinen Planetensystem.[24]
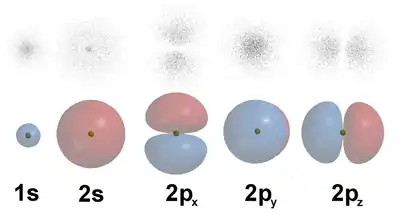
1925 entwickelte Werner Heisenberg zusammen mit Max Born, Pascual Jordan, Wolfgang Pauli u. a. die Matrizenmechanik. 1926 ersetzte Erwin Schrödinger die Quantisierungsregeln durch seine Wellenmechanik. Sie beschreibt die Elektronen nicht als Massenpunkte auf bestimmten ebenen Bahnen, sondern als in drei Dimensionen ausgedehnte stehende Materiewelle. Beide Formen einer neuen "Quantenmechanik" konnten das Spektrum des Wasserstoffatoms richtig erklären. Als Folge dieser Beschreibungen ist es unter anderem unzulässig, einem Elektron gleichzeitig genaue Werte für Ort und Impuls zuzuschreiben. Dieser Sachverhalt wurde 1927 von Heisenberg in der Unschärferelation formuliert. Demnach können statt der Bewegung auf bestimmten Bahnen nur Wahrscheinlichkeitsverteilungen für Wertebereiche von Ort und Impuls angegeben werden, eine Vorstellung, die nur schwer zu veranschaulichen ist. Den quantisierten Umlaufbahnen des Bohrschen Modells entsprechen hier „Atomorbitale“. Sie geben unter anderem an, wie sich in der Nähe des Atomkerns die Aufenthaltswahrscheinlichkeit der Elektronen konzentriert, und bestimmen damit die wirkliche Größe des Atoms.
Die Beschreibung der Eigenschaften der Atome gelang mit diesen ersten vollständig quantenmechanischen Atommodellen sehr viel besser als mit den Vorläufermodellen. Insbesondere ließen sich auch bei Atomen mit mehreren Elektronen die Spektrallinien und die Struktur der Atomhülle in räumlicher und energetischer Hinsicht darstellen, einschließlich der genauen Möglichkeiten, mit den Atomhüllen anderer Atome gebundene Zustände zu bilden, also stabile Moleküle. Daher wurde das Bohrsche Atommodell zugunsten des quantenmechanischen Orbitalmodells des Atoms verworfen.[25][26]
Das Orbitalmodell ist bis heute Grundlage und Ausgangspunkt genauer quantenmechanischer Berechnungen fast aller Eigenschaften der Atome. Das Orbitalmodell bei einem Atom mit mehr als einem Elektron ist physikalisch als eine Näherung zu bezeichnen, nämlich als eine Ein-Teilchen-Näherung, die jedem einzelnen Elektron ein bestimmtes Orbital zuschreibt. Ein so gebildeter Zustand wird als Konfiguration des Atoms bezeichnet und gehört in der Quantenmechanik zu der einfachsten Art von Mehrteilchenzuständen. Genauere Modelle berücksichtigen, dass nach den Regeln der Quantenmechanik die Hülle auch in einem Zustand sein kann, der durch Superposition verschiedener Konfigurationen entsteht, wo also mit verschiedenen Wahrscheinlichkeitsamplituden gleichzeitig verschiedene Elektronenkonfigurationen vorliegen (Konfigurationsmischung). Hiermit werden die genauesten Berechnungen von Energieniveaus und Wechselwirkungen der Atome möglich. Wegen des dazu nötigen mathematischen Aufwands werden jedoch, wo es möglich ist, auch weiterhin einfachere Atommodelle genutzt. Zu nennen ist hier neben dem Schalenmodell unter anderen das Thomas-Fermi-Modell, in dem die Elektronenhülle pauschal wie ein im Potentialtopf gebundenes ideales Elektronengas („Fermigas“) behandelt wird, dessen Dichte wiederum zusammen mit der Kernladung die Form des elektrostatischen Potentialtopfs bestimmt.
Aufbau des Atomkerns
Zur Entdeckung des Atomkerns und seiner Zusammensetzung aus Protonen und Neutronen siehe den Abschnitt "Teilbarkeit und Aufbau der Atome" oben. Hier folgen Stichworte zur Erforschung weiterer Eigenschaften der Kerne.
Bindungsenergie
Die Bindungsenergie der Nukleonen ist Ursache der hohen Energie der Quanten der radioaktiven Strahlung. Sie übersteigt die chemische Bindungsenergie von Molekülen um fünf bis sechs Größenordnungen. Ab 1935 war hierbei erstmals eine grobe Modellvorstellung erfolgreich, das Tröpfchenmodell von C.F. von Weizsäcker und Hans Bethe. Damit wurde für Kerne ab etwa 10 Nukleonen die anfängliche Zunahme der mittleren Bindungsenergie bis etwa durch die wachsende Anzahl erklärt, in der die Nukleonen sich aufgrund der eigentlichen Kernkräfte mit ihren jeweiligen Nachbarn binden, und danach die Abnahme der mittleren Bindungsenergie aufgrund der zunehmenden elektrostatischen Abstoßung, die alle Protonen untereinander betrifft.
Kernfusion und Kernspaltung
Da das Maximum der mittleren Bindungsenergie bei mittelschweren Kernen liegt, bedeutet es Energiefreisetzung sowohl, wenn sehr leichte Kerne fusionieren, als auch wenn sehr schwere Kerne spalten. Die Fusion von Wasserstoff zu Helium wurde 1938 als Energiequelle der Sterne identifiziert. Die Spaltung nach Neutroneneinfang wurde erstmals 1938 an Urankernen (des Isotops U-235) durch Otto Hahn und Fritz Strassmann nachgewiesen. Danach wurde die Kernforschung erheblich intensiviert und führte 1945 zu den ersten Atombomben, 1952 den Wasserstoffbomben und ab Mitte der 1950er Jahre zur Nutzung der Atomenergie zur Energieversorgung.
Schalenmodell und vereinheitlichtes Modell
Sehr viel detaillierter als das Tröpfchenmodell ist das 1949 von J.H.D. Jensen und Maria Goeppert-Mayer aufgestellte Schalenmodell der Kerne. Ähnlich wie das Schalenmodell der Atome nimmt es für je ein Nukleon ein bestimmtes Orbital in einem gemeinsamen kugelsymmetrischen Potentialtopf an. Damit kann eine Fülle von Daten über die Grundzustände und angeregten Zustände der Kerne erklärt werden, zum Beispiel ihr Kernspin, ihr magnetisches Dipol- und elektrisches Quadrupolmoment, sowie über ihre Zerfalls- und Reaktionsweisen. Aage Bohr, Ben Mottelson und James Rainwater gelang es Anfang der 1960er Jahre, dies Einzelteilchenmodell mit den Aspekten kollektiver Bewegung zu verbinden, womit auch die Abweichungen von der Kugelgestalt in bestimmten Bereichen der Nukleonenzahlen verständlich wurden.
Ursprung der Kernkräfte
Die kurzreichweitigen Kernkräfte konnten in den 1970er Jahren auf die Starke Wechselwirkung zwischen Quarks zurückgeführt werden.[27][28]
Aufbau von Proton und Neutron
Ab den 1950er Jahren konnten Atome und vor allem die Atomkerne durch die Entwicklung verbesserter Teilchenbeschleuniger und Teilchendetektoren beim Beschuss mit Teilchen sehr hoher Energie untersucht werden.[29] Ende der 1960er Jahre zeigte sich in der „tiefinelastischen Streuung“ von Elektronen an Atomkernen, dass auch Neutronen und Protonen keine unteilbaren Einheiten sind, sondern aus Quarks zusammengesetzt sind.[30]
Einige fortgeschrittene Experimente mit Atomen
1951 entwickelte Erwin Müller das Feldionenmikroskop und konnte damit von einer Nadelspitze erstmals ein Abbild erzeugen, das auf direkte Weise so stark vergrößert war, dass einzelne Atome darin sichtbar wurden (wenn auch nur als verschwommene Flecken). 1953 entwickelte Wolfgang Paul die magnetische Ionenfalle (Paulfalle), in der einzelne Ionen gespeichert und mit immer höherer Genauigkeit untersucht werden können.
1985 entwickelte eine Arbeitsgruppe um Steven Chu die Laserkühlung, ein Verfahren, die Temperatur einer Ansammlung von Atomen mittels Laserstrahlung stark zu verringern. Im selben Jahr gelang es einer Gruppe um William D. Phillips, neutrale Natriumatome in einer magneto-optischen Falle einzuschließen. Durch Kombination dieser Verfahren mit einer Methode, die den Dopplereffekt nutzt, gelang es einer Arbeitsgruppe um Claude Cohen-Tannoudji, geringe Mengen von Atomen auf Temperaturen von einigen Mikrokelvin zu kühlen. Mit diesem Verfahren können Atome mit höchster Genauigkeit untersucht[31] werden; außerdem ermöglichte es auch die experimentelle Realisierung der Bose-Einstein-Kondensation.[32]
Anfang der 1980er Jahre wurde von Gerd Binnig und Heinrich Rohrer das Rastertunnelmikroskop entwickelt, in dem eine Nadelspitze eine Oberfläche mittels des Tunneleffekts so fein abtastet, dass einzelne Atome sichtbar werden.[33][34] Damit wurde es auch möglich, Atome einzeln an bestimmte Plätze zu setzen. In den 1990er Jahren konnten Serge Haroche und David Wineland in Experimenten die Wechselwirkung eines einzelnen Atoms mit einem einzelnen Photon erfolgreich untersuchen. In den 2000er Jahren wurde die Handhabbarkeit einzelner Atome unter anderem genutzt, um einen Transistor aus nur einem Metallatom mit organischen Liganden herzustellen.[35]
Seit Ende der 1980er Jahre werden durch Vielfachanregung mit einem Laserimpuls Rydberg-Atome erzeugt. In einem Rydberg-Atom ist ein Elektron in einem so hohen Energiezustand angeregt, dass es den Atomkern, teilweise auch den gesamten Atomrumpf, bestehend aus dem Atomkern und den restlichen Elektronen, in weitem Abstand umkreist und sein Verhalten sich damit dem eines klassischen Teilchens nähert. Rydberg-Atome können über 100.000-mal größer sein als nicht angeregte Atome. Da sie extrem empfindlich auf äußere Felder reagieren, kann man mit ihnen z. B. die Wechselwirkung eines einzelnen Atoms mit einem einzelnen Photon im Detail untersuchen. Sind zwei oder mehr Elektronen in solchen Zuständen angeregt, spricht man von planetarischen Atomen.
Klassifizierung
Elemente, Isotope, Nuklide
Die Unterscheidung und Bezeichnung verschiedener Atomsorten geht zunächst vom Aufbau des Atomkerns aus, während der Zustand der Hülle gegebenenfalls durch zusätzliche Symbole angegeben wird. Kennzahlen sind die Protonenzahl (Ordnungszahl, Kernladungszahl) Z, die Neutronenzahl N des Kerns, und die daraus gebildete Massenzahl A=Z+N. Je nach ihrer Protonenzahl gehören die Atome zu einem der 118 bekannten chemischen Elemente, von Wasserstoff mit Z=1 bis Oganesson mit Z=118. Davon sind 91 in natürlichen Vorkommen entdeckt worden, 27 nur nach künstlicher Herstellung durch Kernreaktionen. Die Ordnung der Elemente wird im Periodensystem – wichtig für die Chemie – graphisch veranschaulicht. Darin werden die Elemente mit aufsteigender Ordnungszahl in Form einer Tabelle angeordnet. Jede Zeile wird als Periode des Periodensystems bezeichnet und endet, wenn das jeweilige Orbital mit Elektronen voll besetzt ist (Edelgas). In den nächsten Zeilen wiederholt sich aufgrund der schrittweisen Elektronenbesetzung der nächsten Orbitale der chemische Charakter der Elemente. So stehen Elemente mit ähnlichen chemischen Eigenschaften in einer Spalte untereinander; sie bilden eine Gruppe des Periodensystems.
Atome eines Elements, die sich in der Neutronenzahl unterscheiden, gehören zu verschiedenen Isotopen des Elements. Insgesamt bestehen die 118 Elemente aus etwa 2800 Isotopen, wovon 2500 künstlich erzeugt wurden. Isotope werden – bis auf die Ausnahmen der Wasserstoffisotope Deuterium und Tritium – nach dem chemischen Element und der Massenzahl bezeichnet. Das Symbol für ein bestimmtes Isotop des Elements hat die Form , oder X-A (Beispiele: , , Pb-208). Die Angabe der Protonenzahl Z ist redundant, da sie schon durch die Ordnungszahl des Elements gegeben ist.
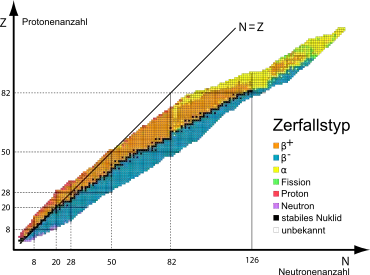
Nuklid ist die ganz allgemeine Bezeichnung für Atomarten, unabhängig davon, ob sie zum gleichen Element gehören oder nicht. Die Nuklidkarte oder Isotopenkarte – wichtig für die Kernphysik und ihre Anwendungen – ist eine Tabelle, in der jede Atomart einen eigenen Platz erhält. Dazu wird auf einer Achse die Anzahl der Protonen, auf der anderen die der Neutronen aufgetragen. Häufig wird die Stabilität und bei instabilen Nukliden auch die Art der Umwandlung oder die Größenordnung der Halbwertszeit durch bestimmte Farben und gegebenenfalls auch Teilung des dem Isotop zugewiesenen Platzes dargestellt.
Stabile und instabile (radioaktive) Atome
Der Atomkern eines Nuklids kann entweder im energetischen Grundzustand oder in einem der verschiedenen Anregungszustände vorliegen. Wenn darunter relativ langlebige, sogenannte metastabile Zustände sind, werden diese als Isomere bezeichnet und als eigene Nuklide gezählt (Symbol , o. ä.). Nach dieser Definition sind mit dem Stand von 2003 insgesamt etwa 3200 Nuklide bekannt.[36]
In der Kernphysik werden Nuklide mit unterschiedlichen Protonenzahlen, aber gleicher Massenzahl als Isobare bezeichnet. Seltener werden unter dem Namen Isotone Nuklide mit verschiedenen Protonenzahlen, aber gleicher Neutronenzahl zusammengefasst.
Nur etwa 250 Isotope von 80 Elementen haben einen stabilen Kern. Alle anderen Atome sind instabil und wandeln sich über kurz oder lang in Atome eines stabilen Isotops um. Da sie dabei im Allgemeinen ionisierende Strahlung aussenden, heißen sie auch Radioisotope oder Radionuklide. Auf der Erde wurden in den natürlichen Vorkommen neben allen 250 stabilen Isotopen 30 Radioisotope gefunden, die sich auf 10 radioaktive Elemente verteilen und die natürliche Radioaktivität verursachen.[37] Viele weitere kurzlebige Isotope existieren im Inneren von Sternen, insbesondere während der Supernova-Phase.
Seltene und theoretische Formen
Als Rydberg-Atom wird ein Atom bezeichnet, in dem ein Elektron in einem so hohen Energiezustand angeregt ist, dass es den Atomkern, teilweise auch den gesamten Atomrumpf, bestehend aus dem Atomkern und den restlichen Elektronen, in weitem Abstand umkreist und sein Verhalten damit dem eines klassischen Teilchens ähnelt. Rydberg-Atome können über 100.000-mal größer sein als nicht angeregte Atome. Da sie extrem empfindlich auf äußere Felder reagieren, kann man mit ihnen z. B. die Wechselwirkung mit einem einzelnen Photon im Detail untersuchen. Sind zwei oder mehr Elektronen in solchen Zuständen angeregt, spricht man von planetarischen Atomen.
Im teils übertragenen Sinn werden als exotische Atome auch solche Systeme bezeichnet, die in physikalischer Hinsicht gewisse Ähnlichkeiten zu den gewöhnlichen Atomen aufweisen. In ihnen kann z. B. eines der Protonen, Neutronen oder Elektronen durch ein anderes Teilchen derselben Ladung ersetzt worden sein. Wird etwa ein Elektron durch ein schwereres Myon ersetzt, bildet sich ein myonisches Atom.[38][39][40] Als Positronium wird ein exotisches Atom bezeichnet, in dem ein Elektron statt an ein Proton an ein Positron, das ist das positiv geladene Antiteilchen des Elektrons, gebunden ist. Auch Atome, die gänzlich aus Antiteilchen zur normalen Materie aufgebaut sind, sind möglich. So wurden erstmals 1995 am Genfer CERN Antiwasserstoffatome künstlich hergestellt und nachgewiesen.[41] An solchen exotischen Atomen lassen sich unter anderem fundamentale physikalische Theorien über die Symmetrie zwischen Teilchen und Antiteilchen überprüfen.
Des Weiteren wird der Name Atom manchmal auch für Zwei-Teilchen-Systeme verwendet, die nicht durch elektromagnetische Wechselwirkung zusammengehalten werden, sondern durch die starke Wechselwirkung. Bei einem solchen Quarkonium handelt es sich um ein kurzlebiges Elementarteilchen vom Typ Meson, das aus einem Quark und einem Antiquark aufgebaut ist. Ein Quarkonium-Atom lässt sich in seinen verschiedenen metastabilen Zuständen so durch Quantenzahlen klassifizieren wie das Wasserstoffatom.
Entstehung
Etwa eine Sekunde nach dem Urknall kamen wegen sinkender Temperatur die ständigen Umwandlungen zwischen den Elementarteilchen zur Ruhe, übrig blieben Elektronen, Protonen und Neutronen. In den darauf folgenden drei Minuten verbanden sich in der primordialen Nukleosynthese die vorhandenen Neutronen mit Protonen zu den einfachsten Kernen: Deuterium, Helium, in geringerem Umfang auch Lithium und möglicherweise in noch kleineren Mengen Beryllium und Bor. Die übrigen Protonen (86 Prozent) blieben erhalten.[42] Die ersten neutralen Atome mit dauerhaft gebundenen Elektronen wurden erst 380.000 Jahre nach dem Urknall in der Rekombinationsphase gebildet, als das Universum durch Expansion so weit abgekühlt war, dass die Atome nicht sogleich wieder ionisiert wurden.[43]
Die Kerne aller schwereren Atome wurden und werden durch verschiedene Prozesse der Kernfusion erzeugt. Am wichtigsten ist die stellare Nukleosynthese, durch die in Sternen zunächst Helium, anschließend auch die schwereren Elemente bis zum Eisen gebildet werden. Elemente mit höheren Kernladungszahlen als Eisen entstehen in explosionsartigen Vorgängen wie im r-Prozess in Supernovae und im s-Prozess in AGB-Sternen, die kurz vor dem Ende ihrer Lebensdauer sind.
Kleine Mengen verschiedener Elemente und Isotope werden auch dadurch gebildet, dass schwere Kerne wieder geteilt werden. Das geschieht durch radioaktive Zerfälle (siehe Zerfallsreihe), die u. a. für einen Teil des Vorkommens von Helium und Blei verantwortlich sind, und Spallationen, die für die Entstehung von Lithium, Beryllium und Bor wichtig sind.[44]
Vorkommen und Verteilung
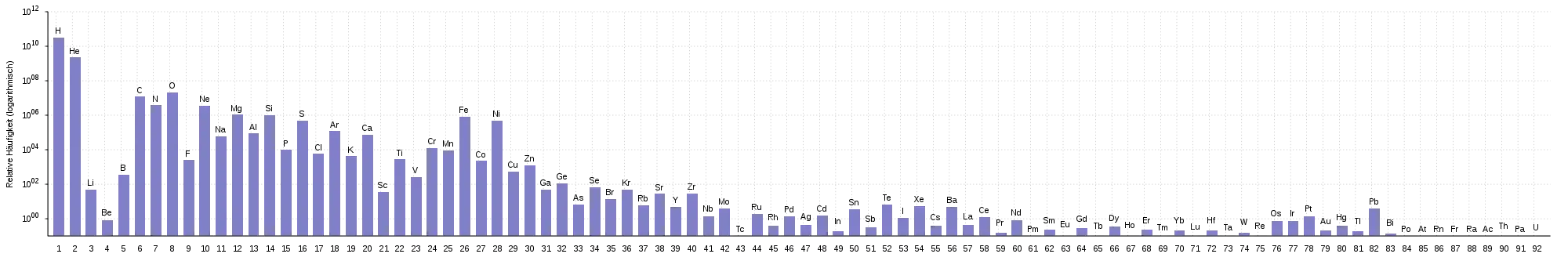
Im beobachtbaren Universum liegen die Atome mit einer mittleren Dichte von 0,25 Atome/m³ vor. Nach dem Urknallmodell (Lambda-CDM-Modell) bilden sie etwa 4,9 Prozent der gesamten Energiedichte. Die übrigen 95,1 Prozent, deren Natur noch weitgehend unklar ist, setzen sich aus etwa 27 Prozent dunkler Materie und 68 Prozent dunkler Energie zusammen,[45] sowie kleinen Beiträgen von Neutrinos und elektromagnetischer Strahlung.[46] Im Inneren einer Galaxie wie etwa der Milchstraße ist im interstellaren Medium (ISM) die Dichte der Atome wesentlich höher und liegt zwischen 104 und 1011 Atome/m3.[47] Die Sonne befindet sich in der weitgehend staubfreien lokalen Blase, daher ist die Dichte in der Umgebung des Sonnensystems nur etwa 103 Atome/m3.[48] In festen Himmelskörpern wie der Erde beträgt die Atomdichte etwa 1029 Atome/m3.
In der Verteilung der Elemente dominiert im Universum Wasserstoff mit rund drei Viertel der Masse, danach folgt Helium mit etwa einem Viertel. Alle schwereren Elemente sind viel seltener und machen nur einen kleinen Teil der im Universum vorhandenen Atome aus. Ihre Häufigkeiten werden von den verschiedenen Mechanismen der Nukleosynthese bestimmt.[49]
Im Sonnensystem sind Wasserstoff und Helium vorwiegend in der Sonne und den Gasplaneten enthalten. Dagegen überwiegen auf der Erde die schweren Elemente. Die häufigsten Elemente sind hier Sauerstoff, Eisen, Silicium und Magnesium. Der Erdkern besteht vorwiegend aus Eisen, während in der Erdkruste Sauerstoff und Silicium vorherrschen.
Bestandteile des Atoms
Die beiden Hauptbestandteile eines Atoms sind der Atomkern und die Atomhülle. Die Hülle besteht aus Elektronen. Sie trägt mit weniger als 0,06 Prozent zur Masse des Atoms bei, bestimmt aber dessen Größe und dessen Verhalten gegenüber anderen Atomen, wenn sie einander nahekommen. Der Kern besteht aus Protonen und Neutronen, ist im Durchmesser zehn- bis hunderttausendmal kleiner als die Hülle, enthält aber mehr als 99,9 Prozent der Masse des Atoms.
Atomkern
Aufbau
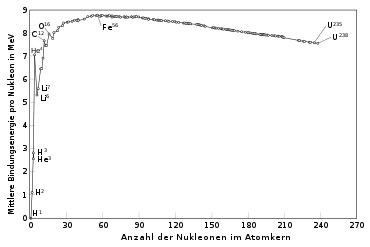
Die in einem Atom vorhandenen Protonen und Neutronen, zusammen auch als Nukleonen bezeichnet, sind aneinander gebundenen und bilden den Atomkern. Die Nukleonen zählen zu den Hadronen. Das Proton ist positiv geladen, das Neutron ist elektrisch neutral. Proton und Neutron haben einen Durchmesser von etwa 1,6 fm (Femtometer) und sind selber keine Elementarteilchen, sondern nach dem Standardmodell der Elementarteilchenphysik aus den punktförmigen Quarks aufgebaut. Jeweils drei Quarks binden sich durch die starke Wechselwirkung, die durch Gluonen vermittelt wird, zu einem Nukleon. Die starke Wechselwirkung ist darüber hinaus für den Zusammenhalt der Nukleonen im Atomkern verantwortlich, insbesondere ist die Anziehung bis zu etwa 2,5 fm Abstand deutlich stärker als die gegenseitige elektrische Abstoßung der Protonen.[50] Unterhalb von etwa 1,6 fm wird die starke Wechselwirkung der Hadronen jedoch stark abstoßend. Anschaulich gesprochen verhalten sich die Nukleonen im Kern also etwa wie harte Kugeln, die aneinander haften. Daher steigt das Volumen des Kerns proportional zur Nukleonenzahl (Massenzahl) . Sein Radius beträgt etwa fm.
Der leichteste Atomkern besteht aus nur einem Proton. Mehrere Protonen stoßen sich zwar gemäß der Elektrostatik ab, können zusammen mit einer geeigneten Anzahl von Neutronen aber ein stabiles System bilden. Doch schon bei kleinen Abweichungen von dem energetisch günstigsten Zahlenverhältnis ist der Kern instabil und wandelt sich spontan um, indem aus einem Neutron ein Proton wird oder umgekehrt und die frei werdende Energie und Ladung als Betastrahlung abgegeben wird. Kerne mit bis zu etwa 20 Protonen sind nur bei einem Verhältnis von nahezu 1:1 von Neutronenzahl und Protonenzahl stabil. Darüber steigt in den stabilen Atomkernen das Verhältnis von 1:1 bis auf etwa 1,5:1, weil bei größeren Protonenzahlen wegen ihrer elektrostatischen Abstoßung die Anzahl der Neutronen schneller anwachsen muss als die der Protonen (Details siehe Tröpfchenmodell). Die Bindungsenergie liegt in stabilen Kernen (abgesehen von den leichtesten) oberhalb von 7 MeV pro Nukleon (siehe Abbildung) und übertrifft damit die Bindungsenergie der äußeren Elektronen der Atomhülle oder die chemische Bindungsenergie in stabilen Molekülen um das ca. 106-fache. Kerne mit bestimmten Nukleonenzahlen, die als Magische Zahl bezeichnet werden, beispielsweise Helium-4, Sauerstoff-16 oder Blei-208, sind besonders stabil, was mit dem Schalenmodell des Atomkerns erklärt werden kann.
Oberhalb einer Zahl von 82 Protonen (also jenseits von Blei) sind alle Kerne instabil. Sie wandeln sich durch Ausstoßen eines Kerns He-4 in leichtere Kerne um (Alphastrahlung). Dies wiederholt sich, zusammen mit Betastrahlung, so lange, bis ein stabiler Kern erreicht ist; mehrere Zerfallsstufen bilden eine Zerfallsreihe. Auch zu den Protonenzahlen 43 (Technetium) und 61 (Promethium) existiert kein stabiler Kern. Daher kann es insgesamt nur 80 verschiedene stabile chemische Elemente geben, alle weiteren sind radioaktiv. Sie kommen auf der Erde nur dann natürlich vor, wenn sie selber oder eine ihrer Muttersubstanzen eine genügend lange Halbwertzeit haben.
Masse
Da der Großteil der Atommasse von den Neutronen und Protonen stammt und diese etwa gleich schwer sind, wird die Gesamtzahl dieser Teilchen in einem Atom als Massenzahl bezeichnet. Die genaue Masse eines Atoms wird oft in der atomaren Masseneinheit u angegeben; ihr Zahlenwert ist dann etwa gleich der Massenzahl. Kleinere Abweichungen entstehen durch den Massendefekt der Atomkerne. Die atomare Masseneinheit ergibt sich aus der Definition der SI-Einheit des Mols in der Art und Weise, dass ein Atom des Kohlenstoffisotops 12C (im Grundzustand inklusive seiner Hüllenelektronen) eine Masse von exakt 12 u besitzt. Damit beträgt 1 u gleich 1,66053904 · 10−27 kg.[51] Ein Atom des leichtesten Wasserstoffisotops hat eine Masse von 1,007825 u. Das schwerste stabile Nuklid ist das Bleiisotop 208Pb mit einer Masse von 207,9766521 u.[52]
Da makroskopische Stoffmengen so viele Atome enthalten, dass die Angabe ihrer Anzahl als natürliche Zahl unhandlich wäre, erhielt die Stoffmenge eine eigene Einheit, das Mol. Ein Mol sind etwa 6,022 · 1023 Atome (oder auch Moleküle oder andere Teilchen; die betrachtete Teilchenart muss immer mitgenannt werden). Die Masse von 1 Mol Atomen der Atommasse X u ist daher exakt X g.[51] Daher ist es in der Chemie üblich, Atommassen statt in u auch indirekt in g/mol anzugeben.
Bildung und Zerfall
In welcher Art ein instabiler Atomkern zerfällt, ist für das jeweilige Radionuklid typisch. Bei manchen Nukliden können die (untereinander völlig gleichen) Kerne auch auf verschiedene Arten zerfallen, so dass mehrere Zerfallskanäle mit bestimmten Anteilen beteiligt sind. Die wichtigsten radioaktiven Zerfälle sind
- Alpha-Zerfall, bei dem sich aus zwei Protonen und zwei Neutronen des Kerns durch die starke Wechselwirkung ein Helium-Atomkern bildet, der ausgestoßen wird,
- Beta-Zerfall, bei dem mittels der schwachen Wechselwirkung ein Neutron des Kerns in ein Proton oder umgekehrt umgewandelt wird und ein Elektron und ein Antineutrino beziehungsweise ein Positron und ein Neutrino erzeugt und ausgesendet werden,
- Gamma-Zerfall, bei dem ein angeregter Kern durch elektromagnetische Wechselwirkung Gammastrahlung erzeugt und in ein niedrigeres Energieniveau gelangt, bei gleichbleibender Protonen- und Neutronenzahl.
Die Energien der Strahlungen sind für das jeweilige Nuklid charakteristisch, ebenso wie die Halbwertszeit, die angibt, wie lange es dauert, bis die Hälfte einer Probe des Nuklids zerfallen ist.
Durch Anlagerung eines Neutrons kann sich ein Kern in das nächstschwerere Isotop desselben Elements verwandeln. Durch den Beschuss mit Neutronen oder anderen Atomkernen kann ein großer Atomkern in mehrere kleinere Kerne gespalten werden. Einige schwere Nuklide können sich auch ohne äußere Einwirkung spontan spalten.
Größere Atomkerne können aus kleineren Kernen gebildet werden. Dieser Vorgang wird Kernfusion genannt. Für eine Fusion müssen sich Atomkerne sehr nahekommen. Diesem Annähern steht die elektrostatische Abstoßung beider Kerne, der sogenannte Coulombwall, entgegen. Aus diesem Grund ist eine Kernfusion (außer in bestimmten Experimenten) nur unter sehr hohen Temperaturen von mehreren Millionen Grad und hohen Drücken, wie sie im Inneren von Sternen herrschen, möglich. Die Kernfusion ist bei Nukliden bis zum Nickel-62 eine exotherme Reaktion, so dass sie im Großen selbsterhaltend ablaufen kann. Sie ist die Energiequelle der Sterne. Bei Atomkernen jenseits des Nickels nimmt die Bindungsenergie pro Nukleon ab; die Fusion schwererer Atomkerne ist daher endotherm und damit kein selbsterhaltender Prozess. Die Kernfusion in Sternen kommt daher zum Erliegen, wenn die leichten Atomkerne aufgebraucht sind.[53]
Atomhülle
Aufbau und Bindungsenergie
Die Atomhülle besteht aus Elektronen, die aufgrund ihrer negativen Ladung an den positiven Atomkern gebunden sind. Sie wird oft auch als Elektronenhülle bezeichnet. Bei einem neutralen Atom mit Elektronen beträgt die durchschnittliche Bindungsenergie je Elektron etwa .[54] Sie nimmt daher mit steigender Teilchenzahl erheblich zu, im Gegensatz zur durchschnittlichen Bindungsenergie pro Nukleon im Kern, die ab der Massenzahl sogar abnimmt. Zur Erklärung wird angeführt, dass zwischen Nukleonen nur Bindungskräfte kurzer Reichweite wirken, die kaum über die benachbarten Teilchen hinausreichen, während die Hülle durch die elektrostatische Anziehungskraft gebunden ist, die vom -fach geladenen Kern aus alle Elektronen erfasst.
Abgesehen von der Masse, die zu über 99,95 Prozent im Atomkern konzentriert ist, ist die Atomhülle für praktisch alle äußeren Eigenschaften des Atoms verantwortlich. Der Begriff Atommodell bezieht sich daher im engeren Sinn meist nur auf die Hülle (siehe Liste der Atommodelle). Ein einfaches Atommodell ist das Schalenmodell, nach dem die Elektronen sich in bestimmten Schalen um den Kern anordnen, in denen jeweils für eine bestimmte Anzahl Elektronen Platz ist. Allerdings haben diese Schalen weder einen bestimmten Radius noch eine bestimmte Dicke, sondern überlappen und durchdringen einander teilweise. Besser getrennt sind sie auf der Skala der Bindungsenergie der Elektronen.
Interpretation grundlegender Atomeigenschaften im Rahmen des Schalenmodells
Die Atomhülle bestimmt die Stärke und Abstandsabhängigkeit der Kräfte zwischen zwei Atomen. Im Abstandsbereich mehrerer Atomdurchmesser polarisieren sich die gesamten Atomhüllen wechselseitig, sodass durch elektrostatische Anziehung anziehende Kräfte, die Van-der-Waals-Kräfte, entstehen. Sie bewirken vor allem die Kondensation der Gase zu Flüssigkeiten, also einen Wechsel der Aggregatzustände.
Die (näherungsweise) Inkompressibilität der Flüssigkeiten und Festkörper hingegen beruht darauf, dass alle Atome bei starker Annäherung einander stark abstoßen, sobald sich ihre Hüllen im Raum merklich überschneiden und daher verformen müssen. Außer im Fall zweier Wasserstoffatome, die jeweils nur ein Elektron in der Hülle haben, spielt die elektrostatische Abstoßung der beiden Atomkerne dabei nur eine geringe Rolle.
In einem mittleren Abstandsbereich zwischen dem Vorherrschen der schwach anziehenden Van-der-Waals-Kräfte und der starken Abstoßung kommt es zwischen zwei oder mehr zueinander passenden Atomhüllen zu einer besonders starken Anziehung, der chemischen Bindung. Bei Atomen bestimmter Elemente kann diese Anziehung zu einem stabilen Molekül führen, das aus Atomen in zahlenmäßig genau festgelegter Beteiligung und räumlicher Anordnung aufgebaut ist. Die Moleküle sind die kleinsten Stoffeinheiten der chemischen Verbindungen, also der homogenen Materialien in all ihrer Vielfalt. Vermittelt über die Hüllen ihrer Atome ziehen auch Moleküle einander an. Ein fester Körper entsteht, wenn viele Moleküle sich aneinander binden und dabei, weil es energetisch günstig ist, eine feste Anordnung einhalten. Ist diese Anordnung regelmäßig, bildet sich ein Kristallgitter. Infolge dieser Bindung ist der feste Körper nicht nur weitgehend inkompressibel wie eine Flüssigkeit, sondern im Unterschied zu dieser auch auf Zug belastbar und deutlich weniger leicht verformbar. Verbinden sich Atome metallischer Elemente miteinander, ist ihre Anzahl nicht festgelegt und es können sich nach Größe und Gestalt beliebige Körper bilden. Vor allem chemisch reine Metalle zeigen dann meist auch eine große Verformbarkeit. Verbindungen verschiedener Metalle werden Legierung genannt. Die Art der Bindung von Metallatomen erklärt, warum Elektronen sich fast frei durch das Kristallgitter bewegen können, was die große elektrische Leitfähigkeit und Wärmeleitfähigkeit der Metalle verursacht. Zusammengefasst ergeben sich aus der Wechselwirkung der Atomhüllen miteinander die mechanische Stabilität und viele weitere Eigenschaften der makroskopischen Materialien.
Aufgrund des unscharfen Randes der Atomhülle liegt die Größe der Atome nicht eindeutig fest. Die als Atomradien tabellierten Werte sind aus der Bindungslänge gewonnen, das ist der energetisch günstigste Abstand zwischen den Atomkernen in einer chemischen Bindung. Insgesamt zeigt sich mit steigender Ordnungszahl eine in etwa periodische Variation der Atomgröße, die mit der periodischen Variation des chemischen Verhaltens gut übereinstimmt. Im Periodensystem der Elemente gilt allgemein, dass innerhalb einer Periode, also einer Zeile des Systems, eine bestimmte Schale aufgefüllt wird. Von links nach rechts nimmt die Größe der Atome dabei ab, weil die Kernladung anwächst und daher alle Schalen stärker angezogen werden. Wenn eine bestimmte Schale mit den stark gebundenen Elektronen gefüllt ist, gehört das Atom zu den Edelgasen. Mit dem nächsten Elektron beginnt die Besetzung der Schale mit nächstkleinerer Bindungsenergie, was mit einem größeren Radius verbunden ist. Innerhalb einer Gruppe, also einer Spalte des Periodensystems, nimmt die Größe daher von oben nach unten zu. Dementsprechend ist das kleinste Atom das Heliumatom am Ende der ersten Periode mit einem Radius von 32 pm, während eines der größten Atome das Caesiumatom ist, das erste Atom der 5. Periode. Es hat einen Radius von 225 pm.[55]
Erklärung der Atomeigenschaften im Rahmen des Orbitalmodells
Die dem Schalenmodell zugrundeliegenden Elektronenschalen ergeben sich durch die Quantisierung der Elektronenenergien im Kraftfeld des Atomkerns nach den Regeln der Quantenmechanik. Um den Kern herum bilden sich verschiedene Atomorbitale, das sind unscharf begrenzte Wahrscheinlichkeitsverteilungen für mögliche räumliche Zustände der Elektronen. Jedes Orbital kann aufgrund des Pauli-Prinzips mit maximal zwei Elektronen besetzt werden, dem Elektronenpaar. Die Orbitale, die unter Vernachlässigung der gegenseitigen Abstoßung der Elektronen und der Feinstruktur theoretisch die gleiche Energie hätten, bilden eine Schale. Die Schalen werden mit der Hauptquantenzahl durchnummeriert oder fortlaufend mit den Buchstaben K, L, M,… bezeichnet. Genauere Messungen zeigen, dass ab der zweiten Schale nicht alle Elektronen einer Schale die gleiche Energie besitzen. Falls erforderlich, wird durch die Nebenquantenzahl oder Drehimpulsquantenzahl eine bestimmte Unterschale identifiziert.
Sind die Orbitale, angefangen vom energetisch niedrigsten, so weit mit Elektronen besetzt, dass die gesamte Elektronenzahl gleich der Protonenzahl des Kerns ist, ist das Atom neutral und befindet sich im Grundzustand. Werden in einem Atom ein oder mehrere Elektronen in energetisch höherliegende Orbitale versetzt, ist das Atom in einem angeregten Zustand. Die Energien der angeregten Zustände haben für jedes Atom wohlbestimmte Werte, die sein Termschema bilden. Ein angeregtes Atom kann seine Überschussenergie abgeben durch Stöße mit anderen Atomen, durch Emission eines der Elektronen (Auger-Effekt) oder durch Emission eines Photons, also durch Erzeugung von Licht oder Röntgenstrahlung. Bei sehr hoher Temperatur oder in Gasentladungen können die Atome durch Stöße Elektronen verlieren (siehe Ionisationsenergie), es entsteht ein Plasma, so z. B. in einer heißen Flamme oder in einem Stern.
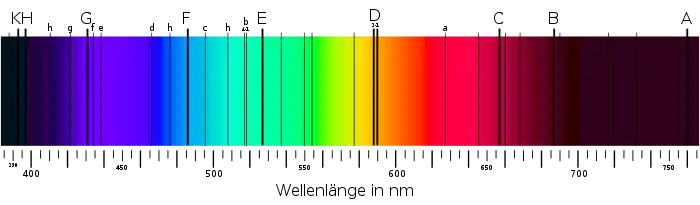
Da die Energien der Quanten der emittierten Strahlung je nach Atom bzw. Molekül und den beteiligten Zuständen verschieden sind, lässt sich durch Spektroskopie dieser Strahlung die Quelle im Allgemeinen eindeutig identifizieren. Beispielsweise zeigen die einzelnen Atome ihr elementspezifisches optisches Linienspektrum. Bekannt ist etwa die Natrium-D-Linie, eine Doppellinie im gelben Spektralbereich bei 588,99 nm und 589,59 nm,[56] die auch in nebenstehender Abbildung mit D-1 bezeichnet wird. Ihr Aufleuchten zeigt die Anwesenheit von angeregten Natrium-Atomen an, sei es auf der Sonne oder über der Herdflamme bei Anwesenheit von Natrium oder seinen Salzen. Da diese Strahlung einem Atom auch durch Absorption dieselbe Energie zuführen kann, lassen sich die Spektrallinien der Elemente sowohl in Absorptions- als auch in Emissionsspektren beobachten. Diese Spektrallinien lassen sich auch verwenden, um Frequenzen sehr präzise zu vermessen, beispielsweise für Atomuhren.
Obwohl Elektronen sich untereinander elektrostatisch abstoßen, können in einem neutralen Atom zusätzlich bis zu zwei weitere Elektronen gebunden werden, wenn es bei der höchsten vorkommenden Elektronenenergie noch Orbitale mit weiteren freien Plätzen gibt (siehe Elektronenaffinität). Chemische Reaktionen, d. h. die Verbindung mehrerer Atome zu einem Molekül oder sehr vieler Atome zu einem Festkörper, werden dadurch erklärt, dass ein oder zwei Elektronen aus einem der äußeren Orbitale eines Atoms (Valenzelektronen) unter Energiegewinn auf einen freien Platz in einem Orbital eines benachbarten Atoms ganz hinüberwechseln (Ionenbindung) oder sich mit einer gewissen Wahrscheinlichkeit dort aufhalten (kovalente Bindung durch ein bindendes Elektronenpaar). Dabei bestimmt die Elektronegativität der Elemente, bei welchem Atom sich die Elektronen wahrscheinlicher aufhalten. In der Regel werden chemische Bindungen so gebildet, dass die Atome die Elektronenkonfiguration eines Edelgases erhalten (Edelgasregel). Für das chemische Verhalten des Atoms sind also Form und Besetzung seiner Orbitale entscheidend. Da diese allein von der Protonenzahl bestimmt werden, zeigen alle Atome mit gleicher Protonenzahl, also die Isotope eines Elements, nahezu das gleiche chemische Verhalten.
Nähern sich zwei Atome über die chemische Bindung hinaus noch stärker an, müssen die Elektronen eines Atoms wegen des Pauli-Prinzips auf freie, aber energetisch ungünstige Orbitale des anderen Atoms ausweichen, was einen erhöhten Energiebedarf und damit eine abstoßende Kraft nach sich zieht.
Wechselwirkung zwischen Kern und Hülle
Mit großer Genauigkeit wird die Wechselwirkung zwischen Kern und Hülle schon durch den einfachen Ansatz beschrieben, in dem der Kern eine punktförmige Quelle eines elektrostatischen Felds nach dem Coulomb-Gesetz darstellt. Alle genannten Atommodelle beruhen hierauf. Aufgrund zusätzlicher Effekte, die in erweiterten Modellen behandelt werden, sind nur extrem kleine Korrekturen nötig, die unter dem Namen Hyperfeinstruktur zusammengefasst werden. Zu berücksichtigen sind hier drei Effekte: erstens die endliche Ausdehnung, die jeder Kern besitzt, zweitens eine magnetische Dipolwechselwirkung, wenn sowohl Kern als auch Hülle eine Drehimpulsquantenzahl von mindestens ½ haben, und drittens eine elektrische Quadrupolwechselwirkung, wenn beide Drehimpulsquantenzahlen mindestens 1 sind.
Die endliche Ausdehnung des Kerns – verglichen mit einer theoretischen Punktladung – bewirkt eine schwächere Anziehung derjenigen Elektronen, deren Aufenthaltswahrscheinlichkeit bis in den Kern hineinreicht. Betroffen sind nur s-Orbitale (Bahndrehimpuls Null). Bei Atomen mittlerer Ordnungszahl liegt die Korrektur der Bindungsenergie in der Größenordnung von 1 Prozent. Die magnetischen Dipol- bzw. elektrischen Quadrupol-Momente von Hülle und Kern bewirken eine Kopplung mit der Folge, dass die Gesamtenergie eines freien Atoms je nach Quantenzahl seines Gesamtdrehimpulses äußerst geringfügig aufgespalten ist. Im H-Atom beträgt die Aufspaltung etwa ein Millionstel der Bindungsenergie des Elektrons (siehe 21-cm-Linie). Anschaulich gesprochen hängt die Energie davon ab, in welchem Winkel die Achsen der beiden magnetischen Dipolmomente bzw. elektrischen Quadrupolmomente von Kern und Hülle zueinander stehen.
Auch bei Atomen in Flüssigkeiten und Festkörpern machen sich diese Wechselwirkungen in entsprechend modifizierter Form bemerkbar. Trotz der Kleinheit der dadurch verursachten Effekte haben sie eine große Rolle in der Atom- und Kernforschung gespielt und sind in besonderen Fällen auch bei modernen Anwendungen wichtig.
Beobachtung
Indirekte Beobachtung
Indirekte Möglichkeiten, Atome zu erkennen, beruhen auf der Beobachtung der von ihnen ausgehenden Strahlung. So kann aus Atomspektren beispielsweise die Elementzusammensetzung entfernter Sterne bestimmt werden. Die verschiedenen Elemente lassen sich durch charakteristische Spektrallinien identifizieren, die auf Emission oder Absorption durch Atome des entsprechenden Elements in der Sternatmosphäre zurückgehen. Gasentladungslampen, die dasselbe Element enthalten, zeigen diese Linien als Emissionslinien.[57] Auf diese Weise wurde z. B. 1868 Helium im Spektrum der Sonne nachgewiesen – über 10 Jahre bevor es auf der Erde entdeckt wurde.[58]
Ein Atom kann ionisiert werden, indem eines seiner Elektronen entfernt wird. Die elektrische Ladung sorgt dafür, dass die Flugbahn eines Ions von einem Magnetfeld abgelenkt wird. Dabei werden leichte Ionen stärker abgelenkt als schwere. Das Massenspektrometer nutzt dieses Prinzip, um das Masse-zu-Ladung-Verhältnis von Ionen und damit die Atommassen zu bestimmen.
Die Elektronenenergieverlustspektroskopie misst den Energieverlust eines Elektronenstrahls bei der Wechselwirkung mit einer Probe in einem Transmissionselektronenmikroskop.
Beobachtung einzelner Atome

Eine direkte Abbildung, die einzelne Atome erkennen lässt, wurde erstmals 1951 mit dem Feldionenmikroskop (oder Feldemissionsmikroskop) erzielt. Auf einem kugelförmigen Bildschirm, in dessen Mittelpunkt sich eine extrem feine Nadelspitze befindet, erscheint ein etwa millionenfach vergrößertes Bild. Darin sind die obersten Atome, die die Spitze bilden, nebeneinander als einzelne Lichtpunkte zu erkennen. Dies kann heute auch im Physikunterricht an der Schule vorgeführt werden. Das Bild entsteht in Echtzeit und erlaubt z. B. die Betrachtung der Wärmebewegung einzelner Fremdatome auf der Spitze.
Auch das Rastertunnelmikroskop ist ein Gerät, das einzelne Atome an der Oberfläche eines Körpers sichtbar macht. Es verwendet den Tunneleffekt, der es Teilchen erlaubt, eine Energiebarriere zu passieren, die sie nach klassischer Physik nicht überwinden könnten. Bei diesem Gerät tunneln Elektronen durch einen nur Nanometer breiten Spalt zwischen einer elektrisch leitenden Spitze und der elektrisch leitenden Probe. Bei Seitwärtsbewegungen zur Abrasterung der Probe wird die Höhe der Spitze so nachgeregelt, dass immer derselbe Strom fließt. Die Bewegung der Spitze bildet die Topographie und Elektronenstruktur der Probenoberfläche ab. Da der Tunnelstrom sehr stark vom Abstand abhängt, ist die laterale Auflösung viel feiner als der Radius der Spitze, manchmal atomar.[33][34]
Eine tomographische Atomsonde erstellt ein dreidimensionales Bild mit einer Auflösung unterhalb eines Nanometers und kann einzelne Atome ihrem chemischen Element zuordnen.[59]
Aufbauend auf einer um 2010 entwickelten Atom-Licht-Schnittstelle ist es 2020 gelungen, Fotos einzelner Atome zu machen, die weniger als einen Tausendstel Millimeter über einer lichtleitenden Glasfaser schweben. Dadurch ist es unter Laborbedingungen nun möglich, Effekte wie die Absorption und Aussendung von Licht kontrollierter als bisher zu untersuchen. Dies kann bei der Entwicklung neuartiger optischer Glasfaser-Netzwerke helfen.[60]
Literatur
- Hans-Werner Kirchhoff: Vorstellungen vom Atom 1800–1934. Aulis Verlag Deubner, 2001, ISBN 3-7614-2300-4.
- Richard Feynman, Robert B. Leighton, Matthew Sands: Vorlesungen über Physik. Band I–III. Oldenbourg, 1991.
- Wolfgang Demtröder: Atome, Moleküle und Festkörper. 3. Auflage. Springer, 2005, ISBN 3-540-21473-9.
- Richard Feynman: Six Easy Pieces. The Penguin Group, 1995, ISBN 0-14-027666-1.
- Oskar Höfling, Pedro Waloschek: Die Welt der kleinsten Teilchen. Rowohlt, 1984, ISBN 3-498-02862-6.
- Jeremy I. Pfeffer, Shlomo Nir: Modern Physics: An Introductory Text. Imperial College Press, 2000, ISBN 1-86094-250-4 (englisch).
- Robert Siegfried: From Elements to Atoms: A History of Chemical Composition. In: Transactions of the Americal Philosophical Society. Band 92, Nr. 4. American Philosophical Society, 2002, ISBN 0-87169-924-9.
- Werner Kutzelnigg: Einführung in die Theoretische Chemie. Wiley Chemie, 2002, ISBN 3-527-30609-9.
- Dick Teresi: Lost Discoveries: The Ancient Roots of Modern Science-from the Babylonians to the Maya. Simon & Schuster, 2003, ISBN 0-7432-4379-X, S. 213–214.
Weblinks
- HydrogenLab: Wie sieht ein Atom aus?
- Übersicht über die verschiedenen Atommodelle
- Geschichtlicher Überblick zum Atombegriff aus naturphilosophischer Perspektive von Brigitte Falkenburg im Online-Lexikon naturphilosophischer Grundbegriffe.
Einzelnachweise
- Dick Teresi: Lost Discoveries: The Ancient Roots of Modern Science--from the Babylonians to the Maya. Simon & Schuster, 2003, ISBN 0-7432-4379-X, S. 213–214.
- Leonid I. Ponomarev: The Quantum Dice. 2. Auflage. Inst. of Physics Pub, 1993, ISBN 0-7503-0251-8, S. 14–15.
- Jörn Bleck-Neuhaus: Elementare Teilchen. Von den Atomen über das Standard-Modell bis zum Higgs-Boson. 2., überarbeitete Auflage. Springer, 2013, ISBN 978-3-642-32578-6, ISSN 0937-7433, doi:10.1007/978-3-642-32579-3.
- Robert Siegfried: From Elements to Atoms: A History of Chemical Composition. In: Transactions of the Americal Philosophical Society. Band 92, Nr. 4. American Philosophical Society, 2002, ISBN 0-87169-924-9, S. 42–55.
- Charles Kittel: Einführung in die Festkörperphysik. 7. Auflage 1988, Verlag R. Oldenbourg (München), S. 16.
- Lavoisier's Elements of Chemistry. In: Elements and Atoms. Le Moyne College, Department of Chemistry, abgerufen am 2. März 2014 (englisch).
- Charles Adolphe Wurtz: The Atomic Theory. D. Appleton and company, New York 1881, S. 1–2.
- J. Dalton: A New System of Chemical Philosophy, Part 1. S. Russell, London/Manchester 1808.
- F. Dannemann: Die Naturwissenschaften in ihrer Entwicklung und in ihrem Zusammenhange. Bd. 3, Verlag W. Engelmann 1922, S. 198.
- Loschmidt: Zur Grösse der Luftmoleküle. In: Sitzungsberichte der kaiserlichen Akademie der Wissenschaften Wien. Band 52, 1866, Abt. II, S. 395–413.
- Albert Einstein: Eine neue Bestimmung der Moleküldimensionen. Bern 1905 (Online [PDF; abgerufen am 25. März 2014]).
- Albert Einstein: Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen. In: Annalen der Physik. Band 322, Nr. 8, 1905, S. 549–560, doi:10.1002/andp.19053220806 (PDF (Memento vom 18. März 2006 im Internet Archive) [abgerufen am 4. Februar 2007]). Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen (Memento vom 18. März 2006 im Internet Archive)
- Robert M. Mazo: Brownian Motion: Flucuations, Dynamics, and Applications. In: The International Series of Monographs on Physics. Band 112. Oxford University Press, 2002, ISBN 0-19-851567-7, S. 1–7.
- Y. K. Lee, Kelvin Hoon: Brownian Motion. (Nicht mehr online verfügbar.) Imperial College, London, 1995, archiviert vom Original am 18. Dezember 2007; abgerufen am 2. März 2014 (englisch).
- Christian Wiener: Erklärung des atomistischen Wesens des tropfbar flüssigen Körperzustandes und Bestätigung desselben durch die sogenannten Molekularbewegungen. In: Poggendorffs Annalen. Band 118, 1863, S. 79–94.
- G. Patterson: Jean Perrin and the triumph of the atomic doctrine. In: Endeavour. Band 31, Nr. 2, 2007, S. 50–53, doi:10.1016/j.endeavour.2007.05.003.
- The Nobel Foundation: J.J. Thomson. Nobelprize.org, 1906, abgerufen am 2. März 2014 (englisch).
- E. Rutherford: The Scattering of α and β Particles by Matter and the Structure of the Atom. In: Philosophical Magazine. Band 21, 1911, S. 669–688 (Scans [abgerufen am 2. März 2014]).
- Frederick Soddy, The Nobel Prize in Chemistry 1921. Nobel Foundation, abgerufen am 2. März 2014 (englisch).
- Nagel, Miriam C.: Frederick Soddy: From Alchemy to Isotopes. In: Journal of Chemical Education. Band 59, Nr. 9, 1982, S. 739–740, doi:10.1021/ed059p739.
- Joseph John Thomson: Bakerian Lecture: Rays of Positive Electricity. In: Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. Band 89, Nr. 607, 1913, S. 1–20 (royalsocietypublishing.org [PDF; abgerufen am 2. März 2014]).
- Francis W. Aston: The constitution of atmospheric neon. In: Philosophical Magazine. Band 39, Nr. 6, 1920, S. 449–455.
- James Chadwick: Nobel Lecture: The Neutron and Its Properties. Nobel Foundation, 12. Dezember 1935, abgerufen am 2. März 2014 (englisch).
- Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture. The Nobel Foundation, 11. Dezember 1922, abgerufen am 2. März 2014 (englisch).
- Kevin Brown: The Hydrogen Atom. MathPages, 2007, abgerufen am 2. März 2014 (englisch).
- David M. Harrison: The Development of Quantum Mechanics. University of Toronto, März 2000, abgerufen am 2. März 2014 (englisch).
- Lise Meitner, Otto Robert Frisch: Disintegration of uranium by neutrons: a new type of nuclear reaction. In: Nature. Band 143, 1939, S. 239.
- Manfred Schroeder: Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages. (Online [abgerufen am 2. März 2014]). Online (Memento vom 19. Juli 2011 im Internet Archive)
- Sven Kullander: Accelerators and Nobel Laureates. The Nobel Foundation, 28. August 2001, abgerufen am 2. März 2014 (englisch).
- Staff: The Nobel Prize in Physics 1990. The Nobel Foundation, 17. Oktober 1990, abgerufen am 2. März 2014 (englisch).
- P. Domokos, J. Janszky, P. Adam: Single-atom interference method for generating Fock states. In: Physical Review. Band 50, 1994, S. 3340–3344, doi:10.1103/PhysRevA.50.3340.
- The Nobel Prize in Physics 1997. Nobel Foundation, 15. Oktober 1997, abgerufen am 2. März 2014 (englisch).
- Marilyn Jacox, J. William Gadzuk: Scanning Tunneling Microscope. National Institute of Standards and Technology, November 1997, abgerufen am 2. März 2014 (englisch).
- The Nobel Prize in Physics 1986. The Nobel Foundation, abgerufen am 11. Januar 2008 (englisch, insbesondere der Nobel-Preis-Vortrag von G. Binnig und H. Rohrer).
- Jiwoong Park, et al.: Coulomb blockade and the Kondo effect in single-atom transistors. In: Nature. Band 417, Nr. 6890, 2002, S. 722–725, doi:10.1038/nature00791.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. A 729, 2003, S. 3–128, doi:10.1016/j.nuclphysa.2003.11.001 (englisch, in2p3.fr [PDF; abgerufen am 2. März 2014]).
- Eintrag zu Isotope. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Februar 2014.
- Roger Barrett, Daphne Jackson, Habatwa Mweene: The Strange World of the Exotic Atom. In: New Scientist. Nr. 1728, 1990, S. 77–115 (Online [abgerufen am 2. März 2014]).
- Paul Indelicato: Exotic Atoms. In: Physica Scripta. T112, 2004, S. 20–26, doi:10.1238/Physica.Topical.112a00020.
- Barrett H. Ripin: Recent Experiments on Exotic Atoms. American Physical Society, Juli 1998 (Online [abgerufen am 2. März 2014]).
- G. Baur et al.: Production of antihydrogen. In: Physics Letters B. 368, Nr. 3, 1996, S. 251–258, doi:10.1016/0370-2693(96)00005-6; Preprint online.
- Craig J. Copi, David N. Schramm, Michael S Turner: Big-Bang Nucleosynthesis and the Baryon Density of the Universe. In: Science. Band 267, 1995, S. 192–199, doi:10.1126/science.7809624, PMID 7809624.
- Brian Abbott: Microwave (WMAP) All-Sky Survey. (Nicht mehr online verfügbar.) Hayden Planetarium, 30. Mai 2007, archiviert vom Original am 5. September 2008; abgerufen am 2. März 2014 (englisch).
- D. C. Knauth, S. R. Federman, David L. Lambert, P. Crane: Newly synthesized lithium in the interstellar medium. In: Nature. Band 405, 2000, S. 656–658, doi:10.1038/35015028.
- Michael Banks: Planck reveals 'almost perfect' universe. 21. März 2013, abgerufen am 20. Januar 2014 (englisch).
- Masataka Fukugita, James Peebles: The Cosmic Energy Inventory. 18. August 2004, arxiv:astro-ph/0406095 (englisch).
- Michael Richmond: The Interstellar Medium: Gas. Abgerufen am 12. März 2014.
- Arthur F. Davidsen: Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission. In: Science. Band 259, Nr. 5093, 1993, S. 327–334, doi:10.1126/science.259.5093.327, PMID 17832344.
- A. G. W. Cameron: Abundances of the elements in the solar system. In: Space Science Reviews. Band 15, 1970, S. 121–146.
- Jeremy I. Pfeffer: Modern Physics: An Introductory Text. Imperial College Press, 2000, ISBN 1-86094-250-4, S. 330–336.
- E.R. Cohen, et al.: Quantities, Units and Symbols in Physical Chemistry. 3. Auflage. IUPAC & RSC Publishing, 2008, ISBN 978-0-85404-433-7, S. 88, 92 (englisch, Online [PDF; abgerufen am 28. April 2014]). Online (Memento vom 11. Februar 2014 im Internet Archive)
- G. Audi, A. H. Wapstra, C. Thibault: The Ame2003 atomic mass evaluation (II). In: Nuclear Physics. A729, 2003, S. 337–676 (englisch, Online [abgerufen am 2. März 2014]).
- Wolfgang Demtröder: Experimentalphysik Bd. 4: Kern-,Teilchen- und Astrophysik. 3. Auflage. Springer, 2010, ISBN 978-3-642-01597-7, ISSN 0937-7433, S. 366–367, doi:10.1007/978-3-642-01598-4.
- Julian Schwinger: Thomas-Fermi model: The leading correction. In: Phys. Rev. A. Band 22, 1980, S. 1827–1832, doi:10.1103/PhysRevA.22.1827.
- Mark Winter: Covalent radius. Abgerufen am 12. März 2014 (englisch).
- Yu. Ralchenko, A. E. Kramida, J. Reader: NIST Atomic Spectra Database. National Institute of Standards and Technology, Gaithersburg, MD, 2008, abgerufen am 2. März 2014 (Version 5).
- Jim Lochner, Meredith Gibb, Phil Newman: What Do Spectra Tell Us? NASA/Goddard Space Flight Center, 30. April 2007, abgerufen am 2. März 2014 (englisch).
- Mark Winter: Helium. WebElements, 2007, abgerufen am 2. März 2014 (englisch).
- Erwin W. Müller, John A. Panitz, S. Brooks McLane: The Atom-Probe Field Ion Microscope. In: Review of Scientific Instruments. Band 39, Nr. 1, 1968, ISSN 0034-6748, S. 83–86, doi:10.1063/1.1683116.
- Atome beim Fotoshooting. (PDF) In: Pressemitteilung. Humboldt-Universität zu Berlin, 3. August 2020, abgerufen am 3. August 2020.