Iod
Iod (standardsprachlich Jod[13]) ist ein chemisches Element mit dem Elementsymbol I (vor der internationalen Elementsymboleinführung war es J) und der Ordnungszahl 53. Im Periodensystem steht es in der 7. Hauptgruppe bzw. der 17. IUPAC-Gruppe und gehört somit zu den Halogenen. Der Name leitet sich vom altgriechischen Wort „ioeides“ (ιο-ειδής) für „veilchenfarbig, violett“ ab. Beim Erhitzen entstehende Dämpfe sind charakteristisch violett.
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Iod, I, 53 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Halogene | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 17, 5, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | gasförmig: dunkel-violett, als Feststoff: grauschwarz, glänzend | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-442-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.585 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,06 ppm[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 126,90447(3)[3] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 140 (115) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 139 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 198 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d10 5s2 5p5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 10.451260(25) eV[4] ≈ 1008.39 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 19.13126(12) eV[4] ≈ 1845.89 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 29.570(25) eV[4] ≈ 2853.1 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 40.357(25) eV[4] ≈ 3893.9 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 51.52(4) eV[4] ≈ 4971 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. Ionisierungsenergie | 74.4(4) eV[4] ≈ 7179 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7. Ionisierungsenergie | 87.61(6) eV[4] ≈ 8453 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | orthorhombisch | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 4,94 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −4,3 · 10−5)[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 386,85 K (113,70 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 457,2 K[8] (184 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 25,72 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 41,6 kJ/mol[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 7,76 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | 35 Pa bei 298 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,449 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | ±1, 3, 5, 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 0,536 V (I2 + 2 e− → 2 I−) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,66 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3 bzw. 1 mg·m−3[12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ältere Bezeichnungen sind Jodium, Jodina und Jodine.[14]
Iod ist bei Raumtemperatur ein Feststoff, der schlecht wasserlöslich, aber gut löslich in wässriger Kaliumiodid-Lösung (siehe dazu: Lugolsche Lösung) und sehr gut löslich in Ethanol und anderen organischen Lösungsmitteln ist.
In der Alltagssprache ist Jod die gebräuchliche Schreibweise, auch in der älteren chemischen und überwiegend in der aktuellen medizinischen Fachliteratur. Die Schreibweise Iod wird im Duden mit dem Hinweis auf Jod aufgeführt und auf die Fachsprachlichkeit hingewiesen.[15] Das Elementsymbol I wird bereits seit 1970 in der IUPAC-Publikation[16] in der chemischen Fachliteratur benutzt, in der älteren deutschsprachigen Literatur findet man durchgängig die Elementbezeichnung J.[17]
Iod ist ein unentbehrlicher Bestandteil des tierischen und menschlichen Organismus und wird mit der Nahrung aufgenommen. Am höchsten ist die Konzentration beim Menschen in der Schilddrüse und wird dort in den Hormonen Thyroxin und Triiodthyronin und als Diiodtyrosin genutzt. Jodmangel im Trinkwasser und der Nahrung ist in der Regel für das Auftreten des Kropfs verantwortlich. Als Vorbeugung wird der wöchentlich ein- bis mehrmalige Verzehr von Seefisch sowie die Verwendung von sogenanntem Jodsalz (Speisesalz mit Natrium- oder Kaliumiodat versetzt) empfohlen. Durch diese individuelle Jodprophylaxe und die Iodierung von Futtermitteln wird in Deutschland der Mangel an Iod in den Böden teilweise ausgeglichen. Es konnte vorübergehend erreicht werden, dass in der Gesamtjodversorgung der Bevölkerung die Vorgaben der WHO knapp eingehalten wurden. Stand 2020 weist die Jodversorgung laut Bundesinstitut für Risikobewertung eine rückläufige Tendenz auf und ist nicht optimal.[18]
Geschichte
Die pharmakologische Bedeutung iodhaltiger Zubereitungen war schon im Altertum bekannt. So wurden bereits 1500 Jahre vor unserer Zeitrechnung Kropfkranken die iodhaltigen Schilddrüsen von Schafen oder Aschen von Meeresschwämmen verordnet.
Iod wurde erstmals im Jahr 1811 durch den Pariser Salpetersieder und Sodafabrikanten Bernard Courtois bei der Herstellung von Schießpulver aus der Asche von Seetang gewonnen. Den elementaren Charakter (den zum Beispiel Humphry Davy früh öffentlich bekanntgab und der dem Jod den Namen gab[19]) erforschten jedoch erst ab 1813 die französischen Naturwissenschaftler Nicolas Clément und Joseph Louis Gay-Lussac, der ihm ein Jahr später den heutigen Namen verlieh.
Vorkommen
Iod ist abgesehen von Astat wesentlich seltener als die übrigen Halogene. In der Natur ist es weit verbreitet, jedoch nur in Form seiner Verbindungen, zum Beispiel angereichert (0,02–1 %) im Chilesalpeter, hauptsächlich in Form von Natriumiodat (NaIO3), aber auch Natriumperiodat (NaIO4) und Lautarit (Ca(IO3)2). In geringen Spuren ist es in Böden und Gesteinen nachweisbar. Im Durchschnitt enthält 1000 Gramm wasserfreier Feinboden aus dem deutschen Raum etwa 2,5 Milligramm Iod.[20] Der Iodgehalt des Bodens ist wesentlich für die Versorgung der Bevölkerung mit natürlichem Iod. Als Iodwasserstoff kommt es in geringsten Mengen in vulkanischen Gasen vor.
Lösliche Iodverbindungen wie Alkali- und Erdalkaliiodide werden während der Verwitterung von Gesteinen durch Regenwasser freigesetzt oder zerfallen bei höheren Temperaturen. So gelangen sie ins Grundwasser und schließlich in die Meere. Einige Mineralwässer enthalten Iod. Die Mineralquelle von Woodhall Spa in Lincolnshire (England) bringt Wasser hervor, das durch Iod braun gefärbt ist. Im Meerwasser liegt die Menge an Iod bei 0,05 Milligramm pro Liter. Es kommt dort in Form von Iodid (I−) und Iodat (IO3−) in einer Konzentration von etwa 500 nmol/L vor. Die Verteilung variiert in Oberflächenwasser im Allgemeinen von 0–200 nmol I−/L.[21]
In der Erdatmosphäre ist Iod in Form von organischen Verbindungen oder anorganisch in Form von Iodoxid (IO), Iodnitrat oder höheren Oxiden zu finden. Für die Stratosphäre gibt es wenig Informationen und eine obere Grenze von 0,1 ppt für anorganisches Iod.[22] Über Algenfeldern an Küsten wurden hohe Konzentrationen von mehr als 10 ppt IO nachgewiesen[23] und auch auf dem tropischen Atlantik wurde das Iodoxid-Radikal nachgewiesen.[24]
Organische Iodverbindungen kann man aus Meeresalgen (19 Gramm Iod pro Kilogramm Trockenmasse), Tangen und Schwämmen (bis zu 14 Gramm Iod pro Kilogramm Trockenmasse) isolieren. Einen wichtigen Speicher für organisch gebundenes Iod stellt die Schilddrüse dar.
Isotope
Von Iod sind bisher 36 Isotope und 10 Kernisomere bekannt. Von diesen ist nur ein Isotop stabil, so dass natürlich vorkommendes Iod zu 100 % aus dem einzigen stabilen Isotop 127I besteht. Iod ist daher ein Reinelement (anisotop). Von den instabilen Isotopen besitzt der Betastrahler 129I mit 15.700.000 Jahren eine sehr lange Halbwertszeit. Daneben gibt es vier Isotope mit mehr als einem Tag Halbwertszeit: 124I (4,2 Tage), 125I (59 Tage), 126I (13 Tage) und 131I (8,0 Tage). Instabile Iodisotope entstehen z. B. bei der Kernspaltung und stellen bei ihrer Freisetzung in die Luft eine Gesundheitsgefahr dar, weil sie sich in der Schilddrüse anreichern können.
Gewinnung und Darstellung
Früher gewann man Iod in Form von Iodiden und Iodaten, indem man die durch die Flut an den Strand angeschwemmten Tange einsammelte und verbrannte. Die erhaltene Asche enthielt etwa 0,1–0,5 % Iod. Diese Iodgewinnung hat heute jedoch nur noch lokale Bedeutung und macht ungefähr 2 % der Weltjahresproduktion aus.
Die technische Gewinnung von Iod ist eng mit der Salpetergewinnung verknüpft. Das in den Mutterlaugen enthaltene Iodat wird durch Reduktion in elementares Iod umgewandelt. Im ersten Reaktionsschritt setzt man Schweflige Säure ein, um Iodsäure (Iodat ist das Anion dieser Säure) zu Iodwasserstoff zu reduzieren:
- Iodsäure und Schweflige Säure reagieren zu Iodwasserstoff und Schwefelsäure
Der Iodwasserstoff wird wiederum in einem zweiten Schritt durch die in der Lösung vorhandene Iodsäure zu Iod oxidiert. Man spricht in diesem Fall von einer Komproportionierung, da Iod in zwei verschiedenen Oxidationsstufen (−1 im Iodwasserstoff und +5 in der Iodsäure) zu elementarem Iod mit der Oxidationsstufe 0 wird.
- Iodsäure und Iodwasserstoff komproportionieren zu Wasser und Iod
Alternativ kann zur Reduktion auch Schwefeldioxid (SO2) den Endlaugen, aus denen der Salpeter bereits auskristallisiert ist, zugesetzt werden.
Bei der Erdöl- und Erdgasförderung fallen bedeutende Mengen an Salzsole an, die einen Iodgehalt von 30 bis über 100 ppm aufweisen. Das in Form von Natriumiodid vorliegende Iod wird durch die Oxidation mit Chlor aus der Sole freigesetzt:
- Natriumiodid und Chlor reagieren zu Natriumchlorid und Iod
Eine weitere Reinigung des gewonnenen Iods wird dadurch erreicht, dass es mit Luft ausgeblasen, anschließend mit Schwefeldioxid in schwefelsaurer Lösung wieder reduziert und zum Schluss mit gasförmigem Chlor zum Iod zurück oxidiert wird.
- Iod wird durch Schwefeldioxid zu Iodwasserstoff reduziert
- Iodwasserstoff und Chlor reagieren zu Chlorwasserstoff und Iod
Chromatographisch kann Iod mittels Adsorption von Polyiodid an Anionenaustauschern angereichert werden. Zur Reinstherstellung setzt man Kaliumiodid und halogenfreies Kupfersulfat ein.
Im Labormaßstab lässt sich Iod durch Einwirken von Schwefelsäure und Mangan(IV)-oxid oder Wasserstoffperoxid auf Kaliumiodid herstellen. Die Gewinnung gelingt ebenso aus der iodhaltigen Asche von Meerespflanzen durch Behandlung mit Chlor.
Eigenschaften
Physikalische Eigenschaften
Iod ist unter Normalbedingungen ein Feststoff, der grauschwarze, metallisch glänzende Schuppen bildet, deren Dichte 4,94 g·cm−3 beträgt. Iod geht beim Schmelzen (Schmelzpunkt 113,70 °C) in eine braune, elektrisch leitfähige Flüssigkeit über. Es siedet bei 184,2 °C unter Bildung eines violetten Dampfes, der aus I2-Molekülen besteht. Iod sublimiert schon bei Zimmertemperatur, so dass ein Schmelzen nur unter rascher und starker Temperaturerhöhung möglich ist.[25]
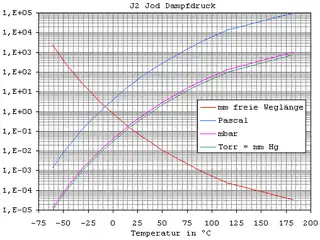 Dampfdruck von Iod
Dampfdruck von Iod Iod als Kristall
Iod als Kristall Iod als Dampf
Iod als Dampf Kristallines Iod
Kristallines Iod
Kristall- und Molekülstruktur
Iod besitzt die Eigenschaften eines Halbleiters. Diese Eigenschaften sind auf das Vorhandensein eines Schichtgitters zurückzuführen, in dem einzelne Ebenen aus I2-Molekülen (Bindungslänge 271,5 pm) bestehen. Der Abstand der Ebenen in einem orthorhombischen Schichtkristall beträgt 441,2 pm und entspricht damit dem Van-der-Waals-Abstand zwischen zwei Iod-Atomen (430 pm). Das Ergebnis der Messung des kürzesten Abstands zwischen zwei Iod-Molekülen liegt mit 349,6 pm deutlich darunter.
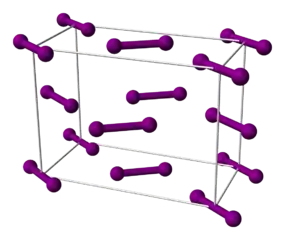 3-D-Modell der Elementarzelle
3-D-Modell der Elementarzelle
Chemische Eigenschaften
Iod reagiert weitaus weniger heftig mit anderen Elementen wie Phosphor, Aluminium, Eisen und Quecksilber als Chlor und Brom. Mit Wasserstoff reagiert Iod zu Iodwasserstoff, welcher beim leichten Erwärmen jedoch schnell wieder in die Elemente zerfällt.
- Iod und Wasserstoff stehen mit Iodwasserstoff im Gleichgewicht. Bei erhöhter Temperatur wird dieses nach links verschoben.
Mit Ammoniak findet aufgrund der damit verbundenen Volumenzunahme eine explosionsartige Reaktion statt.
- Drei Mol Iod und zwei Mol Ammoniak reagieren zu sechs Mol Iodwasserstoff und einem Mol Stickstoff.
Mit Ammoniaklösung bildet Iod Triiodstickstoff (NI3).
Eine interessante Eigenschaft des Iods äußert sich darin, Polyiodidverbindungen einzugehen. Dabei verbinden sich gelöste I2-Moleküle jeweils mit einem Iodid-Anion zum einfach negativ geladenen I3−-Anion. Eine Eigenschaft dieser Polyiodidverbindung ist, dass sie sich in Stärke-Helices einlagert. Diese Einlagerungsverbindungen rufen bereits in geringen Konzentrationen eine intensive Blaufärbung hervor (empfindlicher und spezifischer Iod-Stärke-Nachweis).
Iod-Kationen
Von Iod sind verschiedene Kationen bekannt. So entsteht das blaue Diiod-Kation I2+, wenn Iod durch in Schwefelsäure gelöstes Schwefeltrioxid (65%iges Oleum: H2SO4 · 2 SO3) oxidiert wird:
Zur Oxidation kann ebenso Antimon(V)-fluorid bzw. Tantalpentafluorid in flüssigem Schwefeldioxid verwendet werden:
Es gelang jedoch bisher nicht, Verbindungen mit dem unsolvatisierten, das heißt lösungsmittelfreien Monoiod-Kation I+ herzustellen. Selbst in Verbindung mit einer extrem schwachen Lewis-Base wie dem Perchlorat-Anion ClO4− findet man kovalent gebundenes Iod vor. In der Gasphase kann man das I+-Ion bei Abwesenheit eines Gegenions jedoch nachweisen.
Verwendung
Lebensmittel
| Tiergruppe | Iodmenge [mg/kg] |
|---|---|
| Unpaarhufer (Pferde, Esel, Maultiere) |
4 |
| Milchkühe | 5 |
| Legehennen | 5 |
| Schweine | 10 |
| Mastgeflügel | 10 |
| Fische | 20 |
Der Mineralstoff Iod (meist in der Form als Iodid) gilt in der Ernährung der Menschen und vieler Tiere als Nährstoff und hierbei als essentielles Spurenelement. Insbesondere Jodsalz wird als iodiertes Lebensmittel (angereichert mit Iodaten) zur Vorbeugung gegen Jodmangel eingesetzt. In Verordnung (EG) Nr. 1925/2006 (Anreicherungsverordnung) wurde der Iodgehalt in Lebensmitteln festgesetzt, um ihn gesundheitsbezogen entsprechend Verordnung (EG) Nr. 1924/2006 (Health Claims) in der Europäischen Union (deklariert nach Maßgabe der nationalen Lebensmittel-Kennzeichnungsverordnungen in Deutschland, Österreich und der Schweiz) bewerben zu dürfen. Dazu wird es oft zugesetzt, meist als Calciumiodid. Auch in Fertig-Tierfutter wird Iod zugesetzt, so in den meisten Katzen- und Hundenahrungen, aber auch Vogelfutter (z. B. für Kanarienvögel) kann iodiert werden. Für die Iodzugabe bei Schlachttieren gelten in der EU auf Empfehlung bzw. auf Befragen der Europäischen Behörde für Lebensmittelsicherheit (EFSA) Höchstgehalte. (siehe nebenstehende Tabelle)
In Deutschland kommen Iodverbindungen in den Böden unverändert in zu geringen Mengen vor. Durch die Jodprophylaxe, die im Wesentlichen aus der Iodierung von Speisesalz („Jodsalz“) und der Iodierung von Futtermitteln in der Landwirtschaft besteht, konnte die Iodversorgung in Deutschland soweit verbessert werden, dass die Iodurie bei Kindern – die als zuverlässigstes Kriterium zur Beurteilung der Iodversorgung gilt – in einer großen Stichprobe zwischen 2003 und 2006 im Median 117 µg/l erreichte. Sie lag damit im unteren Bereich der von der Weltgesundheitsorganisation (WHO) empfohlenen Spanne von 100 bis 200 µg/l.[27] Damit gilt Deutschland nach WHO-Kriterien als ausreichend mit Iod versorgt.[28] Dennoch besteht in Deutschland bei 36 % der Bevölkerung ein milder und bei 21 % ein moderater bis schwerer Jodmangel.[28]
Medizinische Anwendungen
Iodtinktur und Iodoform enthalten Iod in elementarer bzw. gebundener Form und dienen als Antimykotikum und Antiseptikum. Es wird vermutet, dass die desinfizierende Wirkung auf der Abspaltung von Sauerstoff aus Wasser beruht. Dieser Sauerstoff ist kurz nach seiner Freisetzung (in statu nascendi) besonders reaktionsfähig:
Dieser Mechanismus wird auch für die anderen Halogene diskutiert. Iod wird aus diesem Grund in einzelnen Fällen auch zur Desinfektion von Wasser in Badeanstalten genutzt. Vorteilhaft ist in diesem Zusammenhang, dass Iod weniger aggressiv ist als Chlor. Allerdings vermag diese Wasserbehandlung nicht Algen abzutöten, so dass zusätzlich ein Algizid zugesetzt werden muss. Der intensive Gebrauch von Iod kann aber zu Hautverfärbungen führen. Auch besteht die Gefahr der Allergisierung. Beides ist durch Einsatz von so genannten Iodophoren, Trägermaterialien, die Iod binden können, vermeidbar.
Iodate werden in Form von Natriumiodat oder Kaliumiodat in geringen Mengen dem Speisesalz zugesetzt, um Jodmangelerkrankungen vorzubeugen. Es wird im Handel umgangssprachlich als Jodsalz angeboten.
Die radioaktiven Iod-Isotope 131I (8,02 Tage Halbwertszeit) und 123I (13,22 Stunden Halbwertszeit) werden als Radiopharmaka in der nuklearmedizinischen Diagnostik und Therapie vorwiegend von Schilddrüsenerkrankungen eingesetzt (vergleiche Radiojodtherapie), wobei 131I heute verstärkt zum Einsatz kommt. Zur Bestimmung des Knochenmineralgehalts wird 125I (Gammastrahlung von γ = 35 keV, 59,4 Tage Halbwertszeit) herangezogen. 125I ist zudem das am häufigsten im Radioimmunassay (RIA) verwendete Radioisotop.[29]
Iod ist ein häufig eingesetzter Katalysator bei chemischen Reaktionen. So verwendet man es bei stereospezifischen Polymerisationen von 1,3-Butadien. Die Sulfurierung aromatischer Verbindungen sowie die Alkylierung und Kondensation aromatischer Amine sind weitere Einsatzfelder.
Aromatische Iodverbindungen werden als Röntgenkontrastmittel in der Diagnostik eingesetzt.
Natriumiodid wird als Szintillator in Szintillationszählern eingesetzt.
Strahlenschutz
Radioaktive Iod-Isotope sind im Fallout von Nuklearexplosionen und im Reaktor von Kernkraftwerken (KKW) enthalten. Für den Fall eines Atomunfalles mit der Freisetzung radioaktiver Iodisotope bevorraten Bund und Länder in der Umgebung der deutschen Kernkraftwerke insgesamt 137 Millionen Kaliumiodid-Tabletten mit hohem Gehalt des stabilen Iodisotops 127I (meist als „Jod-Tabletten“ bezeichnet), die im Kontaminierungsfall durch eine Iodblockade die Aufnahme der radioaktiven Iodisotope in der Schilddrüse verhindern sollen. Der Vorrat wurde zuletzt 2004 erneuert.[30] In der Schweiz werden an alle Personen, die im Umkreis von 50 Kilometer um ein Kernkraftwerk wohnen (rund 4,6 Millionen), sowie an die dort ansässigen Betriebe Kaliumiodid-Tabletten abgegeben.[31]
Iod-Radionuklide liegen als Ergebnis der Kernspaltung in hoher Konzentration im Gap, dem Spalt zwischen den Brennstofftabletten und dem Hüllrohr der KKW-Brennstäbe, vor. Sollte der Sicherheitsbehälter des KKW im Falle eines Kernschadens oder gar einer Kernschmelze nach Unfalleintritt ein Leck aufweisen, so sorgt es aus Sicht des Strahlenschutzes für großen Schaden, da es als sehr flüchtiges Nuklid praktisch als erstes, neben den radioaktiven Isotopen 85Kr und 135Xe der Edelgase Krypton und Xenon, in größerer Konzentration freigesetzt wird und in den biologischen Kreislauf gelangt.
Biologische Bedeutung
-Thyroxine_Structural_Formulae_V2.svg.png.webp)
Nach Aufnahme von größeren, im Milligrammbereich liegenden Dosen von Iodverbindungen treten Reizwirkungen an Haut und Schleimhäuten auf. Dies kann zum „Jodismus“ führen, einhergehend mit den Symptomen Schnupfen („Jodschnupfen“), Konjunktivitis, Bronchitis und Exanthemen. Die Wirkung auf die Bronchialschleimhaut hat dazu geführt, dass Iodsalze früher als Expektorans benutzt wurden. Andererseits kann hochdosiertes Iodid bei Hyperthyreose zur Suppression genutzt werden, da es die Freisetzung und die Synthese von Schilddrüsenhormonen hemmt.
Schilddrüsenhormone
Iod spielt im Organismus hauptsächlich eine Rolle für die Produktion der Schilddrüsenhormone Thyroxin (T4) und Triiodthyronin (T3), die vier bzw. drei Iodatome enthalten. Der Iodvorrat im menschlichen Körper wird auf 10 bis 30 Milligramm beziffert. Jodmangel führt zunächst nur zu einer euthyreoten Kropfbildung. Erst ein ausgeprägter Jodmangel hat auch eine Unterfunktion der Schilddrüse (Hypothyreose) zur Folge, die sich durch eine Minderproduktion von T4 und T3 auszeichnet. Da die Schilddrüsenhormone wesentliche Funktionen in der Regulation von Stoffwechselprozessen in beinahe jeder Zelle des Körpers übernehmen, resultieren aus einer Schilddrüsenunterfunktion schwerwiegende Stoffwechsel- und Entwicklungsstörungen.
Zur Rolle der Iodversorgung bei Schilddrüsenkrankheiten siehe Jodprophylaxe, Iodunverträglichkeit, Hyperthyreose und Hashimoto-Thyreoiditis.
Brust
Es gibt Hinweise, dass Iod und seine Stoffwechselprodukte auch in der Brustdrüse die Entstehung und das Wachstum von Neoplasien beeinflussen.[32][33]
Sicherheitshinweise
Iod ist von der EU als Gefahrstoff klassifiziert, dessen Freisetzung in die Umwelt zu vermeiden ist. Beim Umgang mit dem Element sind entsprechende Schutzmaßnahmen einzuhalten. Reste von Iod sind mit Natriumthiosulfat-Lösung zu behandeln (→ Reduktion zu Iodid). Vor der Entsorgung ins Abwasser muss der pH-Wert des Reaktionsgemisches mit Natriumhydrogencarbonat neutralisiert werden. Iod darf niemals mit Ammoniak in Verbindung gebracht werden, da sich sonst explosiver Iodstickstoff bilden kann.
Analytik
Klassische qualitative Analytik von Iod
Die Iod-Stärke-Reaktion ist die bekannteste Methode, um elementares Iod nachzuweisen. Für den Nachweis gibt man etwas wässrige Stärkelösung in die zu untersuchende Probe. Bei Anwesenheit von Iod bildet sich ein farbiger Komplex aus.
Iodid-Ionen lassen sich durch spezifische Fällungsreaktionen nachweisen. Sehr bekannt ist die Reaktion mit Silbernitrat, was zu einer Fällung von gelbem Silberiodid führt:
Quecksilber(I)-nitrat fällt, wenn es im Überschuss eingesetzt wird, Iodid-Ionen in Form von gelbgrünem Quecksilber(I)-iodid:
Wird dagegen Quecksilber(II)-nitrat verwendet, so erhält man einen roten Niederschlag von Quecksilber(II)-iodid:
Die Redoxreaktion von elementarem Chlor mit Iodid ist die Grundlage einer weiteren qualitativen Nachweisreaktion. Chlorwasser vermag Iodid zu elementarem Iod zu oxidieren, während Chlor zum Chlorid reduziert wird. Das gebildete Iod wird als bräunliche Färbung sichtbar. Es kann mit organischen Lösungsmitteln (z. B. Chloroform oder Tetrachlorkohlenstoff) extrahiert und zur photometrischen quantitativen Analyse herangezogen werden.
Atomabsorptionsspektrometrie (AAS)
Iod ist mit Hilfe der AAS praktisch nicht routinemäßig nachweisbar, da die Resonanzlinie im Vakuum-UV bei 183,0 nm liegt. Lediglich vereinzelte analytische Arbeitsgruppen berichten von indirekten Verfahren, welche jedoch mit großen Unsicherheiten behaftet sind.[34]
Atomemissionsspektrometrie (AES)
Iodid kann mit Hilfe der ICP-AES (ICP, induktiv-gekoppeltes Plasma) nachgewiesen werden. Eine Methode ist die oxidative Ioddampferzeugung. Die aus Iodat reduktiv erzeugten Iodidionen werden im Plasma atomisiert und zur Emission bei 178,3 nm angeregt. Die mit dieser Methode erreichte Nachweisgrenze beträgt 0,4 µg/l.[35]
Massenspektrometrie (MS)
In der Natur kommt nur das Isotop 127I vor. Es ist als einziges stabil. Mit Hilfe der ICP-Quadrupol-MS (ICP, induktiv-gekoppeltes Plasma) kann es in aufgeschlossenen Gesteinsproben mit einer Nachweisgrenze von etwa 0,01 ng/ml bestimmt werden.[36] Für die Analytik des Iods in Serum- und Urinproben steht als spezifische und sensitive Methode die Kopplung der Ionenchromatographie und der ICP-MS zur Verfügung.[37]
Ionenchromatographie (IC)
Eine gute Methode, um Iodide aus einer Probelösung zu separieren, ist die Anionenaustausch-Chromatographie. Dabei wird Iodid auf einer Ionentauschersäule von anderen Ionen getrennt. Die Detektion erfolgt z. B. mit Hilfe elektrochemischer Detektoren, die entweder die Leitfähigkeit des Eluats messen oder mittels gepulster Amperometrie die geflossene Strommenge bestimmen. Mit Hilfe der gepulsten Amperometrie konnte eine Nachweisgrenze von 0,5 µg/l Iodid im Meerwasser erzielt werden.[38] Seit kurzer Zeit wird die Ionenchromatographie auch mit der Massenspektrometrie gekoppelt. Die IC-Tandem-MS-Technik erreicht eine Nachweisgrenze von 0,33 µg/l Urin.[39]
Photometrie
Die bekannteste Methode zur photometrischen Erfassung von Iodid ist die kinetische Methode nach Sandell und Kolthoff. Die katalytische Wirkung von Iodid auf die Reduktion von Cer(IV) durch As(III) ist proportional zur Iodidkonzentration und kann über die Geschwindigkeit der Entfärbung der gelben Cer(III)-Lösung bestimmt werden. Dieses Verfahren wurde von Moxon und Dixon weiterentwickelt und auf die Oxidation von Thiocyanat durch Nitrit angewandt. Die kinetische Messung der Absorbanz wird bei 450 nm durchgeführt. Es wurde eine Nachweisgrenze für den Gesamtiodgehalt in Nahrungsmitteln von 0,01 µg/g erreicht.[40]
Voltammetrie
Für die elektrochemische Bestimmung von Iodid eignet sich hervorragend die kathodische Stripping-Voltammetrie. Dabei geht der eigentlichen voltammetrischen Bestimmung eine oxidative Anreicherungsperiode auf einer Kohlenstoffpaste-Elektrode bei 700 mV voraus. Das angereicherte Iod wird beim Scannen eines Potentialfensters von 700 mV bis −400 mV wieder reduziert. Der Reduktionsstrom ist proportional zur Iodidkonzentration. Es wurde eine Nachweisgrenze von 0,25 µmol/l erzielt.[41]
Verbindungen
→ Kategorie: Iodverbindung
Iod bildet Verbindungen in verschiedenen Oxidationsstufen von −1 bis +7. Die stabilste und häufigste Oxidationsstufe ist dabei −1, die höheren werden nur in Verbindungen mit den elektronegativeren Elementen Sauerstoff, Fluor, Chlor und Brom gebildet. Dabei sind die ungeraden Oxidationsstufen +1, +3, +5 und +7 stabiler als die geraden.
Iodwasserstoff und Iodide
Anorganische Verbindungen, in denen das Iod in der Oxidationsstufe −1 und damit als Anion vorliegt, werden Iodide genannt. Diese leiten sich von der gasförmigen Wasserstoffverbindung Iodwasserstoff (HI) ab. Eine wässrige Lösung davon bezeichnet man als Iodwasserstoffsäure. In wässriger Lösung gibt sie sehr leicht das Proton (pKs –10) ab und wirkt daher stärker sauer als Bromwasserstoff (pKs –8,9) oder Chlorwasserstoff (pKs –6,2) in Wasser.
Besonders bekannt sind die Iodide der Alkalimetalle, vor allem Natriumiodid und Kaliumiodid. Iodide sind in der Regel gut wasserlöslich, Ausnahmen sind viele Schwermetalliodide wie z. B. Silberiodid, Quecksilber(I)-iodid, Quecksilber(II)-iodid und Blei(II)-iodid.
Iodide wirken als starke Reduktionsmittel. Lufteinwirkung bewirkt eine allmähliche Braunverfärbung bei Iodiden, Kupfer(II)-Salzlösungen verursachen das Ausfällen von Cu(I)-Iodid und Freisetzen von Iod. Silberiodid ist nur bei Lichtausschluss stabil, bei Belichtung oxidiert Ag(I) das Iodid zu Iod und Silberkristallkeimen (Schwarzfärbung bei Photonegativen).
Iodoxide
Es ist eine größere Anzahl Verbindungen von Iod und Sauerstoff bekannt. Diese sind nach den allgemeinen Formeln IOx (x = 1–4) und I2Ox (x = 1–7) aufgebaut. Von den Iodoxiden wurden die Verbindungen IO, IO2,[42] I2O4, I4O9, I2O5 und I2O6 nachgewiesen, wovon Diiodpentoxid (I2O5) die stabilste Verbindung ist.[43]
Iodsauerstoffsäuren
Neben den Iodoxiden bilden Iod und Sauerstoff auch mehrere Sauerstoffsäuren, bei denen ein Iodatom von einem bis vier Sauerstoffatomen umgeben ist, sowie die dazugehörigen Salze: Hypoiodige Säure (HIO) und Hypoiodite, Iodige Säure (HIO2) und die entsprechenden Iodite, Iodsäure (HIO3) und Iodate sowie die Periodsäure (H5IO6) und die dazugehörigen Periodate.
Interhalogenverbindungen
Iod geht mit den anderen Halogenen eine Reihe von Interhalogenverbindungen ein. Diese sind Iodfluorid (IF), Iodtrifluorid (IF3), Iodpentafluorid (IF5), Iodheptafluorid (IF7), Iodchlorid (ICl), Ioddichlorid ((ICl2)2), Iodtrichlorid (ICl3) und Iodbromid (IBr). Iod ist in diesen Verbindungen stets das elektropositivere Element.
Organische Iodverbindungen
Eine Vielzahl von organischen Iodverbindungen (auch Organoiodverbindungen) wird synthetisch hergestellt, z. B. Iodalkane und Iodaromaten. Eingesetzt werden sie unter anderem in der Medizin als Kontrastmittel. Auch in der Natur werden Iodverbindungen durch bspw. Makroalgen produziert. Unter Sonneneinstrahlung ist außerdem die Produktion von CH3I und anderen Verbindungen an der Meeresoberfläche möglich.[44]
Siehe auch
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 440–442.
- B. J. Füger, R. Dudczak, C. H. Pirich, G. Zettinig: Jodstoffwechsel. In: Journal für Ernährungsmedizin. 4 (2), 2002, S. 7–9 (Ausgabe für Österreich), (PDF; 185 kB).
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Iod) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu iodine in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu iodine bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Iod) entnommen.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Iod) entnommen.
- Eintrag zu Iodine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Iod in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. April 2020. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7553-56-2 bzw. Iod), abgerufen am 2. November 2015.
- Theodor C. H. Cole: Wörterbuch der Chemie / Dictionary of Chemistry. Springer-Verlag, 2018, ISBN 978-3-662-56331-1, S. 314.
- Eduard Reich: Lehrbuch der Chemie für Studenten und praktische Ärzte. Band 1, 1858.
- Duden, Die deutsche Rechtschreibung. 24. Auflage. 2006.
- iupac.org
- Wolfgang Liebscher: Nomenklatur der Anorganischen Chemie. John Wiley & Sons, 2009, ISBN 978-3-527-62545-1, S. XXV (eingeschränkte Vorschau in der Google-Buchsuche)
- Jodversorgung in Deutschland wieder rückläufig – Tipps für eine gute Jodversorgung - BfR. In: bfr.bund.de. Bundesinstitut für Risikobewertung, 20. Februar 2020, abgerufen am 7. Juni 2020.
- L. Pearce-Williams: André-Marie Ampère. In: Charles Coulston Gillispie (Hrsg.): Dictionary of Scientific Biography. Band 1: Pierre Abailard – L. S. Berg. Charles Scribner’s Sons, New York 1970, S. 139–147 (Auch Ampère vermutete ein neues Element ähnlich Chlor).
- Europäischer FOREGS-Atlas, 2005 (Forum of the European Geological Surveys Directors, Text/PDF, Karte; PDF; 446 kB).
- V. Truesdale, A. Bale, E. Woodward: The meridional distribution of dissolved iodine in near-surface waters of the atlantic ocean. In: Progress in Oceanography. 45 (3), 2000, S. 387–400, doi:10.1016/S0079-6611(00)00009-4.
- A. Butz u. a.: Constraints on inorganic gaseous iodine in the tropical upper troposphere and stratosphere inferred from balloon-borne solar occultation observations. In: Atmospheric Chemistry and Physics. 9 (18), 2009, S. 7229–7242, (PDF).
- K. Seitz u. a.: The spatial distribution of the reactive iodine species IO from simultaneous active and passive DOAS observations. In: Atmospheric Chemistry and Physics. 10 (5), 2010, S. 2117–2128, (PDF).
- Katie A. Read u. a.: Extensive halogen-mediated ozone destruction over the tropical Atlantic Ocean. In: Nature. 453 (7199), 2008, S. 1232–1235, doi:10.1038/nature07035.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 440–442.
- Deutscher Verband Tiernahrung: Wird Futter Jod zugegeben und wenn ja wieso? Gesehen 12. Mai 2015.
- M. Thamm, U. Ellert, W. Thierfelder, K.-P. Liesenkötter, H. Völzke: Jodversorgung in Deutschland. Ergebnisse des Jodmonitorings im Kinder- und Jugendgesundheitssurvey (KiGGS). In: Bundesgesundheitsbl – Gesundheitsforsch – Gesundheitsschutz. Band 50, 2007, S. 744–749, doi:10.1007/s00103-007-0236-4, PMID 17514459 (rki.de [PDF; abgerufen am 27. Oktober 2011]).
- Hans-Christian Pape, Armin Kurtz, Stefan Silbernagl: Physiologie. 7. Auflage. Georg Thieme Verlag, Stuttgart 2014, ISBN 978-3-13-796007-2, S. 620.
- Rowa Yousef Alhabbab: Radioimmunoassay (RIA). In: Basic Serological Testing (= Techniques in Life Science and Biomedicine for the Non-Expert). Springer International Publishing, Cham 2018, ISBN 978-3-319-77694-1, S. 77–81, doi:10.1007/978-3-319-77694-1_11.
- Vorrat an Jodtabletten wird ausgetauscht – BMUB-Pressemitteilung. In: bmub.bund.de. 19. Mai 2004, abgerufen am 5. November 2017.
- Die Abgabe von Jodtabletten zur Vorsorge bei einem Kernkraftwerkunfall wird ausgeweitet. In: admin.ch. 22. Januar 2014, abgerufen am 5. November 2017.
- Roland Gärtner: Hat Jod eine Bedeutung in der Prävention und adjuvanten Therapie von Brustkrebs? In: Deutsche Zeitschrift für Onkologie. 41 (2), 2009, S. 53–56, doi:10.1055/s-0029-1213543.
- Ingeborg Börglein: Jod gegen Brustkrebs. In: ÄrzteZeitung. 24. März 2012.
- B. Welz, M. Sperling: Atomabsorptionsspektrometrie. 4. Auflage. Wiley-VCH, Weinheim 1997, ISBN 3-527-60320-4.
- E. Vtorushina, A. Saprykin, G. Knapp: Optimization of the Conditions of Oxidation Vapor Generation for Determining Chlorine, Bromine and Iodine in Aqueous Solutions by Inductively Coupled Plasma Atomic-Emission Spectrometry. In: Journal of Analytical Chemistry. 63 (7), 2008, S. 643–648, doi:10.1134/S1061934808070071.
- J. Chai, Y. Muramatsu: Determination of Bromine and Iodine in Twenty-three reference Geochemical Reference Materials by ICP-MS. In: Geostandards and Geoanalytical Research. 31 (2), 2007, S. 143–150, doi:10.1111/j.1751-908X.2007.00856.x.
- B. Michalke, H. Witte: Characterization of a rapid and reliable method for iodide biomonitoring in serum and urine based on ion chromatography-ICP-mass spectrometry. In: J Trace Elem Med Biol. 29, Jan 2015, S. 63–68, PMID 24933092.
- L. Liang, Y. Cai, Sh. Mou, J. Cheng: Comparisons of disposable and conventional silver working electrode for the determination of iodide using high-performance anion-exchange chromatography with pulsed amperometric detection. In: Journal of Chromatography A. 1085, 2005, S. 37–41, doi:10.1016/j.chroma.2004.12.060, PMID 16106845.
- L. Valentin-Blasini, B. Blount, A. Delinsky: Quantification of iodide and sodium-iodide symporter inhibitors in human urine using ion chromatography tandem mass spektrometry. In: Journal of Chromatography A. 1155, 2007, S. 40–46, doi:10.1016/j.chroma.2007.04.014, PMID 17466997.
- R. Moxon, E. Dixon: Semi-automatic Method for the Determination of Total Iodine in Food. In: Analyst. 105, 1980, S. 344–352, doi:10.1039/AN9800500344, PMID 7406209.
- I. Svancara, J. Konvalina, K. Schachl, K. Kalcher, K. Vytras: Stripping Voltammetric Determination of Iodide with Synergistic Accumulation at a Carbon Paste Electrode. In: Electroanalysis. 10 (6), 1998, S. 435–441, doi:10.1002/(SICI)1521-4109(199805)10:6<435::AID-ELAN435>3.0.CO;2-J.
- B. J. Allan, J. M. C. Plane, G. McFiggans: Observations of OIO in the remote marine boundary layer. In: Geophysical Research Letters. 28 (10), 2001, S. 1945–1948, doi:10.1029/2000GL012468.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 488–489.
- Manuela Martino u. a.: A new source of volatile organoiodine compounds in surface seawater. In: Geophysical Research Letters. 36 (1), 2009, doi:10.1029/2008GL036334.


