Taurin
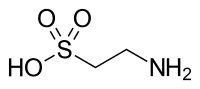
Taurin oder 2-Aminoethansulfonsäure ist eine organische Säure mit einer Sulfonsäure- und einer Aminogruppe. Taurin ist eine Aminosulfonsäure und keine Aminocarbonsäure und kann deswegen keine Peptide bilden.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Taurin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C2H7NO3S | |||||||||||||||||||||
| Kurzbeschreibung |
monokline, farblose und geruchlose Prismen[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 125,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,709 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Es entsteht im Stoffwechsel vieler Tiere und des Menschen als Abbauprodukt der Aminosäure Cystein.
Geschichte
Taurin wurde 1827 von Leopold Gmelin und Friedrich Tiedemann aus der Ochsengalle isoliert und Gallen-Asparagin genannt. Es liegt in der Galle als Taurocholsäure vor, ein Cholsäureamid, aus dem es durch saure Hydrolyse freigesetzt werden kann. Der Begriff „Taurin“ stammt von der lateinischen Bezeichnung für Stiergalle, Fel tauri, bzw. vom griechischen Wort tauros für „Stier“ und wird 1838 erstmals in der Literatur erwähnt.[2]
Herstellung
Taurin wird industriell durch Addition von Natriumsulfit an Aziridin synthetisiert.[2] Es kommt als weißes Pulver in den Handel und hat den EU-Code 3a370 als Futtermittelzusatz[6].
Eigenschaften
Taurin ist eine farblose kristalline Substanz, die sich ab 300 °C zersetzt und bei 328 °C schmilzt.[2] Es ist bis zu ca. 100 g/l in Wasser löslich. Die gute Wasserlöslichkeit und der hohe Schmelzpunkt erklären sich – ähnlich wie bei Aminosäuren – durch die Bildung des Zwitterions (H3N+–C2H4–SO3−).
Physiologische Funktion
Eigensynthese
Alle Tiere und der Mensch enthalten und benötigen Taurin im Körper. Im Stoffwechsel von Erwachsenen entsteht Taurin aus der Aminosäure Cystein, die unter Sauerstoff- und NAD+-Verbrauch in mehreren Zwischenschritten oxidiert wird. Ein zweiter Entstehungsweg ergibt sich beim Abbau von Coenzym A durch Decarboxylierung von Cysteamin. Eine Zufuhr durch Nahrungsmittel ist bei Erwachsenen nicht nötig.
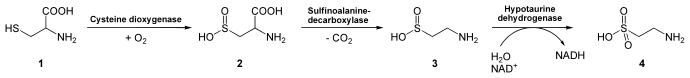
Es wird angenommen, dass der Tauringehalt im Körper eines gesunden Menschen von 70 kg Körpergewicht zwischen 30 und 70 g liegt, davon ca. 75 % in den Muskelzellen, der Rest vor allem in Gehirn, Herz und Blut. Ein gesunder Mensch hat somit zwischen 0,43 und 1 g Taurin je 1 kg Körpergewicht im Körper.[2] Muttermilch enthält pro Liter zwischen 25 und 50 Milligramm Taurin.
Funktion
Die genaue Funktion von Taurin ist, obwohl es sich in den meisten Zellen findet, ungeklärt.[7][8]
Zu den wenigen klar definierten Aufgaben von Taurin im Stoffwechsel gehören die Bildung von Gallensäurenkonjugaten, die Beeinflussung der Signalübertragung und die potentielle Rolle bei der Entwicklung des Zentralnervensystems und der Herzfunktion. Taurin reguliert den Einstrom und die Membranbindung von Calcium, beeinflusst somit die mitochondriale Calciumhomöostase. Es wirkt dabei im Nervensystem als Neuromodulator.[9] Außerdem unterstützt es als Osmoregulator die Bewegung von Natrium und Kalium durch die Zellmembran, insbesondere in den Muskelzellen.[10][11] Die dadurch unterstützte Stabilisierung des Membranpotentials weist eine Steigerung der Kontraktion und eine antiarrhythmische Wirkung am Herz auf. Eine niedrige intramuskuläre Taurinkonzentration ist charakteristisch für chronisches Nierenversagen.[12] Taurinmangel führt im menschlichen Körper zu Störungen des Immunsystems.
Taurin ist ein starkes Antioxidans und kann vor oxidativen Schäden und Entzündungsprozessen schützen.[8] In der Netzhaut sorgt Taurin durch seine antioxidativen Eigenschaften für Membranstabilität und die Funktion der Fotorezeptoren.[13]
Taurin ist wesentlich an der pränatalen und postnatalen Entwicklung des zentralen Nervensystems beteiligt.[8] Bei Kindern, die Taurin-freies Milchpulver erhielten, konnten neuronale Beeinträchtigungen gemessen werden.[8] Milchpulver zur Säuglingsernährung wird in den USA seit den 1980ern aus Gründen der Vorsicht mit Taurin angereichert.[14] Andererseits empfehlen nicht alle Organisationen die Aufnahme von Taurin in Säuglingsnahrung für voll ausgetragene Säuglinge.[14] In der EU ist Taurin kein verpflichtender Bestandteil von Säuglingsnahrung.[15]
Ernährung
Zufuhr über Lebensmittel
Taurin ist kein essentieller Nährstoff, da der Körper es selbst bilden kann. Geschätzt wird, dass der Körper täglich zwischen 200 und 400 µmol produziert.[14]
Es kommt in den meisten tierischen Lebensmitteln vor. In pflanzlichen Lebensmitteln ist es überwiegend nur in Spuren enthalten.[14] Ausnahmen bilden Rotalgen und Wolfsbeeren, welche traditionell im ostasiatischen Raum beheimatet sind.[16][17][18]
Die tägliche Aufnahme von Taurin variiert stark von Ernährungsform zu Ernährungsform.[14] Bei omnivorer Ernährung liegt sie bei etwa 58 mg, mit Schwankungen von 9 bis 372 mg. Andere Studien zeigen für eine omnivore Ernährung Werte von unter 200 mg/d oder geben Schätzungen von 40 bis 400 mg pro Tag.[19] Entsprechend stark variieren auch die Plasmakonzentrationen bei unterschiedlichen Gruppen mit Werten von 39 bis 116 µmol/L.[20]
Bei veganer Ernährung wird fast kein Taurin über die Nahrung aufgenommen. Die bei Veganern gemessenen Plasmakonzentrationen liegen niedriger, die gemessenen Urinausscheidungen sehr viel niedriger als bei einer omnivoren Ernährung. Gleichwohl sind Veganer gesund und auch Kinder, die von sich vegan ernährenden Müttern gestillt wurden wachsen und entwickeln sich normal.[14]
Nahrungsergänzungsmittel
Taurinhaltige Getränke sind seit Jahrzehnten in Japan populär.[14]
Da vermutet wurde, dass Taurin bei der Muskel-Kontraktion helfen könnte, enthalten einige Energy-Drinks Taurin.[21] Erste Studien stellten zwar einen positiven Effekt auf die sportliche Leistungsfähigkeit fest, jedoch erlaubte das Studiendesign nicht zu unterscheiden, ob dieser auf Taurin oder das ebenfalls enthaltene Glucuronolacton zurückzuführen ist.[19] Auch wenn Energy-Drinks die Taurin-Zufuhr um das Vielfache der üblichen Tagesaufnahme erhöhen, gibt es wenig Grund zur Annahme, dass davon stark positive oder negative Effekte ausgehen.[14]
Über einen Zeitraum von 56 Tagen können Taurin-Supplemente einige Marker für Entzündungen und oxidativen Stress reduzieren.[22] Bei sportlicher Aktivität kann Taurin DNA-Schäden und Laktat-Level reduzieren.[22]
Toxizität
Gestützt auf wenige Tierversuche und die weitverbreitete Nutzung als Nahrungsmittelzusatz gibt es bisher keine Hinweise auf eine Toxizität von Taurin. Wenn eine solche bestehen sollte, wäre sie gering.[14]
In Tieren
Das Interesse an Taurin stieg, als 1975 entdeckt wurde, dass Katzen, denen Futter ohne Taurin gefüttert wurde, unter degenerativen Veränderungen der Netzhaut litten. Man konnte daraus schließen, dass Katzen kein Taurin synthetisieren können.[14]
Literatur
- The use of taurine and D-glucurono-gamma-lactone as constituents of the so-called “energy” drinks. In: EFSA Journal. Band 7, Nr. 2, 2009, S. 935, doi:10.2903/j.efsa.2009.935.
Einzelnachweise
- Eintrag zu TAURINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. Mai 2020.
- Eintrag zu Taurin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Dezember 2011.
- J. A. Beukes, F. Mo, W. van Beek: Phys. Chem. Chem. Phys. 9 (2007) 4709–4720.
- Datenblatt Taurine bei Sigma-Aldrich, abgerufen am 23. April 2011 (PDF).
- Eintrag zu Taurine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Europäische Union: Register of Feed Additives pursuant to Regulation (EC) No 1831/2003, Seite 34, abgerufen am 16. Nov. 2021
- P. W. Emery: Amino Acids: Chemistry and Classification. In: Encyclopedia of Human Nutrition (Third Edition). Academic Press, Waltham 2013, ISBN 978-0-12-384885-7, S. 64–71, doi:10.1016/b978-0-12-375083-9.00009-x: „High concentrations of taurine are found within most cells of the body, although its role is far from clear. In the liver the main fate of taurine is the production of taurocholic acid, which acts as an emulsifier in the bile. Another key role for cysteine is in the synthesis of the tripeptide glutathione, which is an important intracellular antioxidant.“
- A. Catharine Ross, Benjamin Caballero, Robert J. Cousins, Katherine L. Tucker, Thomas R. Ziegler (Hrsg.): Modern Nutrition in Health and Disease. 11. Auflage. Wolters Kluwer, Baltimore 2014, ISBN 978-1-60547-461-8, S. 457: „...children whose only nutrition was taurine-free parenteral infusion or taurine-devoid formulas have exhibited ophthalmoscopically and electrophysiologically detectable retinal abnormalities and immature brainstem auditory evoked responses.“
- Todd M. Foos, Jang-Yen Wu: The Role of Taurine in the Central Nervous System and the Modulation of Intracellular Calcium Homeostasis. In: Neurochemical Research. Band 27, Nr. 1, 2002, ISSN 1573-6903, S. 21–26, doi:10.1023/A:1014890219513.
- Claire Cuisinier, Jacques Michotte de Welle, Roger K. Verbeeck, Jacques R. Poortmans, Roberta Ward, Xavier Sturbois, Marc Francaux: Role of taurine in osmoregulation during endurance exercise. In: European Journal of Applied Physiology. Band 87, Nr. 6, 2002, ISSN 1439-6327, S. 489–495, doi:10.1007/s00421-002-0679-0.
- Taurin. In: spektrum.de. Abgerufen am 5. Januar 2022.
- P. Fürst, H.-K. Biesalki u. a.: Ernährungsmedizin. Thieme-Verlag, Stuttgart 2004, S. 95.
- Sareen S. Gropper und Jack L. Smith (Hrsg.): Advanced Nutrition and Human Metabolism. 7. Auflage. Cengage Learning, Boston 2018, ISBN 978-1-305-62785-7, S. 196: „Taurine, a β-amino sulfonic acid, is made in the liver from cysteine but concentrated in muscle and the central nervous system; it is also found in smaller amounts in the heart, liver, and kidneys, among other tissues. Although taurine is not involved in protein synthesis, it is important in the retina, where it maintains membrane stability and photoreceptor cell function through its antioxidant abilities (such as scavenging peroxidative, e.g., oxychloride, products). Taurine also serves in the liver and intestine as a bile salt, taurocholate, and in the central nervous system as an inhibitory neurotransmitter“
- A. Catharine Ross, Benjamin Caballero, Robert J. Cousins, Katherine L. Tucker, Thomas R. Ziegler (Hrsg.): Modern Nutrition in Health and Disease. 11. Auflage. Wolters Kluwer, Baltimore 2014, ISBN 978-1-60547-461-8, S. 719.
- Delegierte Verordnung (EU) 2016/127 der Kommission vom 25. September 2015 zur Ergänzung der Verordnung (EU) Nr. 609/2013 des Europäischen Parlaments und des Rates im Hinblick auf die besonderen Zusammensetzungs- und Informationsanforderungen für Säuglingsanfangsnahrung und Folgenahrung und hinsichtlich der Informationen, die bezüglich der Ernährung von Säuglingen und Kleinkindern bereitzustellen sind (Text von Bedeutung für den EWR). 32016R0127, 2. Februar 2016 (europa.eu [abgerufen am 3. Januar 2022]).
- Azusa Kawasaki, Ayuko Ono, Shoshi Mizuta, Mitsunobu Kamiya, Takaaki Takenaga: The Taurine Content of Japanese Seaweed. In: Advances in Experimental Medicine and Biology. 975 Pt 2, 2017, S. 1105–1112, doi:10.1007/978-94-024-1079-2_88, PMID 28849526.
- Fen Wang, Xiao-Yu Guo, Dan-Ni Zhang, Yue Wu, Tao Wu: Ultrasound-assisted extraction and purification of taurine from the red algae Porphyra yezoensis. In: Ultrasonics Sonochemistry. Band 24, 1. Mai 2015, S. 36–42, doi:10.1016/j.ultsonch.2014.12.009.
- H. Xie, S. Zhang: [Determination of taurine in Lycium barbarum L. by high performance liquid chromatography with OPA-urea pre-column derivatization]. In: Se Pu = Chinese Journal of Chromatography. Band 15, Nr. 1, Januar 1997, S. 54–56, PMID 15739436.
- Health and Consumer Protection - Scientific Committee on Food - Outcome of discussions 22. 23. Juni 2006, abgerufen am 3. Januar 2022.
- A. Catharine Ross, Benjamin Caballero, Robert J. Cousins, Katherine L. Tucker, Thomas R. Ziegler (Hrsg.): Modern Nutrition in Health and Disease. 11. Auflage. Wolters Kluwer, Baltimore 2014, ISBN 978-1-60547-461-8, S. 458.
- M. C. G. van de Poll, Y. C. Luiking, C. H. C. Dejong, P. B. Soeters: Amino Acids: Specific Functions. In: Encyclopedia of Human Nutrition (Third Edition). Academic Press, Waltham 2013, ISBN 978-0-12-384885-7, S. 79–87, doi:10.1016/b978-0-12-375083-9.00011-8 (sciencedirect.com [abgerufen am 3. Januar 2022]).
- Amir Hossein Faghfouri, Seyyed Morteza Seyyed Shoura, Pourya Fathollahi, Mahdi Abdoli Shadbad, Shahab Papi: Profiling inflammatory and oxidative stress biomarkers following taurine supplementation: a systematic review and dose-response meta-analysis of controlled trials. In: European Journal of Clinical Nutrition. 28. September 2021, ISSN 1476-5640, doi:10.1038/s41430-021-01010-4, PMID 34584225.
