Triethylamin
Triethylamin (TEA) ist ein basisches Lösungsmittel und ein tertiäres Amin mit der Formel N(CH2CH3)3, dessen Summenformel häufig als Et3N abgekürzt wird. Im Vergleich zum einfachsten Amin, dem Ammoniak, sind alle drei Wasserstoffatome durch Ethylgruppen ersetzt. Das macht das Molekül schwerer flüchtig und viel lipophiler (unpolarer). Es bildet, ähnlich wie Ammoniak, mit Säuren salzartige Verbindungen, die man Triethylammoniumsalze nennt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
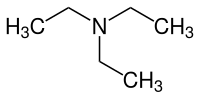 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Triethylamin | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C6H15N | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche, ölige Flüssigkeit mit ammoniakartigem (in Verdünnung fischartigem) Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 101,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert |
10,76 (25 °C)[4] | |||||||||||||||
| Löslichkeit |
gut in Wasser (80 g·l−1 bei 25 °C)[2] | |||||||||||||||
| Brechungsindex |
1,4010[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Die technische Herstellung von Triethylamin erfolgt durch Umsetzung von Ethanol bzw. Bioethanol mit Ammoniak bei Temperaturen von 180–220 °C und Drücken von 20–70 bar in Gegenwart von Wasserstoff an heterogenen Metalloxid-Katalysatoren, welche auf einem oberflächenarmen porösen Träger aufgebracht sind.[8]
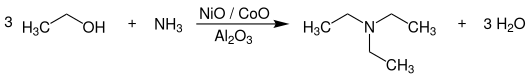
Als Katalysatoren werden Gemische von Metalloxiden, die vorwiegend aus Nickel- (NiO), Cobalt- (CoO) und Kupferoxid (CuO) bestehen und auf Aluminiumoxid (Al2O3) oder Zirkoniumdioxid (ZrO2) geträgert sind, eingesetzt. Die Reaktion wird bevorzugt in der Gasphase durchgeführt und erfolgt kontinuierlich. Der Katalysator ist als Festbett in einem Rohr- oder Rohrbündelreaktor angeordnet. Daneben werden auch die anderen Ethylamine Monoethylamin und Diethylamin gebildet. Durch einen Überschuss an Ethanol kann deren Bildung jedoch zurückgedrängt werden. Die Aufarbeitung und Reinigung des Produktgemisches erfolgt durch Destillation bzw. Rektifikation. Sowohl der Umsatz als auch die Selektivität betragen über 90 % bezogen auf Ethanol.[8]
Eigenschaften
Triethylamin ist eine farblose Flüssigkeit, die unter Normaldruck bei 89 °C siedet.[3] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 2,98368, B = 695,814 und C = −128,271 im Temperaturbereich von 323 bis 367,8 K.[9] Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·e(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 50,32 kJ/mol, β = 0,2684 und Tc = 535,6 K im Temperaturbereich zwischen 298 K und 358 K beschreiben.[10]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−127,8 kJ·mol−1[11]
−92,9 kJ·mol−1[11]als Flüssigkeit
als GasVerbrennungsenthalpie ΔcH0liquid −4377,09 kJ·mol−1[11] Wärmekapazität cp 216,43 J·mol−1·K−1 (25 °C)[12]
2,14 J·g−1·K−1 (25 °C).[12]als Flüssigkeit
als FlüssigkeitKritische Temperatur Tc 535,6 K[10] Verdampfungsenthalpie ΔVH 31,01 kJ·mol−1[10] beim Normaldrucksiedepunkt
Bei 1013 hPa (Normaldruck) hat Triethylamin mit Wasser eine untere kritische Lösungstemperatur, auch untere kritische Entmischungstemperatur genannt,[13] von 18,5 °C. Das heißt, dass Triethylamin unterhalb dieser Temperatur mit Wasser beliebig mischbar ist und es oberhalb dieser Temperatur eine Mischungslücke aufweist.[14] Mit Ethanol, Diethylether und den meisten organischen Lösungsmitteln ist die Verbindung mischbar.[3]
Triethylamin reagiert stark exotherm mit Halogenkohlenwasserstoffen, Nitroalkanen, konzentrierten Säuren, Stickstoffdioxid oder Oxidationsmitteln.[3]
Triethylamin bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −7 °C.[2][15] Der Explosionsbereich liegt zwischen 1,2 Vol.‑% (50 g/m3) als untere Explosionsgrenze (UEG) und 8,0 Vol.‑% (340 g/m3) als obere Explosionsgrenze (OEG).[2][15] Die Zündtemperatur beträgt 215 °C.[2][15] Der Stoff fällt somit in die Temperaturklasse T3.
Verwendung
In der organischen Synthesechemie dient Triethylamin als basisches Lösungsmittel. Weiterhin wird es oft als Hilfsbase eingesetzt, um bei Reaktionen freiwerdende Säuren zu binden (hierzu vgl. auch: Diisopropylethylamin). Als Beispiel sei die Bildung von Estern aus Carbonsäurechloriden und Alkoholen genannt, bei der Salzsäure freigesetzt wird. Die Bindung der Säure erfolgt durch Bildung von Triethylammoniumsalzen, im Falle von Salzsäure also Triethylammoniumchlorid (vgl. auch: Hydrochloride).[16] Weiterhin findet es bei der Herstellung verschiedener Kunststoffe und Kunstharze, wie Polyurethanen und Phenolharzen, als Katalysator Verwendung.[3]
Außerdem kann es als Bestandteil von Raketentreibstoffen (Patent der BMW Flugmotorenbau von 1943 u. a., siehe Tonka) eingesetzt werden. Weiterhin dient es als Grundstoff zur Herstellung von Pflanzenschutzmitteln, Arzneimitteln, Farben und Beschichtungsmaterialien. Als Treibstoff-„Tracer“ in experimentellen Transparentmotoren lässt es sich für laserinduzierte Fluoreszenz (LIF) einsetzen. Zur Anregung wird in diesem Fall ein UV-Laser benutzt.
In der Gießereitechnik wird Triethylamin verwendet, um eine chemische Reaktion und somit ein Aushärten des Sand-Binder-Gemisches (Cold-Box-Verfahren) zu erreichen. Hierbei wird gasförmiges Triethylamin für 30 bis 60 Sekunden in das Sand-Binder-Gemisch geleitet. Danach erfolgt eine Aushärtung der Gussform bei Raumtemperatur. Triethylamin kann auch zur Erhöhung des pH-Wertes bei Triethylenglycol (TEG) eingesetzt werden. TEG wird bei der Dehydratation verwendet.[17]
Gefahren und vorbeugende Maßnahmen
Die Substanz verursacht schwere Verätzungen der Atemwege beim Einatmen der Dämpfe, teilweise mit blutigem Auswurf, sowie der Haut, der Augen und anderer Schleimhäute beim lokalen Kontakt. Als Erste Hilfe bei inhalativen Vergiftungen kann hochdosiert Auxiloson®-Spray (Dexamethason) verabreicht werden. Bei Hautkontakt hilft sofortiges Abspülen mit reichlich Wasser und danach Abtupfen mit Polyethylenglycol (PEG) 400. Kontaminierte Kleidung sofort ausziehen. Die weitere Behandlung bleibt dem unverzüglich hinzuzuziehenden Arzt überlassen. Wenn die Augen betroffen sind, als erstes das betroffene Auge mindestens zehn Minuten mit reichlich Wasser (Augendusche etc.) spülen und den Augenarzt konsultieren. Bei Verschlucken sollte Erbrechen vermieden werden und der Betroffene sollte reichlich Flüssigkeit trinken. Auch hier muss ein Arzt befragt/hinzugezogen werden. Als systemische Folgen einer Intoxikation sind Übelkeit, Erbrechen und Kopfschmerzen bekannt.
Triethylamin ist leichtentzündlich. Der Umgang mit offenem Feuer am Arbeitsplatz ist untersagt. Vorbeugend sind beim Arbeiten mit Triethylamin Schutzkleidung, Handschuhe und eventuell Atemschutz zu tragen. Im Gefahrenfall mit flüssigkeitsbindendem Material (Rench Rapid, Chemizorb, Sand, Kieselgur) aufnehmen und als Sondermüll entsorgen. Bei kleinen Bränden CO2-Löscher, Wasser oder Schaum anwenden.
Bei Langzeiteinwirkung zeigt Triethylamin mutagene Eigenschaften. Über eine Klassifizierung als Karzinogen ist noch nicht abschließend entschieden (Stand 2017).
Verwandte Verbindungen
Einzelnachweise
- Eintrag zu TRIETHYLAMINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. Februar 2020.
- Eintrag zu Triethylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Triethylamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Dezember 2017.
- Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke: Amines, Aliphatic. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, 2000, ISBN 3-527-30673-0, doi:10.1002/14356007.a02_001.
- Arthur I. Vogel: 365. Physical properties and chemical constitution. Part XIX. Five-membered and six-membered carbon rings. In: Journal of the Chemical Society (Resumed). 1948, ISSN 0368-1769, S. 1809, doi:10.1039/JR9480001809.
- Eintrag zu Triethylamine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 121-44-8 bzw. Triethylamin), abgerufen am 19. August 2020.
- Patent EP2782898B1: Verfahren zur Herstellung von Ethylaminen und Mono-iso-propylamin (MIPA). Veröffentlicht am 21. Oktober 2015, Anmelder: BASF SE, Erfinder: Norbert Asprion, Manfred Julius, Oliver Bey, Stefanie Werland, Frank Stein, Matthias Kummer, Wolfgang Mägerlein, Johann-Peter Melder, Kevin Huyghe, Maarten Moors.
- H. J. Bittrich, E. Kauer: Zur Thermodynamik des Systems Diäthylamin-Triäthylamin. I. Das Flüssigkeits-Dampf-Gleichgewicht. In: Z. Phys. Chem. (Frankfurt/Main) 219, 1962, S. 224–238.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- N. D. Lebedeva: Heats of combustion and formation of aliphatic tertiary amine homologues. In: Russ. J. Phys. Chem. (Engl. Transl.) 40, 1966, S. 1465–1467.
- J.-P. E. Grolier, G. Roux-Desgranges, M. Berkane, E. Jimenez, E. Wilhelm: Heat capacities and densities of mixtures of very polar substances 2. Mixtures containing N,N-dimethylformamide. In: J. Chem. Thermodyn. 25, 1993, S. 41–50.
- K. Stephan u. a.: Thermodynamik: Grundlagen und technische Anwendungen. Band II, Verlag Springer, ISBN 3-540-64481-4, S. 94 (eingeschränkte Vorschau in der Google-Buchsuche).
- W. J. Moore, D. O. Hummel: Physikalische Chemie. Verlag Walter de Gruyter, 1986, ISBN 3-11-010979-4, S. 305 (eingeschränkte Vorschau in der Google-Buchsuche).
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Eintrag für Triethylamine, abgerufen am 22. Dezember 2017.
- Eintrag Triethylene Glycol bei chemicalland21.com, abgerufen am 9. Dezember 2015.


