Metalle
Metalle (von altgriechisch μέταλλον metallon „Bergwerk, Erz, Metall“) bilden diejenigen chemischen Elemente, die sich im Periodensystem der Elemente links und unterhalb einer Trennungslinie von Bor bis Astat befinden. Etwa 80 Prozent der chemischen Elemente sind Metalle, wobei der Übergang zu den Nichtmetallen über die Gruppe der Halbmetalle fließend ist, denn viele Halbmetalle können neben metallischen Modifikationen mit metallischen Bindungen auch nichtmetallische Modifikationen mit atomaren Bindungen bilden.
 Kristall aus 99,999 % reinem Gallium
Kristall aus 99,999 % reinem Gallium

Der Begriff Metall wird auch für Legierungen und einige intermetallische Phasen verwendet, denn der Begriff gilt für alle Materialien, die in fester oder flüssiger Form die folgenden vier charakteristischen metallischen Stoffeigenschaften in mehr oder weniger ausgeprägter Form aufweisen:
- hohe elektrische Leitfähigkeit, die mit steigender Temperatur abnimmt,
- hohe Wärmeleitfähigkeit, was dazu führt, dass sich Metalle kühl anfühlen
- Duktilität (Verformbarkeit), was die Bildung dünner Bleche oder langer Drähte ermöglicht
- metallischer Glanz (Spiegelglanz).
Alle diese Eigenschaften beruhen darauf, dass der Zusammenhalt der betreffenden Atome mit der metallischen Bindung erfolgt, deren wichtigstes Merkmal die im Gitter frei beweglichen Elektronen sind.
Ein einzelnes Atom dieser Elemente hat keine metallischen Eigenschaften; es ist kein Metall. Erst wenn mehrere solcher Atome miteinander wechselwirken können und wenn zwischen ihnen metallische Bindungen bestehen, zeigen solche Atomgruppen (cluster) metallische Eigenschaften.[1]
Einzelne Atome dieser Elemente können sich bei extrem schneller Abkühlung auch amorph zusammenlagern, ohne ein Kristallgitter zu bilden – siehe Metallisches Glas.
Andererseits können auch Atome von Nichtmetallen unter extremen Bedingungen (Druck) metallische Bindungen eingehen und dann die genannten metallischen Eigenschaften annehmen – siehe metallischer Wasserstoff.
Metalle finden seit Beginn der Zivilisation vielfältige Anwendungen als Werkstoffe. Unter dem Begriff Metallphysik oder auch Metallkunde beschäftigen sich Physiker und Materialwissenschaftler mit allen Grundlagen, siehe unter Festkörperphysik, und mit Anwendungen, siehe unter Materialwissenschaft.
Einteilung
| H | He | |||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
Traditionell unterteilt man Metalle nach der Dichte in Schwermetalle und Leichtmetalle und nach der Reaktivität in Edelmetalle und unedle Metalle, wobei Letztere gute Reduktionsmittel darstellen. Siehe hierzu auch den Hauptartikel Metallischer Werkstoff (sowie zur Reaktivität unter Redoxreaktion).
Metalle werden gebildet von den Elementen, die im Periodensystem der Elemente im Bereich links und unterhalb einer Linie vom Bor zum Astat stehen, wobei der metallische Charakter von oben nach unten bzw. von rechts nach links zunimmt. Ganz oben rechts befinden sich die Nichtmetalle, dazwischen die Halbmetalle. Die Nebengruppenelemente bilden ausnahmslos Metalle. Die Grenze zu den Nichtmetallen ist fließend. So haben zum Beispiel Antimon, Arsen, Cer und Zinn sowohl metallische als auch nichtmetallische Modifikationen.[3]
Für das chemische Verhalten ist auch die Zugehörigkeit zu Haupt- oder Nebengruppen des Periodensystems entscheidend.
Physikalische Eigenschaften
Allgemeines

Voraussetzung für die Bildung des metallischen Zustandes sind folgende Eigenschaften von Atomen:
- Die Zahl der Elektronen in der äußeren Schale ist gering und kleiner als die Koordinationszahl
- Die (zur Abspaltung dieser Außenelektronen nötige) Ionisierungsenergie ist klein (< 10 eV)
Daraus resultiert, dass derartige Atome sich untereinander nicht über Atombindungen zu Molekülen oder Gittern verbinden können. Allenfalls in Metalldämpfen kommen Atombindungen vor, z. B. besteht Natriumdampf zu etwa 1 % aus Na2-Molekülen.
Metallatome ordnen sich vielmehr zu einem Metallgitter, welches aus positiv geladenen Atomrümpfen besteht, während die Valenzelektronen über das ganze Gitter verteilt sind; keines dieser Elektronen gehört mehr zu einem bestimmten Kern. Diese frei beweglichen Elektronen kann man sich als Teilchen eines Gases vorstellen, das den Platz zwischen den Atomrümpfen ausfüllt. Da dieses Elektronengas unter anderem die gute elektrische Leitfähigkeit der Metalle bewirkt, wird das Energieniveau, auf dem sich die freien Elektronen befinden, als „Leitungsband“ bezeichnet. Die genauen energetischen Gegebenheiten beschreibt das Bändermodell auf Basis des Orbitalmodells.
Aus dieser Bindungsart und diesem Gitteraufbau resultieren folgende typische Eigenschaften der Metalle:
- Glanz (Spiegelglanz): Die frei beweglichen Elektronen können fast die gesamte auftreffende elektromagnetische Strahlung bis zu Wellenlängen der Röntgenstrahlung wieder emittieren; so entstehen der Glanz und Reflexion; aus glatten Metallflächen werden deshalb Spiegel angefertigt.
- Undurchsichtigkeit: Die vorbeschriebene, an der Metalloberfläche stattfindende Reflexion und die Absorption des nicht reflektierten Anteiles bewirken, dass zum Beispiel Licht kaum in Metall eintreten kann. Metalle sind deshalb nur in dünnsten Schichten etwas lichtdurchlässig und erscheinen in der Durchsicht grau oder blau.
- Gute elektrische Leitfähigkeit: Die Wanderung der frei beweglichen Elektronen in eine Richtung ist der elektrische Strom.
- Gute thermische Leitfähigkeit: Die leicht verschiebbaren Elektronen nehmen an der Wärmebewegung teil. Sie übertragen zudem die thermische Eigenbewegung der Atomrümpfe (Schwingungen) und tragen so zum Wärmetransport bei, vgl. Wärmeleitung.
- Gute Verformbarkeit (Duktilität): Im Metall befinden sich Korngrenzen und Versetzungen, die sich schon bei einer Dehnung unterhalb der Bruchdehnung bewegen können, das heißt, ohne dass der Zusammenhalt verloren geht; je nach Gittertyp verformt sich also ein Metall, bevor es bricht.
- Relativ hoher Schmelzpunkt: Er resultiert aus den allseitig gerichteten Bindungskräften zwischen den Kationen und den frei beweglichen Elektronen, ein jedoch weniger starker Effekt als die elektrostatischen Anziehungskräfte zwischen Ionen in Salzkristallen.
Schmelz- und Siedetemperaturen
Als hochschmelzend bezeichnet man Metalle, deren Schmelzpunkt TE über 2000 K bzw. über dem Schmelzpunkt von Platin (TE-Platin = 2045 K = 1772 °C) liegt. Dazu gehören die Edelmetalle Ruthenium, Rhodium, Osmium und Iridium und Metalle der Gruppen IVB (Zirconium, Hafnium), VB (Vanadium, Niob, Tantal), VIB (Chrom, Molybdän, Wolfram) und VIIB (Technetium, Rhenium).
Wärmeleiteigenschaften
Die für die Wärmeleitung relevanten Eigenschaften wie Dichte, Wärmekapazität, Wärmeleitfähigkeit und Temperaturleitfähigkeit variieren stark. So hat etwa Silber mit 427 W/(m·K) eine ca. 50-fach höhere Wärmeleitfähigkeit als Mangan, siehe Liste mit Werten.
Physikalische Eigenschaften einiger Metalle. Die höchsten und niedrigsten Werte sind farblich markiert. Element Lithium Aluminium Chrom Eisen Kupfer Zink Silber Zinn Caesium Wolfram Osmium Gold Quecksilber Blei Schmelzpunkt in °C (1013 hPa)[4] 180,54 660,2 1907 1538 1084,62 419,53 961,78 231,93 28,44 3422 3130 1064,18 −38,83 327,43 Siedepunkt in °C (1013 hPa)[4] 1330 2470 2482 3000 2595 907 2210 2602 690 5930 5000 2970 357 1744 Dichte in g/cm3 (20 °C, 1013 hPa)[4] 0,534 2,6989 7,14 7,874 8,92 7,14 10,49 α-Zinn: 5,769 β-Zinn: 7,265
1,90 19,25 22,59 19,32 13,5459 11,342 Mohshärte 0,6 2,75 8,5 4,0 3,0 2,5 2,5 1,5 0,2 7,5 7,0 2,5 1,5 Elektrische Leitfähigkeit in 106 S/m 10,6 37,7 7,87 10,0 58,1 16,7 61,35 8,69 4,76 18,52 10,9 45,5 1,04 4,76 Wärmeleitfähigkeit in W/(m·K) 85 235 94 80 400 120 430 67 36 170 88 320 8,3 35 Ordnungszahl 3 13 24 26 29 30 47 50 55 74 76 79 80 82 Atommasse in u 6,94 26,982 51,996 55,845 63,546 65,38 107,868 118,710 132,905 183,84 190,23 196,967 200,592 207,2 Elektronegativität 0,98 1,61 1,66 1,83 1,9 1,65 1,93 1,96 0,79 2,36 2,2 2,54 2,0 2,33 Kristallsystem(1) cl cl cl cl cF hcp cF α-Zinn: A4 β-Zinn: tl
cl cl hcp cF P3 cF - (1) cl: kubisch raumzentriert, cF: kubisch flächenzentriert, hcp: hexagonal dichteste Kugelpackung, A4: Diamantstruktur, tl: tetragonal innenzentriert, P3: rhomboedrisch
Chemische Eigenschaften
In Verbindung mit Nichtmetallen treten die Metalle im Allgemeinen als Kationen auf, d. h., die äußeren Elektronen werden vollständig an die Nichtmetallatome abgegeben und es bildet sich eine Ionenverbindung (Salz). In einem Ionengitter werden die Ionen nur durch elektrostatische Kräfte zusammengehalten.
Bei Verbindungen mit Übergangsmetallen und bei größeren Anionen (wie dem Sulfid-Ion) können alle Übergangsstufen zur Atombindung vorkommen.
Mit Nichtmetallen wie Wasserstoff, Kohlenstoff und Stickstoff werden auch Einlagerungsverbindungen gebildet, wobei sich die Nichtmetallatome in Lücken des Metallgitters befinden, ohne dieses wesentlich zu verändern. Diese Einlagerungsverbindungen behalten die typischen Metalleigenschaften wie die Elektrische Leitfähigkeit.
Metallkationen, v. a. die der Nebengruppenmetalle, bilden mit Basen (Wasser, Ammoniak, Halogeniden, Cyaniden u. v. a.) Komplexverbindungen, deren Stabilität nicht allein durch die elektrostatische Anziehung erklärt werden kann.
Metalle in höheren Oxidationsstufen bilden auch Komplexanionen, z. B.:
- Chromtrioxid löst sich in Kalilauge unter Bildung von Kaliumchromat und Wasser.
Legierungen
Mischungen aus einem Metall und einem oder mehreren anderen Elementen, die metallisch oder nicht-metallisch sein können, heißen Legierungen, wenn diese Mischung die typischen metallischen Eigenschaften aufweist (Verformbarkeit, elektrische Leitfähigkeit, …), wenn also weiterhin eine metallische Bindung vorliegt.
Legierungen haben oft völlig andere physikalische und chemische Eigenschaften als die reinen Metalle. Vor allem die Härte und die Festigkeit sind teilweise um Größenordnungen höher. Ebenso kann sich die Korrosionsbeständigkeit deutlich erhöhen. Der Schmelzpunkt von Legierungen liegt dagegen oft unter dem der reinen Metalle; bei einer bestimmten Zusammensetzung wird der tiefste Schmelzpunkt erreicht, das Eutektikum.
Als erste gezielt hergestellte Legierung der Menschheitsgeschichte wurde die Bronze genutzt, eine Legierung aus 80 bis 95 % Kupfer und 5 bis 20 % Zinn. Seit langem ist Stahl die am häufigsten verwendete Legierung; er ist eine Mischung aus Eisen mit Anteilen von Kohlenstoff und teils von weiteren Elementen (→ Stahllegierung).
Vorkommen
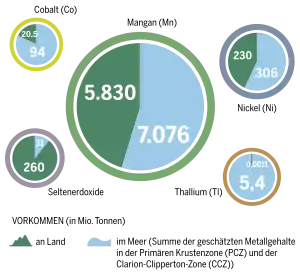
Quelle: Meeresatlas – Daten und Fakten über unseren Umgang mit dem Ozean, 2017[5]
Der Erdkern besteht zum größten Teil aus Eisen, da es erstens in sehr großen Mengen vorkommt, weil es das kernphysikalisch stabilste Element ist, und zweitens aufgrund seiner hohen Dichte.
In der Erdkruste dagegen überwiegen die Nichtmetalle, relativ häufige Metalle sind Aluminium, Eisen, Mangan, Titan, Calcium, Magnesium, Natrium und Kalium. Viele seltene Metalle treten aber in ihren Abbaustätten stark angereichert auf. Gesteine, die nutzbare Metalle in abbauwürdigen Konzentrationen enthalten, werden Erze genannt. Zu den wichtigsten Erzen gehören:
Die Metalle werden aus den jeweiligen Erzen metallurgisch gewonnen.
Manche Edelmetalle, v. a. Gold, kommen auch gediegen, d. h. in reiner Form und nicht als Verbindung (Erz oder Mineral) vor.
Verwendung

Fünf Reichsmark (1927–1933)

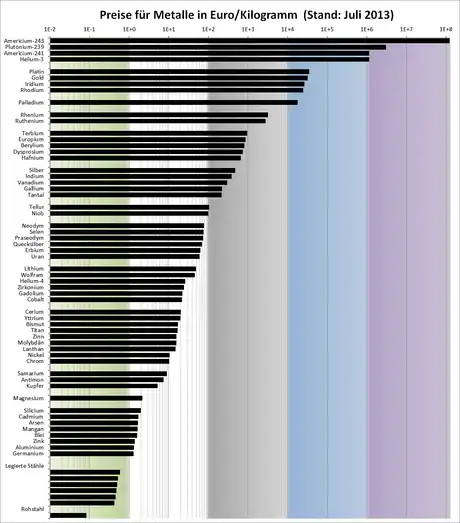
Viele Metalle sind wichtige Werkstoffe. Die moderne Welt wäre ohne Metalle unmöglich. Nicht ohne Grund werden Phasen der Menschheitsentwicklung nach den verwendeten Werkstoffen als Steinzeit, Bronzezeit, Eisenzeit bezeichnet.
Reine Metalle werden zur Herstellung elektrischer Leitungen genutzt, da sie die größte Leitfähigkeit besitzen. Dafür wird vor allem unlegiertes Kupfer und Aluminium und selten auch Gold verwendet. Ansonsten werden reine Metalle praktisch nie eingesetzt.
Die folgende Liste enthält die wichtigsten Metalle und Legierungsbestandteile, keine Verbindungen:
- Aluminium: Leichtmetall; Aluminiumfolie, Behälter, Leitermaterial (Elektrotechnik)
- Beryllium: Legierungen, vor allem mit Kupfer und Aluminium; Kernwaffen (Neutronenreflektor)
- Bismut: Legierungen
- Blei: Legierungen, Bleiakkumulator, Lote, Korrosionsschutz, Strahlenschutz, Gewicht
- Cadmium: Bestandteil von Akkumulatoren
- Chrom: Legierungsbestandteil (Chrom-Vanadium-Stahl, Chrom-Nickel-Stahl, Chrom-Molybdänstahl), Überzugsmetall
- Eisen: wichtigster metallischer Werkstoff (Stahl, Gusseisen), viele Legierungen
- Gallium: Thermometer
- Gold: Schmuckmetall, Blattgold, Elektrotechnik, Wertanlage, Währungsabsicherung
- Indium: Indiumdichtung, Lote
- Iridium: Elektroden, Zündkerzen
- Kalium: legiert mit Natrium als Kühlmittel in Kernreaktoren
- Cobalt: Magnete
- Kupfer: Elektrotechnik (zweithöchste Leitfähigkeit nach Silber), Bronze, Messing
- Magnesium: für besonders leichte Werkstücke; Einweg-Blitzbirnen bzw. Blitzlichtpulver
- Mangan: Legierungsbestandteil (Mangan-Stahl)
- Molybdän: Legierungsbestandteil (Molybdän-Stahl) zur Erhöhung der Warmfestigkeit
- Natrium: legiert mit Kalium als Kühlmittel in Kernreaktoren
- Nickel: Legierungen (Nickel-Eisen, Nickel-Chrom, Nickel-Kupfer etc.), Legierungsbestandteil (Chrom-Nickel-Stahl), Magnete
- Osmium: früher in Glühlampen
- Palladium: Katalyse, Wasserstoffspeicherung, Schmuck
- Platin: Schmuckmetall, Katalyse, eines der wertvollsten Metalle
- Quecksilber: Thermometer, Kompaktleuchtstofflampen
- Rhodium: Schmuckmetall
- Ruthenium: Katalysator, Erhöhung des Härtegrades von Platin und Palladium
- Silber: Schmuckmetall, Fotografie
- Tantal: Kondensatoren
- Titan: für Leichtbauweise ohne Rücksicht auf die Kosten, Schmuck
- Uran: Kernreaktoren, Radioaktivität, Uranmunition
- Vanadium: Legierungsbestandteil (Chrom-Vanadium-Stahl) für wärmefeste Stähle, Katalysator zur Synthese von Schwefelsäure (Vanadium(V)-oxid)
- Wolfram: Glühlampen (höchster Schmelzpunkt aller Metalle), Spezialstähle, Kugelschreiberminen (Kugeln)
- Zink: Legierungsbestandteil (Messing), Zinkdruckgussteile (Zamak-Legierung), Verzinken von Stahlteilen (Feuerverzinken, Galvanisches Verzinken)
- Zinn: Legierungsbestandteil (Bronze), Lote (Lötzinn), Weißblech, Zinnfiguren
- Zirconium: Hülle für Brennstäbe in Kernreaktoren
Metall in der Astrophysik
In der Astrophysik ist Metall anders definiert, siehe dazu Metallizität; hier bezeichnet es jedes chemische Element oberhalb einer bestimmten Ordnungszahl (meist höher als Helium). Das sind alle durch Kernfusion in Sternen oder durch Supernovae entstandenen Elemente, wogegen Wasserstoff und Helium (zusammen mit einigen Spuren von Lithium) als durch den Urknall entstanden gedacht werden. Die Metallizität eines Sterns hängt mit seinem Entstehungszeitpunkt zusammen (siehe Population).
Es wird angenommen, dass Wasserstoff im Inneren von hinreichend schweren Gasplaneten in den metallischen Zustand (im Sinne der chemischen Metalldefinition) übergehen kann; dieser metallische Wasserstoff ist wahrscheinlich auch für das extrem starke Magnetfeld des Jupiter verantwortlich. Metallischer Wasserstoff trägt aber nicht zur astrophysikalischen Metallizität des Objekts bei, in dem er vorkommt.
Metall in der Chinesischen Philosophie
Metall bezeichnet hier ein Element der traditionellen Fünf-Elemente-Lehre.
Heraldik
Als Metalle werden in der Heraldik die Tinkturen (Wappenfarben) Gold und Silber bezeichnet. Bei Wappenmalereien wird als Ersatz für Gold die Farbe Gelb und als Ersatz für Silber die Farbe Weiß verwendet.
Siehe auch
- Festkörper
- Ikora, Verfahren zur farblichen Veränderung zwecks Dekoration
Literatur
- Zur Geschichte der Metalle
- Karl Otto Henseling: Bronze, Eisen, Stahl. Bedeutung der Metalle in der Geschichte (= Rororo. rororo-Sachbuch 7706 = Kulturgeschichte der Naturwissenschaften und der Technik. Bd. 6). Rowohlt, Reinbek bei Hamburg 1981, ISBN 3-499-17706-4.
- Franz Zippe: Geschichte der Metalle. Wien 1857; Neudruck Wiesbaden 1967.
- Adelbert Rössing: Geschichte der Metalle. Berlin 1901.
- Zu den Metallen
- Erhard Hornbogen, Hans Warlimont: Metalle – Struktur und Eigenschaften der Metalle und Legierungen, Springer, 6. Auflage, 2016, ISBN 978-3-662-47952-0.
- Wolfgang Glöckner, Walter Jansen, Rudolf Georg Weissenhorn (Hrsg.): Handbuch der experimentellen Chemie. Sekundarbereich II. Band 5: Chemie der Gebrauchsmetalle. Aulis-Verlag Deubner, Köln 2003, ISBN 3-7614-2384-5.
Weblinks
- [https://de.wikipedia.org/w/index.php?title=Wikipedia:Defekte_Weblinks&dwl=http://www.physik.rwth-aachen.de/~harm/aixphysik/atom/Periodic/index.html Seite nicht mehr abrufbar], Suche in Webarchiven: [http://timetravel.mementoweb.org/list/2010/http://www.physik.rwth-aachen.de/~harm/aixphysik/atom/Periodic/index.html Animationen der Atome von Metallen und Nichtmetallen]
Einzelnachweise
- Uwe Kreibig: Wann ist Gold ein Metall? In: Physik-Journal. Bd. 1, Nr. 1, 2002, ISSN 1617-9439, S. 20–21, online (PDF; 461 kB).
- Burkhard Fricke (1975), Superheavy elements: a prediction of their chemical and physical properties
- Römpp Lexikon Chemie, 9. Auflage, Band 4, Seite 2709
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006 (doi:10.1002/14356007.a17_485).
- Meeresatlas - Daten und Fakten über unseren Umgang mit dem Ozean, dort S. 34