Arsen
Arsen [aʁˈzeːn] ist ein chemisches Element mit dem Elementsymbol As und der Ordnungszahl 33. Im Periodensystem der Elemente steht es in der 4. Periode und der 5. Hauptgruppe, bzw. 15. IUPAC-Gruppe oder Stickstoffgruppe. Arsen kommt selten gediegen vor, meistens in Form von Sulfiden. Es gehört zu den Halbmetallen, da es je nach Modifikation metallische oder nichtmetallische Eigenschaften zeigt.
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Arsen, As, 33 | |||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Halbmetalle | |||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 15, 4, p | |||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | metallisch grau, gelb oder schwarz | |||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-148-6 | |||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.316 | |||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 5,5 ppm[1] | |||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | ||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 74,921595(6)[3] u | |||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 115 (114) pm | |||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 119 pm | |||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 185 pm | |||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d10 4s2 4p3 | |||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 9.78855(25) eV[4] ≈ 944.45 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 18.5892(10) eV[4] ≈ 1793.58 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 28.349(12) eV[4] ≈ 2735.3 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 50.15(6) eV[4] ≈ 4839 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 62.77(6) eV[4] ≈ 6056 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | ||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | 3 | |||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | trigonal (grau) | |||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 5,73 g/cm3 (grau)[7] 1,97 g/cm3 (gelb)[7] 4,7–5,1 g/cm3 (schwarz)[7] | |||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | graues As: 3,5 | |||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (grau: χm = −2,2 · 10−5[8] gelb: = −1,8 · 10−6[8] schwarz: = −1,9 · 10−5[8]) | |||||||||||||||||||||||||||||||||||||||||||||
| Sublimationspunkt | 886[9] K (613 °C) | |||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 12,95 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | Sublimation: 32,4 kJ·mol−1[9] | |||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 27,7 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 328,5[1] J·kg−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 3,03 · 106 A·V−1·m−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 50 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [10] | ||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −3, 3, 5 | |||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 0,240 V (½ As2O3 + 3 H+ + 3 e− → As + 1½ H2O) | |||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,18 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||
Umgangssprachlich wird auch das als Mordgift bekannte Arsenik meist einfach „Arsen“ genannt. Arsenverbindungen kennt man schon seit dem Altertum. Als mutagenes Klastogen können Arsenverbindungen als Gift wirken, welches Chromosomenaberrationen hervorrufen und somit karzinogene Wirkung besitzen kann.[12][13]
Arsen wird zur Dotierung von Halbleitern und als Bestandteil von III-V-Halbleitern wie Galliumarsenid genutzt. Die organische Arsenverbindung Arsphenamin (Salvarsan) galt trotz schwerer und schwerster Nebenwirkungen[14] Anfang des 20. Jahrhunderts als Durchbruch in der Behandlung der Syphilis. Heute wird Arsentrioxid als letzte Behandlungsoption in der Therapie der Promyelozytenleukämie angewendet.
Geschichte

Der Name Arsen geht auf altgriechisch ἀρσενικόν arsenikón zurück, der antiken Bezeichnung des Arsenminerals Auripigment. Sie findet sich schon bei Dioskurides im 1. Jahrhundert. Die griechische Bezeichnung scheint ihrerseits ihren Ursprung im Altpersischen (al-)zarnik (goldfarben, Auripigment, „Arsen“)[15] zu haben und gelangte wohl durch semitische Vermittlung ins Griechische. Volksetymologisch wurde der Name fälschlicherweise vom gleichlautenden (alt- und neu-)griechischen Wort αρσενικός arsenikós abgeleitet, das sich etwa mit männlich/stark übersetzen lässt. Erst seit dem 19. Jahrhundert ist die Bezeichnung Arsen gebräuchlich. Das Elementsymbol wurde 1814 von Jöns Jakob Berzelius vorgeschlagen.
Der erste Kontakt von Menschen mit Arsen lässt sich aus dem 3. Jahrtausend v. Chr. nachweisen: In den Haaren der im Gletschereis erhaltenen Mumie des volkstümlich Ötzi genannten Alpenbewohners ließen sich größere Mengen Arsen nachweisen, was archäologisch als Hinweis darauf gedeutet wird, dass der betroffene Mann in der Kupferverarbeitung tätig war – Kupfererze sind oft mit Arsen verunreinigt. Im klassischen Altertum war Arsen in Form der Arsen-Sulfide Auripigment (As2S3) und Realgar (As4S4) bekannt, die etwa von dem Griechen Theophrastos, dem Nachfolger Aristoteles, beschrieben wurden. Auch der griechische Philosoph Demokrit hatte im 5. Jahrhundert v. Chr. nachweislich Kenntnisse über Arsenverbindungen. Der Leidener Papyrus X aus dem 3. Jahrhundert nach Chr. lässt darauf schließen, dass sie benutzt wurden, um Silber goldartig und Kupfer weiß zu färben. Der römische Kaiser Caligula hatte angeblich bereits im 1. Jahrhundert nach Chr. ein Projekt zur Herstellung von Gold aus dem (goldgelben) Auripigment in Auftrag gegeben. Die Alchimisten, die Arsen-Verbindungen nachweislich der Erwähnung im antiken Standardwerk Physica et Mystica kannten, vermuteten eine Verwandtschaft mit Schwefel und Quecksilber. Arsen(III)-sulfid kam als Malerfarbe und Enthaarungsmittel zum Einsatz sowie zur äußerlichen als auch inneren Behandlung von Lungenkrankheiten.
Im Mittelalter wurde Arsenik (Arsen(III)-oxid) im Hüttenrauch (staubbeladenes Abgas metallurgischer Öfen) gefunden. Albertus Magnus beschrieb um 1250 erstmals die Herstellung von Arsen durch Reduktion von Arsenik mit Kohle. Er gilt daher als Entdecker des Elements, auch wenn es Hinweise darauf gibt, dass das elementare Metall schon früher hergestellt wurde. Paracelsus führte es im 16. Jahrhundert in die Heilkunde ein. Etwa zur gleichen Zeit wurden Arsenpräparate in der chinesischen Enzyklopädie Bencao Gangmu des Apothekers Li Shizhen beschrieben. Dieser Autor hebt insbesondere die Anwendung als Pestizid in Reisfeldern hervor.
Im 17. Jahrhundert wurde das gelbe Auripigment bei niederländischen Malern als Königsgelb populär. Da sich das Pigment über längere Zeiträume hinweg in Arsen(III)-oxid umwandelt und von der Leinwand bröckelt, entstehen Schwierigkeiten bei der Restaurierung. Von 1740 bis 1808 wurden Arsenpräparate in Europa mit Erfolg als Beizmittel im Pflanzenschutz eingesetzt. Wegen ihrer hohen Giftigkeit wurde diese Nutzung schließlich verboten. Der Einsatz von Arsenzusätzen für den Bleiguss beruht auf der größeren Härte solcher Bleilegierungen, typische Anwendung sind Schrotkugeln. Obwohl die Giftigkeit und die Verwendung als Mordgift bekannt war, ist Arsen im beginnenden 19. Jahrhundert eines der bedeutendsten Asthmamittel. Grundlage sind anscheinend Berichte, in denen den Chinesen nachgesagt wurde, sie würden Arsen in Kombination mit Tabak rauchen, um Lungen zu bekommen, die stark wie Blasebälge seien. Ebenfalls bis ins 19. Jahrhundert fanden Arsenverbindungen äußerlich und innerliche Anwendungen bei bösartigen Geschwülsten, Hauterkrankungen und (etwa in Form der Fowlerschen Tropfen) bei Fieber.[16]
Arsen wurde in Form von Kupferarsenaten in Farbmitteln wie dem Pariser Grün eingesetzt, um Tapeten zu bedrucken. Bei hoher Feuchtigkeit wurden diese Pigmente durch Schimmelpilzbefall in giftige flüchtige Arsenverbindungen umgewandelt, die nicht selten zu chronischen Arsenvergiftungen führten.
Im Ersten Weltkrieg wurden Arsenverbindungen in chemischen Kampfstoffen (Blaukreuz) oder Lewisit eingesetzt. Bei den Opfern bewirkten sie durch Angriff auf Haut und Lungen grausame Schmerzen und schwerste körperliche Schädigungen.
Vorkommen

(Mineralogisches Museum der Universität Bonn)

Arsen kommt in geringen Konzentrationen von bis zu 10 ppm praktisch überall im Boden vor. Es ist in der Erdkruste ungefähr so häufig wie Uran oder Germanium. In der kontinentalen Erdkruste kommt Arsen mit durchschnittlich 1,7 ppm vor, wobei es durch seinen lithophilen Charakter (= Silikat liebend) in der oberen Kruste angereichert ist (2 ppm gegenüber 1,3 ppm in der unteren Kruste);[17] damit liegt Arsen in der Tabelle der häufigsten Elemente an 53. Stelle.
Arsen (Scherbenkobalt) kommt in der Natur gediegen, das heißt in elementarer Form, vor und ist daher von der International Mineralogical Association (IMA) als eigenständiges Mineral anerkannt. Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Arsen unter der System-Nr. 1.CA.05 (Elemente – Halbmetalle (Metalloide) und Nichtmetalle – Arsengruppen-Elemente)[18] (8. Auflage: I/B.01-10) eingeordnet. Die im englischsprachigen Raum ebenfalls geläufige Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. 01.03.01.01.
Weltweit sind zurzeit (Stand: 2011) rund 330 Fundorte für gediegenes Arsen bekannt.[19] In Deutschland wurde es an mehreren Fundstätten im Schwarzwald (Baden-Württemberg), im bayerischen Spessart und Oberpfälzer Wald, im hessischen Odenwald, in den Silberlagerstätten des Westerzgebirges (Sachsen), am Hunsrück (Rheinland-Pfalz), im Thüringer Wald sowie in Reichenstein/ Niederschlesien[20] gefunden. In Österreich trat Arsen an mehreren Fundstätten in Kärnten, Salzburg und der Steiermark zutage. In der Schweiz fand sich gediegen Arsen in den Kantonen Aargau und Wallis.
Weitere Fundorte sind in Australien, Belgien, Bolivien, Bulgarien, Chile, China, Finnland, Frankreich, Griechenland, Irland, Italien, Japan, Kanada, Kasachstan, Kirgisistan, Madagaskar, Malaysia, Marokko, Mexiko, Mongolei, Neuseeland, Norwegen, Österreich, Peru, Polen, Rumänien, Russland, Schweden, Slowakei, Spanien, Tschechien, Ukraine, Ungarn, im Vereinigten Königreich (Großbritannien) und in den Vereinigten Staaten (USA) bekannt.
Weit häufiger kommt das Element in verschiedenen intermetallischen Verbindungen mit Antimon (Allemontit) und Kupfer (Whitneyit) sowie in verschiedenen Mineralen vor, die überwiegend der Klasse der Sulfide und Sulfosalze angehören. Insgesamt sind bisher (Stand: 2011) 565 Arsenminerale bekannt.[21] Die höchsten Konzentrationen an Arsen enthalten dabei unter anderem die Minerale Duranusit (ca. 90 %), Skutterudit und Arsenolith (jeweils ca. 76 %), die allerdings selten zu finden sind. Weit verbreitet sind dagegen Arsenopyrit (Arsenkies), Löllingit, Realgar (Rauschrot) und Auripigment (Orpiment, Rauschgelb). Weitere bekannte Minerale sind Cobaltit (Kobaltglanz), Domeykit (Arsenkupfer), Enargit, Gersdorffit (Nickelarsenkies), Proustit (Lichtes Rotgültigerz, Rubinblende), Rammelsbergit sowie Safflorit und Sperrylith.
Arsenate finden sich häufig in phosphathaltigen Gesteinen, da sie eine vergleichbare Löslichkeit aufweisen und das häufigste Sulfidmineral Pyrit kann bis zu einigen Massenprozent Arsen einbauen.
Arsen wird heutzutage als Nebenprodukt der Verhüttung von Gold-, Silber-, Zinn-, Kupfer-, Cobalt- und weiteren Buntmetallerzen sowie bei der Verarbeitung von Phosphatrohstoffen gewonnen. Die größten Produzenten im Jahr 2009 waren China, Chile, Marokko und Peru. Arsen ist nur schwer wasserlöslich und findet sich daher nur in geringen Spuren, etwa 1,6 ppb (Milliardstel Massenanteilen) in Meeren und Ozeanen.
In der Luft findet man Arsen in Form von partikulärem Arsen(III)-oxid. Als natürliche Ursache dafür hat man Vulkanausbrüche identifiziert, die insgesamt jährlich geschätzte 3000 Tonnen in die Erdatmosphäre eintragen. Bakterien setzen weitere 20.000 Tonnen in Form organischer Arsenverbindungen wie Trimethylarsin frei. Ein großer Teil am freigesetzten Arsen entstammt der Verbrennung fossiler Brennstoffe wie Kohle oder Erdöl. Die geschätzten Emissionen, verursacht durch den Straßenverkehr und stationäre Quellen, betrugen 1990 in der Bundesrepublik Deutschland 120 Tonnen (20 Tonnen in den alten, 100 Tonnen in den neuen Bundesländern). Die Außenluftkonzentration von Arsen liegt zwischen 0,5 und 15 Nanogramm pro Kubikmeter.
| Land | Tonnen |
|---|---|
| Volksrepublik China | 25.000 |
| Chile | 11.500 |
| Marokko | 7.000 |
| Peru | 4.000 |
| Kasachstan | 1.500 |
| Russland | 1.500 |
| Mexiko | 1.500 |
| Belgien | 1.000 |
| andere | 500 |
| Gesamt | 53.500 |
Gewinnung und Darstellung

Arsen fällt in größeren Mengen als Nebenprodukt bei der Gewinnung von Kupfer, Blei, Cobalt und Gold an. Dies ist die Hauptquelle für die kommerzielle Nutzung des Elements.
Es kann durch thermische Reduktion von Arsen(III)-oxid mit Koks oder Eisen und durch Erhitzen von Arsenkies (FeAsS) oder Arsenikalkies (FeAs2) unter Luftabschluss in liegenden Tonröhren gewonnen werden. Dabei sublimiert elementares Arsen, das an kalten Oberflächen wieder in den festen Aggregatzustand zurückkehrt.
- Arsenkies zersetzt sich in Eisensulfid und elementares Arsen.
- Arsenikalkies zersetzt sich in Eisenarsenid und elementares Arsen.
Für die Halbleitertechnik wird Arsen, dessen Reinheit über 99,99999 Prozent betragen muss, durch Reduktion von mehrfach destilliertem Arsen(III)-chlorid im Wasserstoffstrom hergestellt:
- Arsentrichlorid reagiert mit Wasserstoff zu Chlorwasserstoff und elementarem Arsen.
Früher wurde es auch durch Sublimation aus Lösungen in flüssigem Blei erzeugt. Dabei wird der Schwefel der Arsen-Erze durch das Blei in Form von Blei(II)-sulfid gebunden. Die hierbei erzielten Reinheiten von über 99,999 Prozent waren für Halbleiteranwendungen nicht ausreichend. Eine andere Möglichkeit besteht im Auskristallisieren bei hohen Temperaturen aus geschmolzenem Arsen oder in der Umwandlung in Monoarsan, einer anschließenden Reinigung sowie der Zersetzung bei 600 °C in Arsen und Wasserstoff.[24]
Eigenschaften
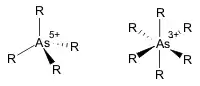

Arsen bildet mit Stickstoff, Phosphor, Antimon und Bismut die 5. Hauptgruppe des Periodensystems und nimmt wegen seiner physikalischen und chemischen Eigenschaften den Mittelplatz in dieser Elementgruppe ein. Arsen hat eine relative Atommasse von 74,92159. Der Radius des Arsen-Atoms beträgt 124,5 Pikometer. In kovalent gebundenem Zustand ist er etwas kleiner (121 Pikometer). Aufgrund der Abgabe der äußeren Elektronen (Valenzelektronen) bei der Ionisierung reduziert sich der Radius beträchtlich auf 34 Pikometer (As5+; das äußerste p- und das äußerste s-Atomorbital bleiben unbesetzt) beziehungsweise 58 Pikometer (As3+; nur das p-Orbital ist unbesetzt). In chemischen Komplexverbindungen ist das As5+-Kation von vier Bindungspartnern (Liganden), As3+ von sechs umgeben. Arsen tritt allerdings nur sehr selten in eindeutig ionischer Form auf.
Der Wert für die Elektronegativität liegt nach Pauling auf der von 0 (Metalle) bis 4 (Nichtmetall) reichenden Skala bei 2,18 und ist damit mit dem Wert des Gruppennachbarn Phosphor vergleichbar. Der Halbmetall-Charakter des Arsens zeigt sich zudem darin, dass die benötigte Dissoziationsenergie von 302,7 kJ/mol, also die Energie, die aufgebracht werden muss, um ein einzelnes Arsen-Atom aus einem Arsen-Festkörper herauszulösen, zwischen der des Nichtmetalls Stickstoff (473,02 kJ/mol; kovalente Bindung) und des Metalls Bismut (207,2 kJ/mol; metallische Bindung) liegt. Unter Normaldruck sublimiert Arsen bei einer Temperatur von 613 °C,[9] geht also aus dem festen Aggregatzustand direkt in die Gasphase über. Arsendampf ist zitronengelb und setzt sich bis ungefähr 800 °C aus As4-Molekülen zusammen. Oberhalb von 1700 °C liegen As2-Moleküle vor.
Arsen zeigt je nach Verbindungspartner Oxidationsstufen zwischen −3 und +5. Mit elektropositiven Elementen wie Wasserstoff oder Metallen bildet es Verbindungen, in denen es eine Oxidationsstufe von −3 einnimmt. Beispiele dafür sind Monoarsan (AsH3) und Arsenkupfer (Cu3As). In Verbindungen mit elektronegativen Elementen wie den Nichtmetallen Sauerstoff, Schwefel und Chlor besitzt es die Oxidationsstufe +3 oder +5; erstere ist dabei gegenüber den in derselben Hauptgruppe stehenden Elementen Stickstoff und Phosphor tendenziell bevorzugt.
Modifikationen
Arsen kommt wie andere Elemente der Stickstoffgruppe in verschiedenen allotropen Modifikationen vor. Anders als beim Stickstoff, der in Form zweiatomiger Moleküle mit kovalenter Dreifachbindung vorkommt, sind die entsprechenden As2-Moleküle instabil und Arsen bildet stattdessen kovalente Netzwerke aus.
Graues Arsen
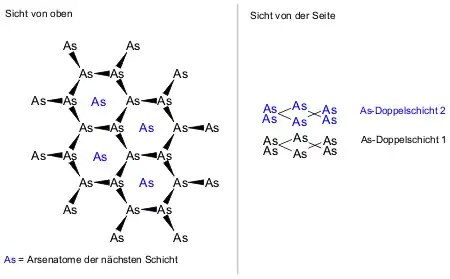
Graues oder metallisches Arsen ist die stabilste Form. Es hat eine Dichte von 5,73 g/cm3. Seine Kristalle sind stahlgrau, metallisch glänzend und leiten den elektrischen Strom.
Betrachtet man den strukturellen Aufbau des grauen Arsens, dann erkennt man Schichten aus gewellten Arsen-Sechsringen, welche die Sesselkonformation einnehmen. Darin bilden die Arsen-Atome eine Doppelschicht, wenn man sich den Aufbau der Schicht im Querschnitt ansieht. Die Übereinanderlagerung dieser Doppelschichten ist sehr kompakt. Bestimmte Atome der nächsten darüberliegenden oder darunterliegenden Schicht sind von einem Bezugsatom fast ähnlich weit entfernt wie innerhalb der betrachteten Doppelschicht. Dieser Aufbau bewirkt, dass die graue Arsen-Modifikation wie die homologen Elemente Antimon und Bismut sehr spröde ist. Deswegen werden diese drei Elemente häufig auch als Sprödmetalle bezeichnet.
Gelbes Arsen
Wird Arsen-Dampf, in dem Arsen gewöhnlich als As4-Tetraeder vorliegt, schnell abgekühlt, so bildet sich das metastabile gelbe Arsen mit einer Dichte von 1,97 g/cm3. Es besteht ebenfalls aus tetraedrischen As4-Molekülen. Gelbes Arsen ist ein Nichtmetall und leitet infolgedessen den elektrischen Strom nicht. Es kristallisiert aus Schwefelkohlenstoff und bildet kubische, stark lichtbrechende Kristalle, die nach Knoblauch riechen. Bei Raumtemperatur und besonders schnell unter Lichteinwirkung wandelt sich gelbes Arsen in graues Arsen um.[24]
Schwarzes Arsen
Schwarzes Arsen selbst kann seinerseits in zwei verschiedenen Formen vorkommen. Amorphes schwarzes Arsen entsteht durch Abkühlung von Arsen-Dampf an 100 bis 200 °C warmen Oberflächen. Es besitzt keine geordnete Struktur, sondern liegt in einer amorphen, glasartigen Form vor, analog zum roten Phosphor. Die Dichte beträgt 4,7 bis 5,1 g/cm3. Oberhalb 270 °C wandelt sich das schwarze Arsen in die graue Modifikation um. Wird glasartiges, amorphes schwarzes Arsen bei Anwesenheit von metallischem Quecksilber auf 100 bis 175 °C erhitzt, so entsteht das metastabile orthorhombische schwarze Arsen, das mit dem schwarzen Phosphor vergleichbar ist.
Natürlich gebildetes orthorhombisches schwarzes Arsen ist in der Natur als seltenes Mineral Arsenolamprit bekannt.
Braunes Arsen
Bei der Reduktion von Arsenverbindungen in wässriger Lösung entstehen ähnlich wie beim Phosphor Mischpolymerisate. Bei diesen bindet ein Teil der freien Valenzen des Arsens Hydroxygruppen (–OH). Man nennt diese Form des Arsens braunes Arsen.[25]
Reaktionen
Arsen reagiert heftig mit Oxidationsmitteln und Halogenen. So verbrennt Arsen an der Luft mit bläulicher Flamme zu einem weißen Rauch von giftigem Arsen(III)-oxid.
- Arsen reagiert mit Sauerstoff zu Arsen(III)-oxid.
Ohne äußere Wärmezufuhr findet die Reaktion mit Chlor unter Feuererscheinung zu Arsen(III)-chlorid statt.
- Arsen reagiert mit Chlor zu Arsentrichlorid.
Eine weitere Oxidation ist möglich.
- Arsentrichlorid reagiert mit Chlor zu Arsenpentachlorid.
Analoge Reaktionsgleichungen gelten für die entsprechenden Reaktionen mit Fluor. Stark oxidierende Säuren, wie konzentrierte Salpetersäure oder Königswasser, wandeln Arsen in Arsensäure um.
- Arsen reagiert mit Salpetersäure zu Stickstoffdioxid, Wasser und Arsensäure.
Ist die Oxidationsstärke weniger groß – etwa bei Verwendung von verdünnter Salpetersäure oder Schwefelsäure – entsteht Arsenige Säure.
- Arsen reagiert mit Schwefelsäure zu Schwefeldioxid und Arseniger Säure.
Unter sauren Bedingungen und bei Anwesenheit von nichtpassivierten unedlen Metallen, insbesondere Zink, reagiert Arsen mit dem gebildeten Wasserstoff zu Monoarsan.
- Zink reagiert mit Wasserstoffionen zu Zinkionen und neutralem Wasserstoff.
- Arsen reagiert mit Wasserstoff zu Monoarsan.
Mit basischem Natriumhydroxid bildet sich das entsprechende Arsenitsalz.
- Arsen reagiert mit Natriumhydroxid zu Natriumarsenit und elementarem Wasserstoff.
Isotope
Vom Arsen sind künstlich hergestellte, radioaktive Isotope mit Massenzahlen zwischen 65 und 87 bekannt. Die Halbwertszeiten liegen zwischen 96 Millisekunden (66As) und 80,3 Tagen (73As). Natürlich vorkommendes Arsen besteht zu 100 Prozent aus dem Isotop 75As, es ist daher ein anisotopes Element. Der entsprechende Arsen-Kern besteht also aus genau 33 Protonen und 42 Neutronen. Physikalisch zählt man ihn daher zu den ug-Kernen (u steht hier für ungerade, g für gerade). Sein Kernspin beträgt 3/2.
Verwendung
Arsen wird Bleilegierungen zugesetzt, um ihre Festigkeit zu verbessern und das Blei gießbar zu machen. Vor allem die fein strukturierten Platten von Akkumulatoren könnten ohne Arsen nicht gegossen werden. Historisch war Arsen eine wichtige Zutat von Kupferlegierungen, die dadurch besser verarbeitbar wurden. Metallisches Arsen wurde früher gelegentlich zur Erzeugung mattgrauer Oberflächen auf Metallteilen verwendet, um eine Alterung vorzutäuschen.

In der Elektronik spielt es als mindestens 99,9999 Prozent reines Element für Gallium-Arsenid-Halbleiter, sogenannte III-V-Halbleiter (aufgrund der Kombination von Elementen aus der 3. und 5. Hauptgruppe des Periodensystems), sowie für Epitaxieschichten auf Wafern in Form von Indiumarsenidphosphid und Galliumarsenidphosphid eine wesentliche Rolle in der Herstellung von Hochfrequenzbauelementen wie Integrierten Schaltkreisen (ICs), Leuchtdioden (LEDs) beziehungsweise Laserdioden (LDs). Es gab Anfang 2004 weltweit nur drei Hersteller von hochreinem Arsen, zwei in Deutschland und einen in Japan.
Arsen wird in Form seiner Verbindungen in einigen Ländern als Schädlingsbekämpfungsmittel im Weinbau, als Fungizid (Antipilzmittel) in der Holzwirtschaft, als Holzschutzmittel, als Rattengift und als Entfärbungsmittel in der Glasherstellung verwendet. Der Einsatz ist umstritten, da die eingesetzten Arsenverbindungen (hauptsächlich Arsen(III)-oxid) giftig sind.
Arsen in Arzneimitteln
Die Verwendung arsenhaltiger Mineralien als Heilmittel ist bereits in der Antike durch Hippokrates und Plinius bezeugt. Sie wurden als Fiebermittel, als Stärkungsmittel und zur Therapie von Migräne, Rheumatismus, Malaria, Tuberkulose und Diabetes eingesetzt. Im 18. Jahrhundert wurde eine Mischung aus Kaliumarsenit und Lavendelwasser als Fowler’sche Lösung bekannt, die lange als medizinisches Wundermittel galt und als Fiebersenker, Heilwasser und sogar als Aphrodisiakum Anwendung fand. Kaliumarsenit war als Bestandteil der Fowler’schen Lösung bis in die 1960er Jahre in Deutschland als Mittel zur Behandlung der Psoriasis im Einsatz.[26]
Constantinus Africanus (1017–1087) empfahl eine Arsenapplikation zur Bekämpfung von Zahnschmerzen. Bereits um 2700 vor Christus soll die Anwendung von Arsen zur Behandlung eines schmerzenden Zahnes in der chinesischen Heilkunst beschrieben worden sein. In dem Mitte des 10. Jahrhunderts erschienenen Werk „Liber Regius“ empfahl der arabische Arzt Haly Abbas (ʿAli ibn al-ʿAbbās; † 944) ebenfalls den Einsatz von Arsenik zur Devitalisation der Pulpa.[27] Arsen(III)-oxid wurde bis in die Neuzeit zur Devitalisation der Zahnpulpa verwendet und verschwand in den 1970er Jahren wegen der krebserregenden Wirkung, Entzündungen des Zahnhalteapparates, des Verlustes eines oder mehrerer Zähne einschließlich Nekrosen des umliegenden Alveolarknochens, Allergien und Vergiftungserscheinungen aus dem Therapiespektrum.[28]
Einen Aufschwung erlebten arsenhaltige bzw. Arsenverbindungen[29] enthaltende Arzneimittel zu Beginn des 20. Jahrhunderts. Harold Wolferstan Thomas und Anton Breinl konnten 1905 beobachten, dass das arsenhaltige Präparat Atoxyl Trypanosomen, zu denen die Erreger der Schlafkrankheit gehören, abtötet. 1920 wurde eine Weiterentwicklung, das Tryparsamid, in der Zeit von 1922 bis 1970 im tropischen Afrika zur Therapie der Schlafkrankheit eingesetzt. Es war bedeutsam für die Eingrenzung dieser Epidemie in der ersten Hälfte des vorigen Jahrhunderts, konnte jedoch zur Erblindung führen. Das in den 1950er Jahren entwickelte Melarsoprol war über mehrere Jahrzehnte das Mittel der Wahl zur Behandlung der Schlafkrankheit und wird heute noch eingesetzt, da keine effektiven Nachfolgepräparate zur Verfügung stehen.
Ebenfalls angeregt durch die Trypanosomen-toxische Wirkung von Atoxyl entwickelte Paul Ehrlich das arsenhaltige Arsphenamin (Salvarsan).[30] Das 1910 in die Therapie der Syphilis eingeführte Mittel stellte das erste auf theoretischen Vorüberlegungen beruhende, systematisch entwickelte, spezifisch wirkende Chemotherapeutikum dar und war Vorbild für die Entwicklung der bis heute verwendeten Sulfonamide. Es wurde lange Zeit auch bei der Behandlung von Dysenterie eingesetzt.[26]
Im Jahr 2000 wurde ein arsenikhaltiges Präparat unter dem Namen Trisenox in den USA zur Behandlung der akuten Promyelozytenleukämie (APL) zugelassen. Seit 2002 besteht für Trisenox in Europa eine Zulassung zur Behandlung der APL, (Vertrieb in EU und USA: Cephalon). Seine Wirksamkeit bei der Krebstherapie wird auch auf die antiangioneogenetische Wirkung zurückgeführt.
Die verschiedenen Arsensulfide sind Bestandteil von Arzneimitteln der Chinesischen Medizin.
Arsenik als Insektizid bei der Taxidermie
Aufgrund der toxischen Eigenschaften von Arsenverbindungen wurde früher überwiegend Arsenik[31] zur Haltbarmachung von Wirbeltieren (Taxidermie) als Insektizid verwendet.[32] Viele andere Stoffe, wie auch Lindan, wurden zum selben Zweck verwendet,[33] wie es die Fachliteratur der Präparatoren aus der Zeit von 1868 bis 1996 beschreibt. Solche Stoffe sind jedoch auch für Menschen giftig und stellen heute an Präparatoren besondere Anforderungen, da diese auch in Kontakt mit derart kontaminierten Präparaten kommen.[34]
Biologische Bedeutung
Die biologische Bedeutung des Arsens für den Menschen ist nicht vollständig geklärt. Es gilt als Spurenelement im Menschen, Mangelerscheinungen wurden bisher aber nur an Tieren nachgewiesen. Der notwendige Bedarf liegt, falls er bestehen sollte, zwischen 5 und 50 µg pro Tag.[35] Eine tägliche Arsenaufnahme von – je nach Wahl der Nahrungsmittel – bis zu einem Milligramm gilt als harmlos. In einer neuen Studie konnte eine erhöhte Arsenbelastung durch hohe Arsengehalte im Grundwasser von Reisanbaugebieten mit der Entstehung von Krebserkrankungen in Verbindung gebracht werden. Die Förderung der Krebsentwicklung ist jedoch dosisabhängig und nur bei Verzehr von belastetem Reis als täglichem Grundnahrungsmittel gegeben.[36] Es gibt bei regelmäßigem Verzehr von Arsenverbindungen, speziell Arsentrioxid eine Gewöhnung, die beim Absetzen der Dosis sogar von Entzugserscheinungen begleitet wird.
Menschen, die wegen der stimulierenden Allgemeinwirkung früher häufig Arsenik konsumierten (vor allem in der Steiermark), wobei häufig Gewöhnung und Sucht eintrat, werden Arsenikesser genannt.[37]
Meerestiere wie Muscheln oder Garnelen enthalten besonders viel Arsen, letztere bis zu 175 ppm. Vermutlich agiert es durch die Bindung an freie Thiolgruppen in Enzymen als Inhibitor, verhindert also deren Wirkung.
Für viele Tiere ist Arsen ein essentielles Spurenelement. So zeigen Hühner oder Ratten bei arsenfreier Ernährung deutliche Wachstumsstörungen; dies hängt wahrscheinlich mit dem Einfluss des Elements auf die Verstoffwechslung der Aminosäure Arginin zusammen. Zahlreiche Algen und Krebstiere enthalten organische Arsen-Verbindungen wie das schon erwähnte Arsenobetain. Arsen führt zur verstärkten Bildung der sauerstofftransportierenden roten Blutkörperchen. Aus diesem Grund wurde es früher dem Futter von Geflügel und Schweinen zugesetzt, um eine schnellere Mästung zu ermöglichen. Trainer von Rennpferden benutzten es zum illegalen Doping ihrer Tiere – heute kann der Zusatz von Arsen zur Nahrung allerdings leicht im Urin nachgewiesen werden.
Lösliche Arsenverbindungen werden leicht über den Magen-Darm-Trakt aufgenommen und rasch innerhalb von 24 Stunden im Körper verteilt. Man findet den größten Teil des aufgenommenen Arsens in den Muskeln, Knochen, Nieren und Lungen. Im Menschen wurde es zusammen mit Thallium in fast jedem Organ nachgewiesen. Blut enthält bis zu 8 ppb Arsen, in den anderen Organen des Körpers wie etwa den Knochen hat es einen Anteil von zwischen 0,1 und 1,5 ppm, in Haaren liegt der Anteil bei etwa 1 ppm. Der Gesamtgehalt von Arsen im Körper eines Erwachsenen liegt im Durchschnitt bei etwa 7 Milligramm.
Organische Arsenverbindungen wie die aus Fischen und Meeresfrüchten stammende Dimethylarsinsäure, Trimethylarsenoxid, Trimethylarsin sowie Arsenobetain verlassen den menschlichen Körper fast unverändert innerhalb von zwei bis drei Tagen über die Nieren. Anorganische Arsenverbindungen werden in der Leber zu Monomethylarsonsäure (MMAA) und Dimethylarsinsäure (DMAA) umgewandelt und anschließend ebenso über die Nieren ausgeschieden.
Bei Pflanzen erhöht das Element den Kohlenhydrat-Umsatz. Der Gebänderte Saumfarn (Pteris vittata) nimmt das Halbmetall bevorzugt aus dem Boden auf und kann bis zu fünf Prozent seines Trockengewichts an Arsen aufnehmen. Aus diesem Grund wird die schnellwachsende Pflanze zur biologischen Säuberung arsenkontaminierter Böden eingesetzt.
Die stimulierende Wirkung des Arsens ist vermutlich auch Ursache des früher in einigen Alpengegenden verbreiteten Arsenikessens. Im 17. Jahrhundert verzehrten manche der dortigen Bewohner lebenslang zweimal wöchentlich bis zu 250 Milligramm Arsen – bei Männern, weil es bei der Arbeit in den Höhenlagen half, bei Frauen, da es angeblich zu einer kräftigen Gesichtsfarbe beitrug. In der Wissenschaft lange als Märchen abgetan, nahm ein Bauer aus den Steirischen Alpen 1875 vor der in Graz versammelten deutschen Fachwelt eine Dosis von 400 Milligramm Arsentrioxid zu sich, die sich später auch in seinem Urin nachweisen ließ. Die Dosis lag weit über dem Doppelten der für normale Menschen tödlichen Arsenmenge, zeigte aber keinerlei negative Auswirkungen auf den Bauern. Ähnliches wird von Bewohnern einer Siedlung in der hochgelegenen chilenischen Atacamawüste berichtet, deren Trinkwasser hochgradig mit Arsen belastet ist, die jedoch keinerlei Vergiftungssymptome zeigen. Heute geht man davon aus, dass eine langsame Gewöhnung an das Gift mit sukzessive steigenden Dosen physiologisch möglich ist.
Über den Bakterienstamm GFAJ-1 wurde 2010 berichtet, dass er unter bestimmten Bedingungen in arsenathaltigen Nährmedien in der Lage sei, Arsenat anstatt Phosphat in Biomoleküle wie die DNA einzubauen, ohne dabei abzusterben, was bisher eher als unmöglich galt.[38] Der Befund scheint jedoch auf unsauberen Arbeitsmethoden zu basieren,[39][40] die Befunde konnten nicht repliziert werden.[41]
Sicherheitshinweise
Arsen-Stäube sind leicht entzündlich.
| Klassifikation nach ICD-10 | |
|---|---|
| T57.0 | Toxische Wirkung: Arsen und dessen Verbindungen |
| ICD-10 online (WHO-Version 2019) | |
Toxizität
Dreiwertige lösliche Verbindungen des Arsens sind hoch toxisch, weil sie biochemische Prozesse wie die DNA-Reparatur, den zellulären Energiestoffwechsel, rezeptorvermittelte Transportvorgänge und die Signaltransduktion stören. Dabei kommt es mutmaßlich nicht zu einer direkten Einwirkung auf die DNA, sondern zu einer Verdrängung des Zink-Ions aus seiner Bindung zu Metallothioneinen und damit zur Inaktivierung von Tumorsupressorproteinen (siehe auch Zinkfingerprotein). Arsen(III)- und Zink(II)-Ionen haben vergleichbare Ionenradien und damit ähnliche Affinität zu diesen Zinkfingerproteinen, allerdings führt Arsen dann nicht zur Aktivierung der Tumorsupressorproteine.
Eine akute Arsenvergiftung führt zu Krämpfen, Übelkeit, Erbrechen, inneren Blutungen, Durchfall und Koliken, bis hin zu Nieren- und Kreislaufversagen. Bei schweren Vergiftungen fühlt sich die Haut feucht und kalt an und der Betroffene kann in ein Koma fallen. Die Einnahme von 60 bis 170 Milligramm Arsenik gilt für Menschen als tödliche Dosis (LD50 = 1,4 mg/kg Körpergewicht); meist tritt der Tod innerhalb von mehreren Stunden bis wenigen Tagen durch Nieren- und Herz-Kreislauf-Versagen ein. Eine chronische Arsenbelastung kann Krankheiten der Haut und Schäden an den Blutgefäßen hervorrufen, was zum Absterben der betroffenen Regionen (Black Foot Disease) sowie zu bösartigen Tumoren der Haut, Lunge, Leber und Harnblase führt. Diese Symptome wurden auch als Reichensteiner Krankheit bezeichnet, nach einem Ort in Schlesien, dessen Trinkwasser durch den Arsenik-Abbau bis zu 0,6 mg Arsen pro Liter enthielt.[42]
Die chronische Arsen-Vergiftung führt über die Bindung an Sulfhydryl-Gruppen von Enzymen der Blutbildung (zum Beispiel Delta-Amino-Laevulin-Säure-Synthetase) zu einem initialen Abfall des Hämoglobins im Blut, was zu einer reaktiven Polyglobulie führt. Des Weiteren kommt es bei chronischer Einnahme von Arsen zur Substitution der Phosphor-Atome im Adenosin-Triphosphat (ATP) und damit zu einer Entkopplung der Atmungskette, was zu einer weiteren reaktiven Polyglobulie führt. Klinisch finden sich hier nach Jahren der As-Exposition Trommelschlägelfinger, Uhrglasnägel, Mees-Nagelbänder und Akrozyanose (Raynaud-Syndrom), mit Folge der Black Foot Disease.
Metallisches Arsen dagegen zeigt wegen seiner Unlöslichkeit nur eine geringe Giftigkeit, da es vom Körper kaum aufgenommen wird (LD50 = 763 mg/kg Ratte, oral).[43] Es sollte aber, da es sich an der Luft leicht mit seinen sehr giftigen Oxiden wie dem Arsenik überzieht, stets mit größter Vorsicht behandelt werden. Anders verhält es sich mit Arsenik, das in früheren Zeiten als Stimulans von Arsenikessern benutzt wurde, um einer Arsenvergiftung vorzubeugen. Der Mechanismus dieser Immunisierung gegen Arsen ist nicht bekannt.
Grenzwerte
Anionisches Arsen tritt als Arsenit ([AsO3]3−) und Arsenat ([AsO4]3−) in vielen Ländern im Grundwasser in hohen Konzentrationen auf. Durch Auswaschungen aus arsenhaltigen Erzen in Form von drei- und fünfwertigen Ionen trinken weltweit über 100 Millionen Menschen belastetes Wasser. Besonders in Indien, Bangladesh und Thailand, wo im 20. Jahrhundert mit internationaler Unterstützung zahlreiche Brunnen gegraben wurden, um von mit Krankheitserregern kontaminiertem Oberflächenwasser auf Grundwasser ausweichen zu können, führte diese unerkannte Belastung des Trinkwassers zu chronischer Arsenvergiftung bei weiten Teilen der betroffenen Bevölkerung. Das Problem kann, wo es bekannt wird, chemisch durch Oxidation der Arsenverbindungen und nachfolgende Ausfällung mit Eisenionen behoben werden. Von der Rice University wurde eine kostengünstige Filtermöglichkeit mit Nano-Magnetit entwickelt.[44]
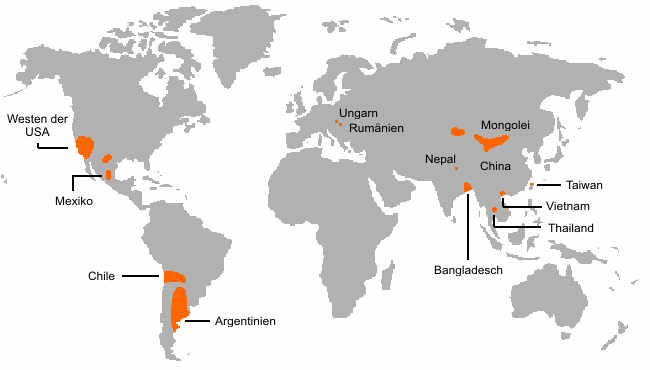
Die Weltgesundheitsorganisation (WHO) empfiehlt seit 1992 einen Grenzwert für Arsen im Trinkwasser von 10 Mikrogramm pro Liter. Der Wert wird in vielen Staaten Europas und in den USA immer noch überschritten. In Deutschland wird er dagegen seit 1996 eingehalten. Eine Richtlinie der Europäischen Union (EU) von 1999 schreibt einen Höchstwert von 10 Mikrogramm pro Liter Trinkwasser EU-weit vor.[45] Die USA verpflichteten sich im Jahre 2001, diesen Grenzwert ab 2006 einzuhalten.
Das im Grundwasser vorkommende Arsen reichert sich in Reis zehnmal so stark an wie in anderen Getreidearten. Auf dem Weltmarkt angebotene Sorten enthalten zwischen 20 und 900 Mikrogramm Arsen pro Kilogramm.[46][47][36] Im Jahr 2005 senkte die chinesische Regierung den zulässigen Gehalt anorganischer Arsenverbindungen von 700 auf 150 Mikrogramm pro Kilogramm Lebensmittel,[46] im Juli 2014 beschloss die Codex-Alimentarius-Kommission erstmals einen Höchstwert von 200 Mikrogramm für polierten Reis.[48][49] Die für Lebensmittelsicherheit zuständige EU-Kommission diskutiert für Erzeugnisse aus Puffreis einen um 15 Prozent höheren Grenzwert und für spezielle Produkte für Kleinkinder einen nur halb so hohen (d. h. 100 Mikrogramm pro kg).[50][51]
Für andere belastete Lebensmittel wie Bier[52] oder Fruchtsäfte gibt es noch keine Grenzwerte, obwohl sie mehr Arsen enthalten können, als für Trinkwasser zulässig ist. Verbraucherorganisationen fordern für Apfelsaft einen Grenzwert von 3, höchstens aber 4,4 ppb (entspricht Mikrogramm pro kg).[53]
Fische und Meeresfrüchte weisen zwar hohe Gehalte an Arsen auf, jedoch nahezu ausschließlich in der als unbedenklich geltenden organisch gebundenen Form.[54] Grenzwerte wie für Quecksilber oder Cadmium gibt es nicht.
Das neue Chemikaliengesetz der EU umgesetzt in der Gefahrstoffverordnung Deutschlands von 2005 verbietet im Anhang 4 die „gewerbliche“ (nicht private) Verarbeitung von arsenhaltigen Mitteln und Zubereitungen, die mehr als 0,3 Gewichtsprozent an Arsen aufweisen. Derartige Grenzwertregelungen sind gegeben, da Arsen in den Verzinkereien der Galvanikindustrie weltweit der Zinkschmelze zugesetzt wird, um die Haftungseigenschaften des Zinks an der Eisenoberfläche des zu verzinkenden Metallstückes zu verbessern. Auf Grund der Temperatur im Zink-Schmelzbad von 460 °C bis 480 °C kommt es zum Verdampfen von Arsen, Cadmium und anderen leicht flüchtigen Metallen und deren Anreicherung in der Luft des Arbeitsplatzes. So können zulässige Grenzwerte kurzfristig um das Tausendfache überschritten werden, mit der Folge der aerogen-alveolaren Aufnahme in den Körper.[55] Messungen ergaben, dass Arsen (und Cadmium) im hochreinen Zink (99,995 Reinheitsgrad, DIN-1179-Reinheitsgrad) mit weniger als 0,0004 Gewichts-% ausgewiesen waren und nach Zugabe von 450 Gramm dieses hochreinen Zinks in die Zinkschmelze zu einem Anstieg der Cd-/As-Konzentration von 3 bis 7 µg/m3 Luft auf über 3000 µg/m3 Luft führten. Für Arsen wurde diese Tatsache überraschend in einer Verzinkerei durch Messung der Arsen-Konzentration in Zinkschmelze, Blut und Urin festgestellt (unveröffentlicht). Bei Galvanik-Arbeitern wird die Urin-Arsen-Konzentration mit 25 bis 68 µg/l Urin gemessen, im Vergleich zu unbelasteter Bevölkerung mit 0,1 µg Arsen/l Urin.
Abreicherung
Für die Entfernung von ionischem Arsen aus dem Trinkwasser gibt es Verfahren, die auf Adsorption an Aktivkohle, aktiviertem Aluminiumoxid oder Eisenhydroxid-Granulat beruhen. Letzteres wird standardmäßig in Festbettreaktoren in der Trinkwasseraufbereitung in Deutschland und international eingesetzt. Daneben werden Ionenaustauscher verwendet. Es ist möglich, Arsen mittels gentechnisch veränderten Pflanzen aus dem Boden zu entfernen, die es in Blättern speichern. Zur Phytosanierung von Trinkwasser bietet sich die Dickstielige Wasserhyazinthe an, die Arsen insbesondere in ihr Wurzelgewebe einlagert und so eine Abreicherung des kontaminierten Wassers bewirkt. Organische Arsenverbindungen in belasteten Böden können enzymatisch mit Hilfe von Pilzen abgebaut werden.
In Bangladesh wird nach einem Verfahren der schweizerischen Forschungseinrichtung EAWAG versucht, Arsen mit Hilfe von transparenten PET-Flaschen und Zitronensaft abzureichern. Bei dieser SORAS (Solar Oxidation and Removal of Arsenic) genannten Methode oxidiert Sonnenlicht das Arsen; die Inhaltsstoffe des Zitronensafts helfen bei der Ausfällung. Mit dieser kostengünstigen Methode lässt sich der Arsengehalt um 75 bis 90 Prozent senken.
In Gewässern des Yellowstone-Nationalparks, die sich aus Geysiren und anderen Thermalquellen vulkanischen Ursprungs speisen, wurden eukaryontische Algen der Gattung Cyanidioschyzon gefunden, die die hohen Arsenkonzentrationen der Gewässer tolerieren und sie zu biologisch weniger verfügbaren organischen Verbindungen oxidieren können. An einer Nutzung zur Abreicherung in Trinkwasser wurde 2009 gearbeitet.[56]
Antidote
Als Antidote bei akuten Arsenvergiftungen stehen die schwefelhaltigen Komplexbildner Dimercaptopropansulfonsäure (DMPS), Dimercaptobernsteinsäure und das ältere, schlechter verträgliche Dimercaprol zur Verfügung. Sie sind noch bei starken Arsendosen effektiv, wenn die Vergiftung rechtzeitig diagnostiziert wird. Ihr Stellenwert bei der Behandlung chronischer Arsenvergiftungen ist hingegen umstritten. Aktivkohle ein bis mehrere Stunden nach der Einnahme kann das Metall ebenfalls binden und zur Ausscheidung bringen.
Prophylaxe
Indische Forscher haben im Tierversuch herausgefunden, dass die Einnahme von Knoblauch zur Senkung der Arsengehalte im Blut und der Erhöhung der Arsengehalte im Urin führen kann. Erklärt wird dies über eine Ausfällung des Arsens bei Reaktion mit schwefelhaltigen Substanzen wie etwa Allicin, das Bestandteil des Knoblauchs ist. Zur Prophylaxe werden zwei bis drei Knoblauchzehen täglich empfohlen.[57]
Nachweis
Anorganische Nachweisreaktionen
Arsenverbindungen zeigen beim Verbrennen eine wenig charakteristische fahlblaue Flammenfärbung. Bei der Glühröhrchenprobe erhitzt man Arsenverbindungen, welche teilweise sublimieren und sich an kalten Oberflächen in Form von schwarzem Arsen, weißem Arsen(III)-oxid oder gelbem Arsentrisulfid wieder niederschlagen.
- Die so genannte Marshsche Probe ist die klassische Nachweisreaktion in der Chemie und Gerichtsmedizin für Arsen:
- Bei der Bettendorfschen Probe oxidiert Arsen in konzentrierter Salzsäure unabhängig von der Oxidationsstufe zweiwertige Zinn-Ionen. Dabei fällt elementares Arsen aus:
- Gibt man zu einer ammoniakalischen, ammoniumchloridhaltigen Lösung von Arsenat Magnesium-Ionen, so erhält man einen kristallinen Niederschlag von Magnesiumammoniumarsenat-Hexahydrat:
Arsenat reagiert mit Magnesiumionen, Ammoniumionen und Wasser zu Magnesiumammoniumarsenat-Hexahydrat. - Eine weitere Nachweisreaktion von Arsen(at) in wässriger Lösung ist die Fällung mit Ammoniumheptamolybdat. Der gelbe Niederschlag ist schwerlöslich in Säuren, aber gut löslich in Basen:
Dihydrogenarsenat reagiert mit Wasserstoffionen, Ammoniumionen und Molybdationen zu Ammoniumarsenomolybdat und Wasser.
Atomabsorptionsspektrometrie (AAS)
Bei der Flammen-AAS werden die Arsenverbindungen in einer reduzierenden Luft-Acetylen-Flamme ionisiert. Anschließend wird eine Atomabsorptionsmessung bei 189,0 nm beziehungsweise 193,8 nm durchgeführt. Nachweisgrenzen bis zu 1 µg/ml wurden beschrieben. Häufig wird das Arsen auch mit Hilfe von NaBH4 in das gasförmige Arsin (AsH3) überführt (Hydridtechnik). In der Quarzrohrtechnik wird AsH3 zuerst bei rund 1000 °C in einem elektrisch beheizten Quarzröhrchen thermisch in seine atomaren Bestandteile zersetzt, um anschließend die Absorption bei o. g. Wellenlängen zu bestimmen. Die Nachweisgrenze bei dieser Technik liegt bei 0,01 µg/l.[58] Eine weitere Methode ist die sog. Graphitrohrtechnik, bei der das Arsen einer festen Probe bei 1700 °C und höher verflüchtigt und anschließend die Extinktion bei 193,8 nm gemessen wird.[59][60][61]
Atomemissionsspektrometrie
Die Kopplung von Hydridtechnik mit dem induktiv gekoppelten Plasma/ laserinduzierter Fluoreszenzmessung ist eine sehr nachweisstarke Methode zur Bestimmung von Arsen. Mittels Hydriderzeugung freigesetztes AsH3 wird dabei im Plasma atomisiert und mit einem Laser zur Emission angeregt. Mit dieser Methode wurden Nachweisgrenzen von 0,04 ng/mL erreicht.[62]
Massenspektrometrie (MS)
Bei der Massenspektrometrie wird die Arsenspezies zunächst durch ein induktiv gekoppeltes Argonplasma (ICP-MS) thermisch ionisiert. Anschließend wird das Plasma in das Massenspektrometer geleitet. Eine Nachweisgrenze von 0,2 µg/l wurde für Arsenit beschrieben.[58][62][63]
Photometrie
Weitverbreitet ist die photometrische Erfassung von As als Arsenomolybdänblau. As(V) reagiert zunächst mit (NH4)2MoO4. Danach folgt eine Reduktion mit SnCl2 oder Hydrazin zu einem blauen Komplex. Die Photometrie erfolgt bei 730 nm und ist somit nahezu störungsfrei. Die Nachweisgrenzen können durch Verwendung von basischen Farbstoffen als Komplexbildner verbessert werden.[58]
Neutronenaktivierungsanalyse
Eine sehr empfindliche Arsenbestimmung im ppt-Bereich ist mittels Neutronenaktivierungsanalyse möglich.[64] Sie kommt insbesondere dann zur Anwendung, wenn die Probe eine komplexe Zusammensetzung aufweist oder schwierig aufzuschließen ist. Allerdings gibt diese Methode keinen Hinweis auf die chemische Verbindung, in der das Arsen vorliegt. Bei der Wechselwirkung von Neutronen mit der Probe, die das natürliche Isotop Arsen-75 enthält, wird das schwerere Isotop Arsen-76 gebildet, das jedoch instabil ist und sich unter einem β-Zerfall in Selen-76 umwandelt. Gemessen werden dabei die β-Strahlen, über die ein Rückschluss auf die Menge des Arsens möglich ist.
Biosensoren
Bei Biosensoren wird die Biolumineszenz bei Kontakt von in Wasser gelöstem Arsen mit genetisch modifizierten Bakterien (z. B. Escherichia coli K12) und eines Lichtmessgeräts (Luminometer) detektiert. Die vorhandene Arsenkonzentration korreliert dabei direkt mit der emittierten Lichtmenge.[65][66]
Verbindungen
Arsenwasserstoffe
Chemische Verbindungen von Arsen und Wasserstoff (→ Arsane) sind im Vergleich zu den entsprechenden Verbindungen der Hauptgruppennachbarn Stickstoff und Phosphor nicht sehr zahlreich und sehr instabil. Es sind zurzeit drei Arsane bekannt.
- Arsenwasserstoff (auch Monoarsan oder Arsin genannt) mit der Summenformel AsH3 ist eine wichtige Ausgangssubstanz zur Herstellung von Galliumarsenid in der Halbleiterindustrie.
- Diarsan (As2H4)
- Triarsan (As3H5)
Halogenverbindungen
Arsen bildet mit Halogenen binäre Verbindungen vom Typ AsX3, AsX5 und As2X4 (X bezeichnet das entsprechende Halogen).
- Arsen(III)-fluorid (AsF3)
- Arsen(V)-fluorid (AsF5)
- Arsen(III)-chlorid (AsCl3)
- Arsenpentachlorid (AsCl5)
- Arsentribromid (AsBr3)
- Arsentriiodid (AsI3)
- Diarsentetraiodid (As2I4)
Sauerstoffverbindungen
Wichtige Sauerstoffsäuren sind:
- Arsensäure (2 H3AsO4 · H2O), deren Salze als Arsenate oder Arsenate(V) bezeichnet werden und den Phosphaten ähneln. Beispiele sind Calciumarsenat (Ca3(AsO4)2·3H2O) und Bleihydrogenarsenat (PbHAsO4), die als Pflanzenschutzmittel verwendet wurden
- Arsenige Säure (H3AsO3), deren Salze als Arsenite oder Arsenate(III) bezeichnet werden.
Das wichtigste Arsenoxid ist Arsen(III)-oxid (Arsentrioxid auch Arsenik oder Weißarsenik, As2O3, das Anhydrid der Arsenigen Säure), das in der Gasphase in Form von Doppelmolekülen mit der Formel As4O6 vorliegt. Es ist amphoter und weist damit auf den Halbmetallcharakter des Arsens hin. Neben As2O3 kennt man As2O5 (Arsenpentaoxid, das Anhydrid der Arsensäure) und das gemischte Anhydrid der Arsenigen Säure und Arsensäure As2O4 (Arsentetraoxid)
Ein historisch wichtiges Färbe- und Pflanzenschutzmittel ist ein Kupfer-Arsen-Oxid mit dem Trivialnamen Schweinfurter Grün (Cu(AsO2)2·Cu(CH3COO)2).
Schwefelverbindungen
Es bestehen zwei wichtige Arsensulfide, die beide als Minerale in der Natur vorkommen.
- Arsenmonosulfid (Realgar, As4S4)
- Arsen(III)-sulfid (Auripigment, As2S3)
Arsen-Metall-Verbindungen
Wichtige Verbindungen von Arsen mit Metallen sind
- Galliumarsenid (GaAs), ein wichtiger Halbleiter
- Indiumarsenid (InAs), ein wichtiger Halbleiter
- Nickelarsenid (NiAs)
- Aluminiumgalliumarsenid (AlGaAs)
- Arsenbronze – (CuAs) in früher Bronzezeit
Organische Verbindungen
In Analogie zu den Aminen und Phosphinen findet man entsprechende Verbindungen mit Arsen anstelle von Stickstoff oder Phosphor. Sie werden als Arsine bezeichnet.
- Dimethylarsin (AsH(CH3)2)
- Trimethylarsin (As(CH3)3), eine übelriechende Flüssigkeit, die zur Behandlung bakterieller Infektionen und als Pilzschutzmittel Anwendung fand.
Zu den Arsoranen, Verbindungen vom Typ R5As, wobei R5 für fünf – möglicherweise unterschiedliche – organische Gruppen steht, zählt man etwa Pentaphenylarsen oder Pentamethylarsen. Fehlt eine der fünf Gruppen, bleibt ein einfach positiv geladenes Ion zurück (R steht wiederum für – möglicherweise verschiedene – organische Gruppen), das man als Arsoniumion (AsR4)+ bezeichnet.
Analog zu den Carbonsäuren lassen sich zwei Klassen arseno-organischer Säuren bilden:
- Arsinsäuren (RR'AsOOH)
- Arsonsäuren (RAsO(OH)2)
Zudem sind Heteroaromaten mit Arsen als Heteroatom bekannt, wie Arsabenzol, das aus einem Benzolring besteht, in dem ein Kohlenstoffatom durch Arsen ersetzt ist und das somit analog zu Pyridin aufgebaut ist.
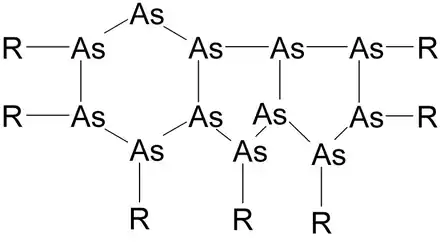
Auch homocyclische Arsenverbindungen existieren. Beispiele sind
- Pentamethylcyclopentaarsen (AsCH3)5
- Hexamethylcyclohexaarsen (AsCH3)6
deren Moleküle einen Fünf- beziehungsweise Sechsring aus Arsenatomen als Rückgrat aufweisen, an den nach außen hin je eine Methylgruppe pro Arsenatom gebunden ist. Eine polycyclische Variante bildet das nebenstehende Molekül, dessen Rückgrat sich aus einem Sechs- und zwei angehefteten Fünfringen zusammensetzt (R steht für jeweils eine tert-Butylgruppe).
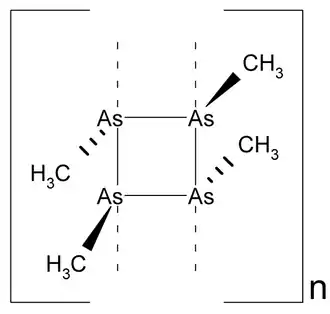
Schließlich lassen sich Arsenpolymere darstellen, lange Kettenmoleküle, die als Polyarsine bezeichnet werden. Sie bestehen aus einer zentralen „Strickleiter“ der Arsenatome, an die außen auf jeder Seite je „Sprosse“ eine Methylgruppe angeheftet ist, so dass sich die chemische Formel (AsCH3)2n ergibt, wobei die natürliche Zahl n weit über 100 liegen kann. Polyarsine zeigen deutliche Halbleitereigenschaften.
Bioorganische Verbindungen
In der Bioorganik spielen Arsenolipide,[67] Arsenosaccharide und arsenhaltige Glycolipide eine bedeutende Rolle. Wichtige Vertreter dieser Stoffklassen sind zum Beispiel Arsenobetain, Arsenocholin und unterschiedlich substituierte Arsenoribosen. Sie treten vor allem kumuliert in maritimen Lebewesen auf und können auf diesem Weg in die menschliche Nahrungskette gelangen. Arsenhaltige Biomoleküle konnten in Algen, Meeresschwämmen und in Fischgewebe nach erfolgter Extraktion mittels HPLC-ICP-MS nachgewiesen werden.[68] Die Analytik von Organo-Arsenverbindungen (einschließlich ihrer Speziation) ist sehr aufwändig.[63][69]
Arsen in Kriminalgeschichte, Literatur und Film
Das Element Arsen erreichte zweifelhafte Berühmtheit als Mordgift, belegt durch geschichtliche Aufzeichnungen sowie die Instrumentalisierung in Literatur und Film. Es handelte sich bei dem Mordgift allerdings nie um elementares Arsen, sondern um dessen Verbindungen.
In Italien und Frankreich starben Herzöge, Könige und Päpste an vorsätzlich herbeigeführten Arsenvergiftungen. Im Frankreich des 17. Jahrhunderts steht die Marquise de Brinvilliers, die ihren Vater und zwei Brüder mit einer Arsenikmischung vergiftete, im Mittelpunkt eines Giftskandals. In Deutschland brachte die Serienmörderin Gesche Gottfried aus Bremen 15 Menschen zu Tode. Aufsehen erregte auch der Fall der Serienmörderin Anna Margaretha Zwanziger zu Beginn des 19. Jahrhunderts. Die Urheber der Morde blieben jedoch meist unerkannt, da Arsen bis 1836 in kleinen Mengen nicht nachgewiesen werden konnte. Erst die durch James Marsh entwickelte und nach ihm benannte Marshsche Probe machte es möglich, Spuren des Elementes zu identifizieren und somit eine unnatürliche Todesursache nachzuweisen. Im 19. und 20. Jahrhundert fanden weiter vorsätzliche Vergiftungen mit arsenhaltigen Mitteln statt – zum einen, weil sie leicht als Herbizide verfügbar waren, zum anderen ließ sich bei chronischer Gabe kleiner Dosen ein krankheitsbedingter Tod vortäuschen. Im September 1840 fiel im Prozess gegen Marie Lafarge das erste Urteil, das alleine auf den Ergebnissen der Marshschen Probe beruhte. Im Fall der Marie Besnard, die angeblich zwischen 1927 und 1949 für mehrere Todesfälle in ihrem Umfeld in Loudun verantwortlich sein sollte, konnte ein eindeutiger Beweis nicht erbracht werden, weil Untersuchungsergebnisse widersprüchlich waren, und sie musste 1954 letztendlich freigesprochen werden.


Jahrelang glaubte die Fachwelt, dass der Tod des ehemaligen französischen Kaisers Napoleon Bonaparte mit 51 Jahren auf der Insel St. Helena einem Giftanschlag mit Arsen zugeschrieben werden muss. Zumindest hatte man in seinen Haaren hochkonzentrierte Spuren des Giftes entdeckt. Heute existieren verschiedene andere Thesen zur Erklärung des Faktenbefunds. Eine Möglichkeit besteht darin, dass das Arsen nach seinem Tod den Haaren beigegeben wurde, um diese zu konservieren, eine damals durchaus übliche Methode. Möglich ist ein Übermaß der Benutzung der arsenhaltigen Fowlersche Lösung, die zu seiner Zeit bei vielen seiner Zeitgenossen als medizinisches Wundermittel galt. Die dritte und heute als wahrscheinlichste angesehene Möglichkeit ist, dass sich Napoleon durch organische Arsenverbindungen vergiftete, die Schimmelpilze beständig aus seinen mit grünen Arsenpigmenten gefertigten Tapeten freisetzten. Deren hoher Arsengehalt ist durch eine 1980 in einem Notizbuch aufgefundene Materialprobe schlüssig belegt.
Der berühmte Philosoph René Descartes starb 1650 wenige Monate nach seiner Ankunft am Hofe der schwedischen Königin Christine. Der Verdacht, er sei von einem der Jesuiten, die sich am Hofe der protestantischen Königin aufhielten, aus religionspolitischen Gründen mit Arsen vergiftet worden, verstärkte sich, als Christine später tatsächlich zum Katholizismus konvertierte, konnte aber nicht erhärtet werden, so dass die offizielle Todesursache, Lungenentzündung, sich in den Biographien etablierte. Erst kürzlich wurde anhand von neu aufgefundenen und neu interpretierten Dokumenten der alte Verdacht erhärtet und behauptet, dass der „Giftmord an Descartes in sehr hohem Maße wahrscheinlich, um nicht zu sagen, fast sicher“ erscheint.[70]
Im Jahre 1900 kam es im britischen Manchester zu einer Massenvergiftung, von der mehrere Tausend Menschen betroffen waren. Wie sich herausstellte, hatten alle Bier derselben Brauerei getrunken. In Vorstufen der Bierproduktion wurde anscheinend Schwefelsäure eingesetzt, die ihrerseits aus Schwefel hergestellt wurde, der aus mit Arsenopyrit kontaminierten Sulfidmineralen stammte. Etwa 70 Menschen erlagen ihren Vergiftungen.
In den Jahren 2010 und 2011 starben in Österreich zwei Männer an einer Arsenvergiftung. Am 11. April 2013 wurde am Landesgericht Krems eine 52-jährige Polin des Mordes an den beiden für schuldig befunden und von dem Geschworenengericht nicht rechtskräftig zu lebenslanger Haft verurteilt.[71] Noch in den 1950er Jahren auf dem Höhepunkt des Kalten Krieges erkrankte die US-amerikanische Botschafterin, Clare Booth Luce, in Rom durch eine Vergiftung mit dem aus Tapeten freigesetzten Arsen. Die Tatsache, dass die Krankheit auf die schimmelpilzbefallenen Tapeten und nicht auf gegnerische Geheimagenten zurückgeführt werden konnte, trug in diesem Fall nicht nur zur Genesung der Botschafterin, sondern auch zum Erhalt des Friedens bei.
In Friedrich Schillers bürgerlichem Trauerspiel Kabale und Liebe vergiftet der junge Major Ferdinand von Walter erst seine Geliebte Luise Millerin und dann sich selbst. Allerdings tritt in Kabale und Liebe der Tod unrealistischerweise binnen Minuten ein.
Die Protagonistin des berühmten Romans Madame Bovary von Gustave Flaubert, die unglücklich verheiratete Landarztgattin Emma Bovary, stirbt am Ende des Romans durch Suizid mit Arsen in Form eines weißen Pulvers. Der Spross einer Arztfamilie Flaubert beschreibt die Vergiftungssymptome und den äußerst qualvollen Tod der Bovary sehr detailliert.
Im Roman Starkes Gift (Strong Poison) von Dorothy L. Sayers ist das Opfer mit Arsen vergiftet worden. Die Verdächtige, Krimi-Schriftstellerin Harriet Vane, hat sich zur fraglichen Zeit intensiv mit Arsenmorden beschäftigt und sich dazu sogar vom Apotheker beraten lassen.
Der berühmte Detektiv „Kalle Blomquist“ aus dem gleichnamigen Kinderbuch von Astrid Lindgren wendete die Marshsche Probe an, um ein mit Arsen vergiftetes Stück Schokolade zu überprüfen.
In dem Theaterstück von Joseph Kesselring Arsen und Spitzenhäubchen (englisch: Arsenic and Old Lace) vergiften zwei alte Damen in gutmeinender Absicht ältere einsame Herren mit einer Arsen-, Strychnin- und Zyankali-Mischung. Bekannt wurde das Stück durch die gleichnamige Verfilmung von Frank Capra mit Cary Grant, Peter Lorre und Priscilla Lane in den Hauptrollen.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 829–860.
- Erwin Riedel: Anorganische Chemie. de Gruyter, Berlin 2002, ISBN 3-11-017439-1.
- Dietmar Ritter: Charakterisierung und Einsatz alternativer Arsen- und Phosphor-Quellen für die Metallorganische Molekularstrahlepitaxie von InP und GaInAs. Shaker, Aachen 1998, ISBN 3-8265-4489-7.
- Giulio Morteani, Lorenz Eichinger: Arsen im Trinkwasser und Dearsenierung. Gesetzliche Vorschriften, Toxikologie, Hydrochemie. In: Wasser, Luft und Boden. WLB-Marktspiegel Umwelttechnik. Band 48, Nr. 6, 2004, ZDB-ID 1213429-6, S. 24–26.
- Nicholas C. Norman: Chemistry of Arsenic, Antimony and Bismuth. Blackie, London 1998, ISBN 0-7514-0389-X.
- Andrew A Meharg: Venomous Earth: How arsenic caused the world’s worst mass poisoning. Macmillan Science.
- Georg Süss-Fink: Arsenvergiftungen. In: Chemie in unserer Zeit. Band 46, Nr. 2, 2012, S. 100–109, doi:10.1002/ciuz.201200565.
- Die bremische Gesina. In: Hans Heinrich: Frau-Geschichten. WM-Literatur-Verlag, Weilheim 2002, ISBN 3-9808439-0-4, S. 62–72.
Weblinks
- Mineralienatlas:Arsen
- Enzymatischer Abbau von Arsenkampfstoffen
- wissenschaft.de – Arsen im Trinkwasser begünstigt Arteriosklerose
- Arsenic and Human Health, Environmental Health & Toxicology, Specialized Information Services, National Library of Medicine (englisch)
- Studienarbeit zum Thema Trinkwasserkontamination mit Arsen (Memento vom 11. Oktober 2012 im Internet Archive) (PDF; 295 KiB)
- Arsen – Informationen des Bundesamts für Lebensmittelsicherheit und Veterinärwesen
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Arsen) entnommen.
- IUPAC, Standard Atomic Weights Revised 2013.
- Eintrag zu arsenic in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu arsenic bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Arsen) entnommen.
- Eintrag zu Arsen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. April 2017. (JavaScript erforderlich)
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Arsen) entnommen.
- Eintrag zu Arsenic im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Jorma Maeki-Paakkanen, Päivi Kurttio, Anna Paldy, Juha Pekkanen: Association between the clastogenic effect in peripheral lymphocytes and human exposure to arsenic through drinking water (PDF). In: Environmental and Molecular Mutagenesis. 32, Nr. 4, 1998, S. 301–313.
- Oyeronke A. Odunola, Aliyu Muhammad, Ahsana D. Farooq, Kourosh Dalvandi, Huma Rasheed, Muhammad I. Choudhary, Ochuko L. Erukainure: Comparative assessment of redox-sensitive biomarkers due to acacia honey and sodium arsenite administration in vivo. In: Mediterranean Journal of Nutrition and Metabolism. 6, Nr. 2, 2013, S. 119–126, doi:10.1007/s12349-013-0127-1.
- Bernhard Fischer: Ueber Todesfälle nach Salvarsan. In: Deutsche Medizinische Wochenschrift. Band 42, 1916, S. 106 f., 908–910, 939–942 und 976–978.
- J. Elfenbein: Der erste Krimi der Weltgeschichte. Teil 3: Die Machtergreifung des König Darius. In: Borsuye. Zeitschrift für Medizin u. Kultur. 10, 39, 1998, S. 10 f.
- Doris Schwarzmann-Schafhauser: Arsen. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 101.
- K. H. Wedepohl: The composition of the continental crust. In: Geochimica et Cosmochimica Acta. 59/7, 1995, S. 1217–1232.
- IMA/CNMNC List of Mineral Names – Gold. (PDF; 1,8 MB) S. 17 (englisch).
- Localities for Arsenic. Mindat.
- Heinrich Trierenberg: Reisewege zu historischen Stätten in Niederschlesien; Laumann-Verlag, Dülmen, 1996 (S. 206).
- Mineral Species sorted by the element As (Arsenic). Webmineral.
- USGS – Arsenic Statistics and Information – Mineral Commodity Summaries 2010 (PDF; 92 kB).
- Gesicherte Altlast S 7: Arsenikhalde Rotgülden. umweltbundesamt.at; abgerufen am 6. November 2012.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. vol. 1, Academic Press 1963, S. 591–592.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Stéphane Gibaud, Gérard Jaouen: Arsenic-based drugs: from Fowler’s solution to modern anticancer chemotherapy. In: Topics in Organometallic Chemistry. Band 32, 2010, S. 1–20, doi:10.1007/978-3-642-13185-1_1.
- J. M. Hyson: A history of arsenic in dentistry. In: Journal of the California Dental Association. Band 35, Nummer 2, Februar 2007, S. 135–139. PMID 17494382.
- M. Hülsmann: Risiken und Nebenwirkungen bei der Devitalisierung permanenter Zähne. In: Zahnärztl. Mitt. 86, 1996, S. 338–345.
- Ernst Sieburg: Zur Biologie aromatischer Arsenverbindungen. In: Hoppe-Seyler’s Zeitschrift für physiologische Chemie. Band 97, 1916, S. 53–108.
- Vgl. auch Florian G. Mildenberger: Kein Heil durch Arsen? Die Salvarsandebatte und ihre Konsequenzen. In: Fachprosaforschung – Grenzüberschreitungen. Band 8/9, 2012/2013 (2014), S. 327–390.
- Fernando Marte, Amandine Pequinot, David W. Von Endt: Arsenic in Taxidermy Collections: History, Detection, and Management. (Memento vom 20. Juli 2011 im Internet Archive) (PDF; 159 kB)
- Gerhard Schröder: Das Sammeln, Konservieren von Wirbeltieren. 1936.
- Rudolf Piechocki, Joachim Händel: Mikroskopische Präparationstechnik. Teil II, 4. Auflage. 1996.
- Felix Divo: Die Untersuchung von Tierpräparaten auf Gifte (Memento vom 22. November 2015 im Webarchiv archive.today). Jugend-forscht-Arbeit von 2011.
- John Emsley: Parfum, Portwein, PVC …. Wiley Verlag, Weinheim 2003, S. 274–275.
- M. Banerjee, N. Banerjee, P. Bhattacharjee, D. Mondal, P. R. Lythgoe, M. Martínez, J. Pan, D. A. Polya, A. K. Giri: High arsenic in rice is associated with elevated genotoxic effects in humans. In: Scientific reports. Band 3, Juli 2013, S. 2195, doi:10.1038/srep02195. PMID 23873074.
- Helmut Schubothe: Vergiftungen. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 1195–1217, hier: S. 1203–1205 (Arsenvergiftung).
- Felisa Wolfe-Simon, Jodi Switzer Blum, Thomas R. Kulp, Gwyneth W. Gordon, Shelley E. Hoeft, Jennifer Pett-Ridge, John F. Stolz, Samuel M. Webb, Peter K. Weber, Paul C. W. Davies, Ariel D. Anbar, Ronald S. Oremland: A Bacterium That Can Grow by Using Arsenic Instead of Phosphorus. In: Science. 2010, doi:10.1126/science.1197258.
- Lars Fischer: Angemerkt!: Der Arsen-Schnellschuss geht nach hinten los – Spektrum der Wissenschaft. In: wissenschaft-online.de. 15. August 2012, abgerufen am 27. Dezember 2014.
- Erika Check Study challenges existence of arsenic-based life: Study challenges existence of arsenic-based life. In: nature news. 20. Januar 2012, doi:10.1038/nature.2012.9861.
- M. L. Reaves, S. Sinha, J. D. Rabinowitz, L. Kruglyak, R. J. Redfield: Absence of arsenate in DNA from arsenate-grown GFAJ-1 cells. 19. April 2012, arxiv:1201.6643v2.
- Johann Mutschmann, Fritz Stimmelmayr: Taschenbuch der Wasserversorgung. Vieweg+Teubner, 2007, ISBN 978-3-8348-0012-1.
- Datenblatt Arsen (PDF) bei Merck, abgerufen am 26. April 2010.
- Arsenic Removal Using Nanoscale Magnetite.
- Richtlinie 98/83/EG des Rates vom 3. November 1998 über die Qualität von Wasser für den menschlichen Gebrauch. In: EUR-Lex.
- Richard Stone: Gefahr durch Arsen – Gift im Korn. In: sueddeutsche.de. 17. Mai 2010, abgerufen am 27. Dezember 2014.
- rme/aerzteblatt.de: Arsen macht Reis genotoxisch. In: aerzteblatt.de. 23. Juli 2013, abgerufen am 27. Dezember 2014.
- Blei im Baby-Brei: Neue Grenzwerte festgelegt. DPA-Meldung auf merkur-online.de vom 17. Juli 2014, abgerufen am 2. November 2014.
- Codex Alimentarius Commission – Geneva 14-18 July 2014. auf der Webseite der FAO, abgerufen am 2. November 2014 (englisch).
- Summary Report Of The Standing Committee On The Food Chain And Animal Health Held In Brussels On 01 July 2014. (PDF) ec.europa.eu; abgerufen am 2. November 2014 (englisch).
- Keiligh Baker: Cereal killers? More than half of rice products including Rice Krispies and Heinz baby rice exceed new EU limits for ARSENIC. In: Daily Mail. 2. November 2014, abgerufen am 2. November 2014 (englisch).
- Nadja Podbregar: Rätsel um Arsen im Bier gelöst. In: wissenschaft.de. 7. April 2013, abgerufen am 3. November 2014.
- FDA data shows arsenic in rice, juice and beer. In: Washington Post. 19. Mai 2014, abgerufen am 3. November 2014 (englisch).
- Elemente, Schwermetalle und Mineralstoffe – Untersuchungsergebnisse 2009. auf der Webseite des LGL Bayern, aktualisiert am 3. Mai 2012, abgerufen am 3. November 2014.
- T. K. Morris: Cadmium exposures at three nonferrous foundries: an unexpected trace source. In: J Occup Environ Hyg. 1(1), Jan 2004, S. 39–44. Ohio Bureau of Workers’ Compensation, Division of Safety and Hygiene, Cincinnati OH.
- Jie Qin u. a.: Biotransformation of arsenic by a Yellowstone thermoacidophilic eukaryotic alga. In: Proceedings of the National Academy of Sciences. (Abstract).
- Umweltproblem Arsen: Körperentgiftung durch Knoblauch möglich. In: derstandard.at. 19. Januar 2008, abgerufen am 27. Dezember 2014.
- R. Lobinski, Z. Marcenko: Spectrochemical Trace Analysis for Metals and Metalloids. Elsevier, 1997.
- P. Liang, L. Peng, P. Yan: Speciation of As(III) and As(V) in water samples by liquid-liquid microextraction separation and determination by graphite furnace atomic absorption spectrometry. In: Microchimica Acta. 166, 1999, S. 47–52 and darin genannte Zitationen.
- Y. Jiang, J. Liu, X. Xia, D. Wang: Ammonium pyrrolidinedithiocarbamate-modified activated carbon micro-column extraction for the determination of As(III) in water by graphite furnace atomic absorption spectrometry. In: Microchimica Acta. 161, 2008, S. 137–142.
- D. Hung, O. Nekrassova, R. Compton: Analytical Methods for Inorganic Arsenic in Water: A Review. In: Talanta. 64, 2004, S. 269–277.
- J. Mattusch, R. Wennrich: Novel Analytical Methodologies for the Determination of Arsenic and other Metalloid Species in Solids, Liquids and Gases. In: Microchimica Acta. 151, 2005, S. 137–139.
- S. Londesborough, J. Mattusch, R. Wennrich: Separation of organic and inorganic arsenic species by HPLC-ICP-MS. In: Fresenius Journal of Analytical Chemistry. 363, 1999, S. 577–581.
- G. Schwedt: Analytische Chemie. 2. Auflage. Wiley-VCH, 2008, S. 352.
- Entwicklung eines anwendungsbereiten Arsenbiosensors auf Basis von Bioreporter-Bakterien. (Memento vom 22. November 2015 im Internet Archive) (PDF) Helmholtz-Zentrum für Umweltforschung.
- Escherichia coli Bakterien in Arsen Detektoren 23. März 2012.
- K. O. Amayo, A. Raab, E. M. Krupp, T. Marschall, M. Horsfall Jr, J. Feldmann: Arsenolipids show different profiles in muscle tissues of four commercial fish species. J Trace Elem Med Biol. 2013 Nov 23. pii: S0946-672X(13)00167-3. PMID 24332310.
- Hou H, Cui W, Xu Q, Tao Z, Guo Y, Deng T: Arsenic Species Analysis at Trace Level by High Performance Liquid Chromatography with Inductively Coupled Plasma Mass Spectrometry, Int J Anal Chem. 2019 Jun 4;2019:3280840, PMID 31275389
- V. Dembitsky, D. Levitsky: Arsenolipides. In: Progress in Lipid Research. 43, 2004, S. 403–448.
- Theodor Ebert (Philosoph): Interview zu seinem Buch Der rätselhafte Tod des René Descartes. Alibri, Aschaffenburg 2009.
- orf.at: Lebenslange Haft im Arsen-Prozess, abgerufen am 12. April 2013.

