Ruthenium
Ruthenium (v. lateinisch Ruthenia „Ruthenien“, „Russland“) ist ein chemisches Element mit dem Elementsymbol Ru und der Ordnungszahl 44. Es zählt zu den Übergangsmetallen, im Periodensystem steht es in der 5. Periode und der Gruppe 8 (früher Teil der 8. Nebengruppe) oder auch Eisengruppe. Es ist ein silberweißes, hartes und sprödes Platinmetall.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Ruthenium, Ru, 44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 8, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß metallisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-127-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.297 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,02 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 101,07(2)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 130 (178) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 146 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d7 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 7.36050(5) eV[4] ≈ 710.18 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 16.76(6) eV[4] ≈ 1617 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 28.47 eV[4] ≈ 2747 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 45.0(1,7) eV[4] ≈ 4342 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 59.0(1,9) eV[4] ≈ 5693 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 12,37 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 6,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 6,6 · 10−5)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 2607 K (2334 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 4423 K[8] (4150 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 8,17 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 619 kJ/mol[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 25,7 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | 1,4 Pa bei 2523 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 5970 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 14,1 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 120 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 2, 3, 4, 6, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,2 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ruthenium wurde 1844 vom deutsch-baltischen Chemiker Karl Ernst Claus in sibirischen Platinerzen entdeckt. Es ist sehr selten und wird nur in geringen Mengen genutzt. Die Hauptanwendungsgebiete des Metalls liegen in der Elektronikindustrie beim Perpendicular Recording, einem Datenspeicherverfahren für Festplatten, und als Katalysator in verschiedenen chemischen Verfahren wie Hydrierungen, Methanisierung oder bei der Ammoniaksynthese. Einige Rutheniumverbindungen, z. B. die Grubbs-Katalysatoren, spielen ebenfalls eine Rolle in chemischen Synthesen.
Ruthenium besitzt keine bekannten biologischen Funktionen, jedoch werden einige Komplexe des Metalls hinsichtlich ihrer Wirkung als Mittel gegen Krebs erforscht.
Geschichte

Nachdem zwischen 1803 und 1804 kurz hintereinander die vier Platinmetalle Palladium, Rhodium, Iridium und Osmium von William Hyde Wollaston und Smithson Tennant in Platinerzen entdeckt wurden, versuchten andere Chemiker ebenfalls, aus derartigen Erzen bislang unbekannte Elemente zu isolieren.
Zunächst meldete der polnische Chemiker Jędrzej Śniadecki 1808, dass er im Jahr zuvor in seltenen südamerikanischen Platinerzen ein neues Element entdeckt habe. Er nannte dieses nach dem kurz zuvor entdeckten Asteroiden Vesta Vestium. Nachdem diese Entdeckung von anderen Chemikern jedoch nicht verifiziert werden konnte, wurde die Entdeckung wieder verworfen.[11]
Nach der Entdeckung großer Platinerzlagerstätten im Ural 1819 begannen Jöns Jakob Berzelius in Stockholm und Gottfried Osann in Tartu, diese zu untersuchen. Dabei erhielt Osann 1828 zunächst ein unbekanntes weißes Oxid, dessen Eigenschaften zu keinem anderen Oxid passten, und nach Reduktion ein unbekanntes goldgelbes Metall. Dieses nannte er nach dem Herkunftsland des Erzes Russland Ruthenium.[12] Nachdem jedoch Berzelius diese Entdeckung nicht bestätigen konnte, wiederholte Osann seine Arbeiten, konnte aber die Isolierung des Rutheniums nicht wiederholen und zog daraufhin seine Entdeckung zurück.[13][14]
Der deutsch-baltische Chemiker Karl Ernst Claus versuchte seit 1841 an der Universität Kasan, Osanns Experimente zu wiederholen und unbekannte Elemente aus Platinerzen zu extrahieren. Dies gelang ihm schließlich 1844, als er sechs Gramm eines unbekannten hellgrauen Metalls gewinnen konnte. Er nannte das neue Element wie Osann ebenfalls Ruthenium. Ebenso wie Osann bat Claus Berzelius, die Experimente zu überprüfen und das neue Element zu bestätigen. Da dieser 1845 die Ergebnisse bestätigen konnte, gilt seitdem Claus als Entdecker des Rutheniums.[15]
Vorkommen
Ruthenium zählt zu den seltensten nicht-radioaktiven Elementen auf der Erde. Seine Häufigkeit beträgt etwa 1 ppb Masseanteil in der Erdkruste,[16][17] während es in der Erdhülle (Kruste bis 16 km Tiefe) mit einem Masseanteil von 20 ppb enthalten ist[18][17]. Die Häufigkeit ist vergleichbar mit der von Rhodium, Iridium oder Rhenium.[19] Es ist meist mit anderen Platinmetallen vergesellschaftet, so beträgt der Anteil des Rutheniums in der wichtigsten Platinmetalllagerstätte, dem südafrikanischen Bushveld-Komplex, zwischen acht und zwölf Prozent.[20]
Wie andere Platinmetalle kommt es gediegen in der Natur vor und ist darum von der IMA als Mineral mit der System-Nr. 1.AF.05 (Klasse: Elemente, Abteilung: Metalle und intermetallische Verbindungen, Unterabteilung: Platingruppen-Elemente) anerkannt.[21]
Seine Typlokalität, in der das Mineral 1974 erstmals von Y. Urashima, T. Wakabayashi, T. Masaki und Y. Terasaki gefunden wurde, liegt am Fluss Uryū auf der japanischen Insel Hokkaidō. Neben dieser sind weitere 21 Fundorte elementaren Rutheniums bekannt. Zu diesen zählen unter anderem Nischni Tagil und der Miass-Fluss in Russland, der Yuba River in Kalifornien oder der Bushveld-Complex in Südafrika.[22]
Neben elementarem Ruthenium sind auch verschiedene rutheniumhaltige Minerale bekannt. Bei den 13 zurzeit bekannten (Stand: 2010)[23] handelt es sich um Legierungen mit anderen Platinmetallen wie Rutheniridosmin, Sulfide wie Laurit (RuS2) oder Arsenide wie Ruthenarsenit (Ru,Ni)As.
Ruthenium befindet sich auch als Spaltprodukt in abgebrannten Brennelementen von Kernreaktoren. Da die radioaktiven Isotope von Ruthenium verhältnismäßig kurzlebig sind (siehe oben), ist das Ruthenium, welches in Brennstäben nach Entnahme aus dem Abklingbecken enthalten ist, nicht radioaktiv. Problematisch ist jedoch das Vorhandensein von 107Pd, das als Platinmetall Ruthenium chemisch sehr ähnlich ist und langlebige Radioaktivität aufweist. Trotz hoher Ruthenium-Preise unterbleibt Stand 2022 die Gewinnung von Ruthenium aus abgebrannten Kernbrennstoff, es ist jedoch einer von mehreren potentiell nutzbaren Bestandteilen des „Atommülls“, der einige Menschen zu der Forderung bringt, ein potentielles Endlager mit „Rückholbarkeit“ zu planen.[24][25]
Gewinnung und Darstellung

Durch die Ähnlichkeiten und geringe Reaktivität der Platinmetalle ist eine Trennung dieser Elemente kompliziert. Es existieren mehrere Möglichkeiten, Ruthenium zu isolieren. Enthält ein Erz eine hohe Rutheniumkonzentration, erfolgt die Abtrennung des Rutheniums am besten zuerst und wird durch Destillation erreicht. Dazu wird eine drei- oder sechswertiges Ruthenium enthaltende Lösung mit Oxidationsmitteln wie Chlor, Chloraten oder Kaliumpermanganat versetzt. Durch dieses wird das Ruthenium zum leicht flüchtigen Ruthenium(VIII)-oxid oxidiert. Dieses kann in verdünnter Salzsäure aufgefangen und zu wasserlöslichen Chlororuthenat-Komplexen reduziert werden. Der Grund für dieses Vorgehen sind die Gefahren, die durch die Bildung von Ruthenium(VIII)-oxid während der Trennung bestehen. So können durch Reaktion von Ruthenium(VIII)-oxid mit Ammoniumsalzen explosive Stickstoff-Chlor-Verbindungen entstehen.[20]
Sind nur geringe Mengen Ruthenium im Ausgangsmaterial enthalten, werden zunächst die übrigen Platinmetalle abgetrennt. Dazu gibt es für die verschiedenen Metalle unterschiedliche Verfahren, insbesondere die Extraktion mit geeigneten Lösungsmitteln oder das Ausfällen der schwerlöslichen Salze. Schließlich bleibt das gelöste Ruthenium übrig. Die Lösung wird von vorhandenem Ammonium befreit, das Ruthenium zu Ruthenium(VIII)-oxid oxidiert und durch Destillation abgetrennt.[20]
Um metallisches Ruthenium zu erhalten, wird es entweder als Ammoniumhexachlororuthenat oder als Ruthenium(IV)-oxid ausgefällt und bei 800 °C in einer Wasserstoffatmosphäre reduziert.
Neben Platinerzen ist auch der Anodenschlamm, der bei der Nickelproduktion anfällt, ein wichtiger Rohstoff für die Gewinnung von Ruthenium und den anderen Platinmetallen.
Ein weiteres Vorkommen von Ruthenium sind abgebrannte Brennelemente, da bei der Kernspaltung auch Platinmetalle entstehen. Eine Tonne dieser Brennelemente enthält über zwei Kilogramm Ruthenium, jedoch auch wertvollere Platinmetalle wie Rhodium oder Palladium. Dieses Ruthenium aus abgebrannten Brennelementen enthält knapp 4 % radioaktives 106Ru (weicher Betastrahler, Halbwertszeit ca. 1 Jahr), das zu 106Rh zerfällt. Das Rhodium zerfällt sofort (Halbwertszeit 30 s) unter Aussendung von Gammastrahlung. Eine Nutzung des Rutheniums aus Atomreaktoren ist daher unter derzeitigen Umständen nicht absehbar.[26]
Die Weltproduktion an Ruthenium liegt im Bereich von ca. 20 t pro Jahr (Stand 2008).[27]
Eigenschaften
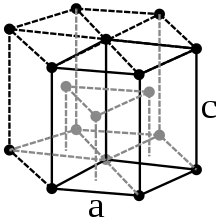
Physikalische Eigenschaften
Ruthenium ist ein silberweißes, hartes und sprödes Metall. Mit einer Dichte von 12,37 g/cm3 ist es nach Palladium das zweitleichteste Platinmetall. Ruthenium schmilzt bei 2606 K und siedet bei etwa 4423 K.[8] Unterhalb von 0,49 K wird das Element zum Supraleiter.[28]
Ebenso wie Osmium kristallisiert Ruthenium in einer hexagonal-dichtesten Kugelpackung in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) mit den Gitterparametern a = 270,6 pm und c = 428,1 pm sowie zwei Formeleinheiten pro Elementarzelle.[29] Mitunter werden vier verschiedene polymorphe Formen des Rutheniums angegeben, in die sich das Metall beim Erhitzen auf Temperaturen von 1308, 1473 und 1770 K umwandelt. Diese beruhen jedoch auf kalorimetrischen Messungen aus dem Jahr 1931, die in der Folgezeit nicht bestätigt werden konnten. Daher ist es wahrscheinlich, dass das Element bis zum Schmelzpunkt lediglich eine Modifikation besitzt.[30] Eine metastabile tetragonale Modifikation wurde in sehr dünnen Filmen auf einer Molybdän-Oberfläche gefunden. Diese zeigt bei Raumtemperatur ferromagnetische Eigenschaften.[31]
Chemische Eigenschaften
Innerhalb der Eisengruppe besitzt Ruthenium ähnliche Eigenschaften wie das Osmium, während es sich von denen des Eisens deutlich unterscheidet. Es ist wie andere Platinmetalle und im Gegensatz zum Eisen ein reaktionsträges Edelmetall. Mit dem Sauerstoff der Luft reagiert es erst bei Temperaturen über 700 °C und bildet dabei Ruthenium(VIII)-oxid. Hierbei unterscheidet es sich auch vom Osmium, das schon bei Raumtemperatur beim Kontakt mit Sauerstoff in Spuren das entsprechende Osmium(VIII)-oxid bildet. Auch mit Fluor und Chlor reagiert Ruthenium erst in der Hitze und bildet dabei Ruthenium(VI)-fluorid beziehungsweise Ruthenium(III)-chlorid.
Das Metall löst sich nicht in Säuren wie z. B. Flusssäure, Schwefelsäure, Salpetersäure oder auch Königswasser. Angegriffen wird es dagegen langsam von wässrigen Chlor- und Bromlösungen, schnell von Cyanidlösungen und von Quecksilber(II)-chlorid. Starke Oxidationsmittel wie Kaliumhydroxid-Kaliumnitrat- oder Natriumhydroxid-Natriumperoxid-Schmelzen oxidieren Ruthenium schnell.[30]
Isotope
Es sind insgesamt 33 Isotope und weitere sechs Kernisomere des Rutheniums zwischen 87Ru und 120Ru bekannt. Von diesen sind sieben stabil und kommen auch in der Natur vor. Am häufigsten ist dabei das Isotop 102Ru mit einem Anteil von 31,6 % an der natürlichen Isotopenzusammensetzung. Vier Isotope, 104Ru, 101Ru, 100Ru und 99Ru sind mit Anteilen zwischen 12 und 19 % ähnlich häufig. Die seltensten der stabilen Isotope sind 96Ru und 98Ru mit Anteilen von 5,52 beziehungsweise 1,88 %. Von den instabilen Isotopen besitzen lediglich 97Ru (2,9 Tage), 103Ru (39,26 Tage) und 106Ru (373,59 Tage) Halbwertszeiten von einigen Tagen; die der anderen liegen im Bereich von Millisekunden (103m1Ru: 1,69 ms) bis Stunden (105Ru: 4,44 h).[32]
Rutheniumisotope, vor allem 101Ru, 102Ru und 104Ru entstehen bei der Kernspaltung und sind daher in abgebrannten Brennelementen vorhanden. Eine Tonne bei der Kernspaltung eingesetztes Uran enthält als Spaltprodukt etwa 1,9 Kilogramm Ruthenium. Dieses kann bei der Wiederaufarbeitung durch Oxidation zu flüchtigem Ruthenium(VIII)-oxid aus dem in Salpetersäure gelösten Gemisch abgetrennt werden. Da dieses Ruthenium aber auch einen Anteil des radioaktiven und mit einer Halbwertszeit von 373 Tagen relativ langlebigen Isotopes 106Ru enthält, kann es nicht direkt für andere Zwecke eingesetzt werden.[33][34] Nach Durchlauf einer ausreichenden Anzahl Halbwertszeiten wäre aber prinzipiell die Gewinnung nutzbaren Rutheniums aus abgebrannten Brennelementen denkbar. Auch die Transmutation des – sowohl als nuklearmedizinischer Abfall wie auch als Spaltprodukt anfallenden – Technetium-99 durch Neutroneneinfang und anschließenden Betazerfall wird verschiedentlich sowohl zur Produktion von Ruthenium als auch zur sicheren Entsorgung des langlebigen und stark radiotoxischen Technetium diskutiert.[35] Die schweren Ruthenium-Isotope zerfallen hauptsächlich zu Rhodium, das noch höhere Preise erzielt als Ruthenium selbst. Aus kerntechnisch erzeugtem Ruthenium könnte also auch nach Ablauf entsprechender Halbwertszeiten Rhodium gewonnen werden. Problematisch ist hierbei, dass 103Rh das einzige stabile Isotop des Rhodium ist, wobei Rhodium-Isotopen mit Massezahlen größer 103 sämtlich kurzlebig sind und bevorzugt zu Palladium-Isotopen betazerfallen.
Verwendung
Ruthenium wird nur in geringem Maß genutzt. Der größte Teil des Metalls wird dabei in der Elektronikindustrie verwendet. Hier spielt seit dem Jahr 2006 vor allem das Perpendicular Recording eine Rolle, ein Verfahren zur Speicherung von Daten auf Festplatten, bei dem eine dünne Schicht Ruthenium die Speicherschicht aus einer Cobalt-Chrom-Platin-Legierung von einer weichmagnetischen Unterschicht trennt. Der Grund dafür, dass Ruthenium genutzt wird, liegt in seiner hexagonalen Kristallstruktur, die eine ähnliche Gitterkonstante wie die verwendete Speicherschicht-Legierung besitzt.[36][27] Dünne Rutheniumschichten werden in elektrischen Kontakten wie Schleifringen oder Reed-Relais eingesetzt. Sie sind im Vergleich zu anderen einsetzbaren Metallen wie cobalt-gehärtetem Gold härter und damit beständiger gegen Abrieb.[37]
Wie andere Platinmetalle wirkt auch Ruthenium katalytisch. So kann es etwa zur Hydrierung von Aromaten, Säuren und Ketonen verwendet werden.[38] Ruthenium wirkt auch katalytisch bei der Methanisierung, der Herstellung von Methan aus Wasserstoff und Kohlenstoffmonoxid bzw. Kohlenstoffdioxid. Ruthenium hat bislang jedoch nur geringe Anwendungen für die Methanisierung gefunden, meist werden Nickel-Katalysatoren genutzt. Die zur Methanisierung mit Ruthenium benötigten niedrigeren Temperaturen könnten für Langzeit-Weltraummissionen interessant sein, da das von den Astronauten ausgeatmete Kohlenstoffdioxid umgesetzt und so der Sauerstoffkreislauf geschlossen werden könnte.[39][40]
Analog zu Eisen und Osmium katalysiert auch Ruthenium die Ammoniak-Synthese aus Stickstoff und Wasserstoff. Es besitzt eine höhere Katalysatoraktivität als Eisen und ermöglicht so eine höhere Ausbeute bei niedrigeren Drücken. Der Einsatz des Metalls ist vor allem durch den Preis limitiert.[41] Industriell eingesetzt wird ein Rutheniumkatalysator, der auf einer Kohlenstoffmatrix geträgert und durch Barium und Caesium als Promotoren verbessert wurde, seit 1998 in zwei Produktionsanlagen von KBR auf Trinidad. Da die langsame Methanisierung des Kohlenstoffträgers beim Prozessablauf stört, wird an kohlenstofffreien Rutheniumkatalysatoren für die Ammoniaksynthese geforscht.[42]
In kleinen Mengen wird Ruthenium in Legierungen von Palladium oder Platin zur Erhöhung der Härte eingesetzt. Rutheniumhaltige Legierungen werden unter anderem für Federspitzen von Füllfederhaltern[38] oder für Zahnfüllungen gebraucht.[43] Titanlegierungen werden durch geringe Mengen an Ruthenium (0,1 %) korrosionsbeständiger, was für Anwendungen in der chemischen Industrie oder der Ölförderung wichtig ist. Es ist dabei eine mögliche Alternative zu Palladium.[44] Auch in Superlegierungen auf Nickelbasis, die für Turbinenschaufeln verwendet werden, kann Ruthenium ein Legierungsbestandteil sein, es bewirkt hier eine erhöhte Phasenstabilität.[45]
Ein großer Teil des Rutheniums wird nicht in Form des Metalls, sondern als Verbindung, vor allem als Ruthenium(IV)-oxid eingesetzt, das unter anderem als Material für Widerstände und Elektroden, beispielsweise für die Beschichtung von Titananoden in der Chloralkali-Elektrolyse.[38][11]
Der Betastrahler 106Ru wird zur Strahlentherapie des Aderhautmelanoms eingesetzt.[46][47]
Biologische Bedeutung
Wie andere Platinmetalle besitzt Ruthenium keine biologische Bedeutung und kommt im Körper normalerweise nicht vor. Verschiedene Rutheniumkomplexe haben ein pharmakologisches Potenzial. Es werden verschiedene Anwendungen als Wirkstoff erforscht. Einige Verbindungen werden schon in klinischen Studien erprobt. Am wichtigsten hierfür ist die Wirkung als Zytostatikum, also als Mittel zur Therapie von Krebs. Hier gelten Rutheniumkomplexe als mögliche Alternativen zu Cisplatin beziehungsweise Carboplatin. Neben der tumorhemmenden Wirkung, die die Verbindungen mehrerer Platinmetalle besitzen, begründet sich dies vor allem auf drei Eigenschaften von Rutheniumkomplexen:
- Sie besitzen einen langsamen Ligandenaustausch, so dass der Komplex die richtige Stelle im Körper erreichen kann, ohne dass er mit Wasser oder anderen Molekülen reagiert,
- mehrere mögliche Oxidationsstufen (+2, +3, +4) unter physiologischen Bedingungen, sowie
- eine große Ähnlichkeit zu Eisen, so dass sie dieses in Proteinen wie Transferrin ersetzen können.
Da dreiwertiges Ruthenium relativ inaktiv ist, während zweiwertiges eine starke tumorhemmende Wirkung zeigt, sollte es möglich sein, dreiwertiges Ruthenium in einem Tumor zum zweiwertigen zu reduzieren und so zu aktivieren. Damit wäre eine selektivere Wirkung als bei anderen Zytostatika möglich.[48] Bisher ist noch kein Arzneimittel auf der Basis von Ruthenium zugelassen.[49]
Neben der Verwendung in der antineoplastischen Chemotherapie werden auch Anwendungen von Rutheniumverbindungen als Immunsuppressivum, Antibiotikum und antimikrobielle Substanz, beispielsweise zur Bekämpfung von Malaria oder der Chagas-Krankheit, untersucht.[48]
Vorsichtsmaßnahmen
Ruthenium ist als Metall ungiftig. Im Gegensatz zu Osmium bildet sich auch das giftige und leicht flüchtige Tetraoxid nicht durch Reaktion mit Sauerstoff bei Raumtemperatur, sondern nur bei der Reaktion mit starken Oxidationsmitteln. In Pulverform ist Ruthenium brennbar, bei Bränden darf nicht mit Wasser, sondern nur mit Löschpulver oder Metallbrandlöschern gelöscht werden.[50]
Verbindungen
Ruthenium bildet Verbindungen in den Oxidationsstufen −2 bis +8, die stabilsten und häufigsten sind dabei +3 und +4. Es zählt damit zusammen mit Osmium und Xenon zu den Elementen, bei denen die höchste Oxidationsstufe +8 chemisch erreicht werden kann.
Sauerstoffverbindungen
Ruthenium bildet mit Sauerstoff drei binäre Oxide, Ruthenium(VIII)-oxid, Ruthenium(VI)-oxid und Ruthenium(IV)-oxid. Dazu sind noch Ruthenium(III)-oxid, dieses jedoch nur als Hydrat, und verschiedene Ruthenate, unter anderen orangefarbenes Ruthenat(VI), Salze deren Anion eine Ruthenium-Sauerstoffverbindung ist, bekannt. Ruthenium(VIII)-oxid ist, wie Osmium(VIII)-oxid, eine gelbe, leicht flüchtige und giftige Verbindung, die durch Reaktion von Ruthenium oder dessen Verbindungen mit starken Oxidationsmitteln gewonnen wird und die als starkes Oxidationsmittel und für die Abtrennung von Ruthenium von anderen Platinmetallen von Bedeutung ist. Während Ruthenium(VI)-oxid nur in der Gasphase bekannt ist, ist Ruthenium(IV)-oxid ein stabiles, in der Rutilstruktur kristallisierendes Salz, das unter anderem in Widerständen verwendet wird und zur Beschichtung von Elektroden dient.
Im Gegensatz zu Osmium ist vom Ruthenium kein achtwertiges Ruthenat bekannt, in wässrigen Lösungen entsteht bei Reaktion mit starken Oxidationsmitteln ein siebenwertiges, dem Permanganat entsprechendes gelbgrünes Perruthenat. Dieses wirkt ebenfalls als Oxidationsmittel, ist jedoch milder und damit selektiver als Ruthenium(VIII)-oxid oder Osmium(VIII)-oxid. So werden primäre Alkohole durch Perruthenate nicht zu Carbonsäuren, sondern nur zu Aldehyden oxidiert. Häufig wird es in organischen Synthesen in Form von Tetrapropylammoniumperruthenat (TPAP) eingesetzt. Es wird dabei zu vierwertigem Ruthenium reduziert.[51][52]
Komplexe
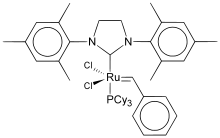
Vom Ruthenium sind zahlreiche Komplexverbindungen sowohl mit anorganischen als auch organischen Liganden bekannt. Diese können in sehr unterschiedlichen Oxidationsstufen von −2 bis +8 vorliegen. In mittleren Stufen, wie +2, +3 und +4, sind auch nichtklassische Komplexe synthetisiert worden, die Metallcluster mit Ruthenium-Ruthenium-Bindungen enthalten.
Einige Rutheniumkomplexe haben Anwendung als Katalysatoren in verschiedenen organischen Synthesen gefunden. So ist Ruthenium das Zentralmetall in den Komplexen der Grubbs-Katalysatoren, die zu den wichtigsten Katalysatoren für die Olefinmetathese zählen. Ein weiterer, in der organischen Synthese bedeutender Komplex ist der Noyori-Katalysator, ein Ruthenium-Chlor-BINAP-Komplex, der eine effiziente asymmetrische Hydrierung von β-Keto-Estern ermöglicht.[53]
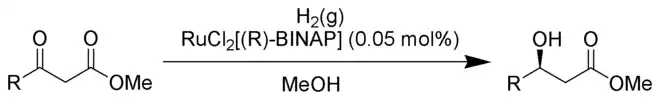
Rutheniumkomplexe sind in der Lage, Polymerisationen zu katalysieren. Neben der auf der Metathese beruhenden Ringöffnungspolymerisation (ROMP) können auch lebende freie radikalische Polymerisationen durch Rutheniumkomplexe ermöglicht werden. Ein Beispiel hierfür ist die Polymerisation von Methylmethacrylat mit RuCl2(PPh3)3 als Katalysator.[54]
Zu den bekanntesten Rutheniumkomplexen zählt der Amin-Komplex Rutheniumrot, der in der Histologie als Färbemittel sowie als Redoxindikator und zur Untersuchung von Textilfasern verwendet wird.[55] Ein weiteres Beispiel für einen Rutheniumkomplex ist (1,5-Cyclooctadien)(1,3,5-cyclooctatrien)ruthenium, das erstmals 1963 von Ernst Otto Fischer synthetisiert wurde.[56]
Weitere Rutheniumverbindungen
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Ruthenium eine Reihe von Verbindungen. Am stabilsten sind dabei die dreiwertigen Rutheniumhalogenide, diese sind auch von allen Halogenen bekannt. In höheren Oxidationsstufen sind lediglich die Fluoride bis zum Ruthenium(VI)-fluorid sowie das instabile Ruthenium(IV)-chlorid bekannt. Die wichtigste dieser Verbindungen ist Ruthenium(III)-chlorid, die ein Ausgangsstoff für die Synthese vieler anderer Rutheniumverbindungen ist.
Einen Überblick über Rutheniumverbindungen bietet die Kategorie:Rutheniumverbindung.
Freisetzung von 106Ru südlich des Urals 2017
Im Oktober 2017 wurden in mehreren Ländern Europas erhöhte atmosphärische 106Ru-Konzentrationen in der Größenordnung 10 mBq/m3 gemessen, die allerdings weit unterhalb normaler Luftaktivitäten lagen.[57] Die Analyse der Luftströmungen ließ auf eine Quelle südlich des Urals in Russland schließen. In jenem Zeitraum wurde für das Experiment SOX-Borexino in Gran Sasso, das »sterile« Neutrinos finden soll, eine kompakte, extrem aktive Strahlungsquelle benötigt. Diese bestellte man in einer Wiederaufarbeitungsanlage in Majak[58]. Das dafür nötige stark angereicherte Cer liefern nur frisch ausgebrannte Kernbrennstäbe. Der Anteil von 103Ru in den Proben legt nahe, dass die abgebrannten Brennelemente nur zwei Jahre nach dem Ende des Kraftwerksbetriebs in Majak aufgearbeitet wurden. Derart stark radioaktive Brennelemente sind schwer zu verarbeiten. Dabei wird Ruthenium ohnehin abgetrennt. Es entweicht als gasförmiges Rutheniumtetroxid. 30 Kilometer entfernt von Majak in der Gemeinde Argajasch wurden hohe Luftkonzentrationen von 106Ru gemessen. Die freigesetzte Aktivität wurde mit 100–300 Terabecquerel abgeschätzt, eine für die lokale Bevölkerung riskante Menge. Die französische Zeitung Le Figaro beschrieb im Februar 2018 den Auftrag französischer und italienischer Forscher. Majak teilte im Dezember 2017 mit, das bestellte Cer-144 sei nicht zu liefern, weil der Prozess das erforderliche Niveau nicht erreichte.[59] Diese Ursachen-Vermutung wird auch in einer 2019 veröffentlichten Studie erläutert.[60][61]
Literatur
- Eintrag zu Ruthenium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- Hermann Renner u. a.: Platinum Group Metals and Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2001, doi:10.1002/14356007.a21_075.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Ruthenium) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu ruthenium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu ruthenium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Ruthenium) entnommen.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Ruthenium) entnommen.
- Datenblatt Ruthenium bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- John Emsley: Nature’s Building Blocks. An A–Z Guide to the Elements. Oxford University Press, Oxford 2001, ISBN 0-19-850341-5, S. 368–369.
- G. Osann: Fortsetzung der Untersuchung des Platins vom Ural. In: Poggendorffs Annalen der Physik und Chemie. 14, 1828, S. 329–257 (Digitalisat auf Gallica).
- G. Osann: Berichtigung, meine Untersuchung des uralschen Platins betreffend. In: Poggendorffs Annalen der Physik und Chemie. 15, 1829, S. 158 (Digitalisat auf Gallica).
- Helvi Hödrejärv: Gottfried Wilhelm Osann and ruthenium. In: Proceedings of the Estonian Academy of Sciences, Chemistry. 53, Nr. 3, 2004, S. 125–144 (eingeschränkte Vorschau in der Google-Buchsuche).
- V. N. Pitchkov: The Discovery of Ruthenium. (PDF; 689 kB) In: Platinum Metals Review. 40, 4, 1996, S. 181–188.
- uniterra.de
- periodensystem-online.de
- periodensystem.info
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC, Boca Raton 2009, ISBN 978-1-4200-9084-0 (Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea).
- Hermann Renner u. a.: Platinum Group Metals and Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2001, doi:10.1002/14356007.a21_075.
- IMA/CNMNC List of Mineral Names - Ruthenium (Memento vom 20. März 2009 im Internet Archive) (englisch, PDF 1,8 MB, S. 247).
- Jolyon Ralph, Ida Chau: Ruthenium. In: mindat.org. abgerufen am 12. April 2010 (engl.).
- Webmineral - Mineral Species sorted by the element Ru (Ruthenium) (englisch).
- https://link.springer.com/article/10.1007/s10512-020-00638-y
- https://www.technology.matthey.com/wp-content/uploads/pdf/pmr-v47-i2-074-087.pdf
- Zdenek Kolarik, Edouard V. Renard: Potential Applications of Fission Platinoids in Industry. (PDF; 379 kB) In: Platinum Metals Review. 49, 2005, S. 79–90.
- United States Geological Survey (Hrsg.): 2008 Minerals Yearbook – Platinum-Group Metals (PDF; 64 kB). 2007.
- Mark Winter: Ruthenium: physical properties. In: Webelements.com. Abgerufen am 28. April 2010.
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 30, 1974, S. 193–204, doi:10.1107/S0567740874002469.
- Joseph A. Rard: Chemistry and thermodynamics of ruthenium and some of its inorganic compounds and aqueous species. In: Chemical Reviews. 85, Nr. 1, 1985, S. 1–39, doi:10.1021/cr00065a001.
- P. Quarterman, Congli Sun, Javier Garcia-Barriocanal, Mahendra DC, Yang Lv, Sasikanth Manipatruni, Dmitri E. Nikonov, Ian A. Young, Paul M. Voyles, Jian-Ping Wang: Demonstration of Ru as the 4th ferromagnetic element at room temperature. In: Nature Communications. 9, 2018, doi:10.1038/s41467-018-04512-1.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- R. P. Bush: Recovery of Platinum Group Metals from High Level Radioactive Waste. (PDF; 494 kB) In: Platinum Metals Review. 35, Nr. 4, 1991, S. 202–208.
- Martin Volkmer: Basiswissen Kernenergie. Informationskreis Kernenergie, Bonn 1996, ISBN 3-925986-09-X, S. 80.
- https://www.sciencedirect.com/science/article/pii/S1631074804002188
- J. Z. Shi u. a.: Influence of dual-Ru intermediate layers on magnetic properties and recording performance of CoCrPt–SiO2 perpendicular recording media. In: Applied Physics Letters. 87, 2005, S. 222503–222506, doi:10.1063/1.2137447.
- Paul C. Hydes: Electrodeposited Ruthenium as an Electrical Contact Material. (PDF; 452 kB) In: Platinum Metals Review. 24, Nr. 2, 1980, S. 50–55.
- Eintrag zu Ruthenium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- Yvonne Traa, Jens Weitkamp: Kinetik der Methanisierung von Kohlendioxid an Ruthenium auf Titandioxid. In: Chemie Ingenieur Technik. 70, Nr. 11, 1998, S. 1428–1430, doi:10.1002/cite.330701115.
- Heinz Hiller u. a.: Gas Production. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2001, doi:10.1002/14356007.a12_169.pub2.
- Max Appl: Ammonia. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, doi:10.1002/14356007.a02_143.pub2.
- Hubert Bielawa, Olaf Hinrichsen, Alexander Birkner, Martin Muhler: Der Ammoniakkatalysator der nächsten Generation: Barium-promotiertes Ruthenium auf oxidischen Trägern. In: Angewandte Chemie. 113, Nr. 6, 2001, S. 1093–1096, doi:10.1002/1521-3757(20010316)113:6<1093::AID-ANGE10930>3.0.CO;2-3.
- Karl Eichner, Heinrich F. Kappert: Zahnärztliche Werkstoffe und ihre Verarbeitung. 8. Auflage. Thieme, Stuttgart 2005, ISBN 3-13-127148-5, S. 93.
- R. W. Schutz: Ruthenium Enhanced Titanium Alloys. (PDF; 474 kB) In: Platinum Metals Reviews. 40, Nr. 2, 1996, S. 54–61.
- Yutaka Koizumi u. a.: Development of a Next-Generation Ni-base Single Crystal Superalloy. (PDF; 313 kB) In: Proceedings of the International Gas Turbine Congress 2003 Tokyo. 2003.
- Holger Voigt: Malignes Melanom. Springer-Verlag, 2013, ISBN 978-3-642-70460-4, S. 56 (eingeschränkte Vorschau in der Google-Buchsuche).
- Aderhautmelanom - Ärzteinformation. In: radioonkologie.uniklinikum-leipzig.de. 15. April 2015, abgerufen am 9. Oktober 2017.
- Claire S. Allardyce, Paul J. Dyson: Ruthenium in Medicine: Current Clinical Uses and Future Prospects. (PDF; 612 kB) In: Platinum Metals Review. 45, Nr. 2, 2001, S. 62–69.
- Emmanuel S. Antonarakis, Ashkan Emadi: Ruthenium-based chemotherapeutics: are they ready for prime time? In: Cancer Chemotherapy and Pharmacology. 66, Nr. 1, 2010, S. 1–9, doi:10.1007/s00280-010-1293-1.
- Eintrag zu Ruthenium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. April 2008. (JavaScript erforderlich)
- Steven V. Ley, Joanne Norman, William P. Griffith, Stephen P. Marsden: Tetrapropylammonium Perruthenate, Pr4N+RuO4−, TPAP: A Catalytic Oxidant for Organic Synthesis. In: Synthesis. 7, 1994, S. 639–666, doi:10.1055/s-1994-25538.
- Holleman-Wiberg, Lehrbuch der Anorganischen Chemie, 101. Auflage, de Gruyter Verlag 1995 ISBN 3-11-012641-9.
- Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 632–633, 642.
- Ruthenium in Living Radical Polymerisation. (PDF; 114 kB) In: Platinum Metals Review. 43, Nr. 3, 1999, S. 102.
- Eintrag zu Ruthenium-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- Ernst Otto Fischer, Jörn Müller: Metall-π-Komplexe des Rutheniums und Osmiums mit 6- und 8-gliedrigen cyclischen Oligoolefinen. In: Chemische Berichte. 96, 1963, S. 3217–3222, doi:10.1002/cber.19630961217.
- Ursprung in Russland? – Ruthenium-106-Werte lassen aufmerken. n-tv.de, 21. November 2017, abgerufen am 30. November 2017.
- Neutrinoexperiment steckte hinter Nuklearunfall. Spektrum-Verlag, 29. Juli 2019, abgerufen am 30. Juli 2019
- Une commande franco-italienne à l'origine de la pollution au ruthénium 106?, Le Figaro, 2. Februar 2018
- Airborne concentrations and chemical considerations of radioactive ruthenium from an undeclared major nuclear release in 2017. PNAS (englisch), 26. Juli 2019, abgerufen am 28. Juli 2019.
- Rätsel um radioaktive Wolke gelöst. science.orf.at, 27. Juli 2019, abgerufen am 28. Juli 2019.
