Chemotrophie
Chemotrophie (wörtlich „chemische Ernährung“, vgl. Trophie) bezeichnet den Stoffwechseltyp aller Lebewesen, die Energie für ihren Stoffwechsel aus chemischen Reaktionen von Stoffen gewinnen, die sie aus der Umgebung aufnehmen.[1] Lebewesen mit einem derartigen Energiestoffwechsel werden als chemotroph bezeichnet. Alternative ist die Phototrophie, bei der Licht als Energiequelle genutzt wird.
Die ersten Lebensformen und der Urvorfahr, von dem alle heutigen Lebewesen abstammen, waren vermutlich chemotroph. Phototrophe Organismen entwickelten sich erst später.
Adenosintriphosphat (ATP)
Alle bekannten Lebewesen benötigen Energie durch Abbau (Hydrolyse) von Adenosintriphosphat (ATP) zu Adenosindiphosphat (ADP) oder Adenosinmonophosphat (AMP).
ATP kann durch energieliefernde Redoxreaktionen gebildet werden. Die aufgenommenen Reduktionsmittel oder katabolisch daraus gebildete Elektronendonatoren reagieren mit externen Elektronenakzeptoren. Diese Reaktionen werden meist durch Enzyme katalysiert, die sich an Biomembranen befinden. Dort wird dann nach dem chemiosmotischen Prinzip ATP durch eine ATP-Synthase (Abb. 1, rechts) gebildet.
ATP kann auch durch Gärungen gebildet werden, bei denen ATP im Zellinneren durch den chemischen Umbau organischer Stoffe gebildet wird (Substratkettenphosphorylierung (SKP), Abb. 1, unten Mitte).
Nutzung von organischen Stoffen
Membrantransport und Gärung am Beispiel eines Milchsäurebakteriums
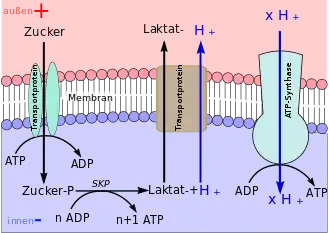
SKP = Substratkettenphosphorylierung
Chemotrophe Organismen, die von außen aufgenommene organische Stoffe nutzen, müssen häufig Energie in Form von ATP aufwenden, um die Energie liefernden Stoffe in ihr Zellinneres zu transportieren (aktiver Transport). Bei dem in Abb. 1 vereinfacht dargestellten Stoffwechsel eines Milchsäurebakteriums wird von außen unter Energieverbrauch ein Zucker ins Zellinnere transportiert. Der Zucker wird dabei mit Phosphat verestert. Anschließend folgt bei diesem Bakterium der Abbau des aufgenommenen Energielieferanten über eine Substratkettenphosphorylierung (SKP). Dadurch kann ATP aus ADP regeneriert werden.
Als Endprodukt entsteht Milchsäure, die durch ein Transportprotein aus der Zelle hinaus befördert wird. Dadurch entsteht ein elektrochemischer pH-Gradient, den das Bakterium nutzen kann. Mittels des Enzyms ATP-Synthase kann weiteres ATP gewonnen werden, wenn die nach außen gepumpten H+-Ionen ins Zellinnere zurückfließen.
Milchsäurebakterien gehören zu den wenigen Organismen, die für ihre Energiegewinnung nur einen Stoff aufnehmen müssen. In der Regel sind mindestens zwei Stoffe nötig, nämlich ein Reduktions- und ein Oxidationsmittel.
Oxidation von organischen Stoffen
Tiere sind chemotroph und können aus aufgenommenen organischen Stoffen, beispielsweise Zuckern, Energie gewinnen. Weil sie aber die organischen Stoffe mit O2 oxidieren, ist ihr Energiegewinn wesentlich höher als bei deren Vergärung. Die Oxidation des durch Oxidation der organischen Stoffe gebildeten NADH findet bei Tieren an der Mitochondrienmembran in der Atmungskette statt. Hier liefert eine ATP-Synthase nach dem Prinzip der chemiosmotischen Kopplung das benötigte ATP.
Das Oxidationsmittel Sauerstoff muss nicht unter Energieverbrauch durch die Mitochondrienmembran transportiert werden, da O2 als ungeladenes, kleines Molekül frei durch die Biomembran diffundieren kann. Einige anaerobe chemotrophe Organismen nutzen unter anoxischen Bedingungen, also bei Fehlen von O2, Oxidationsmittel, die zur Nutzung ins Zellinnere unter Energieaufwand transportiert werden müssen. Diese Oxidationsmittel sind schwächere Oxidationsmittel als O2 und dadurch wird dementsprechend weniger ATP als bei der Oxidation mit O2 gebildet.
Die Zahl der von chemotrophen Organismen genutzten Oxidationsmittel ist beschränkt. Dagegen ist die Zahl der organischen Stoffe, die von diesen Organismen (aerob oder anaerob) oxidiert werden, enorm. Sie umfasst nahezu das gesamte Spektrum aller biologisch erzeugten Stoffe (Dogma der biologischen Unfehlbarkeit) und nicht wenige Xenobiotika.
Nutzung von anorganischen Stoffen
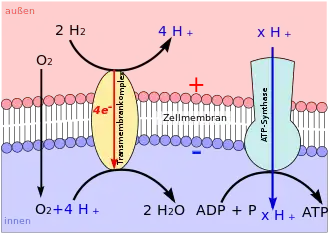
Auch bei Organismen, die anorganische Stoffe mit kleinen Molekülen zur Energiegewinnung nutzen, finden die Energie liefernden Redoxreaktionen an einer Biomembran unter Bildung eines elektrochemischen Protonengradienten statt, der die ATP-Synthase antreibt. Häufig wird der Protonengradient dadurch erzeugt, dass die anorganischen Reduktionsmittel an der Außenseite der Membran oxidiert werden und die Oxidationsmittel an der Innenseite der Membran reduziert werden (siehe Abbildung). Auch bei diesen Organismen gibt es viele, die statt Sauerstoff andere Oxidationsmittel mit einem niedrigeren Redoxpotential nutzen, so dass die molare ATP-Ausbeute geringer ist.
Chemoautotrophie und Chemoheterotrophie
Chemotrophe Organismen, die ausschließlich anorganische Stoffe zur Energiegewinnung nutzen, können meist ihren Kohlenstoffbedarf aus CO2 decken (Autotrophie). Dann spricht man von Chemoautotrophie. Solche Organismen findet man nur unter Bakterien und Archaeen.
In der Regel nutzen chemoautotrophe Organismen anorganische Elektronendonatoren zur Reduktion von CO2. Diese Nutzung bezeichnet man als Lithotrophie und bei diesen Organismen als Chemolithoautotrophie.
Eukaryoten, soweit sie nicht Photosynthese betreiben, decken ihren Kohlenstoffbedarf heterotroph aus organischen Verbindungen. Sie sind chemoheterotroph.
Literatur
- Albert L. Lehninger: Prinzipien der Biochemie: Walter de Gruyter, Berlin, New York 1987, ISBN 3-11-008988-2
- Rudolf K. Thauer, Kurt Jungermann, Karl Decker: Energy conservation in chemotrophic anaerobic bacteria. In: Bacteriological Reviews. Bd. 41, Nr. 1, 1977, S. 100–180.
Siehe auch
Einzelnachweise
- Eintrag zu Chemotrophie. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. Juli 2015.
- Otto R et al.: Lactate Efflux-Induced Electrical Potential in Membrane Vesicles of Streptococcus cremoris 1982 J. Bact. 149,2 S. 733–738.
- G. Gottschalk: Bacterial Metabolism. 2. Auflage. Springer, New York 1986, S. 223f.