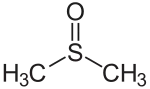
Dimethylsulfoxid
Dimethylsulfoxid (Abkürzung DMSO) ist ein organisches Lösungsmittel und zählt zur Verbindungsklasse der Sulfoxide.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Dimethylsulfoxid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H6OS | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 78,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,10 g·cm−3 (20 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
189 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser, Alkoholen, Aceton, Chloroform und Benzol, nicht aber mit Alkanen[2] | |||||||||||||||||||||
| Dipolmoment | ||||||||||||||||||||||
| Brechungsindex |
1,4793 (20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 50 ml·m−3 bzw. 160 mg·m−3[5] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−204,2 kJ/mol[7] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Darstellung und Gewinnung
Technisch wird Dimethylsulfoxid aus Dimethylsulfid z. B. durch katalytische Oxidation mit Distickstofftetroxid in Anwesenheit von Sauerstoff hergestellt.[8] Im Labor kann der Thioether Dimethylsulfid mit stöchiometrischen Mengen Wasserstoffperoxid oder verdünnter Salpetersäure oxidiert werden. Das Dimethylsulfoxid kann allerdings weiter zu Dimethylsulfon oxidiert werden:[8]
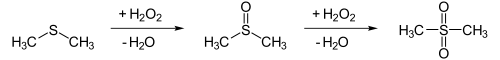
DMSO fällt daneben als Nebenprodukt bei der Zellstoffherstellung an.[8]
Eigenschaften
Physikalische Eigenschaften
Dimethylsulfoxid ist eine farb- und geruchlose, hygroskopische Flüssigkeit. Nach längerer Lagerung weist es häufig einen fauligen Geruch (nach Dimethylsulfid) auf. Mit einem Schmelzpunkt bei 18 °C kann die Substanz nur wenig unterhalb der Raumtemperatur erstarren.[9] Die Schmelzenthalpie beträgt 14,37 kJ·mol−1.[10] Bei Normaldruck siedet die Verbindung bei 189 °C.[11] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,49107, B = 1807,002 und C = −60,995 im Temperaturbereich von 325,5 bis 442,1 K.[12] bzw. mit A = 5,23039, B = 2239,161 und C = −29,215 im Temperaturbereich von 293 bis 323 K.[13] Es ist in jedem Verhältnis mit Wasser mischbar, weiterhin mit vielen organischen Lösemitteln wie Alkoholen, Carbonsäureestern, Ketonen, und chlorierten Kohlenwasserstoffen. Es gehört der Gruppe nukleophiler, aprotischer, dipolarer Lösemittel an (wie zum Beispiel Dimethylformamid).
 Dampfdruckfunktion
Dampfdruckfunktion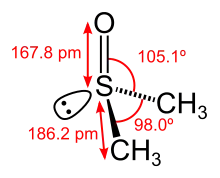 DMSO-Molekül mit Bindungslängen und -winkeln
DMSO-Molekül mit Bindungslängen und -winkeln
Chemische Eigenschaften
Die Verbindung beginnt sich am Normaldrucksiedepunkt bei 189 °C thermisch zu zersetzen, was heftig bis explosionsartig erfolgen kann.[14] Die Zersetzung wird durch Säuren oder Basen katalysiert, so dass diese schon bei wesentlich niedrigeren Temperaturen relevant werden kann.[14] Eine heftige bis explosionsartige Zersetzung erfolgt auch in Gegenwart von Halogenverbindungen, Metallnitraten, Metallperchloraten, Natriumhydrid, Periodsäure und von Fluorierungsmitteln.[14][8]
Dimethylsulfoxid kann mit Natriumhydrid[15] oder Natriumamid[16] unter Bildung eines Methylsulfinylcarbanions (Dimsylanion) deprotoniert werden, welches als sehr starkes nucleophiles Reagenz in der organischen Synthese verwendet wird. Die Reaktionsgemische können sich oberhalb von 70 °C explosionsartig zersetzen. Es besteht auch beim Isolieren des festen Natriumsalzes Explosionsgefahr.[14]
Sicherheitstechnische Kenngrößen
Dimethylsulfoxid bildet oberhalb des Flammpunktes bei 88 °C entzündbare Dampf-Luft-Gemische.[17] Die untere Explosionsgrenze liegt bei 1,8 Vol.‑% (58 g/m³). Eine obere Explosionsgrenze (OEG) kann wegen der thermischen Zersetzung der Substanz nicht bestimmt werden.[17] Die Sauerstoffgrenzkonzentration wurde bei 200 °C mit 3,9 Vol% bestimmt.[18] Die Zündtemperatur beträgt 270 °C.[17] Der Stoff fällt somit in die Temperaturklasse T3. Die elektrische Leitfähigkeit ist mit 2·10−7 S·m−1 eher gering.[19]
DMSO-d6
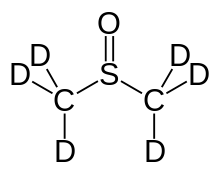
Vollständig deuteriertes DMSO (DMSO-d6) – in dem alle sechs Wasserstoffatome durch Deuterium ausgetauscht sind – wird als Lösungsmittel in der NMR-Spektroskopie benutzt.
Pharmakologie
Dimethylsulfoxid hat entzündungshemmende (antiphlogistische) und schmerzlindernde (analgetische) Eigenschaften.[8][20] Es findet daher therapeutische Verwendung als perkutanes (lat. durch die Haut) Arzneimittel zur Behandlung lokaler Schmerzzustände (beispielsweise bei Sportverletzungen oder rheumatischen Beschwerden). Da DMSO bei Blutergüssen zum schnellen Abschwellen beiträgt, wird es bei Bedarf besonders in Kampfsportarten angewandt.[21] Eine Studie aus Brasilien konnte zeigen, dass DMSO-Gel in Kombination mit therapeutischem Ultraschall gegenüber anderen Behandlungsformen (bzw. keiner Behandlung) signifikant bessere Ergebnisse im Hinblick auf das Abschwellen stumpfer Verletzungen aufweisen.[22]
Seine besondere Fähigkeit ist das leichte Eindringen in Haut und andere Zellmembranen. Es dient daher als Trägersubstanz bei auf der Haut angewendeten Arzneimitteln (Salben, Gele, Pflaster, Tinkturen) zur Einschleusung der Wirkstoffe wie Schmerzmittel[23] als sogenannter Transportvermittler (auch Penetrationsverstärker, Schleppersubstanzen genannt), d. h., in DMSO gelöste Substanzen werden leicht vom Organismus durch die Haut aufgenommen.[24] Das gilt auch für Gifte, die sonst keine oder schwach wirksame Kontaktgifte darstellen, wie Cyanide. Daher müssen Lösungen von als toxisch geltenden Verbindungen sofort, wenn diese auf die Haut gelangen, mit geeigneten Mitteln (z. B. Wasser) abgespült werden.
Dimethylsulfoxid ist in keiner Kombination mehr im deutschen Arzneimittelhandel verfügbar.[25] Es besitzt bei intravenöser Anwendung verschiedene toxische Eigenschaften, die sich auf Herz, Nerven, Magen-Darm-Trakt auswirken und darüber hinaus wurden allergische Reaktionen beschrieben.[26]
Verwendung
DMSO ist ein weitverbreitetes Lösungsmittel in Labor und Technik. So wird es in Spinnlösungen von Polyacrylnitril, als Abbeizmittel, als Lösungsmittel bei der Aromatenextraktion und als Reaktionsmedium bei organischen Synthesen verwendet. Auch viele anorganische Salze haben eine gute Löslichkeit in DMSO.[27]
In der organischen Synthesechemie dient es in der Swern-Oxidation und der Parikh-Doering-Oxidation als Oxidationsmittel. In der Pharmazie dient es als pharmazeutischer Hilfsstoff als Bestandteil von Salben (siehe Pharmakologie).
In der Zellkultur findet DMSO Verwendung in Einfriermedien bei der Kryokonservierung von eukaryotischen Zellen.[28][26] Als Gefrierschutzmittel verhindert es während des Einfrierprozesses die Bildung von Eiskristallen; diese können Zellorganellen zerstören und so zum Absterben der Zellen führen. DMSO hemmt die Kristallbildung etwas besser als Glycerin.
Auch die meisten Substanzbibliotheken verwenden DMSO als Lösungsmittel. Da das Lösungsmittel jedoch nicht komplett inert ist, kann dies zu einer Verschlechterung der Probenreinheit führen.[29]
DMSO wird in der Alternativmedizin vermarktet. Seine Popularität als alternatives Heilmittel soll auf eine 60-Minuten-Dokumentation aus dem Jahr 1980 zurückgehen, in der ein früher Befürworter zu Wort kam.[30] DMSO ist jedoch Bestandteil einiger Produkte, die von der amerikanischen Arzneimittelbehörde FDA als gefälschte Krebsmedikamente gelistet sind,[31] und die FDA setzt sich mit den Vertreibern juristisch auseinander.[30] Die Verwendung von DMSO als alternative Behandlung von Krebs ist besonders besorgniserregend, da es nachweislich mit einer Reihe von Chemotherapie-Medikamenten, einschließlich Cisplatin, Carboplatin und Oxaliplatin, interferiert.[32] Es gibt keine ausreichenden Beweise für eine medizinische Wirksamkeit von DMSO als Arzneistoff.[33]
Einzelnachweise
- Eintrag zu CAS-Nr. 67-68-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. April 2018. (JavaScript erforderlich)
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 23. Auflage. S. Hirzel Verlag, Stuttgart 1998, ISBN 3-7776-0808-4.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-55.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-210.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 67-68-5 bzw. Dimethylsulfoxid), abgerufen am 2. November 2015.
- Eintrag zu Dimethyl sulfoxide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 25. März 2021.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- Eintrag zu Dimethylsulfoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- T. B. Douglas: Heats of Formation of Liquid Methyl Sulfoxide and Crystalline Methyl Sulfone at 18 deg. In: J. Am. Chem. Soc. 68, 1946, S. 1072–1076, doi:10.1021/ja01210a046.
- H. L. Clever, E. F. Westrum, Jr.: Dimethylsulfoxide and dimethylsulfone. Heat capacities, enthalpies of fusion, and thermodynamic properties. In: J. Phys. Chem. 74, 1970, S. 1309–1317, doi:10.1021/j100701a027.
- B. Kaczmarek, A. Radecki: Vapor-Liquid Equilibria in Binary Systems Containing Ethanol with Tetramethyldisiloxane and Dimethyl Sulfoxide. In: J. Chem. Eng. Data. 34, 1989, S. 195–197, doi:10.1021/je00056a014.
- G. Jakli, W. A. van Hook: The Vapor Pressures of Dimethyl Sulfoxide and Hexadeuterodimethyl Sulfoxide from about 313 to 453 K. In: J. Chem. Thermodyn. 4, 1972, S. 857–864, doi:10.1016/0021-9614(72)90007-9.
- T. B. Douglas: Vapor Pressure of Methyl Sulfoxide from 20 to 50°. Calculation of the Heat of Vaporization. In: J. Am. Chem. Soc. 70, 1948, S. 2001–2002, doi:10.1021/ja01186a005.
- Roth/Weller: Gefährliche Chemische Reaktionen. ecomed Sicherheit, Verlagsgruppe Hüthig Jehle Rehm, Landsberg/Lech, 31. Ergänzungslieferung 8/2000.
- I. Iwai, J. Ide: 2,3-Diphenyl-1,3-Butadiene In: Organic Syntheses. 50, 1970, S. 62, doi:10.15227/orgsyn.050.0062; Coll. Vol. 6, 1988, S. 531 (PDF).
- E. M. Kaiser, R. D. Beard, C. R. Hauser: Preparation and reactions of the mono- and dialkali salts of dimethyl sulfone, dimethyl sulfoxide, and related compounds. In: J. Organomet. Chem. 59, 1973, S. 53. doi:10.1016/S0022-328X(00)95020-4.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003, ISBN 3-89701-745-8.
- P. M. Osterberg, J. K. Niemeier, C. J. Welch, J. M. Hawkins, J. R. Martinelli, T. E. Johnson, T. W. Root, S. S. Stahl: Experimental Limiting Oxygen Concentrations for Nine Organic Solvents at Temperatures and Pressures Relevant to Aerobic Oxidations in the Pharmaceutical Industry. In: Org. Process Res. Dev. 19, 2015, S. 1537–1542. doi:10.1021/op500328f
- Technische Regel für Gefahrstoffe TRGS 727, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand August 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6.
- S. H. Huang, C. H. Wu, S. J. Chen, H. K. Sytwu, G. J. Lin: Immunomodulatory effects and potential clinical applications of dimethyl sulfoxide. In: Immunobiology. Band 225, Nummer 3, 05 2020, S. 151906, doi:10.1016/j.imbio.2020.151906, PMID 31987604.
- Arnd Krüger: DMSO. In: Leistungssport. 43, 3, 2013, S. 28.
- Paulo C. L. Silveira, Eduardo G. Victor, Débora Schefer, Luciano A. Silva, Emilio L. Streck, Marcos M. Paula, Ricardo A. Pinho: Effects of therapeutic pulsed ultrasound and dimethylsulfoxide (DMSO) phonophoresis on parameters of oxidative stress in traumatized muscle. In: Ultrasound in Medicine & Biology. Band 36, Nr. 1, 2010, S. 44–50, doi:10.1016/j.ultrasmedbio.2009.09.001, PMID 19900747.
- K. Marren: Dimethyl sulfoxide: an effective penetration enhancer for topical administration of NSAIDs. In: The Physician and sportsmedicine. Band 39, Nummer 3, September 2011, S. 75–82, doi:10.3810/psm.2011.09.1923, PMID 22030943.
- S. Briançon: DMSO als a penetration enhancer. In: Howard I. Maibach, Nina Dragicevic (Hrsg.): Percutaneous Penetration Enhancers Drug Penetration Into/Through the Skin – Methodology and General Considerations. ISBN 9783662532706. S. 236.
- Fachinfo-Service der Roten Liste, Stand Dezember 2021
- X. Yao, S. Matosevic: Cryopreservation of NK and T Cells Without DMSO for Adoptive Cell-Based Immunotherapy. In: BioDrugs : clinical immunotherapeutics, biopharmaceuticals and gene therapy. Band 35, Nummer 5, September 2021, S. 529–545, doi:10.1007/s40259-021-00494-7, PMID 34427899.
- Dimethyl Sulfoxide (DMSO) Solubility Data. (PDF) Gaylord Chemical Company, Bulletin 102, Juni 2014, S. 14.
- David H. Yawn: Cryopreservation. In: Britannica Online. Abgerufen am 14. Mai 2009.
- Derek Lowe: The Miracle Solvent. In: In the Pipeline (Blog). 20. Mai 2008 (englisch, sciencemag.org).
- William T. Jarvis: DMSO. National Council Against Health Fraud. 24. November 2001.
- 187 Fake Cancer "Cures" Consumers Should Avoid. In: FDA. Archiviert vom Original am 23. Juli 2017.
- M. D. Hall, K. A. Telma, K. E. Chang, T. D. Lee, J. P. Madigan, J. R. Lloyd, I. S. Goldlust, J. D. Hoeschele, M. M. Gottesman: Say no to DMSO: dimethylsulfoxide inactivates cisplatin, carboplatin, and other platinum complexes. In: Cancer Research. Band 74, Nummer 14, Juli 2014, S. 3913–3922, doi:10.1158/0008-5472.CAN-14-0247, PMID 24812268, PMC 4153432 (freier Volltext).
- DMSO at WebMD