Molekül
Moleküle [moleˈkyːl] (älter auch: Molekel [moˈleːkəl]; von lat. molecula, „kleine Masse“) sind im weiten Sinn zwei- oder mehratomige Teilchen, die durch chemische Bindungen zusammengehalten werden und wenigstens so lange stabil sind, dass sie z. B. spektroskopisch beobachtet werden können. Ein Molekül kann dabei aus mehreren gleichen oder aus verschiedenen Atomen bestehen. Es kann sich um neutrale Teilchen, aber auch um Radikale, Ionen oder auch ionische Addukte handeln. So sind z. B. viele Typen von interstellaren Molekülen unter irdischen Bedingungen nicht stabil. IUPAC nennt solche Teilchen molekulare Gebilde (molecular entity).[1]
Grundsätzliches
Im engen Sinn und im allgemeinen Sprachgebrauch der Chemie sind Moleküle elektrisch neutrale Teilchen, die aus zwei oder mehreren Atomen aufgebaut sind.[2] Die Atome sind kovalent miteinander verknüpft und bilden einen in sich abgeschlossenen, chemisch abgesättigten Verband.[3][4] Ein so definiertes Molekül ist das kleinste Teilchen eines bestimmten Reinstoffes und hat eine bestimmbare Molekülmasse. Ein Molekül ist kein starres Gebilde, bei Energiezufuhr treten unterschiedliche Molekülschwingungen auf; hierzu reicht schon die Normaltemperatur.
Moleküle können aus Atomen eines einzigen chemischen Elements aufgebaut sein, wie z. B. Sauerstoff (O2) und Stickstoff (N2) (sogenannte Elementmoleküle). Viele Moleküle sind jedoch Verbände von Atomen verschiedener Elemente, wie beispielsweise Wasser (H2O) und Methan (CH4). Die Anordnung der Atome (ihre Konstitution) in einem Molekül ist durch die chemischen Bindungen fixiert. So unterscheiden sich trotz gleicher Anzahl der beteiligten Atome Ethanol (H3C–CH2–OH) von Dimethylether (H3C–O–CH3); sie werden durch unterschiedliche chemische Formeln dargestellt. In bestimmten Fällen können Moleküle wie z. B. die Moleküle der Milchsäure Formen mit gleicher Konstitution, aber unterschiedlicher räumlicher Anordnung (der Konfiguration) vorliegen. Dass gleiche Summenformeln unterschiedliche Moleküle zulassen, wird allgemein Isomerie genannt.
Ein einzelnes Molekül hat die chemischen Eigenschaften eines Stoffes. Die physikalischen Eigenschaften, wie Siede- oder Schmelzpunkt eines molekularen Stoffes werden durch zwischenmolekulare Kräfte bestimmt und können bei Feststoffen zur Bildung von Molekülgittern führen. Große Moleküle werden Makromoleküle genannt. Aus Makromolekülen bestehen Kunststoffe wie PET und Biopolymere wie die Stärke.
Die Größe von zweiatomigen Molekülen liegt im Bereich von 10−10 m (1 Å), relativ große Moleküle aus recht vielen Atomen erreichen einen Durchmesser im Bereich von 10−9 m (10 Å), wobei Makromoleküle noch etwas größer sein können. Experimentell lässt sich die Größe von Molekülen z. B. mit dem Ölfleckversuch abschätzen.
Die Bindungsverhältnisse in Molekülen beruhen auf quantenmechanischen Effekten und werden beispielsweise mit dem VSEPR-Modell, der Valenzbindungstheorie oder der MO-Theorie erklärt und beschrieben.
Abgrenzung
Nicht alle chemischen Verbindungen bestehen aus individuellen Molekülen. Keine Moleküle liegen z. B. bei diamantartigen Stoffen, wie Borcarbid (B4C) und Siliciumcarbid (SiC) vor. Die Atome werden zwar durch kovalente Bindungen zusammengehalten, ein typisches Molekül lässt sich jedoch nicht festlegen. Die chemische Formel ist nur eine Verhältnisformel. Die Anordnung der Atome lässt sich durch eine Elementarzelle darstellen, welche sich immer wiederholt und mit formal offenen (ungenutzten) Valenzelektronen an ihrer Oberfläche enden.
Keine Moleküle liegen auch bei Salzen wie Natriumchlorid (NaCl) vor, die durch ionische Bindungen zusammengehalten werden. Auch hier gibt die Formel das Verhältnis der beteiligten Atome wieder und auch hier kann der Verband der Atome prinzipiell eine beliebige Größe haben und den Bereich von einigen Millimetern erreichen. Grundelemente dieses Verbindungstyps sind Teilchen (hier Atome) mit einer Ladung. Solche Teilchen werden allgemein Ionen genannt. Das Natriumatom bildet ein Kation (Na+), das Chloratom ein Anion (Cl−). Im Fall von Natriumsulfat (Na2SO4) besteht das Anion SO42− aus einem Atomverband, der eine Ladung trägt. Atomverbände mit Ladungen sind keine Moleküle im engen Sinn. Dies ist auch in der organischen Chemie üblich: Essigsäure besteht aus Molekülen, das Anion der Säure wird Acetat-Ion genannt. Ein Sonderfall ist die Massenspektrometrie, bei der der Begriff Molekül-Ion verwendet wird.[5]
Mehratomige Radikale sind ebenfalls keine Moleküle im engeren Sinn, da diese Teilchen chemisch nicht abgesättigt sind. Es ist genügend und eindeutig, sie Radikale zu nennen. Besonders in der organischen Chemie sind sie hochreaktive Zwischenprodukte in bestimmten chemischen Reaktionen. Es gibt jedoch auch stabile Radikale, wie Stickstoffmonoxid oder TEMPO. Hier führen zwischenmolekulare Kräfte zu physikalischen Eigenschaften der Verbindungen und diese Verbindungen können als molekular betrachtet werden.
Darstellungsweisen
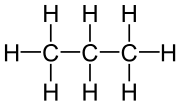
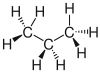
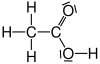
Es gibt verschiedene Möglichkeiten, Moleküle darzustellen. Grundsätzlich kann dabei zwischen Formelschreibweisen, zweidimensionalen Schemata (sog. Strukturformeln) und dreidimensionalen Modellen (sog. Stereoformeln) unterschieden werden. Summenformeln haben den niedrigsten, Stereoformeln den höchsten Informationsgehalt. Um von abstrahierten Schreibweisen auf die tatsächliche Anordnung schließen zu können, sollte man sich bewusst sein, dass die kovalenten Bindungen ungefähr in Form eines Tetraeders angeordnet sind. (siehe Kovalente Bindungen; Räumliche Ausrichtung)
| Strukturformeln | Andere Darstellungsweisen | ||||||
|---|---|---|---|---|---|---|---|
| Elektronenformel | Valenzstrichformel | Keilstrichformel | Skelettformel | Konstitutionsformel | Summenformel | Verhältnisformel | |
| Methan | existiert nicht | CH4 | CH4 | CH4 | |||
| Propan | 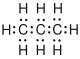 |
 |
 |
CH3–CH2–CH3 | C3H8 | C3H8 | |
| Essigsäure | 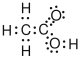 |
 |
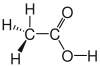 |
CH3–COOH | C2H4O2 | CH2O | |
| Wasser | existiert nicht | existiert nicht | H2O | H2O | |||
Gebräuchliche räumliche Molekülmodelle sind das Kalottenmodell und Stäbchenmodell.
Weblinks
Siehe auch
Einzelnachweise
- Eintrag zu molecular entity. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.M03986.
- Eintrag zu molecule. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.M04002.
- Der Brockhaus, Naturwissenschaft und Technik, F. A. Brockhaus, Mannheim; Spektrum Akademischer Verlag, Heidelberg, 2003.
- Eintrag zu Moleküle. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- Eintrag zu molecular ion. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.M03988.