Kohlenstoffdioxid
Kohlenstoffdioxid oder Kohlendioxid (CO2) ist eine chemische Verbindung aus Kohlenstoff und Sauerstoff. CO2 ist ein nicht brennbares, saures und farbloses Gas. Da es sich gut in Wasser löst, wird es umgangssprachlich manchmal fälschlicherweise auch „Kohlensäure“ genannt. Mit basischen Metalloxiden oder -hydroxiden kann es Carbonate und Hydrogencarbonate bilden.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||||||||
| Name | Kohlenstoffdioxid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | CO2 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses, geruchloses Gas[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
V03AN02 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 44,01 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||||||||
| Dichte |
1,98 kg·m−3 (0 °C und 1013 hPa)[4] | |||||||||||||||||||||
| Schmelzpunkt |
kein Schmelzpunkt (Tripelpunkt bei −56,6 °C und 5,19 bar)[4] | |||||||||||||||||||||
| Sublimationspunkt |
−78,5 °C / 1013 mbar[4] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
in Wasser: 3,3 g·l−1 bei 0 °C, 1,7 g·l−1 bei 20 °C, jeweils bei 1013 hPa[5] | |||||||||||||||||||||
| Dipolmoment |
0[6] | |||||||||||||||||||||
| Brechungsindex |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Treibhauspotential |
1 (per Definition)[10] | |||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−393,5 kJ·mol−1 (g)[11] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
CO2 ist ein elementarer Bestandteil des globalen Kohlenstoffzyklus, ein natürlicher Bestandteil der Luft und ein wichtiges Treibhausgas in der Erdatmosphäre: Durch menschliche Aktivitäten, insbesondere durch die Verbrennung fossiler Energieträger, stieg der Anteil von Kohlendioxid in der Erdatmosphäre von ca. 280 parts per million (ppm, Teile pro Million) zu Beginn der Industrialisierung auf 407,8 ppm im Jahr 2018 an.[12][13] Im Mai 2019 wurde in der NOAA-Messstation Mauna Loa in Hawaii ein Monatsdurchschnitt von rund 415 ppm gemessen,[14][15] Tendenz weiter steigend.[16] Dieser Anstieg bewirkt eine Verstärkung des Treibhauseffekts und führt zur aktuellen globalen Erwärmung.[17] Pro Tag werden ca. 100 Mio. Tonnen Kohlenstoffdioxid durch menschliche Aktivitäten in die Atmosphäre freigesetzt (Stand 2020).[18]
Unter ausreichender Sauerstoffzufuhr entsteht CO2 sowohl bei der Verbrennung kohlenstoffhaltiger Substanzen als auch im Organismus von Lebewesen als Produkt der Zellatmung. Pflanzen, Algen sowie manche Bakterien und Archaeen wandeln CO2 durch Fixierung (Kohlenstoffdioxid-Assimilation) in Biomasse um. Bei der Photosynthese entsteht aus anorganischem CO2 und Wasser Glucose.
CO2 kann giftig wirken. Die Konzentrationen in der Luft oder Mengen durch die Aufnahme von beispielsweise Limonade reichen hierfür aber bei weitem nicht aus. CO2 hat ein breites technisches Anwendungsspektrum: In der chemischen Industrie z. B. wird es zur Gewinnung von Harnstoff eingesetzt. In fester Form als Trockeneis wird es als Kühlmittel verwendet, überkritisches Kohlenstoffdioxid dient als Löse- und Extraktionsmittel.
Geschichte
CO2 war eines der ersten Gase, das Bezeichnung bekam. Der flämische Chemiker Johan Baptista van Helmont (1580–1644) beobachtete, dass die Masse von Holzkohle bei der Verbrennung abnahm, da die Masse der verbleibenden Asche geringer war als die der eingesetzten Holzkohle. Seine Interpretation war, dass sich der Rest der Holzkohle in eine unsichtbare Substanz verwandelt hatte, die er Gas oder Spiritus sylvestre („Waldgeist“) nannte.[19] Wann dieses Gas erstmals Kohlenstoffdioxid genannt wurde, ist nicht bekannt.
Der schottische Arzt Joseph Black (1728–1799) studierte die Eigenschaften von CO2 gründlicher. Er fand im Jahr 1754 heraus, dass beim Versetzen von Calciumcarbonat-Lösungen mit Säuren ein Gas freigesetzt wird, das er fixed air („fixierte/festgesetzte Luft“) nannte.[20] Er erkannte, dass dieses schwerer als Luft war und Verbrennungsvorgänge nicht unterstützte. Beim Einleiten dieses Gases in eine Lösung von Calciumhydroxid konnte er einen Niederschlag erzeugen. Mit diesem Phänomen zeigte er, dass Kohlenstoffdioxid im Atem von Säugetieren vorkommt und durch mikrobiologische Fermentation freigesetzt wird. Seine Arbeiten bewiesen, dass Gase an chemischen Reaktionen beteiligt sein können, und trugen zum Fall der Phlogistontheorie bei.[21]
Joseph Priestley gelang 1772 die erste Herstellung von Sodawasser, indem er Schwefelsäure in eine kalkhaltige Lösung leitete und das entstandene Kohlenstoffdioxid in einem Becher mit Wasser löste.[22] Den Zusammenhang von Kohlendioxid und Kohlensäure hatte William Brownrigg schon früher erkannt. Im Jahr 1823 verflüssigten Humphry Davy und Michael Faraday Kohlenstoffdioxid durch Druckerhöhung.[23] Henry Hill Hickman operierte ab 1820 Tiere, was nach Inhalation von Kohlendioxid zur Erreichung einer Narkose schmerzfrei gelang. Zudem beschrieb er die physiologischen Vorgänge während der Narkose.[24] Die erste Beschreibung von festem Kohlenstoffdioxid stammt von Adrien Thilorier, der 1834 einen unter Druck stehenden Behälter mit flüssigem Kohlenstoffdioxid öffnete und feststellte, dass die spontane Verdampfung unter Abkühlung stattfindet, die zu festem CO2 führt.[25]
Vorkommen
Kohlenstoffdioxid kommt in der Atmosphäre, der Hydrosphäre, der Lithosphäre und der Biosphäre vor. Der Kohlenstoffaustausch zwischen diesen Erdsphären erfolgt zum großen Teil durch Kohlenstoffdioxid. In der Atmosphäre befanden sich um 2015 circa 830 Gigatonnen (830 Milliarden Tonnen) Kohlenstoff in Form von Kohlenstoffdioxid.[26] Die Hydrosphäre enthält circa 38.000 Gigatonnen Kohlenstoff in Form von physikalisch gelöstem Kohlenstoffdioxid sowie als gelöste Hydrogencarbonate und Carbonate. Die Lithosphäre enthält den bei weitem größten Anteil chemisch gebundenen Kohlenstoffdioxids. Carbonatgesteine wie Calcit und Dolomit enthalten etwa 60.000.000 Gigatonnen Kohlenstoff.[27] Darüber hinaus sind in Permafrostgebieten wie den Tundren der arktischen und antarktischen Polargebiete, in borealen Nadelwäldern oder Hochgebirgen und in Mooren große Mengen Kohlenstoff gespeichert.[28][29][30]
Vorkommen in der Atmosphäre und menschengemachter Klimawandel
- Zum Einfluss des Menschen siehe auch speziell Anthropogener Anstieg der CO2-Konzentration und Keeling-Kurve.
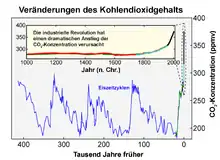
Kohlenstoffdioxid ist ein natürlich auftretendes, klimawirksames Spurengas der Erdatmosphäre, dessen Konzentration jedoch insbesondere durch die Verbrennung fossiler Brennstoffe ansteigt. Eisbohrkerndaten ergaben, dass die atmosphärischen CO2-Werte in den vergangenen 420.000 Jahren bis zum Beginn der Industrialisierung Mitte des 18. Jahrhunderts zwischen 190 ppm während den Höhepunkten der Eiszeiten und 280 ppm während der Warmzeiten schwankten.[31]
Mit der Industrialisierung kam es infolge menschlicher Aktivitäten zu einem starken Anstieg des Kohlenstoffdioxidanteils in der Atmosphäre, der weiterhin anhält. Zwischen 1750 und 1958 (dem Beginn systematischer Messungen durch Charles David Keeling) stieg der CO2-Wert zunächst moderat auf 315 ppm, um anschließend bis zum Jahr 2015 auf 401 ppm anzuwachsen.[32] Die Konzentration hat am 9. Mai 2013 im lokalen Tagesmittel die Schwelle von 400 ppm (0,04 % Volumenanteil der gesamten Gashülle der Erde) überschritten, wie die Messung der Nationalen Behörde für Ozean- und Atmosphärenforschung (NOAA) der Vereinigten Staaten auf dem Mauna Loa (Hawaii) ergab.[33] Der von der NOAA gemessene monatliche, weltweite Mittelwert hat erstmals im März 2015 die 400-ppm-Grenze überschritten,[34] im Februar 2018 lag dieser Wert bei 408 ppm (vorläufiger Stand, da die Daten des jeweils letzten Jahres noch geprüft werden).[35] Abschließend zeigen die Daten für 2017 mit 405,5 ppm ein neues Rekordhoch, welches 46 Prozent über dem vorindustriellen Wert liegt.[36] 2018 wurde mit 407,8 ppm wiederum ein neues Rekordhoch erreicht.[16] Hauptquellen sind die Verbrennung fossiler Energieträger für die Energiegewinnung sowie im Industriesektor. In deutlich geringerem Maße trägt ebenfalls Freisetzung von in Böden und Wäldern gespeichertem Kohlenstoffdioxid durch Veränderungen in der Landnutzung, beispielsweise durch Rodung von Wäldern zum Anstieg bei. 2014 machten Energienutzung und industrieller Einsatz fossiler Energieträger sowie die Landnutzung 70 % respektive 5 % der gesamten menschengemachten Treibhausgasemissionen (gemessen in Kohlenstoffdioxidäquivalenten) aus.[37]
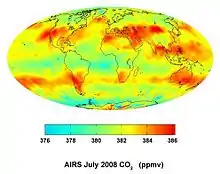
Die Gesamtmasse an Kohlenstoffdioxid in der Atmosphäre beträgt circa 3000 Gigatonnen beziehungsweise etwa 800 Gt Kohlenstoff (das Verhältnis der molaren Massen von CO2 zu C ist gerundet 44:12). Die Konzentration variiert jahreszeitlich sowie lokal besonders in Bodennähe. In städtischen Regionen ist die Konzentration im Allgemeinen höher, in geschlossenen Räumen kann die Konzentration bis um das Zehnfache über dem Durchschnittswert liegen.[38]
Kohlenstoffdioxid absorbiert einen Teil der Wärmestrahlung (Infrarotstrahlung), während der kurzwelligere Teil der Sonnenstrahlung nahezu ungehindert passieren kann. Ein absorbierender Körper emittiert auch entsprechend seiner Temperatur. Diese Eigenschaften machen Kohlenstoffdioxid zu einem sogenannten Treibhausgas. Nach Wasserdampf ist Kohlenstoffdioxid entsprechend seinem Mengenanteil das zweitwirksamste der Treibhausgase, wenngleich die spezifischen Wirksamkeiten von Methan und Ozon höher sind. Alle Treibhausgase zusammen erhöhen die mittlere Temperatur auf der Erdoberfläche durch den natürlichen Treibhauseffekt von circa −18 °C auf +15 °C. Kohlenstoffdioxid hat einen relativ großen Anteil am Gesamteffekt und trägt somit zum lebensfreundlichen Klima der Erde bei.[39]
Der Kohlenstoffdioxid-Anteil in der Erdatmosphäre war im Verlauf der Erdgeschichte beträchtlichen Schwankungen unterworfen, die verschiedene biologische, chemische und physikalische Ursachen haben. Vor 500 Millionen Jahren war die Kohlenstoffdioxid-Konzentration mindestens zehnfach höher als gegenwärtig.[40] In der Folge nahm die CO2-Konzentration stetig ab und lag vor rund 300 Millionen Jahren während des Permokarbonen Eiszeitalters, am Übergang vom Karbon zum Perm, bei durchschnittlich rund 300 ppm[41] und fiel im frühen Perm kurzzeitig auf einen Tiefstwert von wahrscheinlich 100 ppm[42] Während des Mesozoikums bewegte sich das CO2-Level meistens zwischen 1.000 und 2.000 ppm, um in der Erdneuzeit, nach einem Klimaoptimum im frühen Eozän,[43] bis zum Beginn des Känozoischen Eiszeitalters vor etwa 34 Millionen Jahren deutlich unter 1.000 ppm zu sinken.[44]
Seit wenigstens 800.000 Jahren lag der Kohlenstoffdioxid-Anteil immer unterhalb von 300 ppm.[45][46] Die Kohlenstoffdioxid-Konzentration in den letzten 10.000 Jahren blieb relativ konstant bei 300 ppm. Die Bilanz des Kohlenstoffdioxidkreislaufes war somit in dieser Zeit ausgeglichen. Mit Beginn der Industrialisierung im 19. Jahrhundert stieg der Kohlenstoffdioxid-Anteil in der Atmosphäre. Die gegenwärtige Konzentration ist wahrscheinlich der höchste Wert seit 15 bis 20 Millionen Jahren.[47] Im Zeitraum von 1960 bis 2005 stieg der Kohlenstoffdioxid-Anteil im Mittel um 1,4 ppm pro Jahr.[48] 2017 lag der Anstieg im 10-Jahres-Mittel bei gut 2 ppm pro Jahr.[49]
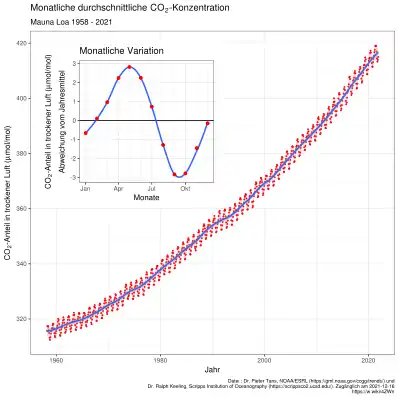
Die anthropogenen, das heißt vom Menschen verursachten Kohlenstoffdioxid-Emissionen betragen jährlich circa 36,3 Gigatonnen[48] und sind nur ein kleiner Anteil des überwiegend aus natürlichen Quellen stammenden Kohlenstoffdioxids von jährlich etwa 550 Gigatonnen.[50] Da die natürlichen Kohlenstoffsenken jedoch gleich viel CO2 wieder aufnehmen, blieb die Kohlenstoffdioxid-Konzentration vor der Industrialisierung relativ konstant. Das zusätzliche Kohlenstoffdioxid wird etwa zur Hälfte von der Biosphäre und von den Ozeanen (dies hat deren Versauerung zur Folge) aufgenommen, so dass diese jetzt mehr Kohlenstoffdioxid aufnehmen als sie abgeben.[51] Dadurch kam es seit 1982 zwischenzeitlich zu einer „Ergrünung“ der Erde (Leaf Area Index), wie durch Satellitendaten der NASA belegt wurde.[52] Neuere Daten deuten jedoch darauf hin, dass diese bis ins späte 20. Jahrhundert beobachtete Ergrünung anschließend stoppte und sich infolge eines größeren Sättigungsdefizit (mehr Dürre) ein gegenläufiger Trend ausbildete, d. h. die Erde derzeit Vegetation verliert.[53] Die andere Hälfte des ausgestoßenen Kohlenstoffdioxids verbleibt in der Atmosphäre und führt dort zu der messbaren Zunahme der Konzentration, was von Charles Keeling mit der nach ihm benannten Keeling-Kurve erstmals Anfang der 1960er Jahre gezeigt werden konnte.
Es ist wissenschaftlich allgemein anerkannt, dass es einen statistisch signifikanten menschlichen Einfluss auf das Klima gibt, der hauptursächlich für die globale Erwärmung ist. Diese Erwärmung geht sehr wahrscheinlich zum größten Teil auf die anthropogene Verstärkung des natürlichen Treibhauseffekts durch den Ausstoß von Treibhausgasen zurück.[54] Das zusätzlich erzeugte Kohlenstoffdioxid hat einen Anteil von etwa 60 % an der Verstärkung des Treibhauseffektes.[55][56]
Luxemburg, Belgien und die Schweiz haben pro Kopf gerechnet den größten CO2-Fußabdruck in ganz Europa.[57] Die Folgen der globalen Erwärmung sollen durch Klimaschutz gemindert werden.
Vorkommen in Ozeanen
Das Wasser der Ozeane enthält Kohlenstoffdioxid in gelöster Form sowie als Kohlensäure im Gleichgewicht mit Hydrogencarbonaten und Carbonaten. Die gelöste Menge ändert sich mit der Jahreszeit, da sie von der Temperatur und dem Salzgehalt des Wassers abhängt: Kaltes Wasser löst mehr Kohlenstoffdioxid. Da kaltes Wasser eine höhere Dichte aufweist, sinkt das kohlenstoffdioxidreiche Wasser in tiefere Schichten ab. Nur bei Drücken über 300 bar und Temperaturen über 120 °C (393 K) ist es umgekehrt, etwa in der Nähe von tiefen, geothermalen Schloten.[58]
In den Ozeanen ist etwa 50-mal so viel Kohlenstoff enthalten wie in der Atmosphäre. Der Ozean wirkt als große Kohlenstoffdioxidsenke und nimmt circa ein Drittel der durch menschliche Aktivitäten freigesetzten Menge Kohlenstoffdioxid auf.[59] In den oberen Schichten der Ozeane wird es teilweise durch Photosynthese gebunden. Mit steigender Lösung von Kohlenstoffdioxid sinkt die Alkalinität des Salzwassers, was als sog. Versauerung der Meere bezeichnet wird und sehr wahrscheinlich negative Folgen für die Ökosysteme der Meere bewirkt. Viele Meeresbewohner reagieren empfindlich auf Schwankungen des Säuregrades der Ozeane; Versauerungsereignisse in der Erdgeschichte führten zu Massensterben und einem starken Rückgang der Artenvielfalt in den Weltmeeren. Betroffen sind insbesondere Organismen, die Calciumcarbonatstrukturen aufbauen, da sich dieses mit zunehmendem Säuregrad der Ozeane auflöst. Als besonders verwundbar gelten Korallen, Muscheln und Stachelhäuter wie Seesterne und Seeigel.[60]
Unter anderem wird befürchtet, dass sich dies unter anderem negativ auf die Ausbildung von Muschelschalen auswirkt.[61][62] Bereits heute sind diese Effekte in Korallenriffen und bestimmten Austernfarmen sichtbar; mit steigender Versauerung wird mit stärkeren ökologischen Folgen gerechnet.[60] Andererseits gibt es Hinweise, dass eine erhöhte Kohlenstoffdioxid-Konzentration einige Spezies zu vermehrter Muschelschalenproduktion anregt.[63]
Vorkommen im Süßwasser
Durch im (unter) Wasser lebende aerobe Bakterien und Tiere wird Sauerstoff verbraucht und CO2 abgeatmet. Sofern ausreichender Kontakt mit der Atmosphäre besteht, kann dieses Gas an die Luft abgegeben und zugleich Sauerstoff aufgenommen werden. Dazu ist eine frei an die Luft grenzende Oberfläche ohne Belag aus Eis oder Öl günstig, ebenso Wellenbewegung, Verwirbelung mit Luft, also Bildung von Schaum und Gischt, Wasserströmung, die auch tiefere Schichten umfasst und Wind. Ohne ausreichendem Gasaustausch kann ein Gewässer auch an der Oberfläche sauerstoffarm und CO2-reich werden. Man sagt "es kippt".
Durch besondere geologische Bedingungen kann Süßwasser mit erheblichen Mengen Kohlenstoffdioxid aus vulkanischer Quelle beladen sein, etwa Wasser aus Mineralquellen oder in Seen auf erloschenen Vulkanen, sogenannten Maaren. Unter dem Druck großer Wassertiefe kann CO2 in viel höherer Massenkonzentration gelöst werden, als unter Atmosphärendruck an der Gewässeroberfläche. Wird ein See nicht (ausreichend) von Wasser durchflossen oder getrieben von Wind und/oder Wärmekonvektionsströmung durchmischt und wird gleichzeitig mehr CO2 von unten eingetragen, als Durchmischung und Diffusion hochtransportieren können, so bildet sich CO2-reiches Tiefenwasser aus, das das Potential zu einer katastrophalen CO2-Freisetzung an die Luft birgt. Eine einmal lokal unter Wasser angestoßene lokale Ausgasung führt zum Hochsteigen einer Wassermasse, die dabei erfolgende Entlastung von hydrostatischem Druck verstärkt die Ausgasung. Dieser sich selbst verstärkende Prozess kann zur Freisetzung großer Mengen an CO2 führen, die Mensch und Tier nahe dem See töten kann.
Eine dieser Naturkatastrophen ereignete sich 1986 am Nyos-See in Kamerun.[64] Der See befindet sich in einem alten Vulkankrater im Oku-Vulkangebiet. Eine Magmakammer speist den See mit Kohlenstoffdioxid und sättigt damit dessen Wasser. Wahrscheinlich ausgelöst durch einen Erdrutsch wurden 1986 große Mengen von Kohlenstoffdioxid aus dem See freigesetzt und töteten etwa 1700 Bewohner sowie 3500 Nutztiere umliegender Dörfer. Eine weitere Katastrophe ereignete sich 1984 am Manoun-See, dessen Wasser durch einen ähnlichen Mechanismus mit Kohlenstoffdioxid gesättigt wird. Bei dieser Kohlenstoffdioxidfreisetzung kamen 37 Menschen ums Leben. Auch der Kiwusee in Zentralafrika weist in seinem Tiefenwasser hohe Konzentrationen an gelösten Gasen auf. Es wird geschätzt, dass etwa 250 km³ Kohlenstoffdioxid in diesem See gelöst sind.[65]
Extraterrestrisches Vorkommen
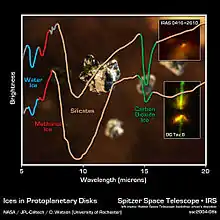
Die Atmosphäre der Venus besteht zu 96,5 % aus Kohlenstoffdioxid, hat etwa die 90-fache Masse der Erdatmosphäre und einen Druck von etwa 90 bar. Der hohe Kohlenstoffdioxid-Anteil ist eine Ursache des starken Treibhauseffektes. Hinzu kommt die im Vergleich zur Erde im Mittel um 41 Millionen Kilometer geringere Entfernung von der Sonne, was insgesamt zu einer Oberflächentemperatur von etwa 480 °C führt.[66] Kohlenstoffdioxid stellt mit einem Anteil von 95 % ebenfalls den Hauptteil der Mars-Atmosphäre.[67] An den Mars-Polen wird atmosphärisches Kohlenstoffdioxid teilweise als Trockeneis gebunden. Durch den niedrigen Atmosphärendruck von etwa sieben Millibar führt der Treibhauseffekt trotz des hohen Kohlenstoffdioxid-Anteils nur zu einer Erhöhung um etwa 5 K. Die Atmosphären der äußeren Planeten und deren Trabanten enthalten Kohlenstoffdioxid, dessen Herkunft Einschlägen von Kometen wie Shoemaker-Levy 9 und kosmischem Staub zugeschrieben wird.[68][69] Mit den Instrumenten des Hubble-Weltraumteleskops fand die NASA auf extrasolaren Planeten wie HD 189733 b Kohlenstoffdioxid.[70]
Kohlenstoffdioxid wird sowohl im interstellaren Raum als auch in protoplanetaren Scheiben um junge Sterne gefunden.[71] Die Bildung erfolgt durch Oberflächenreaktionen von Kohlenstoffmonoxid und Sauerstoff auf Wassereispartikeln bei Temperaturen um −123 °C (150 K). Durch Verdampfung des Eises wird das Kohlenstoffdioxid freigesetzt.[72] Im freien interstellaren Raum ist die Konzentration relativ gering, da durch Reaktionen mit atomarem und molekularem Wasserstoff Wasser und Kohlenstoffmonoxid gebildet werden.[73]
Gewinnung und Darstellung
Kohlenstoffdioxid entsteht bei der Verbrennung kohlenstoffhaltiger Brennstoffe, insbesondere der fossilen Energieträger. Dabei fallen weltweit etwa 36 Gigatonnen (Milliarden Tonnen) Kohlenstoffdioxid pro Jahr an, die in die Atmosphäre abgegeben werden. Verfahren, das Kohlenstoffdioxid abzuscheiden und in tiefen Gesteinsschichten endzulagern, stehen derzeit (2016) am Anfang ihrer Entwicklung und sind noch nicht serienreif; ihre Wirksamkeit und Wirtschaftlichkeit insbesondere in nachhaltigen Energiesystemen wird kritisch bewertet.[74]
Kohlenstoffdioxid entsteht bei der Reaktion von Kohlenstoff mit Sauerstoff:
Technisch fällt Kohlenstoffdioxid beim Verbrennen von Koks mit überschüssiger Luft an. Bei der Kohlevergasung und der Dampfreformierung von Erdgas fällt Kohlenstoffdioxid unter anderem als Produkt der Wassergas-Shift-Reaktion in der Synthesegasherstellung an.
Für den Einsatz in der Ammoniaksynthese und bei der Methanolherstellung wird das Synthesegas zum Beispiel im Rectisolverfahren gewaschen, Kohlenstoffdioxid fällt dadurch in großen Mengen in sehr reiner Form an.[76][77] Als Nebenprodukt fällt Kohlenstoffdioxid beim Kalkbrennen an. Durch anschließende Reinigung über Bildung von Kaliumcarbonat zu Hydrogencarbonat und anschließendes Freisetzen durch Erhitzen werden pro Jahr etwa 530 Millionen Tonnen gewonnen.
Im Labor kann Kohlenstoffdioxid aus Calciumcarbonat und Salzsäure freigesetzt werden, zum Beispiel in einem Kippschen Apparat. Das Gerät fand früher in Laboratorien Verwendung. Die Methode wird kaum noch genutzt, da Kohlenstoffdioxid in Gasflaschen oder als Trockeneis erhältlich ist.[78]
Kohlenstoffdioxid wird auch im Direct-air-capture-Verfahren (DAC) aus der Luft gewonnen.
Eigenschaften
.svg.png.webp)
Physikalische Eigenschaften

Kohlenstoffdioxid liegt bei Normaldruck unter −78,5 °C als Feststoff, Trockeneis genannt, vor. Wird dieses erhitzt, schmilzt es nicht, sondern sublimiert, geht also direkt in den gasförmigen Aggregatzustand über. Es hat daher bei diesen Bedingungen keinen Schmelz- und keinen Siedepunkt.
Der Tripelpunkt, an dem die drei Phasen fest, flüssig und gasförmig im thermodynamischen Gleichgewicht stehen, liegt bei einer Temperatur von −56,6 °C und einem Druck von 5,19 bar.[4]
Die kritische Temperatur beträgt 31,0 °C, der kritische Druck 73,8 bar und die kritische Dichte 0,468 g/cm³.[4] Unterhalb der kritischen Temperatur kann gasförmiges Kohlenstoffdioxid durch Druckerhöhung zu einer farblosen Flüssigkeit verdichtet werden.[79] Bei Raumtemperatur ist dazu ein Druck von circa 60 bar erforderlich.
Festes Kohlenstoffdioxid kristallisiert im kubischen Kristallsystem in der Raumgruppe Pa3 (Raumgruppen-Nr. 205) mit dem Gitterparameter a = 562,4 pm.[80]
Kohlenstoffdioxid absorbiert elektromagnetische Strahlung hauptsächlich im Spektralbereich der Infrarotstrahlung und wird dabei zu Molekülschwingungen angeregt. Auf dieser Eigenschaft beruht seine Wirkung als Treibhausgas.
Die Löslichkeit in Wasser ist vergleichsweise hoch. Bei 20 °C unter Normaldruck liegt die Sättigung im Gleichgewicht mit der reinen Kohlenstoffdioxidphase bei 1688 mg/l. Zum Vergleich im Folgenden die Löslichkeit von Sauerstoff bzw. Stickstoff: Bei einer reinen Sauerstoffphase wird die Sättigung bereits bei 44 mg/l und bei einer reinen Stickstoffphase bei 19 mg/l erreicht.[81] Unter Standardbedingungen beträgt die Dichte von Kohlenstoffdioxid 1,98 kg/m³.[82]
Molekulare Eigenschaften

Das Kohlenstoffdioxidmolekül ist linear, alle drei Atome liegen auf einer geraden Linie. Der Kohlenstoff ist an die beiden Sauerstoffatome mit Doppelbindungen gebunden, wobei beide Sauerstoffatome zwei freie Elektronenpaare aufweisen. Der Kohlenstoff-Sauerstoff-Abstand beträgt 116,32 pm.[79] Die Kohlenstoff-Sauerstoff-Bindungen sind durch die unterschiedlichen Elektronegativitäten von Kohlenstoff und Sauerstoff polarisiert; die elektrischen Dipolmomente heben sich aber durch die Molekülsymmetrie nach außen hin gegenseitig auf, so dass das Molekül kein elektrisches Dipolmoment aufweist. Der (Biege-)Schwingungsmode des Moleküls, bei der sich das Kohlenstoffatom senkrecht zur Achse und die Sauerstoffatome in entgegengesetzter Richtung bewegen (und umgekehrt), entspricht eine Infrarot-Wellenlänge von 15 μm. Diese 15-μm-Strahlung ist der wesentliche Anteil der Wirkung von Kohlenstoffdioxid als Treibhausgas.[83]
Chemische Eigenschaften

Kohlenstoffdioxid ist ein unbrennbares, saures und farbloses Gas; bei niedrigen Konzentrationen ist es geruchlos, bei hohen Konzentrationen nimmt man einen scharfen bis sauren Geruch wahr,[84] wobei es auch hier (ähnlich wie z. B. bei Blausäure) Personen gibt, die diesen Geruch nicht wahrnehmen können. In Wasser gelöstes Kohlenstoffdioxid bildet Kohlensäure (H2CO3), wobei mehr als 99 % des Kohlenstoffdioxids nur physikalisch gelöst sind; die wässrige Lösung reagiert deshalb schwach sauer. Die Kohlensäure als solche und das gelöste Kohlenstoffdioxid liegen in einem Gleichgewicht mit ihren Dissoziationsprodukten (Spezies) Hydrogencarbonat (Bicarbonat, HCO3−) und Carbonat (CO32−) vor, die in einem vom pH-Wert abhängigen Mengenverhältnis zueinander stehen. In Wasser liegt dieses Gleichgewicht überwiegend auf der Seite des Kohlenstoffdioxids und nur in geringem Umfang bilden sich Hydrogencarbonationen. Werden die bei der Dissoziation gebildeten Oxoniumionen (H3O+) durch Zugabe einer Lauge mit Hydroxidionen (OH−) abgefangen, so verschiebt sich das Mengenverhältnis zu Gunsten von Carbonat.
Kohlenstoffdioxid ist ein sehr schwaches Oxidationsmittel. Unedle Metalle wie Magnesium, die als starke Reduktionsmittel fungieren, reagieren mit Kohlenstoffdioxid unter Bildung von Kohlenstoff und Metalloxiden gemäß:[85]
Auf Grund der positiven Partialladung am Kohlenstoff reagiert Kohlenstoffdioxid als Elektrophil in der Carboxylierung von Kohlenstoffnukleophilen wie Metall-Alkinyliden oder Alkylmagnesiumverbindungen unter Ausbildung einer Kohlenstoff-Kohlenstoff-Bindung. Mit Phenolaten reagiert Kohlenstoffdioxid zu Phenolcarbonsäuren.
Verwendung
Industriell wird Kohlenstoffdioxid in vielfältiger Weise verwendet. Es ist preiswert, nicht entflammbar und wird physikalisch als komprimiertes Gas, in flüssiger Form, fest als Trockeneis oder in überkritischer Phase benutzt. Die chemische Industrie nutzt Kohlenstoffdioxid als Rohmaterial für chemische Synthesen. Dieses CO2 stammt z. B. aus der Düngerherstellung, wo es sehr rein anfällt, oder aus Abgasen, die eine nachgeschaltete Reinigung erforderlich machen, um unerwünschte Begleitstoffe zu entfernen.[86]
Verwendung in der Lebensmitteltechnologie

In Getränken enthaltenes Kohlenstoffdioxid stimuliert beim Trinken die Geschmackssinneszellen, was einen Erfrischungseffekt zur Folge hat. Bei Getränken wie Bier oder Sekt entsteht es durch die alkoholische Gärung, bei anderen wie Limonade oder Sodawasser wird es künstlich zugesetzt oder es wird kohlenstoffdioxidhaltiges, natürliches Mineralwasser verwendet. Bei der Herstellung wird Kohlenstoffdioxid unter hohem Druck in das Getränk gepumpt, wobei es zu etwa 0,2 % mit Wasser zu Kohlensäure reagiert, während sich der größte Teil als Gas im Wasser löst. Als Lebensmittelzusatzstoff trägt es die Bezeichnung E 290.[87] Im Privathaushalt wird mit Sodabereitern Kohlenstoffdioxid aus Druckpatronen durch das anzureichernde Getränk geleitet.
Backhefe entwickelt durch die Vergärung von Zucker Kohlenstoffdioxid und dient als Triebmittel bei der Herstellung von Hefeteig. Backpulver, eine Mischung aus Natriumhydrogencarbonat und einem sauren Salz, setzt beim Erhitzen Kohlenstoffdioxid frei und wird ebenfalls als Triebmittel verwendet.[88]
Bei der Weinherstellung wird Trockeneis als Kühlmittel verwendet, um frisch gepflückte Trauben ohne Wasserverdünnung zu kühlen und so eine spontane Fermentation zu vermeiden. Die Weinbauern in Beaujolais benutzen die Kohlensäuremaischung zur Erzeugung des Beaujolais Primeur.[89]
Bei der Lagerung von Obst und Gemüse spielt neben der Temperatur die Zusammensetzung der Atmosphäre eine große Rolle. In den Lagern der Obstproduzenten und des Handels werden Äpfel seit vielen Jahrzehnten in kontrollierten Atmosphären gelagert. Die Erkenntnis, dass reifendes Obst Sauerstoff verzehrt und Kohlenstoffdioxid abgibt und dass eine Atmosphäre ohne Sauerstoff die Reifung zum Stillstand bringt, geht auf das frühe 19. Jahrhundert zurück. In den 1930er Jahren wurde in Großbritannien erstmals ein Lager mit der Möglichkeit eingerichtet, den Gehalt von Sauerstoff und Kohlenstoffdioxid in der Luft zu regulieren.[90] Die wirtschaftliche Bedeutung genau angepasster kontrollierter Atmosphären bei der Obstlagerung ist erheblich. Durch den Zusatz von Kohlenstoffdioxid zur Atmosphäre kann die Lagerfähigkeit um Monate verlängert und so für einen Teil des Winters und Frühjahrs die Abhängigkeit von Importen aus wärmeren Regionen reduziert werden. Andererseits kann ein unangepasster Zusatz von Kohlenstoffdioxid Fehler des Fruchtfleisches hervorrufen und einen gesamten Lagerbestand oder Containertransport wertlos machen.[91] Die biochemischen Vorgänge, die zu der verzögerten Reife führen, sind bis heute nicht entschlüsselt. Gegenwärtig wird angenommen, dass sowohl die Verlangsamung des Reifeprozesses als auch die Ausbildung der verschiedenen Schäden durch Stressreaktionen auf zellulärer Ebene gesteuert werden.[90]
Für den Einzelhandel in Folie abgepacktes Obst, Gemüse und Pilze,[92] unbearbeitet oder geschnitten, werden mit einer Schutzatmosphäre versehen, um die Haltbarkeit zu verlängern und um auf dem Weg bis zum Verbraucher den Eindruck der Frische nicht zu verlieren. Heute werden auch Fleisch, Fisch und Meeresfrüchte, Teigwaren, Backwaren und Milchprodukte so angeboten. Der Anteil des Kohlenstoffdioxids in der Schutzatmosphäre liegt bei verpackten Produkten, für die keine monatelange Lagerfähigkeit angestrebt wird, deutlich höher als bei eingelagertem Obst und Gemüse (1–5 %, selten bis 20 %), bei dem Kohlenstoffdioxid Schäden verursachen kann. Typische Anteile sind 20 % Kohlenstoffdioxid für Rindfleisch, 50 % für Kalbfleisch, Schweinefleisch und Teigwaren, 60 % für Backwaren und 80 % für Fisch. Eine Verpackung unter reinem Kohlenstoffdioxid wird jedoch vermieden, da sie die Entwicklung pathogener, anaerober Keime begünstigen und in vielen Fällen Farbe und Geschmack der Produkte beeinträchtigen würde. Das Ermitteln der für ein Produkt optimalen Schutzatmosphäre ist Gegenstand intensiver Forschung in der Lebensmittelindustrie.[93][94]
Überkritisches Kohlenstoffdioxid besitzt eine hohe Löslichkeit für unpolare Stoffe und kann giftige organische Lösemittel ersetzen. Es wird als Extraktionsmittel verwendet, zum Beispiel zur Extraktion von Naturstoffen wie Koffein bei der Herstellung von koffeinfreiem Kaffee durch Entkoffeinierung.[95]
Technische Verwendung
Kohlenstoffdioxid kommt wegen seiner sauerstoffverdrängenden Eigenschaften zu Feuerlöschzwecken, vor allem in Handfeuerlöschern und automatischen Löschanlagen, als Löschmittel zum Einsatz. CO2-Löschanlagen fluten zum Schutz von Silos oder Lagerhallen für brennbare Flüssigkeiten den kompletten Raum mit Kohlenstoffdioxid. Dadurch kam es wiederholt zu Unfällen, teilweise mit Todesfolge durch Ersticken.[96] Eine Studie der US-amerikanischen Umweltbehörde EPA identifizierte 51 Unfälle zwischen 1975 und 1997 mit 72 Todesfällen und 145 Verletzten.[97]
Als Kältemittel kommt Kohlenstoffdioxid unter der Bezeichnung R744 in Fahrzeug- und stationären Klimaanlagen, bei industrieller Kältetechnik, Supermarkt- und Transportkühlung sowie in Getränkeautomaten zum Einsatz.[98] Es hat eine große volumetrische Kälteleistung und damit eine höhere Effizienz bei gegebenem Volumen. Kohlenstoffdioxid ist umweltverträglicher, da dessen Treibhauspotenzial nur einen Bruchteil synthetischer Kältemittel beträgt. Es trägt im Gegensatz zu diesen nicht zum Ozonabbau bei. Kohlenstoffdioxid wird auch in Klimaanlagen für Fahrzeuge genutzt.[99] In gasgekühlten Kernreaktoren des Typs AGR wird Kohlenstoffdioxid als Kühlmittel eingesetzt.
Kohlenstoffdioxid wird als Schutzgas in der Schweißtechnik eingesetzt, entweder in reiner Form oder als Zusatz zu Argon oder Helium. Bei hohen Temperaturen ist es thermodynamisch instabil, daher wird es nicht als Inertgas, sondern als Aktivgas bezeichnet.[100]
Beim Kohlenstoffdioxidlaser durchströmt Lasergas, ein Gemisch aus Stickstoff, Helium und Kohlenstoffdioxid, kontinuierlich das Entladungsrohr. Diese Gaslaser zählen neben den Festkörperlasern zu den leistungsstärksten industriell eingesetzten Lasern mit Leistungen zwischen 10 Watt und 80 Kilowatt. Der Wirkungsgrad liegt bei etwa 10 bis 20 %.[101]
In flüssiger Form wird Kohlenstoffdioxid in Druckgasflaschen gehandelt. Dabei gibt es zwei Typen: Steigrohrflaschen zur Flüssigentnahme und Flaschen ohne Steigrohr zur Entnahme gasförmigen Kohlenstoffdioxids.[102] Beide müssen zur Entnahme senkrecht stehen. Die Steigrohrflasche wird grundsätzlich ohne, die andere mit Druckminderventil betrieben. Solange sich noch flüssiges Kohlenstoffdioxid in der Druckflasche befindet, ist der Innendruck lediglich von der Temperatur abhängig. Eine Messung des Füllstandes ist deshalb bei beiden Flaschentypen ausschließlich über Wägen möglich. Die Entnahmegeschwindigkeit ist dadurch begrenzt, dass durch Wärmeaufnahme aus der Umgebung erst wieder flüssiges Kohlenstoffdioxid in der Flasche verdampfen muss, um den der Temperatur entsprechenden Druck wieder aufzubauen.
Bei der Sublimation von Trockeneis entsteht ein weißer Nebel aus dem kalten Kohlenstoffdioxid-Luft-Gemisch und kondensierender Luftfeuchtigkeit, der als Bühnen-Effekt dient. Es gibt auch Nebelkühl-Vorsätze für Verdampfer-Nebelmaschinen, die mit flüssigem Kohlenstoffdioxid betrieben werden.[103]
In zunehmendem Maße wird Kohlenstoffdioxid in Verbindung mit einem automatisierbaren Strahlverfahren verwendet, um hochreine Oberflächen zu erzeugen. Mit seiner Kombination aus mechanischen, thermischen und chemischen Eigenschaften kann beispielsweise Kohlenstoffdioxid-Schnee verschiedene Arten von Oberflächen-Verunreinigungen rückstandsfrei lösen und abtragen.[104]
Überkritisches Kohlenstoffdioxid wird als Lösungsmittel zum Reinigen und Entfetten, zum Beispiel von Wafern in der Halbleiterindustrie und von Textilien in der chemischen Reinigung, verwendet.[105] Überkritisches Kohlenstoffdioxid wird als Reaktionsmedium für die Feinchemikalienherstellung zum Beispiel für die Herstellung von Aromastoffen verwendet, da isolierte Enzyme hierin vielfach aktiv bleiben und im Gegensatz zu organischen Lösungsmitteln keine Lösungsmittelrückstände in den Produkten verbleiben.
In der tertiären Ölförderung wird überkritisches Kohlenstoffdioxid zur Flutung von Öllagerstätten verwendet, um Öl aus größeren Tiefen an die Oberfläche zu spülen.[106]
Mit Kohlenstoffdioxid gefüllte Wärmerohre werden zur Bereitstellung von Erdwärme verwendet und haben eine höhere Energieeffizienz als Sole-Kreisläufe.
Verwendung als Chemierohstoff
In der chemischen Industrie wird Kohlenstoffdioxid durch Umsatz mit Ammoniak vor allem für die Herstellung von Harnstoff verwendet. Im ersten Schritt reagieren Ammoniak und Kohlenstoffdioxid zu Ammoniumcarbamat, welches im zweiten Schritt zu Harnstoff und Wasser weiterreagiert.[107]
Durch Reduktion mit Wasserstoff wird Formamid erhalten. Durch Reaktion mit Aminen wie Dimethylamin wird Dimethylformamid erhalten.[108]
Durch Umsetzung von Kohlenstoffdioxid mit Natrium-Phenolat wird mit der Kolbe-Schmitt-Reaktion Salicylsäure gewonnen.[109]
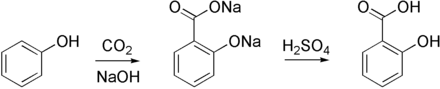 Darstellung von Salicylsäure durch die Kolbe-Schmitt-Reaktion
Darstellung von Salicylsäure durch die Kolbe-Schmitt-Reaktion
Durch Umsatz mit Ethylenoxid wird Ethylencarbonat hergestellt. Dieses wird im OMEGA-Prozess mit Wasser hochselektiv zu Monoethylenglykol umgesetzt.
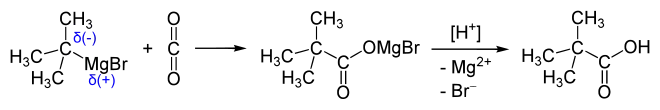
Die Umsetzung von Kohlenstoffdioxid mit einem Grignard-Reagenz führt zu Carbonsäuren, z. B.:
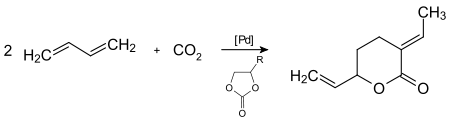
Die Telomerisation von Kohlenstoffdioxid mit zwei Molekülen 1,3-Butadien unter homogener Palladium-Katalyse führt zu Feinchemikalien wie Lactonen unter milden Reaktionsbedingungen.[107]
Im Solvay-Verfahren wird aus Kohlenstoffdioxid Soda (Natriumcarbonat) hergestellt. Manche Metallcarbonate wie Bleicarbonat, die zum Beispiel durch Umsatz der Metallhydroxide mit Kohlenstoffdioxid erhalten werden, haben eine Bedeutung als Pigment.
Bei einem hohen Ölpreis und günstigen Strompreisen bei Erneuerbaren Energien zum Beispiel aus Windkraft- und Solaranlagen könnte es sich zukünftig lohnen, Kohlenstoffdioxid auch für andere Anwendungen etwa zur Methan-Gewinnung in Power-to-Gas-Anlagen (Sabatier-Prozess) und Methanolproduktion (Power-to-Liquid) mit Wasserstoff aus Elektrolysen zu nutzen.[110] Weitere potenzielle Anwendungsfelder wären die Herstellung von Ameisensäure sowie von Synthesegasen zur Herstellung von Treibstoffen (Power-to-Fuel) und Chemierohstoffen (Power-to-Chemicals). Dies kann über eine Fischer-Tropsch-Synthese oder die direkte Nutzung zusammen mit Ethylenoxid oder Propylenoxid zur Herstellung von Polyolen und Polymeren wie Polyurethanen oder Polycarbonaten geschehen. Aus thermodynamischen Gründen ist eine Nutzung von Kohlenstoffdioxid allerdings derzeit meistens unwirtschaftlich.
Kohlenstoffdioxidrecycling
Neben der Kohlenstoffdioxid-Abscheidung und -Lagerung gehen die Forschungen in die Richtung, das bei der Verbrennung von fossilen Energieträgern anfallende Kohlenstoffdioxid in verwertbare Verbindungen und nach Möglichkeit wieder in Energieträger umzuwandeln. So lassen sich bereits über Reduktion Verbindungen wie Methanol[111] und Ameisensäure herstellen.[112]
Ebenso ist die Synthese von Harnstoff möglich. Ein französisches Forscherteam untersucht die organokatalytische Umwandlung zu Formamid beziehungsweise dessen Derivaten.[113][114] Da die Prozessenergie zugeführt werden muss, sind diese Verfahren nicht zur wirtschaftlichen Herstellung von Energieträgern geeignet. Wissenschaftler der RWTH Aachen entwickelten ein homogen-katalytisches Verfahren zur Herstellung von Methanol aus Kohlenstoffdioxid und Wasserstoff unter Druck mit einem speziellen Ruthenium-Phosphin-Komplex, bei dem Katalysator und Edukte in Lösung vorliegen.[115] Gleichfalls wurde ein kontinuierliches Verfahren zur Herstellung von Ameisensäure mit einem metallorganischen Rutheniumkomplex entwickelt, bei dem Kohlenstoffdioxid die Doppelrolle sowohl als Reaktant als auch in überkritischer Form als extraktive Phase für die gebildete Ameisensäure innehat.[116] In einer anderen, von einer spanischen Forschergruppe entwickelten Variante lässt sich Kohlenstoffdioxid über eine Iridium-katalysierte Hydrosilylierung umsetzen und in Form eines Silyl-Formiats abfangen, aus dem sich Ameisensäure leicht abtrennen lässt. Diese Reaktion, die bereits im Gramm-Maßstab realisiert werden konnte, läuft bei sehr milden Reaktionsbedingungen ab, ist sehr selektiv und hat einen hohen Umsatz.[117]
Im „Innovationszentrum Kohle“ erforschen RWE und die Brain AG, wie Mikroorganismen CO2 umwandeln.[118]
Sonstige Verwendung
Kohlenstoffdioxid wurde bis in die 1950er Jahre, vor allem in den Vereinigten Staaten, routinemäßig als Anästhetikum bei Menschen eingesetzt[119] und als sehr zufriedenstellend bewertet. Diese Methode wird mittlerweile nicht mehr in der klassischen Anästhesie bei Menschen genutzt, da wirksamere, inhalierbare Anästhetika eingeführt wurden.
Für die Betäubung von Schlachttieren findet diese Methode noch heute Anwendung.[120] Schweine werden hierbei in Gruppen mit einem Aufzugsystem in eine Grube hinab gelassen, deren Atmosphäre mindestens 80 % Kohlenstoffdioxid enthält, und verlieren darin das Bewusstsein. Dieses Verfahren wird kontrovers diskutiert und unterliegt intensiven Bemühungen zur Verbesserung des Tierschutzes.[121][122][123] Fische werden durch das Einleiten gasförmigen Kohlenstoffdioxids oder durch die Zugabe kohlensäurehaltigen Wassers betäubt.[124] Die Betäubung von Schlachttieren mit Kohlenstoffdioxid ist in Deutschland nur für Schweine, Puten, Eintagsküken und Lachsfische zulässig.[125]
Im Rahmen der Tiereuthanasie wird Kohlenstoffdioxid zur Tötung angewendet. In Deutschland ist die Anwendung auf kleine Labortiere beschränkt, auch zu Zwecken wie der Beschaffung von Futtertieren in Tierhaltungen.[126] Die Rechtmäßigkeit derartiger Tiertötungen ohne vorherige Betäubung wird jedoch angezweifelt.[127] Für behördlich veranlasste Tötungen von Tierbeständen, dem Keulen, darf Kohlenstoffdioxid auch zur Tötung von anderen Tieren eingesetzt werden, wenn hierfür eine besondere Erlaubnis vorliegt.[128] Die Tierärztliche Vereinigung für Tierschutz (TVT) bezeichnet diese Methode für Geflügel als geeignet.[129]
Kohlenstoffdioxid wird als Abführmittel in Zäpfchen verwendet. Durch die Reaktion von Natriumdihydrogenphosphat und Natriumhydrogencarbonat während der Auflösung des Zäpfchens wird Kohlenstoffdioxid freigesetzt und dehnt den Darm, was wiederum den Stuhlreflex auslöst.[130]
Bei der Kohlenstoffdioxid-Düngung wird es als Dünger in Gewächshäusern eingesetzt. Grund ist der durch den photosynthetischen Verbrauch entstehende Kohlenstoffdioxid-Mangel bei ungenügendem Nachschub an Frischluft, besonders im Winter bei geschlossener Lüftung. Dabei wird das Kohlenstoffdioxid entweder direkt als reines Gas oder als Verbrennungsprodukt aus Propan oder Erdgas eingebracht. Dadurch wird eine Kopplung von Düngung und Heizung erreicht. Die mögliche Ertragssteigerung ist abhängig davon, wie stark der Mangel an Kohlenstoffdioxid und wie stark das Lichtangebot für die Pflanzen ist.[131] Kohlenstoffdioxid wird in der Aquaristik als Dünger für Wasserpflanzen eingesetzt (CO2-Diffusor). Durch Zufuhr von organischer Substanz kann der Kohlenstoffdioxid-Gehalt im Wasser durch Veratmung auf Kosten des Sauerstoff-Gehalts erhöht werden.[132]
Eingesetzt wird das Gas bei dem Fang blutsaugender Insekten und Vektoren, die das im Atem vorkommende Kohlenstoffdioxid in ihrer Wirtsfindung verwenden, wie etwa Stechmücken. Es wird dabei aus Trockeneis, aus Gasflaschen oder aus der Verbrennung von Propan oder Butan freigesetzt und lockt die Insekten in die Nähe der Einsaugöffnung spezieller Fallen.[133] Auch bei der Kultivierung von Mikroorganismen wird das Gas verwendet, vor allem für obligat (strikt) anaerobe Bakterien, die nur unter anoxischen Bedingungen wachsen können. Sie lassen sich in einem CO2-Brutschrank inkubieren, der über eine Gasflasche versorgt wird. Neben strikt anaeroben gibt es auch sogenannte capnophile Bakterien, die für das Wachstum einen Anteil von 5–10 Volumenprozent Kohlenstoffdioxid in der sie umgebenden Atmosphäre benötigen. Sie werden häufig in einem verschließbaren Anaerobentopf kultiviert, in den ein kommerziell erhältlicher Reagenzträger gegeben wird, dessen Kammern mit Natriumhydrogencarbonat und Weinsäure oder Citronensäure befüllt sind. Durch Befeuchten wird – ähnlich dem Prinzip von Backpulver – CO2 freigesetzt.[134]
Physiologische Wirkungen und Gefahren
Wirkung auf Tiere und Menschen
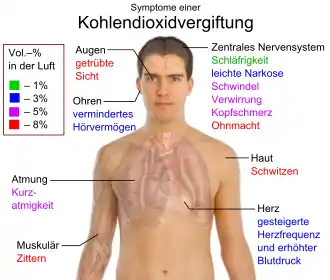
Ein zu hoher Anteil an Kohlendioxid in der Atemluft hat Schadwirkungen auf Tier und Mensch. Diese beruhen nicht nur auf der Verdrängung des Sauerstoffes in der Luft. Die DIN EN 13779 teilt die Raumluft je nach Kohlenstoffdioxid-Konzentration in vier Qualitätsstufen ein. Bei Werten unter 800 ppm gilt die Raumluftqualität als gut, Werte zwischen 800 und 1000 ppm (0,08 bis 0,1 Vol.-%) gelten als mittel, Werte von 1000 bis 1400 ppm als mäßige Qualität. Bei Werten über 1400 ppm gilt die Raumluftqualität als niedrig.[135] Zum Vergleich: Im globalen Mittel liegt der CO2-Anteil der Luft bei etwa 400 ppm Volumenanteil; er schwankt aber regional, tageszeitabhängig und jahreszeitabhängig stark.
Die Maximale Arbeitsplatz-Konzentration für eine tägliche Exposition von acht Stunden pro Tag liegt bei 5000 ppm.[136] Bei einer Konzentration von 1,5 % (15.000 ppm) nimmt das Atemzeitvolumen um mehr als 40 % zu.
Deutlich erhöhte CO2-Konzentrationen und/oder fehlende Ventilation bei Räumen mit vergleichsweise sauberer Umgebungsluft können laut Studien zu einer starken und vermeidbaren Beeinträchtigung der Gehirnleistung – vor allem bei Entscheidungsfindung und komplexem strategischem Denken – in Räumen wie etwa Klassenzimmern führen.[137][138]
Im Blut gelöstes Kohlenstoffdioxid aktiviert in physiologischer und leicht gesteigerter Konzentration das Atemzentrum des Gehirns.
In deutlich höherer Konzentration führt es zur Verminderung oder Aufhebung des reflektorischen Atemanreizes, zunächst zur Atemdepression und schließlich zum Atemstillstand.[139] Ab etwa 5 % Kohlenstoffdioxid in der eingeatmeten Luft treten Kopfschmerzen und Schwindel auf, bei höheren Konzentrationen beschleunigter Herzschlag (Tachykardie), Blutdruckanstieg, Atemnot und Bewusstlosigkeit, die sogenannte Kohlenstoffdioxid-Narkose. Kohlenstoffdioxid-Konzentrationen von 8 % führen innerhalb von 30 bis 60 Minuten zum Tod.[140][141] Eine Anreicherung von Kohlenstoffdioxid im Blut wird als Hyperkapnie bezeichnet.
Durch hohe Kohlenstoffdioxidkonzentrationen kommt es in Weinkellern, Futtersilos, Brunnen und Jauchegruben immer wieder zu Unfällen.[82] Durch Gärprozesse entstehen dort beträchtliche Mengen an Kohlenstoffdioxid, bei der Vergärung von einem Liter Most zum Beispiel etwa 50 Liter Gärgas. Oft fallen mehrere Personen einer Gärgasvergiftung zum Opfer, weil die Helfer beim Rettungsversuch selbst Kohlenstoffdioxid einatmen und bewusstlos werden. Die Rettung eines Verunglückten aus Kohlenstoffdioxid-verdächtigen Situationen ist nur durch professionelle Einsatzkräfte mit umgebungsluftunabhängigem Atemschutz möglich.[142]
Wenn nicht für ausreichende Entlüftung gesorgt ist, bilden sich durch natürliche Kohlenstoffdioxid-Quellen in Höhlen und in Bergwerksstollen mitunter hohe Konzentrationen des Gases. Diese befinden sich dann in Bodennähe, so dass vor allem kleinere Tiere ersticken können. So weist zum Beispiel die Hundsgrotte in Italien eine Kohlenstoffdioxid-Konzentration von circa 70 % auf.[143] Bei einem CO2-Ausbruch im Nyos-See im Jahr 1986 starben ca. 1700 Menschen.
Die Kohlenstoffdioxidkonzentration im Blut beeinflusst dessen pH-Wert und hat damit eine indirekte Wirkung auf den Sauerstoffhaushalt. Das Kohlensäure-Bikarbonat-System, ein Kohlensäure-Hydrogencarbonat-Puffer, stellt etwa 50 % der Gesamtpufferkapazität des Blutes dar, der durch das Enzym Carboanhydratase katalysiert wird.[144]
Bei niedrigerem pH-Wert verringert sich die Sauerstoff-Bindungskapazität des roten Blutfarbstoffs Hämoglobin. Bei gleichem Sauerstoff-Gehalt der Luft transportiert Hämoglobin daher weniger Sauerstoff. Der Bohr-Effekt und der Haldane-Effekt beschreiben diesen Sachverhalt.[145]
Wirkung auf Pflanzen
Auf Pflanzen hat eine geringfügig erhöhte Kohlenstoffdioxid-Konzentration den Effekt der Kohlenstoffdioxid-Düngung, da die Pflanzen bei der Photosynthese für die Kohlenstoffdioxid-Assimilation CO2 benötigen. Übermäßig erhöhte Konzentrationen sind jedoch auch für Pflanzen schädlich. Bei C3-Pflanzen liegt das Optimum meist zwischen 800 und 1000 ppm, bei C4-Pflanzen liegt es jedoch nur knapp über 400 ppm. Die C4-Pflanze Mais als Indikator-Pflanze zeigte bei 10.000 ppm CO2 nach einer sechstägigen Expositionsdauer Streifen auf ihren Blättern.[146] Bei Reis wurden Veränderungen in der Nährstoffzusammensetzung (Proteine, Mikronährstoffe und Vitamine) festgestellt. Eiweiß, Eisen, Zink, die Vitamine B1, B2, B5 und B9 nehmen mit übermäßig ansteigender CO2-Konzentration ab, Vitamin E dagegen nimmt zu. Eine so bedingte Verringerung der Qualität pflanzlicher Nahrungsmittel würde das Problem der weltweiten Unterernährung weiter verstärken.[147]
Ökologische Bedeutung
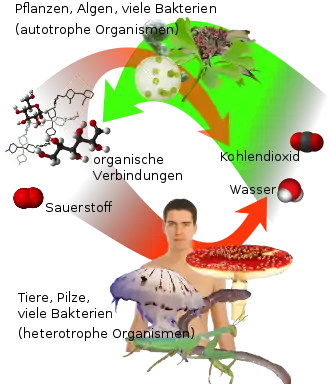
Pflanzen und photosynthesefähige Bakterien nehmen Kohlenstoffdioxid aus der Atmosphäre auf und wandeln es durch Photosynthese unter Einwirkung von Licht und Aufnahme von Wasser in Kohlenhydrate wie Glucose um.
- vereinfachte Netto-Reaktionsgleichung für die oxygene Photosynthese[148]
Dieser Prozess setzt gleichzeitig Sauerstoff aus der Dekomposition von Wasser frei. Die entstehenden Kohlenhydrate dienen als Energieträger und Baustoff für alle anderen biochemischen Substanzen wie Polysaccharide, Nukleinsäuren und Proteine. Kohlenstoffdioxid stellt damit den Rohstoff für die Bildung aller Biomasse in der Primärproduktion der Ökosysteme.[149]
Der Abbau von Biomasse durch aerobe Atmung ist, in Umkehrung zum Prozess der Photosynthese, wieder mit der Bildung von Kohlenstoffdioxid und dem Verbrauch von Sauerstoff verbunden.[150]
- vereinfachte Netto-Reaktionsgleichung für die aerobe Atmung[151]
Alle Organismen eines Ökosystems atmen fortwährend, während die Photosynthese an die Verfügbarkeit von Licht gebunden ist. Dies führt zur zyklischen Zu- und Abnahme von Kohlenstoffdioxid im täglichen und jahreszeitlichen Rhythmus in Abhängigkeit von den unterschiedlichen Lichtintensitäten.
In Gewässern schwankt die Kohlenstoffdioxid-Konzentration ebenfalls entsprechend den genannten Tages- und Jahreszeit-Rhythmen. Kohlenstoffdioxid steht mit den anderen gelösten Kohlensäurespezies in einem chemischen Gleichgewicht, welches den im Wasser herrschenden pH-Wert wesentlich bestimmt. Vom pH-Wert hängen wiederum die chemischen Gleichgewichtslagen der Dissoziationen von Ammonium/Ammoniak, Nitrit/Salpetrige Säure, Sulfid/Schwefelwasserstoff und anderen Säure-Basen-Paaren ab, die sich durch die Toxizität für die Organismen im Gewässer bemerkbar machen.[152]
Ist in einem Gewässer der Vorrat an Kohlenstoffdioxid durch Photosynthese erschöpft, was sich durch einen pH-Wert nahe 8,3 bemerkbar macht, sind manche Arten von Algen und Wasserpflanzen fähig, aus dem gelösten Hydrogencarbonat das benötigte Kohlenstoffdioxid zu gewinnen, wobei sie Hydroxidionen abgeben, sodass der pH-Wert immer alkalischer wird. In nährstoffreichen Gewässern wie Karpfenteichen kann der pH-Wert dann bis auf 12 steigen, mit den entsprechenden gesundheitlichen Folgen für die Fische, zum Beispiel Kiemennekrose der Karpfen.[153]
Wissenschaftler des Biodiversität- und Klima-Forschungszentrums haben 2012 erstmals in einer gemeinsamen Studie mit anderen Institutionen berechnet, dass kryptogame Schichten aus Flechten, Algen und Moosen neben Stickstoff jährlich rund 14 Milliarden Tonnen Kohlenstoffdioxid binden. Sie binden so viel Kohlenstoffdioxid, wie pro Jahr durch Waldbrände und die Verbrennung von Biomasse weltweit freigesetzt wird. Mit Hilfe der kryptogamen Schichten den Klimawandel zu bekämpfen ist jedoch nicht möglich, denn der flächige Bewuchs speichert das Treibhausgas Kohlenstoffdioxid nur über wenige Jahre hinweg.[154][155]
Eine Bedeutung hat die Speicherung und Freisetzung von Kohlenstoffdioxid in Böden. Wie stark die Freisetzung aus organischem Bodenkohlenstoff von den jeweiligen Umweltbedingungen und anderen Faktoren beeinflusst wird, ist derzeit weitgehend unbekannt. Die Freisetzung wird aber durch Erwärmung beschleunigt, was in neueren Studien gezeigt werden konnte, und könnte Auswirkungen auf das Klima haben.[156] Eine 2019 veröffentlichte Studie zeigt, dass bei einer CO2-Konzentration über 1.200 ppm Stratocumuluswolken in verstreute Wolken zerfallen, was die globale Erwärmung weiter vorantreiben könnte.[157]
Mit der Angabe des CO2-Ausstoßes werden verschiedene Prozesse energetisch und ökologisch vergleichbar gemacht. Dazu wird auf die Freisetzung von Kohlenstoffdioxid bei der Verbrennung fossiler Energieträger umgerechnet.
Nachweis und quantitative Bestimmung
Ein einfacher Nachweis von Kohlenstoffdioxid gelingt mit einer wässrigen Calciumhydroxidlösung, der sogenannten Kalkwasserprobe. Dazu wird das zu untersuchende Gas in die Lösung eingeleitet. Enthält das Gas Kohlenstoffdioxid, reagiert dieses mit Calciumhydroxid zu Wasser und Calciumcarbonat (Kalk), das als weißlicher Feststoff ausfällt und die Lösung trübt.
Mit Barytwasser, einer wässrigen Bariumhydroxidlösung, ist der Nachweis empfindlicher, da Bariumcarbonat schwerer löslich ist als Calciumcarbonat.
In wässriger Lösung wird Kohlenstoffdioxid durch Titration mit 0,1 N Natronlauge bis zum pH-Wert von 8,3, dem Farbumschlag des Indikators Phenolphthalein, bestimmt. Die Messung des Säurebindungsvermögens (SBV), des pH-Werts und der elektrischen Leitfähigkeit oder der Ionenstärke ermöglicht die Berechnung des Kohlenstoffdioxidgehalts aus diesen Parametern nach dem Dissoziationsgleichgewicht der Kohlensäure. Die Severinghaus-Elektrode, eine pH-Elektrode mit einer Pufferlösung aus Natriumhydrogencarbonat, bestimmt über die Messung der pH-Wert-Änderung die Kohlenstoffdioxid-Konzentration einer Lösung.[158]
Kohlenstoffdioxid kann mittels Infrarot- oder Raman-Spektroskopie nachgewiesen werden, wobei die asymmetrischen Streckschwingungen sowie Kippschwingungen infrarotaktiv sind, während die symmetrische Streckschwingung bei einer Wellenzahl von 1480 cm−1 raman-aktiv ist.[159] Das dazu verwendete Messgerät wird nichtdispersiver Infrarotsensor genannt.
Literatur
- Hans-Otto Pörtner: Auswirkungen von CO2-Eintrag und Temperaturerhöhung auf die marine Biosphäre. (PDF; 1,3 MB).
- Jens Soentgen, Armin Reller: CO2 – Lebenselixier und Klimakiller. Oekom-Verlag, München 2009, ISBN 978-3-86581-118-9.
- James Newton Butler: Carbon Dioxide Equilibria and Their Applications. Lewis Publishers, 1991, ISBN 0-87371-624-8.
- Martin M. Halmann, Meyer Steinberg: Greenhouse Gas Carbon Dioxide Mitigation: Science and Technology. CRC Press, 1998, ISBN 1-56670-284-4.
- Martin M. Halmann: Chemical Fixation of Carbon Dioxide Methods Recycling: Methods of Recycling CO2 into Useful Products. CRC Press, 1993, ISBN 0-8493-4428-X.
Weblinks
Einzelnachweise
- Eintrag zu E 290: Carbon dioxide in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 1. Juli 2020.
- Eintrag zu CARBON DIOXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. Februar 2020.
- Eintrag zu Kohlendioxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- Eintrag zu Kohlenstoffdioxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Carbon Dioxide Solubility in Water (Memento vom 27. März 2010 im Internet Archive)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Index of Refraction of Gases, S. 10-254.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Index of Refraction of Inorganic Liquids, S. 4-140.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 124-38-9 bzw. Kohlenstoffdioxid), abgerufen am 2. November 2015.
- United Nations Framework Convention on Climate Change: Global Warming Potentials.
- Eintrag zu Kohlenstoffdioxid. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 22. März 2010.
- Greenhouse gas concentrations in atmosphere reach yet another high. WMO, 25. November 2019, abgerufen am 27. November 2019 (englisch).
- Verena Kern: Treibhausgas-Konzentration erreicht neuen Rekordwert. In: Klimareporter. 25. November 2019, abgerufen am 27. November 2019.
- Florian Rötzer auf Telepolis: CO2-Emissionen in der Atmosphäre steigen weiter exponentiell. 7. Juni 2019, abgerufen am 7. Juli 2019.
- Carbon Dioxide Levels Hit Record Peak in May. 3. Juni 2019, abgerufen am 7. Juli 2019 (englisch).
- Weltorganisation für Meteorologie: Greenhouse gas concentrations in atmosphere reach yet another high. 25. November 2019, abgerufen am 25. November 2019 (englisch).
- Jochem Marotzke: „Vorhersagen sind schwierig …“ Möglichkeiten und Grenzen von Klimamodellen. In: Ders., Martin Stratmann (Hrsg.): Die Zukunft des Klimas. Neue Erkenntnisse, neue Herausforderungen. Ein Report der Max-Planck-Gesellschaft. Beck, München 2015, ISBN 978-3-406-66968-2, S. 9–22, hier S. 22.
- Corinne Le Quéré et al.: Temporary reduction in daily global CO2 emissions during the COVID-19 forced confinement. In: Nature Climate Change. Band 10, 2020, S. 647–653, doi:10.1038/s41558-020-0797-x.
- William Emerson Brock, B. Kleidt, H. Voelker: Viewegs Geschichte der Chemie, Springer-Verlag, ISBN 3-540-67033-5, S. 35.
- William Emerson Brock, B. Kleidt, H. Voelker: Viewegs Geschichte der Chemie, Springer-Verlag, ISBN 3-540-67033-5, S. 50.
- William Emerson Brock, B. Kleidt, H. Voelker: Viewegs Geschichte der Chemie. Springer-Verlag, ISBN 3-540-67033-5, S. 72.
- J. Priestley, W. Hey: Observations on Different Kinds of Air. By Joseph Priestley, L L. D. F. R. S.. In: Philosophical Transactions of the Royal Society of London. 62 (1772), S. 147–264, doi:10.1098/rstl.1772.0021.
- Humphry Davy: On the Applicatin of Liquids Formed by the Condensation of Gases as Mechanical Agents. In: Philosophical Transactions of the Royal Society of London. 113 (1823), S. 199–205, doi:10.1098/rstl.1823.0020.
- Ludwig Brandt, Karl-Heinz Krauskopf: „Eine Entdeckung in der Chirurgie“. 150 Jahre Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 970–975, hier: S. 973.
- Joost Mertens, Du côté d’un chimiste nommé Thilorier. Balthazar Claës modèle d’Adrien Thilorier, L'Année balzacienne, 1, 2003, Nr. 4
- Markus Reichstein: Universell und Überall. Der terrestrische Kohlenstoffkreislauf im Klimasystem. In: Jochem Marotzke, Martin Stratmann (Hrsg.): Die Zukunft des Klimas. Neue Erkenntnisse, neue Herausforderungen. Ein Report der Max-Planck-Gesellschaft. Beck, München 2015, ISBN 978-3-406-66968-2, S. 123–136, insb. S. 125.
- Martin Kappas: Klimatologie. Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-1827-2, S. 159.
- Andrea Rehmsmeier: Auf dünnem Eis Deutschlandfunk – Wissenschaft im Brennpunkt vom 7. August 2016.
- ipa.arcticportal.org: International Permafrost Association (5. November 2016).
- Naturschutzbund Deutschland – Informationen über Moore als Kohlenstoffspeicher und ihre damit verbundene Bedeutung für den Klimaschutz
- Stefan Rahmstorf, Hans Joachim Schellnhuber: Der Klimawandel. C. H. Beck, 7. Auflage 2012, S. 23.
- Hans Günter Brauch: Historical Times and Turning Points in a Turbulent Century: 1914, 1945, 1989 and 2014?, in: Ders., Ursula Oswald Spring, Juliet Bennett, Serena Eréndira Serrano Oswald (Hrsg.) Addressing Global Environmental Challenges from a Peace Ecology Perspective. Cham 2016, 11–68, S. 29–31.
- J. Ewald: Carbon Dioxide at NOAA’s Mauna Loa Observatory reaches new milestone: Tops 400 ppm. In: NOAA Research News. 10. Mai 2013, abgerufen am 4. Juni 2018.
- Stern.de, 7. Mai 2015, CO2-Konzentration in der Atmosphäre erreicht Rekordwert (Memento vom 8. Mai 2015 im Internet Archive) (9. Mai 2015).
- NOAA Earth System Research Laboratory: Trends in Atmospheric Carbon Dioxide – Recent Global CO2. 6. Mai 2018, abgerufen am 2. Juni 2018.
- Christian Speicher: Die CO2-Konzentration erklimmt einen neuen Rekordwert. In: nzz.ch. 22. November 2018, abgerufen am 13. Juni 2021.
- Ottmar Edenhofer, Michael Jakob: Klimapolitik. Ziele, Konflikte, Lösungen. München 2017, S. 20.
- Innenraumluftqualität: Kohlendioxid (CO2), Temperatur und Luftfeuchte in Schulklassenräumen. In: Niedersächsisches Ministerium für Umwelt, Energie und Klimaschutz. 25. September 2013, abgerufen am 19. Mai 2013.
- Karsten Schwanke, Nadja Podbregar, Dieter Lohmann, Harald Frater: Naturkatastrophen. Wirbelstürme, Beben, Vulkanausbrüche – entfesselte Gewalten und ihre Folgen. Springer Verlag, Berlin/Heidelberg 2009, ISBN 978-3-540-88684-6, S. 119.
- Carbon Dioxide through Geologic Time. In: Geoscience Research Division at Scripps Institution of Oceanography. Abgerufen am 21. Dezember 2013.
- Isabel P. Montañez, Jennifer C. McElwain, Christopher J. Poulsen, Joseph D. White, William A. DiMichele, Jonathan P. Wilson, Galen Griggs, Michael T. Hren: Climate, pCO2 and terrestrial carbon cycle linkages during late Palaeozoic glacial–interglacial cycles. (PDF) In: Nature Geoscience. 9, Nr. 11, November 2016, S. 824–828. doi:10.1038/ngeo2822.
- Georg Feulner: Formation of most of our coal brought Earth close to global glaciation. In: PNAS. 114, Nr. 43, Oktober 2017, S. 11333–11337. doi:10.1073/pnas.1712062114.
- K. J. Meissner, T. J. Bralower, K. Alexander, T. Dunkley Jones, W. Sijp, M. Ward: The Paleocene-Eocene Thermal Maximum: How much carbon is enough?. In: Paleoceanography. 29, Nr. 10, Oktober 2014, S. 946–963. doi:10.1002/2014PA002650.
- Mark Pagani, Matthew Huber, Zhonghui Liu, Steven M. Bohaty, Jorijntje Henderiks, Willem Sijp, Srinath Krishnan, Robert M. DeConton: The Role of Carbon Dioxide During the Onset of Antarctic Glaciation Archiviert vom Original am 4. März 2016. (PDF) In: Science. 334, Nr. 6060, Dezember 2011, S. 1261–1264. doi:10.1126/science.1203909. Abgerufen am 12. Januar 2019.
- Dieter Lüthi, Martine Le Floch, Bernhard Bereiter, Thomas Blunier, Jean-Marc Barnola, Urs Siegenthaler, Dominique Raynaud, Jean Jouzel, Hubertus Fischer, Kenji Kawamura, Thomas F. Stocker: High-resolution carbon dioxide concentration record 650,000–800,000 years before present. In: Nature. 453, Nr. 7193, 15. Mai 2008, S. 379. doi:10.1038/nature06949.
- U. Siegenthaler: Stable Carbon Cycle-Climate Relationship During the Late Pleistocene. In: Science. 310, Nr. 5752, 25. November 2005, S. 1313. doi:10.1126/science.1120130.
- Iain Colin Prentice et al.: The Carbon Cycle and Atmospheric Carbon Dioxide. In: IPCC Third Assessment Report. 2001, S. 185, abgerufen am 21. Dezember 2013.
- J. G. Canadell, C. Le Quere, M. R. Raupach, C. B. Field, E. T. Buitenhuis, P. Ciais, T. J. Conway, N. P. Gillett, R. A. Houghton, G. Marland: Contributions to accelerating atmospheric CO2 growth from economic activity, carbon intensity, and efficiency of natural sinks. In: Proceedings of the National Academy of Sciences. 104, 2007, S. 18866–18870, doi:10.1073/pnas.0702737104.
- Walter Roedel, Thomas Wagner. Physik unserer Umwelt: Die Atmosphäre. 5. Auflage, Berlin 2017, S. 440.
- GRID-Arendal: Vital Climate Graphics: The present carbon cycle (Memento vom 6. Oktober 2016 im Internet Archive)
- A. P. Ballantyne, C. B. Alden, J. B. Miller, P. P. Tans, J. W. C. White: Increase in observed net carbon dioxide uptake by land and oceans during the past 50 years. In: Nature. 488, 2012, S. 70–72, doi:10.1038/nature11299.
- Karl Hille: Carbon Dioxide Fertilization Greening Earth, Study Finds. 25. April 2016, abgerufen am 10. Dezember 2019.
- Nate G. McDowell et al.: Pervasive shifts in forest dynamics in a changing world. In: Science. Band 368, Nr. 964, 2020, doi:10.1126/science.aaz9463.
- S. A. Montzka, E. J. Dlugokencky, J. H. Butler: Non-CO2 greenhouse gases and climate change. In: Nature. 476, 2011, S. 43–50, doi:10.1038/nature10322.
- Gerald A. Meehl, Warren M. Washington, Caspar M. Ammann, Julie M. Arblaster, T. M. L. Wigley, Claudia Tebaldi: Combinations of Natural and Anthropogenic Forcings in Twentieth-Century Climate. In: Journal of Climate. 17, 2004, S. 3721–3727, doi:10.1175/1520-0442(2004)017<3721:CONAAF>2.0.CO;2.
- James Hansen, Makiko Sato, Reto Ruedy, Larissa Nazarenko, Andrew Lacis, Gavin A. Schmidt, Gary Russell et al.: Efficacy of climate forcings. In: Journal of Geophysical Research. Vol. 110, Issue D18, 27. September 2005, doi:10.1029/2005JD005776.
- Milliarden gegen Klimawandel - «Die Schweiz hat den drittgrössten Fussabdruck in ganz Europa». In: srf.ch. 29. September 2019, abgerufen am 1. Oktober 2019.
- Zhenhao Duan, Rui Sun: An improved model calculating CO2 solubility in pure water and aqueous NaCl solutions from 273 to 533 K and from 0 to 2000 bar. In: Chemical Geology. 193, 2003, S. 257–271, doi:10.1016/S0009-2541(02)00263-2.
- Naomi M. Levine, Scott C. Doney: How Long Can the Ocean Slow Global Warming? In: Woods Hole Oceanographic Institution. 29. November 2006, abgerufen am 21. Dezember 2013.
- Stefan Rahmstorf, Katherine Richardson: Wie bedroht sind die Ozeane? In: Klaus Wiegandt (Hrsg.): Mut zur Nachhaltigkeit. 12 Wege in die Zukunft. Frankfurt am Main 2016, 113–146, S. 128.
- Gabriela Negrete-García, Nicole S. Lovenduski, Claudine Hauri, Kristen M. Krumhardt, Siv K. Lauvset: Sudden emergence of a shallow aragonite saturation horizon in the Southern Ocean. In: Nature Climate Change. 9, 2019, S. 313, doi:10.1038/s41558-019-0418-8.
- Tom Garrison: Oceanography: an invitation to marine science, 2005, Verlag Thomson Brooks/Cole, Belmont, CA, ISBN 0-534-40887-7, S. 505.
- J. B. Ries, A. L. Cohen, D. C. McCorkle: Marine calcifiers exhibit mixed responses to CO2-induced ocean acidification. In: Geology. 37, 2009, S. 1131–1134, doi:10.1130/G30210A.1.
- Killer-Seen Lautloser Tod aus der Tiefe. In: Der Spiegel. 7. März 2008, abgerufen am 21. Dezember 2012.
- Michel Halbwachs, Klaus Tietze, Andreas Lorke, Clément Mudaheranwa: Investigations in Lake Kivu after the Nyiragongo Eruption of January 2002. (PDF; 2,5 MB) In: Das Wasserforschungs-Institut des ETH-Bereichs. 9. März 2002, abgerufen am 21. Dezember 2012.
- The Atmosphere of Venus. In: Department of Physics and Astronomy Georgie State University. Abgerufen am 22. März 2010.
- Kohlendioxid (fast) pur … Atmosphäre und Klima des Roten Planeten. In: Scinexx, das Wissensmagazin. 20. Dezember 2003, abgerufen am 22. März 2010.
- E. Lellouch, B. Bezard, J.I. Moses, G.R. Davis, P. Drossart, H. Feuchtgruber, E.A. Bergin, R. Moreno, T. Encrenaz: The Origin of Water Vapor and Carbon Dioxide in Jupiter’s Stratosphere. In: Icarus. 159, 2002, S. 112–131, doi:10.1006/icar.2002.6929.
- Dale P. Cruikshank, Allan W. Meyer, Robert H. Brown, Roger N. Clark, Ralf Jaumann, Katrin Stephan, Charles A. Hibbitts, Scott A. Sandford, Rachel M.E. Mastrapa, Gianrico Filacchione, Cristina M. Dalle Ore, Philip D. Nicholson, Bonnie J. Buratti, Thomas B. McCord, Robert M. Nelson, J. Brad Dalton, Kevin H. Baines, Dennis L. Matson: Carbon dioxide on the satellites of Saturn: Results from the Cassini VIMS investigation and revisions to the VIMS wavelength scale. In: Icarus. 206, 2010, S. 561–572, doi:10.1016/j.icarus.2009.07.012.
- Hubble finds carbon dioxide on an extrasolar planet. In: Inoovations-Report, Forum für Wissenschaft, Industrie und Wirtschaft. 10. Dezember 2008, abgerufen am 22. März 2010.
- L.B. d’Hendecourt, M. Jourdain de Muizon: The discovery of interstellar carbon dioxide. In: Astronomy and Astrophysics, 223 (1989), S. L5–L8 (Volltext).
- Rebecca L. Rawls: Interstellar Chemistry. In: Chemical & Engineering News. Band 80, Nr. 28, 2002, S. 31–37 (acs.org [abgerufen am 9. Januar 2017]).
- D. Talbi, E. Herbst: The gas-phase destruction of interstellar carbon dioxide: Calculations on the reactions between CO2 and H2 and between CO2 and H. In: Astronomy and Astrophysics 386, 2002, S. 1139–1142, doi:10.1051/0004-6361:20020312.
- Henrik Lund, Brian Vad Mathiesen: The role of Carbon Capture and Storage in a future sustainable energy system. In: Energy 44, 2012, S. 469–476, doi:10.1016/j.energy.2012.06.002.
- o.A.: Schülerduden Chemie, Bibliografisches Institut & F.A. Brockhaus AG, Mannheim 2007, ISBN 978-3-411-05386-5, S. 195.
- G. Hochgesand: Anwendung von Absorptionsverfahren für die CO2-Entfernung aus Natur- und Synthesegasen. In: Chemie Ingenieur Technik. 40, 1968, S. 432–440, doi:10.1002/cite.330400904.
- Birgit Kessler, Jörg Von Eysmondt, Heinrich Merten: Nutzung von CO2 aus Rauchgasen für chemische Synthesen. In: Chemie Ingenieur Technik. 64, 1992, S. 1075–1083, doi:10.1002/cite.330641207.
- H. Kolbe: Antiseptische Eigenschaften der Kohlensäure. In: Journal für praktische Chemie. 26, 1882, S. 249–255, doi:10.1002/prac.18820260116.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 860.
- A. Simon und K. Peters: Single-crystal refinement of the structure of carbon dioxide. In: Acta Crystallographica B. 1980, B36, S. 2750–2751, doi:10.1107/S0567740880009879.
- Frank Wisotzky: Angewandte Grundwasserchemie, Hydrogeologie und hydrogeochemische Modellierung: Grundlagen, Anwendungen und Problemlösungen. Springer Verlag, 2011, ISBN 978-3-642-17812-2, S. 65.
- Roland Benedix: Bauchemie. Vieweg+Teubner Verlag, ISBN 978-3-8348-0584-3, S. 113 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. T. Kiehl, K. E. Trenberth: Earth’s annual global mean energy budget. In: American Meteorological Society. Band 78, 1997, S. 197–208 (PDF, 221 kB)
- Airproducts.com: Carbon Dioxide – Product Stewardship Summary, abgerufen am 19. Juli 2017.
- Hans-Dieter Barke: Chemiedidaktik heute. Springer-Verlag, Berlin 2001, ISBN 3-540-41725-7, S. 30 (eingeschränkte Vorschau in der Google-Buchsuche).
- Kohlensäure aus dem Kamin: Wie ein Thurgauer Unternehmen aus Abgas CO2 für den Zapfhahn macht. In: St. Galler Tagblatt, 8. Juli 2018. Abgerufen am 8. Juli 2018.
- Zusatzstoff-Zulassungsverordnung: Anlage 3 (zu § 5 Abs. 1 und § 7) Allgemein zugelassene Zusatzstoffe.
- Info-Broschüre – Backen mit Hefe. In: Adler-Mühle. Abgerufen am 22. März 2010.
- Hugh Johnson, Steven Brook: Der große Johnson. Die Enzyklopädie der Weine, Weinbaugebiete und Weinerzeuger der Welt, Verlag Gräfe und Unzer GmbH, 2009, ISBN 3-8338-1621-X, S. 135.
- A. Keith Thompson: Fruit and Vegetables Harvesting, Handling and Storage. Blackwell Publishing, Oxford 2003, ISBN 1-4051-0619-0, S. 61–70.
- Hannah James und Jenny Jobling: The Flesh Browning Disorder of ‘Pink Lady’ Apples. (PDF; 608 kB) In: New York Fruit Quarterly Band 16, Nr. 2. 2008, S. 23–28, abgerufen am 4. Juni 2018.
- Irene Palacios et al.: Use of Modified Atmosphere Packaging to Preserve Mushroom Quality during Storage. In: Recent Patents on Food, Nutrition & Agriculture, Band 3, Heft 3, 2012, S. 196–203, doi:10.2174/2212798411103030196.
- Anne Emblem: Predicting packaging characteristics to improve shelf-life. In: David Kilcast, Persis Subramaniam (Hrsg.): The stability and shelf-life of food, 2000, Woodhead Publishing, Cambridge (UK), ISBN 1-85573-500-8, S. 145–169.
- Joseph P. Kerry (Hrsg.): Advances in meat, poultry and seafood packaging, 2012, Woodhead Publishing, Cambridge (UK), ISBN 978-1-84569-751-8.
- Patent DE3882965T2: Verfahren zum Entkoffeinieren von Kaffee mit einer superkritischen Flüssigkeit. Angemeldet am 22. Dezember 1988, veröffentlicht am 24. Februar 1994, Anmelder: Kraft General Foods Inc, Erfinder: Saul Norman Katz.
- Feuerwehr zu Gasunfall: „Keine Einsatz-Fehler“. In: Rheinische Post. 20. August 2008, abgerufen am 21. Dezember 2013.
- Carbon Dioxide as a Fire Suppressant: Examining the Risks. In: U.S. Environmental Protection Agency. 19. August 2010, abgerufen am 22. März 2010.
- Kohlendioxid – Besonderheiten und Einsatzchancen als Kältemittel. In: Deutscher Klima- und Kältetechnischer Verein. Abgerufen am 22. März 2010.
- Natürliches Kältemittel für Pkw-Klimaanlagen. In: Umweltbundesamt. 9. Juni 2008, abgerufen am 22. März 2010.
- Metall-Aktivgasschweißen (MAG/135). (PDF; 42 kB) In: Deutscher Verband für Schweißen und verwandte Verfahren. Abgerufen am 22. März 2010.
- Douglas A. Skoog, James J. Leary, S. Hoffstetter-Kuhn: Instrumentelle Analytik: Grundlagen – Geräte – Anwendungen. Springer-Verlag, ISBN 3-540-60450-2, S. 285 (eingeschränkte Vorschau in der Google-Buchsuche).
- Druckgase zur Versorgung von Getränkeschankanlagen. (PDF) In: Berufsgenossenschaft Nahrungsmittel und Gastgewerbe. 1. Februar 2012, abgerufen am 22. März 2010.
- Merkblatt – Verwendung von Nebelgeräten. (PDF) Abgerufen am 22. März 2010.
- Mark Krieg: Trockeneisstrahlen – mit Schnee oder mit Pellets? In: Journal für Oberflächentechnik, 45.6, 2005, S. 50–55.
- N. Dahmen, P. Griesheimer, A. Hebach: Reinigung und Oberflächenbehandlung mit komprimiertem Kohlendioxid. In: Galvanotechnik, 98, 2007, S. 1111–1120.
- F. M. Orr, J. J. Taber: Use of Carbon Dioxide in Enhanced Oil Recovery. In: Science. 224, 1984, S. 563–569, doi:10.1126/science.224.4649.563.
- Arno Behr und Stefan Neuberg: Katalytische Kohlendioxid-Chemie. In: Aktuelle Wochenschau der GDCh. 13. Mai 2008, abgerufen am 4. Juni 2018.
- A. Behr, P. Ebbinghaus, F. Naendrup: Verfahrenskonzepte für die Übergangsmetallkatalysierten Synthesen von Ameisensäure und Dimethylformamid auf der Basis von Kohlendioxid. In: Chemie Ingenieur Technik. 75, 2003, S. 877–883, doi:10.1002/cite.200303221.
- H. Kolbe: Ueber Synthese der Salicylsäure. In: Liebigs Ann., 113, 1860, S. 125–127, doi:10.1002/jlac.18601130120.
- Alexis Bazzanella, Dennis Krämer, Martina Peters: CO2 als Rohstoff. In: Nachrichten aus der Chemie. 58, 2010, S. 1226–1230, doi:10.1002/nadc.201075752.
- Rudolf-Werner Dreier: Grünes Benzin aus Kohlenstoffdioxid. Albert-Ludwigs-Universität Freiburg im Breisgau, Pressemitteilung vom 13. Juni 2012 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.
- Sebastian Matthes, Susanne Donner: Der Klimakiller als Rohstoff. In: Wirtschaftswoche online. 16. September 2012, abgerufen am 21. Dezember 2013.
- Renate Hoer: Kohlendioxid-Recycling? Gesellschaft Deutscher Chemiker, Pressemitteilung vom 8. November 2011 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.
- Christophe Das Neves Gomes, Olivier Jacquet, Claude Villiers, Pierre Thury, Michel Ephritikhine, Thibault Cantat: A Diagonal Approach to Chemical Recycling of Carbon Dioxide: Organocatalytic Transformation for the Reductive Functionalization of CO2. In: Angewandte Chemie. 124, 2012, S. 191–194, doi:10.1002/ange.201105516.
- Sebastian Wesselbaum, Thorsten vom Stein, Jürgen Klankermayer, Walter Leitner: Hydrogenation of Carbon Dioxide to Methanol by Using a Homogeneous Ruthenium-Phosphine Catalyst. In: Angewandte Chemie. 124, 2012, S. 7617–7620, doi:10.1002/ange.201202320.
- Sebastian Wesselbaum, Ulrich Hintermair, Walter Leitner: Continuous-Flow Hydrogenation of Carbon Dioxide to Pure Formic Acid using an Integrated scCO2 Process with Immobilized Catalyst and Base. In: Angewandte Chemie. 124, 2012, S. 8713–8716, doi:10.1002/ange.201203185.
- Ralte Lalrempuia, Manuel Iglesias, Victor Polo, Pablo J. Sanz Miguel, Francisco J. Fernández-Alvarez, Jesús J. Pérez-Torrente, Luis A. Oro: Effective Fixation of CO2 by Iridium-Catalyzed Hydrosilylation. In: Angewandte Chemie. 124, 2012, S. 12996–12999, doi:10.1002/ange.201206165.
- Stefan Pelzer: Maßgeschneiderte Mikroorganismen. In: Biologie in unserer Zeit. 42, 2012, S. 98–106, doi:10.1002/biuz.201210472.
- A. A. LaVerne: Rapid coma technique of carbon dioxide inhalation therapy. In: Diseases of the nervous system, 14.5 (1953), S. 141.
- B. Nowak, T.V. Mueffling, J. Hartung: Effect of different carbon dioxide concentrations and exposure times in stunning of slaughter pigs: Impact on animal welfare and meat quality. In: Meat Science. 75, 2007, S. 290–298, doi:10.1016/j.meatsci.2006.07.014.
- Roswitha Nitzsche: Verbesserung des Tierschutzes bei der Schweineschlachtung durch Neugestaltung des Zutriebs zur und in die CO2-Betäubungsanlage, Abschlussbericht, BLE – Forschungsvorhaben 05UM012/W, o. J. (2008), Max Rubner – Institut, Institut für Sicherheit und Qualität bei Fleisch, Arbeitsbereich Technologie, Kulmbach Online PDF, 1,3 MB. Abgerufen am 22. Dezember 2013.
- ohne Verfasser: Systemimmanente Probleme beim Schlachten. Stand 21. August 2012, Deutscher Tierschutzbund e. V., Bonn 2012 PDF, 78 kB. Abgerufen am 22. Dezember 2013.
- Tierärztliche Vereinigung für Tierschutz (Hrsg.): Tierschutzgerechtes Schlachten von Rindern, Schweinen, Schafen und Ziegen. Merkblatt Nr. 89. Eigenverlag, Bramsche 2007. Abgerufen am 22. Dezember 2013.
- Lindsay G. Ross, Barbara Ross (Hrsg.): Anaesthetic and Sedative Techniques for Aquatic Animals. Third Edition. Blackwell Publishing, Oxford 2008, ISBN 978-1-4051-4938-9, Kap. 9: Anaesthesia of Fish: II. Inhalation Anaesthesia Using Gases, S. 127–135.
- Almuth Hirt, Christoph Maisack, Johanna Moritz: Verordnung zum Schutz von Tieren im Zusammenhang mit der Schlachtung oder Tötung (Tierschutz-Schlachtverordnung – TierSchlV). In: Almuth Hirt, Christoph Maisack, Johanna Moritz: Tierschutzgesetz. 2. Auflage. Verlag Franz Vahlen, München 2007, ISBN 978-3-8006-3230-5, S. 757–804 (juristischer Fachkommentar), hier S. 778–779 (Schweine), S. 782 (Puten), S. 793–796 (Eintagsküken), S. 784–785 (Fische).
- Tierärztliche Vereinigung für Tierschutz (Hrsg.): Empfehlungen zum Töten von Kleinsäugern zu Futterzwecken, Stellungnahme vom 19. April 2011, Bramsche. Abgerufen am 22. Dezember 2013.
- Almuth Hirt, Christoph Maisack, Johanna Moritz: Tierschutzgesetz. 2. Auflage. Verlag Franz Vahlen, München 2007, ISBN 978-3-8006-3230-5 (juristischer Fachkommentar), S. 217–218.
- Almuth Hirt, Christoph Maisack, Johanna Moritz: Verordnung zum Schutz von Tieren im Zusammenhang mit der Schlachtung oder Tötung (Tierschutz-Schlachtverordnung – TierSchlV). In: Almuth Hirt, Christoph Maisack, Johanna Moritz: Tierschutzgesetz. 2. Auflage. Verlag Franz Vahlen, München 2007, ISBN 978-3-8006-3230-5, S. 757–804 (juristischer Fachkommentar), hier S. 787–789.
- Tierärztliche Vereinigung für Tierschutz (Hrsg.): Töten größerer Tiergruppen im Seuchenfall (Schwein, Rind, Schaf, Geflügel). Merkblatt Nr. 84. Eigenverlag, Bramsche 2011. Abgerufen am 22. Dezember 2013.
- T. Frieling: Diagnostik bei anorektalen Erkrankungen. In: Praxis 96.7, 2007, S. 243–247.
- S. C. Wong: Elevated atmospheric partial pressure of CO2 and plant growth. In: Oecologia. 44, 1979, S. 68–74, doi:10.1007/BF00346400.
- Pflanzenpflege in Aquarien. In: Mongabay.com. Abgerufen am 22. Dezember 2013.
- Y. T. Qiu, J. Spitzen, R. S. Smallegange, B. G. J. Knols: Monitor systems for adult insect pests and disease vectors. In: W. Takken, B.G.J. Knols (Hrsg.): Ecology and control of vector-borne diseases, volume 1: Emerging pests and vector-borne diseases in Europe. Wageningen Academic Publishers, ISBN 978-90-8686-053-1, S. 329–353.
- Eckhard Bast: Mikrobiologische Methoden: Eine Einführung in grundlegende Arbeitstechniken. 2. Auflage. Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin 2001, ISBN 978-3-8274-1072-6, S. 55, 132–135.
- UBA, Bekanntmachung des Umweltbundesamtes: Gesundheitliche Bewertung von Kohlendioxid in der Innenraumluft. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz Band 51, 2008, S. 1358–1369.
- Sicherheitsdatenblatt – Kohlendioxid (tiefkalt verflüssigt). (PDF) (Nicht mehr online verfügbar.) In: Tyczka Kohlensäure. Archiviert vom Original am 2. Dezember 2013; abgerufen am 21. Dezember 2013.
- Rising carbon dioxide levels will make us stupider. In: Nature. 580, Nr. 7805, 20. April 2020, S. 567. bibcode:2020Natur.580Q.567.. doi:10.1038/d41586-020-01134-w. PMID 32317783.
- Kristopher B. Karnauskas, Shelly L. Miller, Anna C. Schapiro: Fossil Fuel Combustion Is Driving Indoor CO2 Toward Levels Harmful to Human Cognition. In: GeoHealth. 4, Nr. 5, 2020, S. e2019GH000237. doi:10.1029/2019GH000237. PMID 32426622. PMC 7229519 (freier Volltext).
- Rauchvergiftungen/Vergiftungen durch Gase. (Nicht mehr online verfügbar.) In: Techniker Krankenkasse. Archiviert vom Original am 4. Juni 2010; abgerufen am 21. Dezember 2013.
- Erste Hilfe bei Vergiftung durch Kohlendioxid. In: Deutsches Rotes Kreuz. Abgerufen am 4. Juni 2018.
- Carbon Dioxide – Life and Death. (PDF) (Nicht mehr online verfügbar.) In: Sensair. Archiviert vom Original am 22. Mai 2013; abgerufen am 21. Dezember 2013.
- Bodo Gorgaß, Friedrich W. Ahnefeld, Rolando Rossi: Rettungsassistent und Rettungssanitäter. Springer Verlag, 1997, ISBN 3-540-21487-9, S. 305–314.
- Ester Majo: I fenomeni vulcanici della grotta del Cane (Campi Flegrei) in rapporto alle variazioni atmosferiche. In: Bulletin Volcanologique. 4, 1927, S. 84–92, doi:10.1007/BF02719519.
- David W. Christianson, Carol A. Fierke: Carbonic anhydrase: Evolution of the zinc binding site by nature and by design. In: Accounts of Chemical Research 29.7, 1996, S. 331–339, doi:10.1021/ar9501232.
- Peter Karlson: Karlsons Biochemie und Pathobiochemie. Thieme-Verlag, Stuttgart 2005, ISBN 3-13-357815-4, S. 38 (Auszug in der Google-Buchsuche).
- M. Schwarz: Carbon toxicity in plants. In: International Symposium on Growing Media and Hydroponics, 1997, S. 481 (Abstract).
- Chunwu Zhu, Kazuhiko Kobayashi, Irakli Loladze, Jianguo Zhu, Qian Jiang, Xi Xu, Gang Liu, Saman Seneweera, Kristie L. Ebi, Adam Drewnowski, Naomi K. Fukagawa und Lewis H. Ziska: Carbon dioxide (CO2) levels this century will alter the protein, micronutrients, and vitamin content of rice grains with potential health consequences for the poorest rice-dependent countries. In: Science Advances, 2018, doi:10.1126/sciadv.aaq1012.
- Spektrum der Wissenschaft Verlagsgesellschaft mbH: Photosynthese
- Heinz-Gerhard Franck, Jürgen W. Stadelhofer: Sauerstoff und Kohlendioxid ? Schlüsselverbindungen des Lebens. In: Die Naturwissenschaften. Band 75, 1988, S. 585–590, doi:10.1007/BF00366470.
- Kohlenstoffkreislauf. In: Spektrum Akademischer Verlag, Heidelberg: Lexikon der Biologie. 1999, abgerufen am 16. März 2017.
- Ulrich Helmich: Atmung, Dissimilation
- Christian Schwägerl: Forscher fordern Säure-Limit für Ozeane. In: Der Spiegel. 14. Dezember 2009, abgerufen am 21. Dezember 2013.
- Kurt Bauer: Zur Bedeutung der Kohlensäure in Karpfenteichen. In: Österreichs Fischerei, Band 44, 1991, S. 49–64.
- W. Elbert, B. Weber, S. Burrows u. a.: Contribution of cryptogamic covers to the global cycles of carbon and nitrogen. In: Nature Geoscience. Band 5, Nr. 7, 3. Juni 2012, S. 459–462, doi:10.1038/ngeo1486.
- Sabine Wendler: Unscheinbar und doch gewaltig: Flechten, Algen und Moose sind Großspeicher für Stickstoff und CO2. Senckenberg Forschungsinstitut und Naturmuseen, Pressemitteilung vom 4. Juni 2012 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.
- Eberhard Fritz: Klimaerwärmung kann sich über Freisetzung von CO2 aus Waldböden selbst verstärken. Max-Planck-Institut für Biogeochemie, Pressemitteilung vom 11. Juni 2012 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.
- Tapio Schneider, Colleen M. Kaul, Kyle G. Pressel: Possible climate transitions from breakup of stratocumulus decks under greenhouse warming. In: Nature Geoscience. 12, 2019, S. 163, doi:10.1038/s41561-019-0310-1.
- Patentanmeldung EP1929938A1: Vorrichtung zur Messung des Partialdrucks von Kohlendioxid. Angemeldet am 4. Dezember 2006, veröffentlicht am 11. Juni 2008, Anmelder: Sentec AG, Erfinder: Adrianus Kleinleugenmors.
- Arthur Adel, David Dennison: The Infrared Spectrum of Carbon Dioxide. Part I. In: Physical Review. 43, 1933, S. 716–723, doi:10.1103/PhysRev.43.716.