Methionin
Methionin ist eine schwefelhaltige α-Aminosäure, in der natürlich vorkommenden L-Form (abgekürzt Met oder M) eine essentielle proteinogene Aminosäure.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
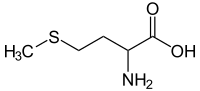 | ||||||||||||||||||||||
| Strukturformel ohne Angaben zur Stereoisomerie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Methionin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C5H11NO2S | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 149,21 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,34 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
mäßig in Wasser: 48 g·l−1 (20 °C)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Stereoisomerie
Methionin ist chiral, da es ein Stereozentrum enthält. Es gibt somit zwei Enantiomere, die (S)-Form [(−)-L-Methionin] und die (R)-Form [(+)-D-Methionin]. Dem D-Methionin kommt praktisch keinerlei Bedeutung zu, wenn Methionin ohne Deskriptor erwähnt wird, ist immer L-Methionin gemeint.
| Isomere von Methionin | ||
| Name | L-Methionin | D-Methionin |
| Andere Namen | (S)-Methionin (−)-Methionin |
(R)-Methionin (+)-Methionin |
| Strukturformel | 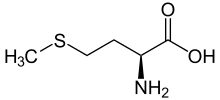 |
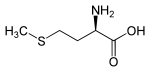 |
| CAS-Nummer | 63-68-3 | 348-67-4 |
| 59-51-8 (DL) | ||
| EG-Nummer | 200-562-9 | 206-483-6 |
| 200-432-1 (DL) | ||
| ECHA-Infocard | 100.000.512 | 100.005.894 |
| 100.000.393 (DL) | ||
| PubChem | 6137 | 84815 |
| 876 (DL) | ||
| FL-Nummer | 17.027 | - |
| 17.014 (DL) | ||
| Wikidata | Q22124685 | Q27093862 |
| Q180341 (DL) | ||
Geschichte
Der amerikanische Bakteriologe und Immunologe John Howard Mueller musste 1922 feststellen, dass der Zusatz einer Mischung der bis dahin bekannten Aminosäuren zu Kolonien von Streptokokken (Streptococcus hemolyticus) nicht für deren Wachstum ausreichte.[7] Dies gelang hingegen unter Zusatz von Casein. Daher nahm Mueller an, dass Casein noch mindestens eine weitere Aminosäure enthalten müsse. Bei der sich anschließenden Untersuchung von Casein konnte Mueller dann erstmals Methionin isolieren.[8] Mueller gab auch die korrekte Summenformel an.[9] Die Aufklärung der Strukturformel und die Synthese gelangen 1926 George Barger und seinem Assistenten Frederick Philip Coine,[10] 1931 veröffentlichte Barger in Zusammenarbeit mit Weichselbaum eine verbesserte Synthese.[11] Der Name Methionin, als Abkürzung für "γ-Methylthiol-α-amino-butyric acid", stammt von S. Odake (1925).[12]
Ein Syntheseverfahren im industriellen Maßstab für racemisches Methionin aus Acrolein, Methylmercaptan und Blausäure wurde ab 1946 von Werner Schwarze, Hans Wagner und Hermann Schulz bei der Degussa AG in den nach Konstanz ausgelagerten Forschungslaboratorien entwickelt. Mit der Synthese der Aminosäure wollte man einen Beitrag zum nach dem Zweiten Weltkrieg besonders bei Kriegsheimkehrern vorhandenen Eiweißmangel leisten (Hungerödeme). Die Ausgangsstoffe Blausäure und Acrolein wurden bei der Degussa produziert, und der Aufbau einer Versuchsanlage mit einer Produktion von 30 Tonnen pro Jahr dauerte nur ein Jahr. Das zur Degussa gehörige Chemiewerk Homburg brachte bald darauf das Methionin-haltige Medikament Thiomedon auf den Markt,[13] und ab 1953 folgte die Anwendung als Futterzusatzmittel in der Landwirtschaft (Legehennen).
Vorkommen
Methionin kommt in den Proteinen aller Lebewesen vor. Da der menschliche Organismus diese Aminosäure nicht selbst herstellen kann, ist er auf die Zufuhr mit der Nahrung angewiesen. Die folgenden Beispiele für den Gehalt an Methionin beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil am Gesamtprotein angegeben:[14]
| Lebensmittel | Protein | Methionin | Anteil |
|---|---|---|---|
| Rindfleisch, roh | 21,26 g | 554 mg | 2,6 % |
| Hähnchenbrustfilet, roh | 21,23 g | 552 mg | 2,6 % |
| Lachs, roh | 20,42 g | 626 mg | 3,1 % |
| Hühnerei | 12,57 g | 380 mg | 3,0 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 82 mg | 2,5 % |
| Sesamkörner | 17,73 g | 586 mg | 3,3 % |
| Paranüsse | 14,32 g | 1008 mg | 7,0 % |
| Walnüsse | 15,23 g | 236 mg | 1,5 % |
| Weizen-Vollkornmehl | 13,70 g | 212 mg | 1,5 % |
| Mais-Vollkornmehl | 6,93 g | 145 mg | 2,1 % |
| Reis, ungeschält | 7,94 g | 179 mg | 2,3 % |
| Buchweizen-Mehl | 12,62 g | 164 mg | 1,3 % |
| Sojabohnen, getrocknet | 36,49 g | 547 mg | 1,5 % |
| Erbsen, getrocknet | 24,55 g | 251 mg | 1,0 % |
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes L-Methionin als Proteinbestandteil, jedoch kein freies L-Methionin.
Eigenschaften
Neben Cystein ist Methionin die einzige schwefelhaltige proteinogene Aminosäure. Durch die Thioethergruppe ist es weniger reaktiv als Cystein, dessen Schwefelatom Teil einer Thiolgruppe (Mercaptogruppe) ist. Methionin liegt überwiegend als inneres Salz bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das freie Elektronenpaar des Stickstoffatoms der Aminogruppe wandert:
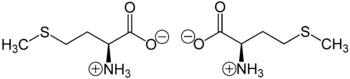
Im elektrischen Feld wandert Methionin am isoelektrischen Punkt, der bei pH 5,74 liegt, nicht, da es dann als Ganzes ungeladen ist. Bei diesem pH-Wert hat Methionin auch seine geringste Löslichkeit in Wasser.
Methionin ist im Stoffwechsel ein Lieferant von Methylgruppen (–CH3) z. B. für die Biosynthese von Cholin, Kreatin, Adrenalin, Carnitin, Nukleinsäuren, Histidin, Taurin und Glutathion (Transmethylierung). Die stoffwechselaktive Form von Methionin ist S-Adenosylmethionin.
- Van-der-Waals-Volumen: 124
- Hydrophobizitätsgrad: 1,9
Bedarf
Im Organismus dient Methionin unter anderem zur Herstellung der nichtessentiellen, ebenfalls schwefelhaltigen proteinogenen Aminosäure Cystein. Bei Abwesenheit von Cystein in der Nahrung liegt der mittlere Methionin-Bedarf von gesunden Erwachsenen bei täglich ungefähr 13 bis 16 mg pro Kilogramm Körpermasse. Die Tagesmenge, die für nahezu jeden gesunden Erwachsenen ausreicht (RDA), wird mit 21 mg pro Kilogramm Körpermasse abgeschätzt. Manchmal wird dieser Betrag auch als der Gesamtbedarf an schwefelhaltigen Aminosäuren bezeichnet. (Korrekterweise muss dann aber als Maßeinheit nicht Gramm, sondern Mol gewählt werden, da sich die Molare Masse von Methionin und Cystein merklich unterscheiden.) In welchem Umfang Cystein Methionin ersetzen kann, ist beim Menschen noch nicht ausreichend geklärt und scheint versuchsabhängig zu sein. Die Angaben für den mittleren Bedarf an Methionin, wenn die Nahrung einen Überschuss an Cystein enthält, schwanken für gesunde Erwachsene zwischen 5 und 13 mg pro Kilogramm Körpermasse.[15][16]
Biochemie
Biosynthese
In Bakterien, Pflanzen und Hefen entsteht aus Cystein über Cystathionin (via Cystathionin-β-Lyase) das Homocystein, aus dem Methionin erzeugt wird. Methionin kann vom Menschen und vielen Tieren nicht synthetisiert werden, sondern muss mit der Nahrung aufgenommen werden.
Funktionen, Rückgewinnung
Im Rahmen der Translation wird die Proteinbiosynthese mit Methionin gestartet. Die Initiator-tRNA ist bei Archaeen und Eukaryoten eine mit Methionin beladene tRNAiMet, bei Bakterien eine tRNAifMet, die N-Formyl-Methionin (fMet) überträgt. Gewöhnlich binden diese tRNAs über ihr Anticodon an das Startcodon AUG. Die erste Aminosäure am N-Terminus der entstehenden Polypeptidkette ist in allen lebenden Zellen damit das (formylierte) Methionin. Doch wird bei dem entstandenen Protein später das erste Methionin häufig abgetrennt oder modifiziert, z. B. durch Acetylierung der Aminogruppe.
Nicht für die Proteinbiosynthese benötigtes Methionin kann durch Verknüpfung mit ATP zu S-Adenosylmethionin (SAM) umgesetzt werden, einem wichtigen Methylgruppen-Donor in den meisten Organismen. Nach Abgabe der Methylgruppe entsteht S-Adenosylhomocystein (SAH), das zu Homocystein umgewandelt wird. Hieraus kann Methionin wieder zurückgewonnen werden.
SAM und damit auch Methionin ist weiterhin Ausgangsmaterial für die Synthese der Polyamine, aus dem dabei entstehenden Nebenprodukt Methylthioadenosin kann Methionin zurückgewonnen werden – der sogenannte Methionin-Salvage-Stoffwechselweg.[17]
Abbau überschüssigen Methionins
Methionin wird nur dann unwiderruflich abgebaut, wenn ein Überschuss besteht. In diesem Fall können zwei mögliche Stoffwechselwege aktiviert werden:
- Umbau zu Cystein über SAM und Homocystein – der Abbau überschüssigen Cysteins zu Sulfat und Taurin ist gut untersucht;
- Abbau auch über Transaminierung – dabei kehrt sich das Gleichgewicht in der letzten Reaktion des Methionin-Salvage-Wegs um und aus Methionin entsteht 5′-Methylthio-3-ketobutanoat (MOB), das mithilfe der Enzymkomplexe Verzweigte-Ketosäuren-Dehydrogenase und Kurzketten-Acyl-CoA-Dehydrogenase zu Methylthiopropionyl-CoA weiterverarbeitet wird, woraus Methanthiol entsteht, das teilweise als CO2 und Sulfat ausgeschieden, teilweise in der Leber im THF-Zyklus verwendet wird.[17]
Dieses Sicherheitsventil bei Schwefelüberschuss kann natürlich nur bis zu einer gewissen Grenze ohne Nebenwirkungen funktionieren. Ältere Studien zeigten Azidose bei frisch entwöhnten Ratten (600 mg Methionin/Tag); hepatisches Koma bei Hunden, bei denen gleichzeitig erhöhte Ammoniumwerte vorlagen; und sogar Tod bei Schafen, die große Mengen des Racemats in ihren Kaumagen erhielten (24 g/Tag).[18][19][20]
Aufgrund der Vermutung, ein erhöhter Spiegel von SAM könnte eine erhöhte Rate der DNA-Methylierung verursachen, untersuchten Amaral und andere, ob Ratten bei erhöhter Methioninzufuhr (2 % in der Diät über sechs Wochen) eine weniger stabile DNA oder eine Methylierung des p53-Gens aufwiesen, fanden jedoch keinen dieser Effekte. Auf der anderen Seite füllte die Diät einen erniedrigten Level an Glutathion in den Nieren wieder auf, der zuvor künstlich verursacht worden war. Dies zeigt, dass überschüssiges Methionin zunächst dem Cysteinpool zugutekommt, bevor Sulfat ausgeschieden wird.[21]
Chemische Synthese
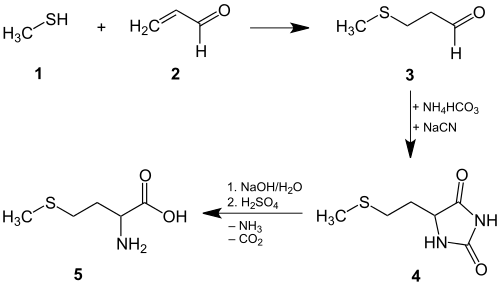
Die industrielle Synthese von racemischem Methionin (Gemisch aus je 50 % L-Methionin und D-Methionin) geht von petrochemischen Rohstoffen aus, insbesondere Propen, Schwefel, Methan und Ammoniak. Nach gängigen Verfahren werden so die Zwischenprodukte Methylmercaptan 1, Acrolein 2 und Blausäure dargestellt. Die Michael-Addition von Methylmercaptan 1 an die Kohlenstoff-Kohlenstoff-Doppelbindung des Acroleins 2 liefert dann das Zwischenprodukt 3-Methylmercaptopropionaldehyd 3.[22] Anschließend wird dieser Aldehyd 3 mit Ammoniak, Kohlendioxid und Blausäure (oder Hirschhornsalz und Natriumcyanid) in ein Hydantoin-Derivat 4 umgewandelt, dessen basische Hydrolyse zu einem Alkalisalz des Methionins führt. Durch Neutralisation mit einer Säure (Kohlendioxid oder Schwefelsäure) erhält man racemisches Methionin 5:[23][24]
Zur Racematspaltung wird racemisches Methionin am Stickstoffatom acetyliert. Das racemische N-Acetyl-methionin [1:1-Gemisch aus (S)-6 und (R)-6] wird mit dem enantioselektiven Enzym L-Acylase behandelt, dabei wird das natürliche L-Methionin [(S)-5] unter Abspaltung von Essigsäure/Acetat gebildet, während die D-Form des N-Acetyl-methionins [(R)-6] unverändert bleibt:[23]
-METHIONINE_Resolution_V1.svg.png.webp)
Anschließend wird L-Methionin abgetrennt. Das D-N-Acetyl-methionin [(R)-6] wird mit Essigsäureanhydrid racemisiert und recycliert.
Medizinische Verwendung
Bei der Verstoffwechselung von überschüssigem Methionin wird der in der Substanz enthaltene Schwefel zu Schwefelsäure oxidiert und über die Nieren ausgeschieden, wodurch der Harn angesäuert wird. Der Mechanismus der Harnansäuerung kann bei einigen Erkrankungen die Heilung unterstützen. Therapeutisch wird L-Methionin verwendet zur:
- Optimierung der Wirkung von Antibiotika mit Wirkungsoptimum im sauren Urin (pH 4–6): z. B. Ampicillin, Carbenicillin, Nalidixinsäure, Nitrofurane
- Vermeidung der Neubildung von Nierensteinen (bei Phosphatsteinen wie Struvit, Carbonatapatit, Brushit)
- Hemmung des Bakterienwachstums bei einer Blasenentzündung
- Bestandteil von Infusionslösungen zur parenteralen Ernährung.[25]
In der Diagnostik wird es in Form von 11C-S-Methyl-L-Methionin als Radiopharmakon zur Darstellung von Hirntumoren bei der Positronen-Emissions-Tomographie benutzt.
Anwendung in der Tierernährung
DL-Methionin (also das Racemat) wird zur Supplementierung (Ergänzung) von Futtermitteln eingesetzt. Dabei wird der Nährwert von Futtermitteln für Hühner durch geringe Zusätze von DL-Methionin gesteigert. Dies ist dann von besonderem wirtschaftlichen Nutzen, wenn die natürlichen Futtermittel-Bestandteile einen mangelhaften Gehalt an schwefelhaltigen Aminosäuren (Cystein/Cystin und Methionin) besitzen. Die mit weitem Abstand größten Mengen des synthetisch gewonnenen Methionins (> 400.000 t pro Jahr) werden für diesen Zweck eingesetzt.[26] Größter Hersteller ist Evonik (früher Degussa) mit einer Kapazität von 580.000 t pro Jahr.
Anwendung in der Chemie
Durch Erhitzen von Methionin mit wässriger Iodwasserstoffsäure wird die Methylgruppe des Methionins abgespalten. Beim Eindampfen entsteht unter Wasserabspaltung als Cyclisierungsprodukt das Hydroiodid von Homocystein-Thiolacton.[27]
Handelsnamen
Acimethin (D), Acimol (D), sowie verschiedene Generika
Weblinks
Einzelnachweise
- Eintrag zu METHIONINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Methionin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- F. A. Carey: Organic Chemistry. 5. Auflage. The McGraw Companies, 2001, S. 1059, Link
- Bernd Hoppe, Jürgen Martens: Aminosäuren – Herstellung und Gewinnung. In: Chemie in unserer Zeit. (1984), Bd. 18, S. 73–86; doi:10.1002/ciuz.19840180302.
- Datenblatt Methionin (PDF) bei Merck, abgerufen am 26. Dezember 2019.
- Eintrag zu Methionine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- S. Hansen: Die Entdeckung der proteinogenen Aminosäuren von 1805 in Paris bis 1935 in Illinois. (Memento vom 15. Juni 2016 im Internet Archive) Berlin 2015.
- J. H. Mueller: A new sulphur-containing amino acid isolated from casein. In: Proc Soc Exp Biol Med. Band 19, 1922, S. 161ff.
- A. M. Pappenheimer: John Howard Mueller. In: Biographical Memoirs National Academy. Band 57, 1987, S. 309.
- G. Barger, F. P. Coine: The amino-acid methionine; constitution and synthesis. In: Biochem J. Band 22, 1928, S. 1417ff.
- G. Barger, T. E. Weichselbaum: A new synthesis of methionine. In: Biochem. J. Band 25, 1931, S. 997.
- S. Odake: Über das Vorkommen einer Schwefelhaltigen Aminosäure im alkoholischen Extrakt der Hefe. In: Biochem. Z. Band 161, 1925, S. 446–455.
- Methionin- eine Erfolgsgeschichte, Evonik Industries.
- Nährstoffdatenbank des US-Landwirtschaftsministeriums, 22. Ausgabe.
- N. K. Fukagawa: Sparing of methionine requirements: evaluation of human data takes sulfur amino acids beyond protein. In: J. Nutr. Band 136, 6 Suppl, Juni 2006, S. 1676S–1681S. PMID 16702339.
- R. O. Ball, G. Courtney-Martin, P. B. Pencharz: The in vivo sparing of methionine by cysteine in sulfur amino acid requirements in animal models and adult humans. In: J. Nutr. Band 136, 6 Suppl, Juni 2006, S. 1682S–1693S. PMID 16702340.
- J. I. Toohey: Vitamin B12 and methionine synthesis: a critical review. Is nature's most beautiful cofactor misunderstood? In: Biofactors. Band 26, Nr. 1, 2006, S. 45–57, PMID 16614482.
- S. Wamberg, K. Engel, P. Kildeberg: Methionine-induced acidosis in the weanling rat. In: Acta Physiol Scand. Band 129, Nr. 4, April 1987, S. 575–583, PMID 3591380.
- G. E. Merino, T. Jetzer, W. M. Doizaki, J. S. Najarian: Methionine-induced hepatic coma in dogs. In: The American Journal of Surgery. Band 130, Nr. 1, Juli 1975, S. 41–46, PMID 1155716.
- P. T. Doyle, N. R. Adams: Toxic effects of large amounts of DL-methionine infused into the rumen of sheep. In: Aust. Vet. J. Band 56, Nr. 7, Juli 1980, S. 331–334, PMID 7436940.
- C. L. Amaral, R. d. Bueno u. a.: The effects of dietary supplementation of methionine on genomic stability and p53 gene promoter methylation in rats. In: Mutation Research. Band 722, Nummer 1, Mai 2011, S. 78–83, doi:10.1016/j.mrgentox.2011.03.006. PMID 21447402.
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine. Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2, S. 53.
- Bernd Hoppe, Jürgen Martens: Aminosäuren – Herstellung und Gewinnung. In: Chemie in unserer Zeit. 18. Jahrg., Nr. 3, 1984, S. 73–86, doi:10.1002/ciuz.19840180302.
- Hans Beyer, Wolfgang Walter: Organische Chemie. S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2, S. 828.
- S. Ebel, H. J. Roth (Hrsg.): Lexikon der Pharmazie. Georg Thieme Verlag, 1987, ISBN 3-13-672201-9, S. 430.
- Synthetic methionine saves resources.
- H. S. Baernstein: A modification of the method for determining methionine in proteins. In: Journal of Biological Chemistry. Band 106, Nr. 2, 1934, S. 451.