Elektronenkonfiguration
Die Elektronenkonfiguration gibt im Rahmen des Schalenmodells der Atomhülle die Verteilung der Elektronen auf verschiedene Energiezustände und damit Aufenthaltsräume (Atomorbitale) an.
Quantenzahlen und Schalen
Der Zustand jedes Elektrons der Hülle wird nach dem Bohr-Sommerfeldschen Atommodell sowie dem Orbitalmodell durch vier Quantenzahlen bestimmt:
| Quantenzahl | Zeichen | Wertebereich | Bezeichnung | Beispiele |
|---|---|---|---|---|
| Hauptquantenzahl | 1, 2, 3, … | K, L, M, … | 3 | |
| Nebenquantenzahl | 0, … , n−1 | s, p, d, f, … | 0, 1, 2 | |
| magnetische Drehimpulsquantenzahl |
, … , | s, px,y,z, dyz,xz,xy,z²,x²-y², … |
−2, −1, ±0, +1, +2 | |
| magnetische Spinquantenzahl |
−½, +½ | ↓, ↑ | −½, +½ |
Gemäß dem Pauli-Prinzip darf der Zustand keiner zwei Elektronen eines Atoms in allen vier Quantenzahlen übereinstimmen. Mit diesem Prinzip lässt sich zeigen, dass sich die Elektronen auf die verschiedenen erlaubten Zustände und damit auf die Schalen und Unterschalen verteilen.
Die Hauptquantenzahlen legen die Schalen fest, die Nebenquantenzahlen die Unterschalen. Jede Schale kann gemäß den Beschränkungen von , und mit maximal 2n² Elektronen besetzt werden. Die Schalen werden aufsteigend, beginnend bei der Kernschale, mit Großbuchstaben bezeichnet: K, L, M, N, O, P, Q... Die Orbitale werden entsprechend den Serien von Spektrallinien benannt, die ein angeregtes Elektron aussendet, wenn es in sein ursprüngliches Orbital zurückfällt; die ersten vier Serien heißen aus historischen Gründen s („sharp“), p („principal“), d („diffuse“) und f („fundamental“).
Die äußerste besetzte Schale (Valenzschale) bestimmt das chemische Verhalten und ist daher maßgeblich für die Einordnung ins Periodensystem.
Auffüllen der Schalen nach dem Aufbauprinzip

Mit steigender Elektronenzahl der Elemente werden die möglichen Zustände – bei den niedrigen Energien beginnend – besetzt. Gemäß der Hundschen Regel werden dabei die Orbitale gleicher Energie zuerst einfach, dann doppelt belegt.
Die Unterschalen werden in folgender Reihenfolge besetzt (zeilenweise, d. h. periodenweise geordnet):
- 1. Periode: 1s
- 2. Periode: 2s 2p
- 3. Periode: 3s 3p
- 4. Periode: 4s 3d 4p
- 5. Periode: 5s 4d 5p
- 6. Periode: 6s 4f 5d 6p
- 7. Periode: 7s 5f 6d …
Zusammenhang mit dem Periodensystem
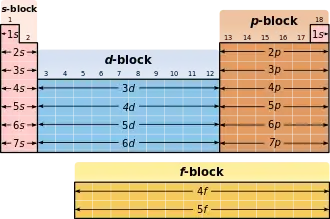
Im Periodensystem entspricht die Besetzung des s-Orbitals einer neuen Schale dem Sprung in eine neue Periode.
| Orbital /Block |
Anzahl Elektronen |
umfasst Elemente der … |
|---|---|---|
| s | 2 | Elemente der 1. und 2. Hauptgruppe sowie Helium |
| p | 6 | übrige Hauptgruppenelemente |
| d | 10 | alle Nebengruppenelemente |
| f | 14 | alle Lanthanoide und Actinoide |
Notation
| 2p |
| ||||
|---|---|---|---|---|---|
| L | 2s |
| |||
| K | 1s |
| |||
| 1s2 2s2 2p4 [He] 2s2 2p4 | |||||
Die Elektronenkonfiguration eines Atoms wird durch die besetzten Unterschalen beschrieben:
- Der Nummer der Schale folgt der Buchstabe für die Unterschale und hochgestellt die Anzahl der Elektronen in der Unterschale. So ergibt sich z. B. für die mit 5 Elektronen besetzte 2. Unterschale (l = 1 bzw. p) der 3. Schale (n = 3 bzw. M) die Schreibweise 3p5.
- Bei mehreren Unterschalen wird die gemeinsame Schale weggelassen: Aus 2s2 2p3 wird 2s2 p3.
- Bei einer weiter verkürzten Schreibweise wird das Kürzel des Edelgases mit der nächstkleineren Ordnungszahl in eckige Klammern gesetzt und damit die fehlenden Unterschalen des darzustellenden Elements angegeben.
Beispiel Chlor: 1s2 2s2 2p6 3s2 3p5 →[Ne] 3s2 3p5.
Dabei sind die Unterschalen nicht nach dem Aufbauprinzip anzugeben, sondern in der Reihenfolge der Hauptquantenzahl; also z. B. für Europium: [Xe] 4f7 6s2.
Daneben ist noch die Zellen- oder auch Pauling-Schreibweise als anschauliche grafische Darstellung üblich.