Phototrophie
Phototrophie oder Fototrophie (von altgriechisch φῶς phos = das Licht + τροφή trophé = die Ernährung) bezeichnet die Nutzung von Licht als Energiequelle durch Lebewesen. Das Licht wird gebraucht, um den energiereichen chemischen Stoff Adenosintriphosphat (ATP) als Energieüberträger und kurzfristigen Energiespeicher zu synthetisieren. Mit dieser ATP-Synthese wandeln Lebewesen die Lichtenergie in chemische Energie.

Nur bestimmte Organismen können Lichtenergie für ihren Stoffwechsel direkt nutzen. Sie heißen phototrophe Organismen oder Phototrophe. Phototrophie ist sowohl unter Prokaryoten (Lebewesen mit Zellen ohne Zellkern) als auch unter Eukaryoten (Lebewesen mit Zellen mit Zellkern) verbreitet.
Die phototrophen Prokaryoten werden stoffwechselphysiologisch in zwei Gruppen gegliedert. Die erste Gruppe nutzt Lichtenergie mit Hilfe von Chlorophyll-Pigmenten (Chlorophylle oder Bacteriochlorophylle). Die zweite Gruppe beschränkt sich auf wenige Archaea. Sie nutzen Lichtenergie mit Hilfe der Rhodopsin-Pigmente Bacteriorhodopsin, Proteorhodopsin oder Xanthorhodopsin. Diese weisen keine strukturelle Ähnlichkeit mit Chlorophyll-Pigmenten auf. Die phototrophen Eukaryoten zeigen dagegen keine derartige stoffwechselphysiologische Vielfalt.
Phototrophie sollte nicht mit Phototropie (Farbänderung bei kristallinen Substanzen und Gläsern durch Lichteinwirkung) verwechselt werden.
Formen der Phototrophie
Um Phototrophie durchzuführen, benötigen Organismen ganz bestimmte Farbstoffe (Pigmente). Diese besonderen Pigmente sitzen in Biomembranen. Dort absorbieren sie Licht und machen die in ihm enthaltene Strahlungsenergie nutzbar. In phototrophen Organismen wurden bisher zwei verschiedene Klassen solcher Pigmente entdeckt: Chlorophylle (Chlorophylle, Bacteriochlorophylle) und Rhodopsine (Bacteriorhodopsin, Proteorhodopsin, Xanthorhodopsin).
Phototrophie mit Chlorophyllen: Lichtabhängige Reaktion der Photosynthese
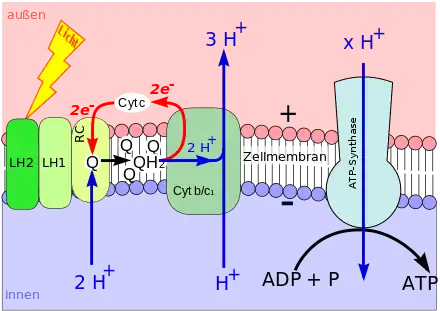
Bei der Photosynthese wird Chlorophyll (oder Bacteriochlorophyll) durch Lichtenergie aus seinem chemischen Grundzustand in einen energiereichen („angeregten“) Zustand versetzt. Im angeregten Zustand gibt ein Chlorophyll-Molekül leicht ein energiereiches Elektron ab.
Das Elektron wird über bestimmte weitere Moleküle fortgereicht (Elektronentransportkette), die ebenfalls in der Biomembran sitzen. Im Zuge des Elektronentransports werden Wasserstoffionen (Protonen, H+) von einer Seite der Biomembran auf die andere geschaufelt. Darum nimmt ihre Konzentration auf der einen Membranseite zu und gleichzeitig auf der anderen Seite ab. Auf diese Weise entsteht ein hohes H+-Konzentrationsgefälle zwischen beiden Membranseiten (Protonengradient).
Der Protonengradient wird genutzt, um ATP aufzubauen: In die Biomembran eingelassen ist die ATP-Synthase. Diese ist ein Enzym, das die Synthese von ATP aus Adenosindiphosphat (ADP) und Phosphat (Pi) katalysiert. Innerhalb der ATP-Synthase verläuft ein Kanal, der beide Membranseiten verbindet. Durch den Kanal strömen Protonen entlang ihres Konzentrationsgefälles (→ Diffusion). Die kinetische Energie der hindurchströmenden Wasserstoffkerne wird von der ATP-Synthase zur ATP-Synthese verwendet, also in chemische Energie gewandelt (→ Chemiosmose).
Lichtenergie wird genutzt, um einen Protonengradienten aufzubauen. Der Protonengradient wird genutzt, um ATP zu synthetisieren. Dieser phototrophe Vorgang gehört zur sogenannten lichtabhängigen Reaktion der Photosynthese.[1]
Die Anbindung von Pi an andere Stoffe wird Phosphorylierung genannt. Während der lichtabhängigen Reaktion wird ADP mit Hilfe von Licht zu ATP phosphoryliert. Demzufolge heißt der Vorgang Photophosphorylierung.
Es werden verschiedene Formen der Photosynthese unterschieden. Bei der oxygenen Photosynthese werden Wassermoleküle gespalten. Die Spaltung der Wassermoleküle (Photolyse) benötigt ebenfalls Licht und Chlorophyll. Aus den gespaltenen Wassermolekülen wird der Elektronennachschub für die Elektronentransportkette gewonnen. Außerdem wird Sauerstoff frei. Bei der anoxygenen Photosynthese werden für den Elektronennachschub andere organische oder anorganische Stoffe herangezogen und eben kein Wasser. Hierzu wird kein Licht benötigt und es wird kein Sauerstoff frei.[2]
| Elektronendon(at)or | Photosynthese-Form | Vorkommen |
|---|---|---|
| Eisen-II-Ionen (Fe2+) | anoxygene Photosynthese | Purpurbakterien[3] |
| Nitrit (NO2−) | anoxygene Photosynthese | Purpurbakterien[4] |
| elementarer Schwefel (S0) | anoxygene Photosynthese | Purpurbakterien[3] |
| Schwefelwasserstoff (H2S) | anoxygene Photosynthese | grüne Nichtschwefelbakterien,[5] grüne Schwefelbakterien,[3] Purpurbakterien[6] |
| Thiosulfat (S2O32−) | anoxygene Photosynthese | Purpurbakterien[3] |
| Wasser (H2O) | oxygene Photosynthese | Cyanobakterien,[7] phototrophe Eukaryoten[8] |
| Wasserstoff (H2) | anoxygene Photosynthese | grüne Nichtschwefelbakterien[5] |
Phototrophie mit Rhodopsinen

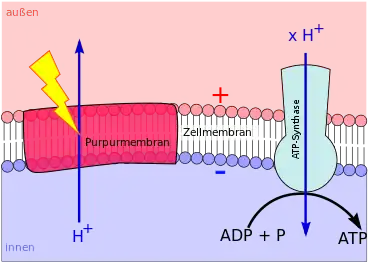
Die phototrophe ATP-Synthese (Photophosphorylierung) mit Hilfe von Bacteriorhodopsin, Proteorhodopsin oder Xanthorhodopsin verläuft ebenfalls chemiosmotisch. Ein Rhodopsin besteht aus einem Protein, das eine ganze Biomembran durchspannt (Transmembranprotein). In dem Eiweiß befindet sich ein Molekül namens Retinal.
Fällt Licht einer bestimmten Wellenlänge auf das Retinal, verändert das Molekül seine Gestalt. Dabei gibt es ein Proton an die Außenseite der Biomembran ab. Dem Retinal wird daraufhin von der Membraninnenseite ein neuer Wasserstoffkern zugeführt. Mit dem neuen Proton fällt das Molekül zurück in seine Ausgangsgestalt – bis es wieder von Licht getroffen wird, es seine Gestalt erneut ändert und ein weiteres Mal ein Proton an die Membranaußenseite abgibt. Auf diese Weise entsteht bei einer Rhodopsin-basierten Phototrophie ein hohes H+-Konzentrationsgefälle zwischen beiden Membranseiten (Protonengradient).
Der Protonengradient wird abgebaut, indem durch den Kanal einer ATP-Synthase Protonen entlang ihres Konzentrationsgefälles auf die Membraninnenseite zurück strömen. Die kinetische Energie der hindurch strömenden Wasserstoffkerne wird zur ATP-Synthese genutzt (→ Funktion des Bacteriorhodopsins).[9]
Phototrophe Organismen
Phototrophe Prokaryoten
Verschiedene Prokaryoten haben verschiedene Formen der Phototrophie evolviert. Einerseits entwickelte sich die ATP-Synthese mit Hilfe der Pigmente Bacteriorhodopsin, Proteorhodopsin oder Xanthorhodopsin.[10][11] Andererseits evolvierte unabhängig davon die Phototrophie mit Hilfe von Chlorophyll-Pigmenten, die Photosynthese.[12] Für viele der phototrophen Prokaryoten ist Phototrophie nicht die einzige Möglichkeit des Energiestoffwechsels. Gerade bei Dunkelheit können sie eventuell auf verschiedene Wege der chemotrophen Energiebereitstellung ausweichen.
| Prokaryoten | Stoff- und Energiewechsel | Phototrophie-Form |
|---|---|---|
| Cyanobakterien | Photolithoautotrophie (Photohydroautotrophie) | oxygene Photosynthese[7] |
| grüne Nichtschwefelbakterien | Photoorganoheterotrophie oder Photolithoautotrophie | anoxygene Photosynthese des Typs II[13] |
| grüne Schwefelbakterien | Photolithoautotrophie oder Photoorganoheterotrophie | anoxygene Photosynthese des Typs I[6], sogar an hydrothermalen Quellen der Tiefsee[14] |
| Haloarchaeen | Photoorganoheterotrophie | Phototrophie mit Bacteriorhodopsin[15] |
| Heliobakterien | Photoorganoheterotrophie | anoxygene Photosynthese des Typs I[16] |
| Nichtschwefelpurpurbakterien | Photolithoautotrophie oder Photoorganoheterotrophie | anoxygene Photosynthese des Typs II[17][18][19] |
| Thermoplasmaten | Photoorganoheterotrophie | Phototrophie mit Proteorhodopsin[20] |
| α-Proteobakterien | Photoorganoheterotrophie | anoxygene Photosynthese des Typs II[21][22] oder Phototrophie mit Proteorhodopsin[23] |
| Fulvimarina pelagi
(ein α-Proteobakterium) |
Photoorganoheterotrophie | anoxygene Photosynthese des Typs II und Phototrophie mit Xanthorhodopsin[24][25] |
| β-Proteobakterien | Photoorganoheterotrophie | anoxygene Photosynthese des Typs II[26] |
| γ-Proteobakterien | Photoorganoheterotrophie | anoxygene Photosynthese des Typs II[27] oder Phototrophie mit Proteorhodopsin[28] |
| Flavobakterien | Photoorganoheterotrophie | Phototrophie mit Proteorhodopsin[29][30] |
| Salinibacter ruber | Photoorganoheterotrophie | Phototrophie mit Xanthorhodopsin[31][32] |
| Schwefelpurpurbakterien | Photolithoautotrophie | anoxygene Photosynthese des Typs II[33] |
Phototrophe Eukaryoten
Eukaryoten waren ursprünglich nicht phototroph. Einige Eukaryoten erlangten jedoch die Fähigkeit zur Phototrophie, indem sie Lebensgemeinschaften zu gegenseitigem Nutzen (Mutualismen) mit phototrophen Organismen eingingen. Solche Mutualismen entstanden mehrfach, zu verschiedenen Zeiten und unabhängig voneinander. Plastiden stellen die am weitesten fortgeschrittene Form des phototrophen Mutualismus dar (→ Endosymbiontentheorie).[34]
Die meisten der phototrophen Eukaryoten betreiben eine Form der Photolithoautotrophie, die manchmal gesondert als Photohydroautotrophie benannt wird.[35] Das heißt, dass sie Kohlenhydrate ausschließlich mit Licht, Wasser und Kohlendioxid synthetisieren. Diese phototrophen Eukaryoten betreiben oxygene Photosynthese mit Hilfe ihrer mutualistischen Partner. Dabei stellt die Phototrophie für viele phototrophe Eukaryoten nicht die einzige Nährstoffquelle dar. Sie können sich darüber hinaus noch chemoorganoheterotroph ernähren, indem sie sich dadurch mit Nährstoffen versorgen, dass sie andere Organismen ganz oder teilweise fressen. Derlei sich sowohl autotroph als auch heterotroph ernährende Lebensformen betreiben Mixotrophie. Dass sehr viele früher als autotroph[36] oder als heterotroph[37] klassifizierte Organismen in Wirklichkeit mixotroph sind, wurde erst vor wenigen Jahren erkannt.
Algen und Landpflanzen
Die bekanntesten phototrophen Eukaryoten beherbergen in ihren Zellen phototrophe Plastiden, die Chloroplasten. Das Chloroplasten-Organell entstand ein einziges Mal und das vor ungefähr 1,6 Milliarden Jahren. Damals gelang es, ein Cyanobakterium dauerhaft innerhalb der eukaryotischen Zelle zu halten. Es entstanden sogenannte primäre Chloroplasten.[38] Die primären Chloroplasten der Rotalgen und der Glaukophyta, die also vermutlich homolog zu den anderen Chloroplasten sind, werden (vor allem aus historischen Gründen) als Rhodoplasten (bei den Rotalgen) und als Muroplasten (früher auch: Cyanellen) bei den Glaukophyten bezeichnet.
Später haben andere Eukaryoten solche Eukaryoten mitsamt ihren primären Chloroplasten (oder alternativ: Rhodoplasten) in sich aufgenommen. Die aufgenommenen Eukaryoten wurden allmählich reduziert, bis fast nur noch ihre primären Chloroplasten übrig waren. Auf diese Weise entstanden sekundäre, komplexe Chloroplasten.[39] Diese sind dann, anders als die primären Chloroplasten, von vier Zellmembranen anstelle von zweien umgeben. Dabei gehen die inneren beiden Membranen auf den Chloroplasten selbst, die dritte auf eine einschließende Vakuole und die vierte auf die ursprüngliche Zellmembran des eingeschlossenen Organismus, der die Chloroplasten enthielt, zurück. Vielfach sind keine weiteren Reste dieses Organismus morphologisch erkennbar, oft lassen sich aber noch, nachträglich ins Kerngenom des Wirts integrierte, Gene nachweisen, die von diesem stammen.
Besonders vielfältig verlief die Chloroplasten-Aufnahme bei den Dinophyceae oder Panzergeißlern. In dieser Gruppe wurden Chloroplasten offenbar mehrfach und unabhängig voneinander erlangt. Die meisten Panzergeißler haben sekundäre Chloroplasten von Rotalgen, doch andere besitzen solche, die von eingezogenen Grünalgen stammen.[40] Eine kleine Gruppe von Dinophyceae besitzt sogar tertiäre Chloroplasten. Sie stammen von aufgenommenen Kieselalgen[41][42], Schlundgeißlern[43] oder Kalkalgen[44][45][46][47][48][49], die selbst wiederum sekundäre Chloroplasten besaßen.
Wenn sich die phototrophen eukaryotischen Zellen teilen, vermehren sich parallel dazu in ihnen auch ihre Chloroplasten. Eukaryoten mit solchen Chloroplasten werden zusammengefasst unter der Bezeichnung Algen. Die meisten Algen zählen zu den Mikroalgen. Sie bleiben mikroskopisch klein, leben häufig als Einzeller oder bilden Zellkolonien oder Coenobien von sehr begrenzter Zellzahl. Wenige Algengruppen haben vielzellige Formen entwickelt. Solche Makroalgen finden sich ausschließlich unter den Rhodophyta (Rotalgen), den Phaeophyta (Braunalgen) und den Chloroplastida (Grünalgen u. ä.).[50]
Einer Gruppe von Algen gelang die dauerhafte Besiedlung des Landes, sie bilden heute die Landpflanzen (daneben kommen, oft einzellige, Mikroalgen als Kolonien oder Überzüge auch an Land vor). Sie gehörten zu den Streptophytina, die zu den Charophyta zählen, welche wiederum den Chloroplastida zugeordnet werden.[51] Die Chloroplasten aller Chloroplastida erscheinen grün. Die ältesten Fossilien grüner Landpflanzen besitzen ein Alter von 475 Millionen Jahren. Es handelt sich um Sporen von Gewächsen, die zu den Lebermoosen gezählt haben dürften.[52] Die heutigen Landpflanzen können gegliedert werden in Moose und in Tracheophyta (Gefäßpflanzen).
| eukaryotische Großgruppe | phototropher Mutualist |
|---|---|
| Chlorarachniophyta (Grüne Scheinfüßer) | komplexe Chloroplasten |
| Chloroplastida: Chlorophyta (Grünalgen), Embryophyta (Landpflanzen) u. a. | Chloroplasten |
| Chrysophyta (Goldalgen): Bacillariophyceae (Kieselalgen), Chrysophyceae (Goldbraune Algen), Xanthophyceae (Gelbgrüne Algen) | komplexe Rhodoplasten |
| Cryptophyta (Schlundgeißler) | komplexe Rhodoplasten |
| Dinophyta (Panzergeißler) | komplexe Rhodoplasten |
| Euglenophyta (Augengeißler) | komplexe Chloroplasten |
| Glaucophyta | Muroplasten (früher Cyanellen genannt) |
| Haptophyta (Kalkalgen) | komplexe Rhodoplasten |
| Phaeophyta (Braunalgen) | Phaeoplasten (komplexe Rhodoplasten) |
| Rhodophyta (Rotalgen) | Rhodoplasten |
Phototrophe Protisten ohne Chloroplasten
Neben den phototrophen Protisten mit Chloroplasten existieren viele weitere phototrophe Einzeller, die aber keine Chloroplasten besitzen. Diese Protisten erlangen die Fähigkeit zur Phototrophie auf andere Weise. Es geschieht häufig, indem sie andere phototrophe Einzeller – Cyanobakterien oder Zoochlorellen – in sich aufnehmen.
Neben der auf Chlorophyll beruhenden Photosynthese wurde primäre (nicht auf Endosymbionten zurückgehende) Energiegewinnung mittels des Rhodopsin-Pigments Proteorhodopsin durch DNA-Sequenzierung nicht nur bei zahlreichen autotrophen, sondern auch einer Vielzahl von heterotrophen Protisten nachgewiesen, die also eigentlich als Formen mit gemischter Ernährung (mixotroph) klassifiziert werden müssten, die ökologische Konsequenz davon ist bisher kaum verstanden.[37] Diese Fähigkeit ist, über Symbiogenese, auch auf autotrophe, und wenige heterotrophe, Eukaryoten übergegangen. Der (heterotrophe) Dinoflagellat Oxyrrhis marina besitzt sogar zahlreiche Rhodopsine aus zwei unterschiedlichen Familien: Neben den bei Eukaryoten weit verbreiteten sensorischen Rhodopsinen wurden auch Proteorhodopsine nachgewiesen, die mittels Sonnenlicht eine Protonenpumpe antreiben und so zur Energiegewinnung beitragen; es wurde experimentell nachgewiesen, dass die Art Hungerperioden bei Belichtung länger übersteht als in Dunkelheit.[54] Entsprechende Proteorhodopsine wurden bei anderen, autotrophen und heterotrophen Dinoflagellaten später ebenfalls nachgewiesen.[37]
| Protist | eukaryotische Großgruppe | besonderer phototropher Mutualist
oder andere Form der Phototrophie |
|---|---|---|
| Auranticordis quadriverberis | Cercozoa | Cyanobakterien[57] |
| Großforaminiferen | Foraminifera (Kammerlinge) | Zoochlorellen oder Zooxanthellen[58] |
| Hatena arenicola | Cryptophyta (Schlundgeißler) | Nephroselmis (eine Grünalgen)[59] |
| Oxyrrhis marina | Dinozoa | Phototrophie mit Proteorhodopsin[60] |
| Paramecium bursaria | Ciliophora (Wimpertierchen) | Zoochlorellen[61] |
| Paulinella chromatophora | Cercozoa | Cyanobakterien (Prochlorococcus oder Synechococcus)[62][63] |
| Stentor polymorphus | Ciliophora (Wimpertierchen) | Zoochlorellen[64] |
Phototrophe Opisthokonta
Nicht nur Algen, Landpflanzen und bestimmte Protisten betreiben Phototrophie. Auch unter den Opisthokonta – also unter Pilzen und Tieren – konnten einige Gruppen zur phototrophen Lebensweise übergehen. Die Phototrophie wurde auf sehr unterschiedlichen Wegen erreicht.
- Phototrophie mit Photobionten: Lichenes (Flechten) sind Mutualismen zwischen Pilzen und phototrophen Einzellern, die zusammenfassend Photobionten genannt werden. Viele Photobionten sind ein- oder wenigzellige Chlorophyta (Grünalgen). Die übrigen Photobionten stammen aus der Gruppe der Cyanobakterien.[65]
- Phototrophie mit Zoochlorellen: Verschiedene Tiere evolvierten Mutualismen zwischen sich und endosymbiontisch lebenden Grünalgen der Gattung Chlorella (Zoochlorellen).[66] Bekanntere Vertreter sind die grünen Süßwasserschwämme Ephydatia fluviatilis und Spongilla lacustris.[67] Zu den Cnidaria (Nesseltiere) gehört die grüne Hydra (Hydra viridissima),[68] die Chlorellen in Vakuolen im Inneren ihrer Zellen lagert.[69] Zu den Cnidaria gehören auch die grünen Riesenanemonen Anthopleura elegantissima und Anthopleura xanthogrammica. Die grünen Riesenanemonen können nicht nur Zoochlorellen, sondern auch Zooxanthellen beherbergen.[70]
 Grünalgen der Gattung Chlorella leben häufig als phototrophe Mutualisten innerhalb anderer Zellen.
Grünalgen der Gattung Chlorella leben häufig als phototrophe Mutualisten innerhalb anderer Zellen. - Phototrophie mit anderen Grünalgen: Neben den häufig vorkommenden Zoochlorellen gingen vereinzelt auch andere einzellige Chlorophyta (Grünalgen) phototrophe Mutualismen mit Tieren ein. Die Grünalge Tetraselmis convolutae lebt zwischen[69] den Zellen des grünen Acoelomorphen Symsagittifera roscoffensis.[71] Und Oophila amblystomatis lebt in Eiern und Embryonen von Ambystoma maculatum (Flecken-Querzahnmolch). Dieser Molch ist das einzige bekannte Beispiel für ein phototrophes Wirbeltier.[72][73]
- Phototrophie mit Zooxanthellen: Noch häufiger als Zoochlorellen werden Zooxanthellen als phototrophe Mutualisten von Tieren genutzt. Am weitesten verbreitet sind Zooxanthellen der Gattung Symbiodinium, die zu den Panzergeißlern gehören.[74] Viele Nesseltiere beherbergen Zooxanthellen, allen voran die verschiedenen Korallen. Zooxanthellen finden sich aber auch in vielen Seeanemonen, beispielsweise in der Wachsrose (Anemonia sulcata),[75] in der Sonnenrose (Cereus pedunculatus)[76] und – neben Zoochlorellen – in den grünen Riesenanemonen Anthopleura elegantissima und Anthopleura xanthogrammica.[70] Zooxanthellen kommen weiterhin in einigen Quallen vor. Zum Beispiel bei den Schirmquallen Mastigias papua[77] und Linuche unguiculata[78] und bei der Mangrovenqualle Cassiopea xamachana.[79] Außerhalb der Nesseltiere wurden bisher nur wenige Fälle für tierische Mutualismen mit Zooxanthellen gefunden. Zumindest aber kommen sie vor in der Acoelomorpha-Gattung Waminoa[80][81] und in Tridacnidae, den Riesenmuscheln.[82]
- Phototrophie mit Kleptoplastiden: Vertreter der Sacoglossa (Schlundsackschnecken) rauben Chloroplasten von Grünalgen. Sie betreiben Kleptoplastie.[83] Dazu fressen sie Zellen bestimmter Grünalgen. Im Darm werden die Chloroplasten aus den gefressenen Zellinhalten entfernt. Sie werden daraufhin durch den Schneckenkörper transportiert. Schließlich werden die Chloroplasten in Vakuolen in Hautzellen gelagert.[69] Diese Chloroplasten, die ursprünglich von den gefressenen Grünalgen geraubt worden waren, werden Klepto(chloro)plast(id)en genannt. Die bekanntesten phototrophen Vertreter der Schlundsackschnecken sind die grüne Samtschnecke (Elysia viridis)[84] und ihre nahe Verwandte Elysia chlorotica.[85][86]
- Phototrophie mit Xanthopterin: Die orientalische Hornisse (Vespa orientalis) scheint eine gänzlich neuartige Form der Nutzung von Sonnenlicht evolviert zu haben. Sie benutzt dazu den gelben Farbstoff Xanthopterin (in Verbindung mit dem braunen Farbstoff Melanin) in der Cuticula ihres Außenskeletts, um analog zu einer Solarzelle elektrischen Strom zu produzieren. Welchem biologischen Zweck die Struktur dient, ist bisher unbekannt, möglicherweise wird mit ihrer Hilfe chemische Energie gewonnen, die der Wespe beim Graben von unterirdischen Nesthohlräumen hilft.[87]
Siehe auch
Literatur
- Donat-Peter Häder (Hrsg.): Photosynthese. Stuttgart/ New York 1999, ISBN 3-13-115021-1.
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2.
- U. Sonnewald: Physiologie. In: Strasburger Lehrbuch der Botanik. Heidelberg 2008, ISBN 978-3-8274-1455-7.
- J. Overmann, F. Garcia-Pichel: The Phototrophic Way of Life. In: The Prokaryotes, Vol. 2: Ecophysiology and Biochemistry. New York 2006, ISBN 0-387-30742-7.
Einzelnachweise
- U. Sonnewald: Physiologie. In: Strasburger Lehrbuch der Botanik. Heidelberg 2008, ISBN 978-3-8274-1455-7, S. 274.
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 604–617.
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 613–614.
- B. M. Griffin, J. Schott, B. Schink: Nitrite, an electron donor for anoxygenic photosynthesis. In: Science. 316, 2007, S. 1870 doi:10.1126/science.1139478
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 621.
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 456.
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 444–447.
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 448–449.
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 478.
- A. K. Sharma, J. L. Spudich, W. F. Doolittle: Microbial rhodopsins: functional versatility and genetic mobility. In: Trends in Microbiology. 14, 2006, S. 463–469 doi:10.1016/j.tim.2006.09.006
- A. Martinez, A. S. Bradley, J. R. Waldbauer, R. E. Summons, E. F. DeLong: Proteorhodopsin photosystem gene expression enables photophosphorylation in a heterologous host. In: PNAS 104, 2007, S. 5590–5595 doi:10.1073/pnas.0611470104
- D. A. Bryant, Frigaard N-U: Prokaryotic photosynthesis and phototrophy illuminated. In: Trends in Microbiology. 14, 2006, S. 488–496 doi:10.1016/j.tim.2006.09.001
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 465.
- J. T. Beatty, J. Overmann, M. T. Lince, A. K. Manske, A. S. Lang, R. E. Blankenship, Van Dover CL, Martinson TA, Plumley FG: An obligately photosynthetic bacterial anaerobe from a deep-sea hydrothermal vent. In: PNAS. 102, 2005, S. 9306–9310 doi:10.1073/pnas.0503674102 (pdf)
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München, 2006: 476,478, ISBN 3-8273-7187-2.
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 431.
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 376.
- E. Duchow, H. C. Douglas: Rhodomicrobium vannielii, a new photoheterotrophic bacterium. In: Journal of bacteriology. 58, 1949, S. 409–416 (pdf)
- K. L. Straub, F. A. Rainey, F. Widdell: Rhodovulum iodosum sp. nov. and Rhodovulum robiginosum sp. nov., two new marine phototrophic ferrous-iron-oxidizing purple bacteria. In: International Journal of Systematic Bacteriology. 49, 1999, S. 729–735. PMID 10319496
- N. U. Frigaard, A. Martinez, T. J. Mincer, E. F. DeLong: Proteorhodopsin lateral gene transfer between marine planktonic Bacteria and Archaea. In: Nature 439, 2006, S. 847–850 doi:10.1038/nature04435
- V. V. Yurkov, J. T. Beatty: Aerobic Anoxygenic Phototrophic Bacteria. In: Microbiology and Molecular Biology Reviews. 62, 1998, S. 695–724 PMC 98932 (freier Volltext)
- N. Jiao, Y. Zhang, Y. Zeng, N. Hong, R. Liu, F. Chen, P. Wang: Distinct distribution pattern of abundance and diversity of aerobic anoxygenic phototrophic bacteria in the global ocean. In: Environmental Microbiology. 9, 2007, S. 3091–3099 doi:10.1111/j.1462-2920.2007.01419.x (pdf)
- de la Torre JR, Christianson LM, Béjà O, Suzuki MT, Karl DM, Heidelberg J, DeLong EF: Proteorhodopsin genes are distributed among divergent marine bacterial taxa. In: PNAS. 100 (2003): 12830–12835 doi:10.1073/pnas.2133554100
- J. C. Cho, S. J. Giovannoni: Fulvimarina pelagi gen. nov., sp. nov., a marine bacterium that forms a deep evolutionary lineage of descent in the order "Rhizobiales". In: International Journal of Systematic and Evolutionary Microbiology. 53, 2003, S. 1853–1859 doi:10.1099/ijs.0.02644-0
- I. Kang, H. M. Oh, S. I. Lim, S. Ferriera, S. J. Giovannoni, J. C. Cho: Genome Sequence of Fulvimarina pelagi HTCC2506T, a Mn(II)-Oxidizing Alphaproteobacterium Possessing an Aerobic Anoxygenic Photosynthetic Gene Cluster and Xanthorhodopsin. In: Journal of Bacteriology. 192, 2010, S. 4798–4799 doi:10.1128/JB.00761-10
- N. Jiao, Y. Zhang, Y. Zeng, N. Hong, R. Liu, F. Chen, P. Wang: Distinct distribution pattern of abundance and diversity of aerobic anoxygenic phototrophic bacteria in the global ocean. In: Environmental Microbiology. 9, 2007, S. 3091–3099. doi:10.1111/j.1462-2920.2007.01419.x (pdf)
- N. Jiao, Y. Zhang, Y. Zeng, N. Hong, R. Liu, F. Chen, P. Wang: Distinct distribution pattern of abundance and diversity of aerobic anoxygenic phototrophic bacteria in the global ocean. In: Environmental Microbiology. 9, 2007, S. 3091–3099 doi:10.1111/j.1462-2920.2007.01419.x (pdf)
- L. Gómez-Consarnau, N. Akram, K. Lindell, A. Pedersen, R. Neutze, D. L. Milton, J. M. González, J. Pinhassi: Proteorhodopsin Phototrophy Promotes Survival of Marine Bacteria during Starvation. In: PLoS Biology. 8 (2010), S. e1000358. doi:10.1371/journal.pbio.1000358
- L. Gómez-Consarnau, J. M. González, M. Coll-Lladó, P. Gourdon, T. Pascher, R. Neutze, C. Pedrós-Alió, J. Pinhassi: Light stimulates growth of proteorhodopsin-containing marine Flavobacteria. In: Nature. 445, 2007, S. 210–213 doi:10.1038/nature05381
- T. Riedel, J. Tomasch, I. Buchholz, J. Jacobs, M. Kollenberg, G. Gerdts, A. Wichels, T. Brinkhoff, H. Cypionka, I. Wagner-Döbler: Constitutive expression of the proteorhodopsin gene by a flavobacterium strain representative of the proteorhodopsin-producing microbial community in the North Sea. In: Applied and Environmental Microbiology. 76, 2010, S. 3187–3197 doi:10.1128/AEM.02971-09
- J. Antón, A. Oren, S. Benlloch, F. Rodríguez-Valera, R. Amann, R. Rosselló-Mora: Salinibacter ruber gen. nov., sp. nov., a novel, extremely halophilic member of the Bacteria from saltern crystallizer ponds. In: International Journal of Systematic and Evolutionary Microbiology. 52, 2002, S. 485–491. PMID 11931160.
- J. K. Lanyi, S. P. Balashov: Xanthorhodopsin: a bacteriorhodopsin-like proton pump with a carotenoid antenna. In: Biochimica et Biophysica Acta (BBA). - Bioenergetics 1777, 2008, S. 684–688. doi:10.1016/j.bbabio.2008.05.005
- M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 375.
- P. J. Keeling: Diversity and evolutionary history of plastids and their hosts. In: American Journal of Botany. 2004, S. 1481–1493 doi:10.3732/ajb.91.10.1481
- U. Sonnewald: Physiologie In: Strasburger Lehrbuch der Botanik. Heidelberg 2008, ISBN 978-3-8274-1455-7, S. 224–225.
- Kevin J. Flynn, Diane K. Stoecker, Aditee Mitra, John A. Raven, Patricia M. Glibert, Per Juel, Hansen Edna, Granéli, Joann M. Burkholder (2013): Misuse of the phytoplankton–zooplankton dichotomy: the need to assign organisms as mixotrophs within plankton functional types. Journal of Plankton Research 35 (1): 3–11. doi:10.1093/plankt/fbs062
- Jarone Pinhassi, Edward F. DeLong, Oded Béjà, José M. González, Carlos Pedrós-Alió (2016): Marine Bacterial and Archaeal Ion-Pumping Rhodopsins: Genetic Diversity, Physiology, and Ecology. Microbiology and Molecular Biology Reviews 80 (4): 929-954. doi:10.1128/MMBR.00003-16
- D. C. Price, C. X. Chan, H. S. Yoon, E. C. Yang, H. Qiu, A. P. Weber, R. Schwacke, J. Gross, N. A. Blouin, C. Lane, A. Reyes-Prieto, D. G. Durnford, J. A. Neilson, B. F. Lang, G. Burger, J. M. Steiner, W. Löffelhardt, J. E. Meuser, M. C. Posewitz, S. Ball, M. C. Arias, B. Henrissat, P. M. Coutinho, S. A. Rensing, A. Symeonidi, H. Doddapaneni, B. R. Green, V. D. Rajah, J. Boore, D. Bhattacharya: Cyanophora paradoxa genome elucidates origin of photosynthesis in algae and plants. In: Science. 335, 2012, S. 843–847 doi:10.1126/science.1213561
- P. J. Keeling: Diversity and evolutionary history of plastids and their hosts. In: American Journal of Botany. 2004, S. 1483–1487. doi:10.3732/ajb.91.10.1481
- G. Hansen, L. Botes, M. D. Salas: Ultrastructure and large subunit rDNA sequences of Lepidodinium viride reveal a close relationship to Lepidodinium chlorophorum comb. nov. (= Gymnodinium chlorophorum). In: Phycological Research. 55, 2007, S. 25–41 doi:10.1111/j.1440-1835.2006.00442.x (pdf)
- B. Imanian, Pombert J-F, P. J. Keeling: The Complete Plastid Genomes of the Two ‘Dinotoms’ Durinskia baltica and Kryptoperidinium foliaceum. In: PLoS ONE. 5 (2010): e10711 doi:10.1371/journal.pone.0010711 (pdf)
- Žerdoner Čalasan A, Kretschmann J, Gottschling M. 2018. Absence of co-phylogeny indicates repeated diatom capture in dinophytes hosting a tertiary endosymbiont. Org Divers Evol 18: 29–38.
- J. D. Hackett, L. Maranda, H. S. Yoon, D. Bhattacharya: Phylogenetic evidence for the cryptophyte origin of the plastid of Dinophysis (Dinophysiales, Dinophyceae). In: Journal of Phycology. 39, 2003, S. 440–448. doi:10.1046/j.1529-8817.2003.02100.x (pdf)
- K. Takishita, K. Koike, T. Maruyama, T. Ogata: Molecular evidence for plastid robbery (Kleptoplastidy) in Dinophysis, a dinoflagellate causing diarrhetic shellfish poisoning. In: Protist. 153, 2002, S. 293–302 doi:10.1078/1434-4610-00106
- K. Koike, H. Sekiguchi, A. Kobiyama, K. Takishita, M. Kawachi, K. Koike, T. Ogata: A Novel Type of Kleptoplastidy in Dinophysis (Dinophyceae): Presence of Haptophyte-type Plastid in Dinophysis mitra. In: Protist. 156, 2005, S. 225–237 doi:10.1016/j.protis.2005.04.002
- T. Tengs, O. J. Dahlberg, K. Shalchian-Tabrizi, D. Klaveness, K. Rudi, C. F. Delwiche, K. S. Jakobsen: Phylogenetic Analyses Indicate that the 199Hexanoyloxy-fucoxanthin-Containing Dinoflagellates Have Tertiary Plastids of Haptophyte Origin. In: Molecular Biology and Evolution 17 (200): 718–729. (pdf)
- Z. B. Yang, H. Takayama, K. Matsuoka, I. J. Hodgkiss: Karenia digitata sp. nov. (Gymnodiniales, Dinophyceae), a new harmful algal bloom species from the coastal waters of west Japan and Hong Kong. In: Phycologia. 39, 2000, S. 463–470. doi:10.2216/i0031-8884-39-6-463.1
- G. Hansen, N. Daugbjerg, P. Henriksen: Comparative study of Gymnodinium mikimotoi and Gymnodinium aureolum, comb. nov. (=Gyrodinium aureolum) based on morphology, pigment composition, and molecular data. In: Journal of Phycology. 36, 2000, S. 394–410 doi:10.1046/j.1529-8817.2000.99172.x (pdf) (Memento des Originals vom 13. Juli 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- N. Daugbjerg, G. Hansen, L. Larsen, Ø. Moestrup: Phylogeny of some of the major genera of dinoflagellates based on ultrastructure and partial LSU rDNA sequence data, including the erection of three new genera of unarmoured dinoflagellates. In: Phycologia. 39, 2000, S. 302–317. doi:10.2216/i0031-8884-39-4-302.1 (pdf)
- W. Probst: Algen - allgegenwärtig und vielseitig nutzbar. In: Unterricht Biologie. 365, 2011, S. 3.
- B. Becker, B. Marin: Streptophyte algae and the origin of embryophytes. In: Annals of Botany. 103, 2008, S. 999–1004.
- C. H. Wellman, P. L. Osterloff, U. Mohiuddin: Fragments of the earliest land plants. In: Nature. 425, 2003, S. 282–285.
- U. Sonnewald: Physiologie. In: Strasburger Lehrbuch der Botanik. Heidelberg 2008, ISBN 978-3-8274-1455-7, S. 224–225.
- Zhiling Guo, Huan Zhang, Senjie Lin (2014): Light-Promoted Rhodopsin Expression and Starvation Survival in the Marine Dinoflagellate Oxyrrhis marina. PLoS ONE 9(12): e114941. doi:10.1371/journal.pone.0114941
- P. J. Keeling: Diversity and evolutionary history of plastids and their hosts. In: American Journal of Botany. 2004, S. 1487 doi:10.3732/ajb.91.10.1481
- D. K. Stoecker, M. D. Johnson, C. de Vargas, F. Not: Acquired phototrophy in aquatic protists – Supplement. In: Aquatic Microbial Ecology. 57, 2009, S. 279–310 (pdf)
- C. Chantangsi, H. J. Esson, B. S. Leander: Morphology and molecular phylogeny of a marine interstitial tetraflagellate with putative endosymbionts: Auranticordis quadriverberis n. gen. et sp. (Cercozoa). In: BMC Microbiology. 8, 2008, S. 123 doi:10.1186/1471-2180-8-123
- P. Hallock: Symbiont-bearing Foraminifera. In: B. K. Sen Gupta (Hrsg.): Modern Foraminifera. Dordrecht 2002, ISBN 1-4020-0598-9, S. 123–140.
- N. Okamoto, I. Inouye: Hatena arenicola gen. et sp. nov., a katablepharid undergoing probable plastid acquisition. In: Protist. 157, 2006, S. 401–419 doi:10.1016/j.protis.2006.05.011
- C. H. Slamovits, N. Okamoto, L. Burri, E. R. James, P. J. Keeling: A bacterial proteorhodopsin proton pump in marine eukaryotes. In: Nature Communications. 2, 2010, S. 183. doi:10.1038/ncomms1188
- M. W. Karakashian: Symbiosis in Paramecium Bursaria. In: Symposia of the Society of Experimental Biology. 29, 1975, S. 145–173. PMID 785659.
- H. S. Yoon, T. Nakayama, A. Reyes-Prieto, R. A. Andersen, S. M. Boo, K. Ishida, D. Bhattacharya: A single origin of the photosynthetic organelle in different Paulinella lineages. In: BMC Evolutionary Biology. 9, 2009, S. 98. doi:10.1186/1471-2148-9-98
- T. Nakayama, K-i. Ishida: Another acquisition of a primary photosynthetic organelle is underway in Paulinella chromatophora. In: Current Biology. 19, 2009, S. R284–R285 doi:10.1016/j.cub.2009.02.043 (pdf)
- C. P. Queimaliños, B. E. Modenutti, E. G. Balseiro: Symbiotic association of the ciliate Ophrydium naumanni with Chlorella causing a deep chlorophyll a maximum in an oligotrophic South Andes lake. In: Journal of Plankton Research. 21, 1999, S. 167–178 doi:10.1093/plankt/21.1.167 (pdf)
- G. Rambold, T. Friedl, A. Beck: Photobionts in lichens: Possible indicators of phylogenetic relationships? In: The Bryologist. 101, 1998, S. 392–397.
- T. Pröschold, T. Darienko, P. C. Silva, W. Reisser, L. Krienitz: The systematics of Zoochlorella revisited employing an integrative approach. In: Environmental Microbiology. 13, 2011, S. 350–364 doi:10.1111/j.1462-2920.2010.02333.x
- P. Brien: Contribution à létude de la régeneration naturelle chez les Spongillidae: Spongilla lacustris (L.) et Ephydatia fluviatilis (L.). In: Arch. Zool. exp. gén. 74, 1932, S. 461–506.
- K. Dunn: Growth of endosymbiotic algae in the green hydra, Hydra viridissima. In: Journal of Cell Science. 88, 1987, S. 571–578 (pdf)
- A. Hauck: Aus zwei wird eins – Algen als Endosymbionten. In: Unterricht Biologie. 365, 2011, S. 37.
- D. Secord, L. Augustine: Biogeography and microhabitat variation in temperate algal-invertebrate symbioses: zooxanthellae and zoochlorellae in two Pacific intertidal sea anemones, Anthopleura elegantissima and A. xanthogrammica. In: Invertebrate Biology. 119, 2000, S. 139–146 doi:10.1111/j.1744-7410.2000.tb00002.x
- A. E. Douglas: Growth and Reproduction of Convoluta Roscoffensis Containing Different Naturally Occurring Algal Symbionts. In: Journal of the Marine Biological Association of the United Kingdom. 65, 1985, S. 871–879. doi:10.1017/S0025315400019378
- P. W. Gilbert: The alga-egg relationship in Ambystoma maculatum, a case of symbiosis. In: Ecology. 25, 1944, S. 366–369. doi:10.2307/1931284
- R. Kerney, E. Kim, R. P. Hangarter, A. A. Heiss, C. D. Bishop, B. K. Hall: Intracellular invasion of green algae in a salamander host. In: PNAS. 108, 2011, S. 6497–6502 doi:10.1073/pnas.1018259108
- D. Riddle: “Types” of Zooxanthellae and What They Tell Us.pdf Anhang zu: D. Riddle: Getting Really Up to Date on Zooxanthellae (Symbiodinium spp.). In: Advanced Aquarist. X (2011) link
- D. L. Taylor: In situ studies on the cytochemistry and ultrastructure of a symbiotic marine dinoflagellate. In: Journal of the Marine Biological Association of the United Kingdom. 48, 1968, S. 349–366 doi:10.1017/S0025315400034548
- S. K. Davy, I. Lucas, J. R. Turner: Uptake and Persistence of Homologous and Heterologous Zooxanthellae in the Temperate Sea Anemone Cereus pedunculatus (Pennant). In: The Biological Bulletin. 192, 1997, S. 208–216. doi:10.2307/1542715
- D. G. Fautin, W. K. Fitt: A jellyfish-eating sea anemone (Cnidaria, Actiniaria) from Palau: Entacmaea medusivora sp. nov. In: Hydrobiologia. 216/217, 1991, S. 453–461 doi:10.1007/BF00026499
- J. H. Costello, P. M. Kremer: Circadian rhythmicity in the location of zooxanthellae of the scyphomedusa Linuche unguiculata. In: Marine Ecology Progress Series. 57, 1989, S. 279–286 (pdf)
- J. L. Sachs, T. P. Wilcox: A shift to parasitism in the jellyfish symbiont Symbiodinium microadriaticum. In: Proceedings of the Royal Society B: Biological Sciences. 273, 2006, S. 425–429 doi:10.1098/rspb.2005.3346
- O. Barneah, I. Brickner, M. Hooge, V. M. Weis, T. C. LaJeunesse: Three party symbiosis: acoelmorph worms, corals and unicellular algal symbionts in Eliat (Red Sea). In: Marine Biology. 151, 2007, S. 1215–1223.
- O. Barneah, I. Brickner, M. Hooge, V. M. Weis, Y. Benayahu: First evidence of maternal transmission of algal endosymbionts at an oocyte stage in a triploblastic host, with observations on reproduction in Waminoa brickneri (Acoelomorpha). In: Invertebrate Biology. 126, 2007, S. 113–119 doi:10.1111/j.1744-7410.2007.00082.x (freier Volltext).
- R. K. Trench, D. S. Wethey, J. W. Porter: Observations on the symbiosis with zooxanthellae among the Tridacnidae (Mollusca, Bivalvia). In: Biological Bulletin. 161, 1981, S. 180–198 (pdf).
- R. Hinde, D. C. Smith: “Chloroplast symbiosis” and the extent to which it occurs in Sacoglossa (Gastropoda: Mollusca). In: Biological Journal of the Linnean Society. 6, 1974, S. 349–356 doi:10.1111/j.1095-8312.1974.tb00729.x.
- D. L. Taylor: Chloroplasts as symbiotic organelles in the digestive gland of Elysia viridis [Gastropoda: opisthobranchia]. In: Journal of the Marine Biological Association of the United Kingdom. 48, 1968, S. 1–15.
- C. V. Mujer, D. L. Andrews, J. R. Manhart, S. K. Pierce, M. E. Rumpho: Chloroplast genes are expressed during intracellular symbiotic association of Vaucheria litorea plastids with the sea slug Elysia chlorotica. In: PNAS. 93, 1996, S. 12333–12338. (pdf)
- M. E. Rumpho, J. M. Worful, J. Lee, K. Kannan, M. S. Tyler, D. Bhattacharya, A. Moustafa, J. R. Manhart: Horizontal gene transfer of the algal nuclear gene psbO to the photosynthetic sea slug Elysia chlorotica. In: PNAS. 105, 2008, S. 17867–17871. doi:10.1073/pnas.0804968105
- M. Plotkin, I. Hod, A. Zaban, S. A. Boden, D. M. Bagnall, D. Galushko, D. J. Bergman: Solar energy harvesting in the epicuticle of the oriental hornet (Vespa orientalis). In: Naturwissenschaften. 97, 2010, S. 1067–1076. doi:10.1007/s00114-010-0728-1.