Schwefelkreislauf
Mit Schwefelkreislauf bezeichnet man das System der chemischen Umwandlungen von Schwefel und schwefelhaltigen Verbindungen in Lithosphäre, Hydrosphäre, Erdatmosphäre und Biosphäre sowie den Austausch dieser Stoffe zwischen diesen Erdsphären.
Im Folgenden werden die globalen, geochemischen, weitgehend biotischen Umsetzungen des chemischen Elements Schwefel und seiner hauptsächlich vorkommenden chemischen Verbindungen kurz dargestellt.
Vorkommen
Das chemische Element Schwefel kommt in den oberen Schichten der Erde und in Lebewesen vor. Die Erdkruste (feste und lockere Gesteine, die sogenannte Lithosphäre) enthält im Mittel etwa 0,5 g S pro kg, Gewässer (Hydrosphäre) im Mittel etwa 0,93 g S pro kg, Lebewesen (Biosphäre) etwa 0,5 bis 2 g S pro kg. Schwefelverbindungen gelangen mit vulkanischen Gasen aus der Tiefe in die Atmosphäre.
Das Element Schwefel existiert in der Litho-, Hydro- und Biosphäre hauptsächlich als Sulfat (SO42−), Schwefelwasserstoff (H2S), Metallsulfiden und -disulfiden sowie elementarem Schwefel (S8). Diese anorganischen Stoffe sind weitgehend stabil und unterliegen nur in sehr geringem Maß abiotischen chemischen Umsetzungen.
In Biomasse kommt Schwefel in organischen Verbindungen als Sulfhydrylgruppe –SH und in heterozyklischen Verbindungen vor. Lebewesen setzen Schwefel und Schwefelverbindungen in ihrem Energie- und Baustoffwechsels in großem Umfang chemisch-enzymatisch um. Dadurch unterliegt Schwefel einer ständigen biotischen Veränderung innerhalb des sogenannten Schwefelkreislaufs, der geochemisch global von erheblicher Bedeutung ist.
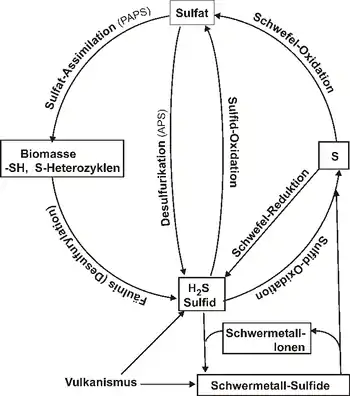
Biotischer Schwefelkreislauf
Im biotischen Schwefelkreislauf finden folgende Umsetzungen statt:
1. Sulfat-Assimilation (PAPS): Einige Bestandteile der Lebewesen enthalten Schwefel, nämlich organische Stoffe mit Sulfhydryl-Gruppen (–SH), wie zum Beispiel die Aminosäuren L-Methionin und L-Cystein, sowie schwefelhaltige Heterocyclen, wie beispielsweise Biotin. Für ihren Aufbau wird der Schwefel aus Sulfat (SO42−) assimiliert. Dazu muss das Sulfat durch Bindung an Adenosintriphosphosulfat über Adenosinphosphosulfat zu 3′-Phosphoadenosin-5′-phosphosulfat (PAPS) aktiviert werden (Unterschied zu 6). Einige wenige Bakterien können elementaren Schwefel aus Schwefelquellen assimilieren.
2. Fäulnis (Desulfurylation): Nach dem Absterben von Lebewesen wird der in ihnen enthaltene Schwefel im Zuge des Abbaus der Biomasse durch organismeneigene Enzyme und durch Mikroorganismen (beispielsweise Escherichia und Proteus) aus den organischen Stoffen als Schwefelwasserstoff (H2S) freigesetzt. Unter anoxischen Bedingungen, wie sie in schlecht durchlüfteten Böden oder in sauerstoffarmen Gewässern herrschen, reichert sich der so gebildete Schwefelwasserstoff an. Er ist für die meisten Lebewesen giftig.
3. Sulfid-Oxidation:
- a: Schwefelwasserstoff wird von bestimmten chemoautotrophen, aeroben, Sulfid-oxidierenden Bakterien (farblose Schwefelbakterien der Gattungen Beggiatoa und Thiovulum beispielsweise) mit Sauerstoff (O2) zu elementarem Schwefel (S) oxidiert. Bei diesen Reaktionen wird Energie frei, die von den Bakterien zur Assimilation von Kohlenstoffdioxid genutzt wird.
- b: Schwefelwasserstoff wird von bestimmten phototrophen (anaeroben) Bakterien (zum Beispiel der Gattungen Chromatium und Chlorobium) unter anoxischen Bedingungen in anoxygener Photosynthese als Reduktionsmittel zur Assimilation von Kohlenstoffdioxid (CO2) genutzt und dabei zu elementarem Schwefel oder Sulfat (Purpurbakterien) oxidiert.
- Beispiel: Grüne Schwefelbakterien
4. Schwefel-Oxidation (Sulfurikation):
- a: Bestimmte Schwefel-oxidierende, aerobe Bakterien (zum Beispiel der Gattungen Thiobacillus und Acidithiobacillus) und Archaeen (zum Beispiel Acidianus) oxidieren elementaren Schwefel mit Sauerstoff (O2) zu Sulfat. Bei dieser Reaktion wird Energie frei, die von den Mikroorganismen genutzt wird (Chemotrophie).
- b: Bei H2S-Mangel können einige der unter 3. genannten Bakterien den von ihnen zunächst als Endprodukt gebildeten Schwefel auch weiter bis zu Sulfat oxidieren (Vorteil: höhere Energieausbeute, Nachteil: Säurebildung).
5. Sulfid-Oxidation zu Sulfat (Sulfurikation): Schwefelwasserstoff wird durch bestimmte aerobe, Sulfid-oxidierende Bakterien (zum Beispiel der Gattungen Thiobacillus und Acidithiobacillus) und Archaeen (beispielsweise Sulfolobus [en]) mit Sauerstoff (O2) zu Sulfat oxidiert. Bei dieser Reaktion wird Energie frei, die von den Mikroorganismen genutzt wird (Chemotrophie).
6. Desulfurikation (Sulfatreduktion): Bestimmte obligat anaerobe Bakterien (sogenannte Desulfurikanten, zum Beispiel die Gattungen Desulfovibrio und Desulfobacter) oxidieren zur Energiegewinnung unter anoxischen Bedingungen molekularen Wasserstoff (H2) oder organische Stoffe mit Sulfat, wobei zum Beispiel dieses zu Schwefelwasserstoff (H2S) reduziert wird (Chemotrophie). Dazu muss das Sulfat durch Bindung an Adenosinmonophosphat zu Adenosinphosphosulfat (APS) aktiviert werden (im Unterschied zu 1).
7. Schwefel-Reduktion: Bestimmte fakultativ oder obligat anaerobe Bakterien (zum Beispiel der Gattung Desulfuromonas) und Archaeen (beispielsweise die Gattung Pyrococcus) oxidieren unter anoxischen Bedingungen zur Energiegewinnung molekularen Wasserstoff (H2) oder organische Stoffe mit elementarem Schwefel, wobei dieser zu Schwefelwasserstoff (H2S) reduziert wird (Chemotrophie).
8. Schwermetallsulfidbildung: Schwefelwasserstoff bildet in abiotischen Reaktionen mit Schwermetallionen (insbesondere Eisen(II)-ionen) Schwermetallsulfide, die praktisch wasserunlöslich sind. Diese Umsetzung schützt Lebewesen vor der Giftwirkung des Schwefelwasserstoffs.
9. Schwermetallsulfid-Auflösung: Schwermetallsulfide werden durch Eisen- und Sulfid-oxidierende Bakterien (zum Beispiel Acidithiobacillus ferrooxidans) und Archaeen (zum Beispiel Acidianus [en]) oxidativ angegriffen und unter Oxidation des Sulfids mit Sauerstoff (O2) zu Sulfat aufgelöst, wobei die Schwermetalle als Ionen gelöst werden. Die Mikroorganismen gewinnen aus dieser Umsetzung Energie (Chemotrophie).
10. Vulkanismus: Schwefelwasserstoff gelangt mit vulkanischen Gasen aus dem Erdinneren an die Erdoberfläche und damit auch in den biotischen Schwefelkreislauf, in die Biosphäre. Auch Schwermetallsulfide gelangen mit hydrothermalen Lösungen aus dem Erdinneren an die Erdoberfläche und damit ebenfalls in biotische Stoffkreisläufe.