Carbonylsulfid
Carbonylsulfid ist ein farbloses, brennbares, giftiges Gas mit unangenehmem Geruch. Chemisch reines COS soll allerdings geruchlos sein.[4] Es spielt vor allem in der Atmosphärenchemie eine wichtige Rolle.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
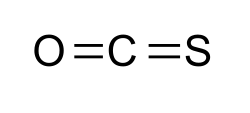 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Carbonylsulfid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | COS | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, übelriechendes Gas[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 60,07 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−50,2 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (1,45 g·l−1)[1] | ||||||||||||||||||
| Brechungsindex |
1,24 (−87 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−142,0 kJ/mol[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Geschichte
Entdeckt wurde es 1867 vom ungarischen Chemiker Carl von Than. 1868 erhielt von Than für seine Arbeiten über die Absorptionskoeffizienten von COS den Lieben-Preis.
Vorkommen
Carbonylsulfid entsteht vor allem in der Atmosphäre. Es kommt jedoch auch in Erdgas, vulkanischen Gasen, Biogas und als Nebenprodukt in der chemischen Industrie vor.[5]
Gewinnung und Darstellung
Im Labor lässt sich Carbonylsulfid aus Kaliumthiocyanat und Schwefelsäure darstellen. Dabei entsteht neben Kaliumhydrogensulfat und Ammoniumhydrogensulfat auch gasförmiges COS mit verschiedenen Verunreinigungen wie Kohlendioxid, Schwefeldioxid, Schwefelwasserstoff, Kohlenstoffdisulfid, Formaldehyd und Blausäure. Es muss daher gereinigt werden.[6]
Ein anderer Syntheseweg besteht in der Reaktion von Kohlenstoffmonoxid mit Schwefeldampf in glühenden Röhren:[4]
Eine weitere Möglichkeit zur Synthese von COS ist die unvollständige Oxidation eines stöchiometrischen Gemisches aus Kohlenstoff und Schwefel mit Sauerstoff gemäß folgender Reaktionsgleichung:[7]
Eigenschaften
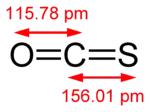
Das Carbonylsulfid-Molekül hat eine lineare Struktur: Das Kohlenstoffatom ist jeweils über eine Doppelbindung mit Schwefel und Sauerstoff verknüpft. Es ist isovalenzelektronisch zu Kohlenstoffdioxid und Schwefelkohlenstoff.
Bei der Verbrennung an Luft entstehen Kohlenstoffdioxid und Schwefeldioxid:
Mit Wasser oder Wasserdampf hydrolysiert es zu Kohlenstoffdioxid und Schwefelwasserstoff:
Carbonylsulfid hat eine kritische Temperatur von 105,3 °C, einen kritischen Druck von 63,5 bar und ein kritisches Volumen von 0,1351 m3·kmol−1.[6] Die Verbindung bildet leicht entzündliche Gas-Luft-Gemische. Der Explosionsbereich liegt zwischen 6,5 Vol.-% (160 g/m3) als untere Explosionsgrenze (UEG) und 29 Vol.-% (730 g/m3) als obere Explosionsgrenze (OEG).[1][8]
Atmosphärenchemie
Carbonylsulfid ist ein die Aerosolbildung in der Atmosphäre (und so das Klima) beeinflussendes Gas und das dominierende Schwefelgas in der Atmosphäre. Grund dafür ist seine Langlebigkeit in der Atmosphäre. Es wird wie Distickstoffmonoxid (Lachgas) in der Troposphäre nicht abgebaut und gelangt damit in die Stratosphäre. Dort wird es zu Sulfataerosolen umgewandelt, die Sonnenlicht in den Weltraum reflektieren und so zur Kühlung der Erde beitragen.[9]
Gebildet wird es in der Natur vor allem durch die Einwirkung von Sonnenlicht auf schwefelhaltige organische Verbindungen (z. B. Dimethylsulfoxid und CS) in den oberen Schichten der Ozeane (vor allem Küstengebiete).
Verwendung
Carbonylsulfid wird zur Containerbegasung zur Bekämpfung von Schädlingen wie Mäusen und Ratten benutzt.[4] In der organischen Synthese dient es zur Herstellung von Thiosäuren, substituierten Thiazolen und Thiocarbamaten.[4]
Biologische Bedeutung
Viele Pflanzen nehmen Carbonylsulfid am Tage als organische Schwefelquelle auf. Die Verbindung spielt auch bei der Bildung von Eiweißketten aus Aminosäuren eine Rolle und es wird angenommen, dass ihr eine wichtige Rolle bei der Entstehung des Lebens zukommt.
Einzelnachweise
- Eintrag zu Carbonylsulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-88.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- Eintrag zu Kohlenoxidsulfid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- ESPERE Klimaenzyklopädie: Gase aus Seewasser (Memento vom 23. Mai 2014 im Internet Archive).
- P. D. N. Svoronos, T. J. Bruno: Carbonyl Sulfide: A Review of Its Chemistry and Properties. In: Ind. Eng. Chem. Res. 41, 2002, S. 5321–5336, doi:10.1021/ie020365n.
- Eberhard Breitmaier, Günther Jung: Organische Chemie - Grundlagen, Verbindungsklassen, Reaktionen, Konzepte, Molekülstruktur, Naturstoffe, Syntheseplanung, Nachhaltigkeit. 7., überarb. Auflage. Georg Thieme Verlag, 2012, ISBN 978-3-13-541507-9, S. 436.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Max-Planck-Institut für Chemie: Faszination Forschung (Memento vom 6. April 2011 im Internet Archive).


