Fluorwasserstoff
Fluorwasserstoff ist ein anorganisch-chemischer Stoff, der zu den Halogenwasserstoffen gehört. Bei Zimmertemperatur liegt er als farbloses, stechend riechendes, sehr giftiges Gas vor, das eine geringere Dichte als Luft hat. Es ist hygroskopisch und dehydratisiert viele Stoffe. In der wasserfreien Form liegt es unterhalb des Siedepunktes von 19,51 °C als rauchende Flüssigkeit vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||||||
| Name | Fluorwasserstoff | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | HF | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 20,00 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
19,5 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
3,2[2] | ||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Fluorwasserstoff ist in jedem Verhältnis mit Wasser mischbar und reagiert dabei sauer. Die wässrige Lösung ist als Fluorwasserstoffsäure oder Flusssäure bekannt.
Gewinnung und Darstellung
Um Fluorwasserstoff herzustellen, werden zunächst seine Salze, die Fluoride (Beispiel: Calciumfluorid, Flussspat), durch Flotation auf über 98 % aufkonzentriert und anschließend in auf etwa 200 °C geheizten Drehöfen mit konzentrierter Schwefelsäure umgesetzt. Dabei gast Fluorwasserstoff aus, welches kondensiert und die Rohsäure bildet:[5]
Diese Reaktion findet auch beim Nachweis von Fluoriden mittels der Kriechprobe Anwendung.
Durch wiederholte Rektifikation wird dann die Reinsäure gewonnen. Die Rektifikation ist notwendig, da die Rohsäure unter anderem noch schwersiedende Bestandteile wie zum Beispiel Wasser und Fluorsulfonsäure (HSO3F), aber auch leichtsiedendes Schwefeldioxid enthält.[5]
Fluorwasserstoff fällt außerdem bei der Aluminiumherstellung und beim Brennen von Ziegeln und Feinkeramik an. Weiterhin wird es bei der Verbrennung von fluorhaltigen Abfällen oder von Brennstoffen wie beispielsweise Steinkohle freigesetzt.
Eigenschaften
Physikalische Eigenschaften
- Kritische Temperatur: 188 °C[1]
- Kritischer Druck: 6,49 MPa[1]
- Kritische Dichte: 0,29 g·cm−3[1]
- Molares Normvolumen: 21,7 l/mol
Chemische Eigenschaften

Das chemische Verhalten des Fluorwasserstoffs wird durch die extrem hohe Elektronegativität des Fluors geprägt; dessen Wert von 4 auf der Pauling-Skala ist der höchste aller Elemente. Das Fluorwasserstoffmolekül ist durch einen ausgeprägten Dipolcharakter mit starker negativer Partialladung beim Fluor gekennzeichnet. Durch Wasserstoffbrücken bilden sich Oligomere wie etwa (HF)6. HF hat im Vergleich zu seinem höheren analogen HCl einen relativ hohen Siedepunkt von 19,5 °C; HCl siedet demgegenüber bei −85,0 °C. Dieses Phänomen ist – wie beim Wasser – auf die Wasserstoffbrücken-Bindungen zurückzuführen.
Reaktionen als Säure
Wässrige HF-Lösung, die Flusssäure, ist eine schwache Säure; jedoch ist wasserfreier Fluorwasserstoff eine sehr starke Protonsäure[6] und autoprotolysiert folgendermaßen:
Fluorwasserstoff ätzt Silikatglas und reagiert mit anderen Silikaten zu gasförmigem Siliciumtetrafluorid:
In einer wässrigen Lösung von Fluorwasserstoff ist Schwefelsäure nicht beständig und bildet nach der Abspaltung von Wasser Fluorsulfonsäure:[5]
Fluorwasserstoff zeigt innerhalb der Reihe der Halogenwasserstoffe die schwächste Neigung zur Dissoziation in Wasser. Gegenüber den übrigen Halogenwasserstoffen, die unter Bildung von Oxonium-Ionen (H3O+) und ihrer entsprechenden Gegenionen vollständig dissoziieren, liegt in der Flusssäure ein Gemisch verschiedener fluoridhaltiger Ionen vor.
Fluorwasserstofflagerung
Reiner gasförmiger Fluorwasserstoff kann in Tankwaggons aus Eisen transportiert werden, da sich die Oberfläche des Eisens mit einer Fluoridschicht überzieht, die das Material gegen weiteren Angriff schützt. Für Ventile, Rohrleitungen und Apparaturen wird auch Monelmetall (eine Nickel-Kupfer-Legierung) verwendet. Die wässrigen Lösungen dagegen würden das Eisen aufgrund des Anlösens der Fluoridschicht tiefgreifend oxidieren. Daher wird Flusssäure in Kunststofftanks transportiert.
Fluorwasserstoff als Feststoff
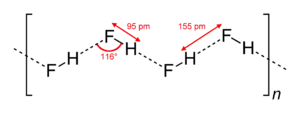
- Die Kettenstruktur von kristallinem HF
Fluorwasserstoff als Feststoff besteht aus orthorhombischen Kristallen mit Ketten, die im Zick-Zack-Muster angeordnet sind. Die HF-Moleküle haben eine H–F-Bindungslänge von 95 pm, die benachbarten Moleküle haben einen intermolekularen H–F-Abstand von 155 pm.[7]
Verwendung
Fluorwasserstoff findet Verwendung bei der Herstellung von Fluorkohlenwasserstoffen, Aluminiumfluorid, synthetischem Kryolith (Eisstein, Na3[AlF6]), Uranhexafluorid, anderen Fluorverbindungen, Flusssäure, beim Herstellungsprozess von Tensiden und in der Farbstoffchemie. Bei der Elektrolyse von Fluorwasserstoff entsteht unter bestimmten Bedingungen elementares Fluor (F2).
Fluorwasserstoff wird als Katalysator bei der Benzinherstellung, als Lösungsmittel, in der organischen Chemie für die Substitution mit Fluor und in der Tieftemperaturtechnik eingesetzt.
Fluorwasserstoff wurde in den 1950er und 1960er Jahren zur Holzschutzbehandlung z. B. von Dachstühlen eingesetzt, Handelsname z. B. "Osmol WB4".
Biologische Bedeutung
Der Hauptaufnahmeweg für Fluorwasserstoff verläuft über die Atemwege und über die Haut. Aufgrund der hohen Hygroskopizität dürfte es nur in Extremfällen zum Einatmen von gasförmigem Fluorwasserstoff kommen, bei der aber mit nahezu vollständiger Resorption in den oberen Atemwegen zu rechnen ist. Viel häufiger tritt die Resorption von wässrigen Lösungen von Fluorwasserstoff (Fluorwasserstoffsäure oder Flusssäure) über die Haut auf. Die Haut stellt bei der Aufnahme kein Hindernis dar. Mit einer versehentlichen oralen Aufnahme ist aus physikalisch-chemischen Gründen und wegen des äußerst stechenden Geruches nicht zu rechnen. Wässrige Lösungen werden vollständig resorbiert. Der Vorgang kann durch eventuellen Mageninhalt verlangsamt werden.
Kontakt mit Fluorwasserstoff hat stark ätzende Wirkung auf Haut und Schleimhäute, insbesondere des Auges. Dabei muss beachtet werden, dass die Symptome mit bis zu 24 Stunden Verzögerung auftreten können. Erste Hilfe bei Hautkontakt ist die unmittelbare Behandlung mit Calciumgluconat-Gel.[8][9] Durch Aufnahme in den Organismus kommt es zur erheblichen Beeinflussung biochemischer Stoffwechselvorgänge durch Enzymhemmung. Chronische Auswirkungen umfassen die Schädigung des Skeletts und der Haut, sowie Beeinträchtigung der Lungenfunktion.
Einzelnachweise
- Eintrag zu Fluorwasserstoff, wasserfrei in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Eintrag zu Hydrogen fluoride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7664-39-3 bzw. Fluorwasserstoff), abgerufen am 2. November 2015.
- V. Kaiser: Siedegleichgewicht der Fluorwasserstoff‐Gemische HF/SO2 und HF/H2O/HSO3F. In: Chemie Ingenieur Technik. Band 38, Nr. 2, 1. Februar 1966, S. 151–154, doi:10.1002/cite.330380210.
- Ralf Alsfasser, Erwin Riedel, H. J. Meyer: Moderne Anorganische Chemie. Walter de Gruyter, 2007, ISBN 3-11-019060-5, S. 104 (eingeschränkte Vorschau in der Google-Buchsuche).
- Johnson, M. W.; Sándor, E.; Arzi, E. The Crystal Structure of Deuterium Fluoride, Acta Crystallographica, 1975, B31, S. 1998–2003. doi:10.1107/S0567740875006711.
- Datenblatt Hydrogen fluoride bei Sigma-Aldrich, abgerufen am 18. Mai 2015 (PDF).
- Eintrag zu Flußsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. November 2013.

