Curium
Curium ist ein künstlich erzeugtes chemisches Element mit dem Elementsymbol Cm und der Ordnungszahl 96. Im Periodensystem steht es in der Gruppe der Actinoide (7. Periode, f-Block) und zählt zu den Transuranen. Curium wurde nach den Forschern Marie Curie und Pierre Curie benannt.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Curium, Cm, 96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Actinoide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | Ac, 7, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig-weißes Metall | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 247,0703 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius | 174,3 pm[2] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Rn] 5f7 6d1 7s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 5.99141(25) eV[3] ≈ 578.08 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 12.4(4) eV[3] ≈ 1200 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 20.1(4) eV[3] ≈ 1940 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 37.7(4) eV[3] ≈ 3640 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 51.0(1,9) eV[3] ≈ 4920 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 13,51 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1613 K (1340 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3383 K (3110 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 18,05 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 10[6] W·m−1·K−1 bei 300 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | (+2), +3, +4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,06 V (Cm3+ + 3 e− → Cm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,3 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gefahren- und Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Radioaktiv | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bei Curium handelt es sich um ein radioaktives, silbrig-weißes Metall großer Härte. Es wird in Kernreaktoren gebildet, eine Tonne abgebrannten Kernbrennstoffs enthält durchschnittlich etwa 20 g.
Curium wurde im Sommer 1944 erstmals aus dem leichteren Element Plutonium erzeugt, die Entdeckung wurde zunächst nicht veröffentlicht. Erst in einer amerikanischen Radiosendung für Kinder wurde durch den Entdecker Glenn T. Seaborg als Gast der Sendung die Existenz der Öffentlichkeit preisgegeben, indem er die Frage eines jungen Zuhörers bejahte, ob neue Elemente entdeckt worden seien.
Curium ist ein starker α-Strahler; es wird gelegentlich aufgrund der sehr großen Wärmeentwicklung während des Zerfalls in Radionuklidbatterien eingesetzt. Außerdem wird es zur Erzeugung von 238Pu für gammastrahlungsarme Radionuklidbatterien, beispielsweise in Herzschrittmachern, verwendet. Das Element kann weiterhin als Ausgangsmaterial zur Erzeugung höherer Transurane und Transactinoide eingesetzt werden. Es dient auch als α-Strahlenquelle in Röntgenspektrometern, mit denen u. a. die Mars-Rover Sojourner, Spirit und Opportunity auf der Oberfläche des Planeten Mars Gestein chemisch analysieren. Der Lander Philae der Raumsonde Rosetta sollte damit die Oberfläche des Kometen 67P/Tschurjumow-Gerassimenko untersuchen.
Geschichte


Curium wurde im Sommer 1944 von Glenn T. Seaborg und seinen Mitarbeitern Ralph A. James und Albert Ghiorso entdeckt. In ihren Versuchsreihen benutzten sie ein 60-Inch-Cyclotron an der Universität von Kalifornien in Berkeley. Nach Neptunium und Plutonium war es das dritte seit dem Jahr 1940 entdeckte Transuran. Seine Erzeugung gelang noch vor der des in der Ordnungszahl um einen Platz tiefer stehenden Elements Americium.[10][11]
Zur Erzeugung des neuen Elements wurden meistens die Oxide der Ausgangselemente verwendet. Dazu wurde zunächst Plutoniumnitratlösung (mit dem Isotop 239Pu) auf eine Platinfolie von etwa 0,5 cm2 aufgetragen, die Lösung danach eingedampft und der Rückstand dann zum Oxid (PuO2) geglüht. Nach dem Beschuss im Cyclotron wurde die Beschichtung mittels Salpetersäure gelöst und anschließend wieder mit einer konzentrierten wässrigen Ammoniak-Lösung als Hydroxid ausgefällt; der Rückstand wurde in Perchlorsäure gelöst. Die weitere Trennung erfolgte mit Ionenaustauschern. In diesen Versuchsreihen entstanden zwei verschiedene Isotope: 242Cm und 240Cm.
Das erste Isotop 242Cm erzeugten sie im Juli/August 1944 durch Beschuss von 239Pu mit α-Teilchen. Hierbei entsteht in einer sogenannten (α,n)-Reaktion das gewünschte Isotop und ein Neutron:
Die Identifikation gelang zweifelsfrei anhand der charakteristischen Energie des beim Zerfall ausgesandten α-Teilchens. Die Halbwertszeit dieses α-Zerfalls wurde erstmals auf 150 Tage bestimmt (162,8 d[8]).
Das zweite, kurzlebigere Isotop 240Cm, das ebenfalls durch Beschuss von 239Pu mit α-Teilchen entsteht, entdeckten sie erst später im März 1945:
Die Halbwertszeit des anschließenden α-Zerfalls wurde erstmals auf 26,7 Tage bestimmt (27 d[8]).
Auf Grund des andauernden Zweiten Weltkriegs wurde die Entdeckung des neuen Elements zunächst nicht veröffentlicht. Die Öffentlichkeit erfuhr erst auf äußerst kuriose Weise von dessen Existenz: In der amerikanischen Radiosendung Quiz Kids vom 11. November 1945 fragte einer der jungen Zuhörer Glenn Seaborg, der als Gast der Sendung auftrat, ob während des Zweiten Weltkriegs im Zuge der Erforschung von Nuklearwaffen neue Elemente entdeckt worden seien. Seaborg bejahte die Frage und enthüllte damit die Existenz des Elements gleichzeitig mit der des nächstniedrigeren Elements, Americium.[12] Dies geschah noch vor der offiziellen Bekanntmachung bei einem Symposium der American Chemical Society.
Die Entdeckung von Curium (242Cm, 240Cm), ihre Produktion und die ihrer Verbindungen wurden später unter dem Namen Element 96 and compositions thereof patentiert, wobei als Erfinder nur Glenn T. Seaborg angegeben wurde.[13]
Der Name Curium wurde in Analogie zu Gadolinium gewählt, dem Seltenerdmetall, das im Periodensystem genau über Curium steht. Die Namenswahl ehrte das Ehepaar Marie und Pierre Curie, dessen wissenschaftliche Arbeit für die Erforschung der Radioaktivität bahnbrechend gewesen war. Es folgte damit der Namensgebung von Gadolinium, das nach dem berühmten Erforscher der Seltenen Erden, Johan Gadolin benannt wurde: As the name for the element of atomic number 96 we should like to propose "curium", with symbol Cm. The evidence indicates that element 96 contains seven 5f electrons and is thus analogous to the element gadolinium with its seven 4f electrons in the regular rare earth series. On this basis element 96 is named after the Curies in a manner analogous to the naming of gadolinium, in which the chemist Gadolin was honored.[10]
Die erste wägbare Menge Curium konnte 1947 in Form des Hydroxids von Louis B. Werner und Isadore Perlman hergestellt werden. Hierbei handelte es sich um 40 μg 242Cm, das durch Neutronenbeschuss von 241Am entstand.[14] In elementarer Form wurde es erst 1951 durch Reduktion von Curium(III)-fluorid mit Barium dargestellt.[15][16]
Vorkommen
Das langlebigste Isotop 247Cm besitzt eine Halbwertszeit von 15,6 Millionen Jahren. Aus diesem Grund ist das gesamte primordiale Curium, das die Erde bei ihrer Entstehung enthielt, mittlerweile zerfallen. Curium wird zu Forschungszwecken in kleinen Mengen künstlich hergestellt. Weiterhin fällt es in geringen Mengen in abgebrannten Kernbrennstoffen an.
In der Umwelt vorkommendes Curium stammt größtenteils aus atmosphärischen Kernwaffentests bis 1980. Lokal gibt es höhere Vorkommen, bedingt durch nukleare Unfälle und andere Kernwaffentests. Zum natürlichen Hintergrund der Erde trägt Curium allerdings kaum bei.[17]
Über die Erstentdeckung von Einsteinium und Fermium in den Überresten der ersten amerikanischen Wasserstoffbombe, Ivy Mike, am 1. November 1952 auf dem Eniwetok-Atoll hinaus wurden neben Plutonium und Americium auch Isotope von Curium, Berkelium und Californium gefunden: vor allem die Isotope 245Cm und 246Cm, in kleineren Mengen 247Cm und 248Cm, in Spuren 249Cm. Aus Gründen der militärischen Geheimhaltung wurden die Ergebnisse erst später im Jahr 1956 publiziert.[18]
Gewinnung und Darstellung
Gewinnung von Curiumisotopen
Curium fällt in geringen Mengen in Kernreaktoren an. Es steht heute weltweit lediglich in Mengen von wenigen Kilogramm zur Verfügung, worauf sein sehr hoher Preis von etwa 160 US-Dollar pro Mikrogramm 244Cm bzw. 248Cm beruht.[19] In Kernreaktoren wird es aus 238U in einer Reihe von Kernreaktionen gebildet. Ein wichtiger Schritt ist hierbei die (n,γ)- oder Neutroneneinfangsreaktion, bei welcher das gebildete angeregte Tochternuklid durch Aussendung eines γ-Quants in den Grundzustand übergeht. Die hierzu benötigten freien Neutronen entstehen durch Kernspaltung anderer Kerne im Reaktor. In diesem kernchemischen Prozess wird zunächst durch eine (n,γ)-Reaktion gefolgt von zwei β−-Zerfällen das Plutoniumisotop 239Pu gebildet. In Brutreaktoren wird dieser Prozess zum Erbrüten neuen Spaltmaterials genutzt.
- Die angegebenen Zeiten sind Halbwertszeiten.
Zwei weitere (n,γ)-Reaktionen mit anschließendem β−-Zerfall liefern das Americiumisotop 241Am. Dieses ergibt nach einer weiteren (n,γ)-Reaktion mit folgendem β-Zerfall 242Cm.
Zu Forschungszwecken kann Curium auf effizienterem Wege gezielt aus Plutonium gewonnen werden, das im großen Maßstab aus abgebranntem Kernbrennstoff erhältlich ist. Dieses wird hierzu mit einer Neutronenquelle, die einen hohen Neutronenfluss besitzt, bestrahlt. Die hierbei möglichen Neutronenflüsse sind um ein Vielfaches höher als in einem Kernreaktor, so dass hier ein anderer Reaktionspfad als der oben dargestellte überwiegt. Aus 239Pu wird durch vier aufeinander folgende (n,γ)-Reaktionen 243Pu gebildet, welches durch β-Zerfall mit einer Halbwertszeit von 4,96 Stunden zu dem Americiumisotop 243Am zerfällt. Das durch eine weitere (n,γ)-Reaktion gebildete 244Am zerfällt wiederum durch β-Zerfall mit einer Halbwertszeit von 10,1 Stunden letztlich zu 244Cm.[11]
Diese Reaktion findet auch in Kernkraftwerken im Kernbrennstoff statt, so dass 244Cm auch bei der Wiederaufarbeitung abgebrannter Kernbrennstoffe anfällt und auf diesem Wege gewonnen werden kann.
Aus 244Cm entstehen durch weitere (n,γ)-Reaktionen im Reaktor in jeweils kleiner werdenden Mengen die nächst schwereren Isotope. In der Forschung sind besonders die Isotope 247Cm und 248Cm wegen ihrer langen Halbwertszeiten beliebt. Die Entstehung von 250Cm auf diesem Wege ist jedoch sehr unwahrscheinlich, da 249Cm nur eine kurze Halbwertszeit besitzt und so weitere Neutroneneinfänge in der kurzen Zeit unwahrscheinlich sind. Dieses Isotop ist jedoch aus dem α-Zerfall von 254Cf zugänglich. Problematisch ist hierbei jedoch, dass 254Cf hauptsächlich durch Spontanspaltung und nur in geringem Maße durch α-Zerfall zerfällt. 249Cm zerfällt durch β−-Zerfall zu Berkelium 249Bk.
- (n,γ)-Reaktionen für die Nukleonenzahlen A=244–248, selten auch für A=249 und 250.
Durch Kaskaden von (n,γ)-Reaktionen und β-Zerfällen hergestelltes Curium besteht jedoch immer aus einem Gemisch verschiedener Isotope. Eine Auftrennung ist daher mit erheblichem Aufwand verbunden.
Zu Forschungszwecken wird auf Grund seiner langen Halbwertszeit bevorzugt 248Cm verwendet. Die effizienteste Methode zur Darstellung dieses Isotops ist durch den α-Zerfall von Californium 252Cf gegeben, das auf Grund seiner langen Halbwertszeit in größeren Mengen zugänglich ist. Auf diesem Wege gewonnenes 248Cm besitzt eine Isotopenreinheit von 97 %. Etwa 35–50 mg 248Cm werden auf diese Art derzeit pro Jahr erhalten.
Das lediglich zur Isotopenforschung interessante reine 245Cm kann aus dem α-Zerfall von Californium 249Cf erhalten werden, welches in sehr geringen Mengen als Tochternuklid des β−-Zerfalls des Berkeliumisotops 249Bk erhalten werden kann.
Darstellung elementaren Curiums
Metallisches Curium kann durch Reduktion aus seinen Verbindungen erhalten werden. Zuerst wurde Curium(III)-fluorid zur Reduktion verwendet. Dieses wird hierzu in wasser- und sauerstofffreier Umgebung in Reaktionsapparaturen aus Tantal und Wolfram mit elementarem Barium oder Lithium zur Reaktion gebracht.[11][15][20][21][22]
Auch die Reduktion von Curium(IV)-oxid mittels einer Magnesium-Zink-Legierung in einer Schmelze aus Magnesiumchlorid und Magnesiumfluorid ergibt metallisches Curium.[23]
Eigenschaften

Im Periodensystem steht das Curium mit der Ordnungszahl 96 in der Reihe der Actinoide, sein Vorgänger ist das Americium, das nachfolgende Element ist das Berkelium. Sein Analogon in der Reihe der Lanthanoiden ist das Gadolinium.
Physikalische Eigenschaften
Curium ist ein radioaktives Metall. Dieses ist hart und hat ein silbrig-weißes Aussehen ähnlich dem Gadolinium, seinem Lanthanoidanalogon. Auch in seinen weiteren physikalischen und chemischen Eigenschaften ähnelt es diesem stark. Sein Schmelzpunkt von 1340 °C liegt deutlich höher als der der vorhergehenden Transurane Neptunium (637 °C[25]), Plutonium (639 °C) und Americium (1173 °C). Im Vergleich dazu schmilzt Gadolinium bei 1312 °C. Der Siedepunkt von Curium liegt bei 3110 °C.
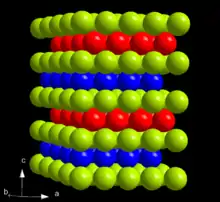
Von Curium existiert bei Standardbedingungen mit α-Cm nur eine bekannte Modifikation. Diese kristallisiert im hexagonalen Kristallsystem in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) mit den Gitterparametern a = 365 pm und c = 1182 pm sowie vier Formeleinheiten pro Elementarzelle.[26] Die Kristallstruktur besteht aus einer doppelt-hexagonal dichtesten Kugelpackung mit der Schichtfolge ABAC und ist damit isotyp zur Struktur von α-La.
Oberhalb eines Drucks von 23 GPa geht α-Cm in β-Cm über. Die β-Modifikation kristallisiert im kubischen Kristallsystem in der Raumgruppe Fm3m (Nr. 225) mit dem Gitterparameter a = 493 pm,[26] was einem kubisch flächenzentrierten Gitter (fcc) beziehungsweise einer kubisch dichtesten Kugelpackung mit der Stapelfolge ABC entspricht.
Die Fluoreszenz angeregter Cm(III)-Ionen ist ausreichend langlebig, um diese zur zeitaufgelösten Laserfluoreszenzspektroskopie zu nutzen.[27] Die lange Fluoreszenz kann auf die große Energielücke zwischen dem Grundterm 8S7/2 und dem ersten angeregten Zustand 6D7/2 zurückgeführt werden. Dies erlaubt die gezielte Detektion von Curiumverbindungen unter weitgehender Ausblendung störender kurzlebiger Fluoreszenzprozesse durch weitere Metallionen und organische Substanzen.[28]
Chemische Eigenschaften
Die stabilste Oxidationsstufe für Curium ist +3. Gelegentlich ist es auch in der Oxidationsstufe +4 zu finden.[29][30] Sein chemisches Verhalten ähnelt sehr dem Americium und vielen Lanthanoiden. In verdünnten wässrigen Lösungen ist das Cm3+-Ion farblos, das Cm4+-Ion blassgelb.[31] In höher konzentrierten Lösungen ist das Cm3+-Ion jedoch ebenfalls blassgelb.[11][32][33]
Curiumionen gehören zu den harten Lewis-Säuren, weshalb sie die stabilsten Komplexe mit harten Basen bilden.[34] Die Komplexbindung besitzt hierbei nur einen sehr geringen kovalenten Anteil und basiert hauptsächlich auf ionischer Wechselwirkung. Curium unterscheidet sich in seinem Komplexierungsverhalten von den früher bekannten Actinoiden wie Thorium und Uran und ähnelt auch hier stark den Lanthanoiden.[35] In Komplexen bevorzugt es eine neunfache Koordination mit dreifach überkappter trigonal-prismatischer Geometrie.
Biologische Aspekte
Curium besitzt keine biologische Bedeutung.[36] Die Biosorption von Cm3+ durch Bakterien und Archäen wurde untersucht.[37][38]
Spaltbarkeit
Die ungeradzahligen Curiumisotope, insbesondere 243Cm, 245Cm und 247Cm eignen sich aufgrund der hohen Spaltquerschnitte prinzipiell auch als Kernbrennstoffe in einem thermischen Kernreaktor. Generell können alle Isotope zwischen 242Cm und 248Cm sowie 250Cm eine Kettenreaktion aufrechterhalten, wenn auch zum Teil nur mit schneller Spaltung. In einem schnellen Reaktor könnte also jede beliebige Mischung der genannten Isotope als Brennstoff verwendet werden.[39] Der Vorteil liegt dann darin, dass bei der Gewinnung aus abgebranntem Kernbrennstoff keine Isotopentrennung durchgeführt werden müsste, sondern lediglich eine chemische Separation des Curiums von den anderen Stoffen.
Die unten stehende Tabelle gibt die kritischen Massen für eine reine Kugelgeometrie ohne Moderator und Reflektor an:
| Isotop | Kritische Masse | Radius |
|---|---|---|
| 242Cm | 371 kg | 40,1 cm |
| 243Cm | 7,34–10 kg | 10–11 cm |
| 244Cm | (13,5)–30 kg | (12,4)–16 cm |
| 245Cm | 9,41–12,3 kg | 11–12 cm |
| 246Cm | 39–70,1 kg | 18–21 cm |
| 247Cm | 6,94–7,06 kg | 9,9 cm |
| 248Cm | 40,4 kg | 19,2 cm |
| 250Cm | 23,5 kg | 16,0 cm |
Mit Reflektor liegen die kritischen Massen der ungeradzahligen Isotope bei etwa 3–4 kg. In wässriger Lösung mit Reflektor lässt sich die kritische Masse für 245Cm bis auf 59 g reduzieren (243Cm: 155 g; 247Cm: 1,55 kg); diese Werte sind aufgrund von Unsicherheiten der für die Berechnung relevanten physikalischen Daten nur auf etwa 15 % genau, dementsprechend finden sich in unterschiedlichen Quellen teils stark schwankende Angaben.[40][39] Aufgrund der geringen Verfügbarkeit und des hohen Preises wird Curium aber nicht als Kernbrennstoff eingesetzt und ist daher in § 2 Abs. 1 des Atomgesetzes in Deutschland auch nicht als solcher klassifiziert.
Die ungeradzahligen Curiumisotope, hier wiederum insbesondere 245Cm und 247Cm, könnten ebenso wie für den Reaktorbetrieb auch zum Bau von Kernwaffen eingesetzt werden. Bomben aus 243Cm wären aber aufgrund der geringen Halbwertszeit des Isotops mit einem erheblichen Wartungsaufwand verbunden. Außerdem müsste 243Cm als α-Strahler durch die beim radioaktiven Zerfall freiwerdende Energie glühend heiß sein, was die Konstruktion einer Bombe sehr erschweren dürfte. Da die kritischen Massen zum Teil sehr klein sind, ließen sich so vergleichsweise kleine Bomben konstruieren. Bisher sind allerdings keine Aktivitäten dieser Art publik geworden, was sich ebenfalls auf die geringe Verfügbarkeit zurückführen lässt.
Isotope
Von Curium existieren nur Radionuklide und keine stabilen Isotope. Insgesamt sind 20 Isotope und 7 Kernisomere des Elements zwischen 233Cm und 252Cm bekannt.[8] Die längsten Halbwertszeiten haben 247Cm mit 15,6 Mio. Jahren und 248Cm mit 348.000 Jahren. Daneben haben noch die Isotope 245Cm mit 8500, 250Cm mit 8300 und 246Cm mit 4760 Jahren lange Halbwertszeiten. 250Cm ist dabei eine Besonderheit, da sein radioaktiver Zerfall zum überwiegenden Teil (etwa 86 %) in spontaner Spaltung besteht.
Die am häufigsten technisch eingesetzten Curiumisotope sind 242Cm mit 162,8 Tagen und 244Cm mit 18,1 Jahren Halbwertszeit.
Die Wirkungsquerschnitte für induzierte Spaltung durch ein thermisches Neutron betragen:[41] für 242Cm etwa 5 b, 243Cm 620 b, 244Cm 1,1 b, 245Cm 2100 b, 246Cm 0,16 b, 247Cm 82 b, 248Cm 0,36 b. Dies entspricht der Regel, nach der meist die Transuran-Nuklide mit ungerader Neutronenzahl "thermisch leicht spaltbar" sind.
Verwendung
Radionuklidbatterien
Da die beiden am häufigsten erbrüteten Isotope, 242Cm und 244Cm, nur kurze Halbwertszeiten (162,8 Tage bzw. 18,1 Jahre) und Alphaenergien von etwa 6 MeV haben, zeigt es eine viel stärkere Aktivität als etwa das in der natürlichen Uran-Radium-Zerfallsreihe erzeugte 226Ra.[6] Aufgrund dieser Radioaktivität gibt es sehr große Wärmemengen ab; 244Cm emittiert 3 Watt/g und 242Cm sogar 120 Watt/g.[42] Diese Curiumisotope können aufgrund der extremen Wärmeentwicklung in Form von Curium(III)-oxid (Cm2O3) in Radionuklidbatterien zur Versorgung mit Elektrischer Energie z. B. in Raumsonden eingesetzt werden. Dafür wurde vor allem die Verwendung von 244Cm untersucht. Als α-Strahler benötigt es eine wesentlich dünnere Abschirmung als die Betastrahler, jedoch ist seine Spontanspaltungsrate und damit die Neutronen- und Gammastrahlung höher als die von 238Pu. Es unterlag daher wegen der benötigten dicken Abschirmung und starken Neutronenstrahlung sowie seiner kürzeren Halbwertszeit (18,1 Jahre) dem 238Pu mit 87,7 Jahren Halbwertszeit.[43]
242Cm wurde auch eingesetzt, um 238Pu für Radionuklidbatterien in Herzschrittmachern zu erzeugen. Im Reaktor erbrütetes 238Pu wird durch die (n,2n)-Reaktion von 237Np immer mit 236Pu verunreinigt, in dessen Zerfallsreihe der starke Gammastrahler 208Tl vorkommt. Ähnliches gilt auch für aus Uran unter Deuteronenbeschuss gewonnene 238Pu. Die anderen gewöhnlicherweise im Reaktor in relevanten Mengen erbrüteten Curium-Isotope führen in ihren Zerfallsreihen schnell auf langlebige Isotope, deren Strahlung für die Konstruktion von Herzschrittmachern dann nicht mehr relevant ist.[44]

Röntgenspektrometer
244Cm dient als α-Strahlenquelle in den vom Max-Planck-Institut für Chemie in Mainz entwickelten α-Partikel-Röntgenspektrometern (APXS), mit denen die Mars-Rover Sojourner, Spirit und Opportunity auf dem Planeten Mars Gestein chemisch analysierten. Auch der Lander Philae der Raumsonde Rosetta ist mit einem APXS ausgestattet, um die Zusammensetzung des Kometen Tschurjumow-Gerassimenko zu analysieren.[45]
Außerdem hatten bereits die Mondsonden Surveyor 5–7 Alphaspektrometer an Bord. Diese arbeiteten jedoch mit 242Cm und maßen die von den α-Teilchen aus dem Mondboden herausgeschlagenen Protonen und zurückgeworfene α-Teilchen.[46][47]
Herstellung anderer Elemente
Weiterhin ist Curium Ausgangsmaterial zur Erzeugung höherer Transurane und Transactinoide. So führt zum Beispiel der Beschuss von 248Cm mit Sauerstoff (18O) beziehungsweise Magnesiumkernen (26Mg) zu den Elementen Seaborgium 265Sg beziehungsweise Hassium 269Hs und 270Hs.[48]
Sicherheitshinweise
Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen, die eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielen. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Da von Curium nur radioaktive Isotope existieren, darf es selbst sowie seine Verbindungen nur in geeigneten Laboratorien unter speziellen Vorkehrungen gehandhabt werden. Die meisten gängigen Curiumisotope sind α-Strahler, weshalb eine Inkorporation unbedingt vermieden werden muss. Auch zerfällt ein Großteil der Isotope zu einem gewissen Anteil unter Spontanspaltung. Das breite Spektrum der hieraus resultierenden meist ebenfalls radioaktiven Tochternuklide stellt ein weiteres Risiko dar, das bei der Wahl der Sicherheitsvorkehrungen berücksichtigt werden muss.[17]
Wirkung im Körper
Wird Curium mit der Nahrung aufgenommen, so wird es größtenteils innerhalb einiger Tage wieder ausgeschieden und lediglich 0,05 % werden in den Blutkreislauf aufgenommen. Von hier werden etwa 45 % in der Leber deponiert, weitere 45 % werden in die Knochensubstanz eingebaut. Die verbleibenden 10 % werden ausgeschieden. Im Knochen lagert sich Curium insbesondere an der Innenseite der Grenzflächen zum Knochenmark an. Die weitere Verbreitung in die Kortikalis findet nur langsam statt.[17]
Bei Inhalation wird Curium deutlich besser in den Körper aufgenommen, weshalb diese Art der Inkorporation bei der Arbeit mit Curium das größte Risiko darstellt. Die maximal zulässige Gesamtbelastung des menschlichen Körpers durch 244Cm (in löslicher Form) beträgt 0,3 µCi.[19]
In Tierversuchen mit Ratten wurde nach einer intravenösen Injektion von 242Cm und 244Cm ein erhöhtes Auftreten von Knochentumoren beobachtet, deren Auftreten als Hauptgefahr bei der Inkorporation von Curium durch den Menschen betrachtet wird. Inhalation der Isotope führte zu Lungen- und Leberkrebs.[17]
Kernreaktor-Abfallproblematik
In wirtschaftlich sinnvoll (d. h. mit langer Verweildauer des Brennstoffs) genutzten Kernreaktoren entstehen physikalisch unvermeidlich Curiumisotope durch (n,γ)-Kernreaktionen mit nachfolgendem β−-Zerfall (siehe auch oben unter Gewinnung von Curiumisotopen). Eine Tonne abgebrannten Kernbrennstoffs enthält durchschnittlich etwa 20 g verschiedener Curiumisotope.[49] Darunter befinden sich auch die α-Strahler mit den Massenzahlen 245–248, die auf Grund ihrer relativ langen Halbwertszeiten in der Endlagerung unerwünscht sind und deshalb zum Transuranabfall zählen. Eine Verminderung der Langzeitradiotoxizität in nuklearen Endlagern wäre durch Abtrennung langlebiger Isotope aus abgebrannten Kernbrennstoffen möglich. Zur Beseitigung des Curiums wird derzeit die Partitioning-&-Transmutation-Strategie verfolgt.[50] Geplant ist hierbei ein dreistufiger Prozess, in welchem der Kernbrennstoff aufgetrennt, in Gruppen aufgearbeitet und endgelagert werden soll. Im Rahmen dieses Prozesses sollen abgetrennte Curiumisotope durch Neutronenbeschuss in speziellen Reaktoren zu kurzlebigen Nukliden umgewandelt werden. Die Entwicklung dieses Prozesses ist Gegenstand der aktuellen Forschung,[27] wobei die Prozessreife zum jetzigen Zeitpunkt noch nicht erreicht ist.
Verbindungen und Reaktionen
→ Kategorie:Curiumverbindung
Oxide
Curium wird leicht von Sauerstoff angegriffen. Von Curium existieren Oxide der Oxidationsstufen +3 (Cm2O3) und +4 (CmO2). Auch das zweiwertige Oxid CmO ist bekannt.[51]
Das schwarze Curium(IV)-oxid kann direkt aus den Elementen dargestellt werden. Hierzu wird metallisches Curium an Luft oder in einer Sauerstoffatmosphäre geglüht.[30] Für Kleinstmengen bietet sich das Glühen von Salzen des Curiums an. Meistens werden hierzu Curium(III)-oxalat (Cm2(C2O4)3) oder Curium(III)-nitrat (Cm(NO3)3) herangezogen.
Aus Curium(IV)-oxid kann das weißliche Curium(III)-oxid durch thermische Zersetzung im Vakuum (ca. 0,01 Pa) bei 600 °C erhalten werden:[30]
Ein weiterer Weg ist durch die Reduktion von Curium(IV)-oxid mit molekularem Wasserstoff gegeben:[52]
Weiterhin ist eine Reihe ternärer oxidischer Curiumverbindungen des Typs M(II)CmO3 bekannt.[53]
Der größte Teil des in freier Natur vorkommenden Curiums (s. Abschnitt "Vorkommen") liegt als Cm2O3 und CmO2 vor.[17]
Halogenide
Von den vier stabilen Halogenen sind Halogenide des Curiums bekannt.
| Oxidationszahl | F | Cl | Br | I |
| +4 | Curium(IV)-fluorid CmF4 braun |
|||
| +3 | Curium(III)-fluorid CmF3 farblos |
Curium(III)-chlorid CmCl3 farblos |
Curium(III)-bromid CmBr3 farblos |
Curium(III)-iodid CmI3 farblos |
Das farblose Curium(III)-fluorid (CmF3) kann durch Versatz von Cm(III)-haltigen Lösungen mit Fluoridionen erhalten werden. Das tetravalente Curium(IV)-fluorid (CmF4) ist nur durch die Umsetzung von Curium(III)-fluorid mit molekularem Fluor zugänglich:[11]
Eine Reihe komplexer Fluoride der Form M7Cm6F31 (M = Alkalimetall) sind bekannt.[54]
Das farblose Curium(III)-chlorid (CmCl3) kann durch die Reaktion von Curium(III)-hydroxid (Cm(OH)3) mit wasserfreiem Chlorwasserstoffgas dargestellt werden. Dieses kann genutzt werden, um die weiteren Halogenide, Curium(III)-bromid (hellgrün) und -iodid (farblos), zu synthetisieren. Hierzu wird Curium(III)-chlorid mit dem Ammoniumsalz des Halogenids umgesetzt:[55]
Chalkogenide und Pentelide
Von den Chalkogeniden sind das Sulfid und das Selenid bekannt. Sie sind durch die Reaktion von gasförmigem Schwefel oder Selen im Vakuum bei erhöhter Temperatur zugänglich.[56]
Die Pentelide des Curiums des Typs CmX sind für die Elemente Stickstoff, Phosphor, Arsen und Antimon dargestellt worden.[11] Ihre Herstellung kann durch die Reaktion von entweder Curium(III)-hydrid (CmH3) oder metallischem Curium mit diesen Elementen bei erhöhter Temperatur bewerkstelligt werden.
Metallorganische Verbindungen
Analog zu Uranocen, einer Organometallverbindung, in der Uran von zwei Cyclooctatetraen-Liganden komplexiert ist, wurden die entsprechenden Komplexe von Thorium, Protactinium, Neptunium, Plutonium und Americium dargestellt. Das MO-Schema legt nahe, dass eine entsprechende Verbindung (η8-C8H8)2Cm, ein Curocen, synthetisiert werden kann, was jedoch bisher nicht gelang.[57]
Literatur
- Gregg J. Lumetta, Major C. Thompson, Robert A. Penneman, P. Gary Eller: Curium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1397–1443 (doi:10.1007/1-4020-3598-5_9).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Band 7 a, Transurane: Teil A 1 I, S. 34–38; Teil A 1 II, S. 18, 315–326, 343–344; Teil A 2, S. 44–45, 164–175, 185–188, 289; Teil B 1, S. 67–72.
Weblinks
- Eintrag zu Curium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- William G. Schulz: Curium, Chemical & Engineering News, 2003.
Einzelnachweise
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Curium) entnommen.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 2149.
- Eintrag zu curium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu curium bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Curium) entnommen.
- Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3, S. 174–178.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Curium) entnommen.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties, in: Nuclear Physics A, 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieses Element entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- G. T. Seaborg, R. A. James, A. Ghiorso: The New Element Curium (Atomic Number 96), NNES PPR (National Nuclear Energy Series, Plutonium Project Record), Vol. 14 B, The Transuranium Elements: Research Papers, Paper No. 22.2, McGraw-Hill Book Co., Inc., New York, 1949 (Abstract; Maschinoskript (Januar 1948), PDF, 876 kB).
- Gregg J. Lumetta, Major C. Thompson, Robert A. Penneman, P. Gary Eller: Curium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1397–1443 (doi:10.1007/1-4020-3598-5_9).
- Rachel Sheremeta Pepling: Americium, Chemical & Engineering News, 2003.
- Patent US3161462: Element 96 and compositions thereof. Angemeldet am 7. Februar 1949, veröffentlicht am 15. Dezember 1964, Erfinder: Glenn T. Seaborg.
- L. B. Werner, I. Perlman: Isolation of Curium, NNES PPR (National Nuclear Energy Series, Plutonium Project Record), Vol. 14 B, The Transuranium Elements: Research Papers, Paper No. 22.5, McGraw-Hill Book Co., Inc., New York, 1949.
- J. C. Wallmann, W. W. T. Crane, B. B. Cunningham: The Preparation and Some Properties of Curium Metal, in: J. Am. Chem. Soc., 1951, 73 (1), S. 493–494 (doi:10.1021/ja01145a537).
- L. B. Werner, I. Perlman: First Isolation of Curium, in: J. Am. Chem. Soc., 1951, 73 (11), S. 5215–5217 (doi:10.1021/ja01155a063).
- Lenntech (Curium).
- P. R. Fields, M. H. Studier, H. Diamond, J. F. Mech, M. G. Inghram, G. L. Pyle, C. M. Stevens, S. Fried, W. M. Manning (Argonne National Laboratory, Lemont, Illinois); A. Ghiorso, S. G. Thompson, G. H. Higgins, G. T. Seaborg (University of California, Berkeley, California): Transplutonium Elements in Thermonuclear Test Debris, in: Physical Review, 1956, 102 (1), S. 180–182 (doi:10.1103/PhysRev.102.180).
- Informationen zum Element Curium bei www.speclab.com (englisch)
- B. B. Cunningham, J. C. Wallmann: Crystal Structure and Melting Point of Curium Metal, in: J. Inorg. Nucl. Chem., 1964, 26 (2), S. 271–275 (doi:10.1016/0022-1902(64)80069-5).
- J. N. Stevenson, J. R. Peterson: Preparation and Structural Studies of Elemental Curium-248 and the Nitrides of Curium-248 and Berkelium-249, in: J. Less Common Metals, 1979, 66 (2), S. 201–210 (doi:10.1016/0022-5088(79)90229-7).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Band 7 a, Transurane, Teil B 1, S. 67–68.
- I. D. Eubanks, M. C. Thompson: Preparation of Curium Metal, in: Inorg. Nucl. Chem. Lett., 1969, 5 (3), S. 187–191 (doi:10.1016/0020-1650(69)80221-7).
- Laserinduzierte orangefarbene Fluoreszenz eines Tris(hydrotris)pyrazolylborato-Cm(III)-Komplexes in Lösung, bei einer Anregungswellenlänge von 396,6 nm.
- WebElements Periodic Table of the Elements: Neptunium physical properties.
- V. Milman, B. Winkler, C. J. Pickard: Crystal Structures of Curium Compounds: An ab initio study, in: Journal of Nuclear Materials, 2003, 322 (2–3), S. 165–179 (doi:10.1016/S0022-3115(03)00321-0).
- M. A. Denecke, A. Rossberg, P. J. Panak, M. Weigl, B. Schimmelpfennig, A. Geist: Characterization and Comparison of Cm(III) and Eu(III) Complexed with 2,6-Di(5,6-dipropyl-1,2,4-triazin-3-yl)pyridine Using EXAFS, TRFLS, and Quantum-Chemical Methods, in: Inorg. Chem., 2005, 44, S. 8418–8425; und darin zitierte Quellen (doi:10.1021/ic0511726).
- J.-C. G. Bünzli, G. R. Choppin: Lanthanide Probes in Life, Chemical and Earth Sciences: Theory and Practice, Elsevier, Amsterdam, 1989.
- Thomas K. Keenan: First Observation of Aqueous Tetravalent Curium, in: J. Am. Chem. Soc., 1961, 83 (17), S. 3719–3720 (doi:10.1021/ja01478a039).
- L. B. Asprey, F. H. Ellinger, S. Fried, W. H. Zachariasen: Evidence for Quadrivalent Curium. X-ray Data on Curium Oxides, in: J. Am. Chem. Soc., 1955, 77 (6), S. 1707–1708 (doi:10.1021/ja01611a108).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1956.
- C. Keller: The Chemistry of the Transuranium Elements, Verlag Chemie, Weinheim 1971, S. 544.
- David R. Lide (ed. in chief): CRC Handbook of Chemistry and Physics, CRC Press, 78th Edition, Boca Raton 1997-1998. Seite 4-9.
- M. P. Jensen, A. H. Bond: Comparison of Covalency in the Complexes of Trivalent Actinide and Lanthanide Cations, in: J. Am. Chem. Soc., 2002, 124 (33), S. 9870–9877 (doi:10.1021/ja0178620).
- G. T. Seaborg: Overview of the Actinide and Lanthanide (the f) Elements, in: Radiochim. Acta, 1993, 61, S. 115–122 (doi:10.1524/ract.1993.61.34.115).
- The Biochemical Periodic Tables – Curium.
- H. Moll, T. Stumpf, M. Merroun, A. Rossberg, S. Selenska-Pobell, G. Bernhard: Time-resolved Laser Fluorescence Spectroscopy Study on the Interaction of Curium(III) with Desulfovibrio äspöensis DSM 10631T, in: Environ. Sci. Technol., 2004, 38 (5), S. 1455–1459 PMID 15046347.
- T. Ozaki, J. B. Gillow, A. J. Francis, T. Kimura, T. Ohnuki, Z. Yoshida: Association of Eu(III) and Cm(III) with Bacillus subtilis and Halobacterium salinarium, in: J. Nuc. Sc. and Tech., 2002, Suppl. 3, S. 950–953 (doi:10.1080/00223131.2002.10875626).
- Institut de Radioprotection et de Sûreté Nucléaire: Evaluation of nuclear criticality safety data and limits for actinides in transport (Memento vom 18. November 2014 im Internet Archive) (PDF, S. 16).
- H. Okundo, H. Kawasaki: Critical and Subcritical Mass Calculations of Curium-243 to -247 Based on JENDL-3.2 for Revision of ANSI/ANS-8.15, in: J. Nuc. Sc. and Tech., 2002, 39, S. 1072–1085 (doi:10.1080/18811248.2002.9715296).
- G. Pfennig, H. Klewe-Nebenius, W. Seelmann-Eggebert (Hrsg.): Karlsruher Nuklidkarte, 6. Aufl., korrig. Nachdr. 1998.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Band 7 a, Transurane, Teil A 2, S. 289.
- Nuklide für RTGs (PDF; 297 kB) letzte Seite.
- Basiswissen-Kernenergie: Plutonium-Batterien (Memento vom 26. Dezember 2013 im Internet Archive).
- Bernd Leitenberger: Der Rosetta Lander Philae.
- Bernd Leitenberger: Die Surveyor Raumsonden.
- SP-480 Far Travelers: The Exploring Machines: Essentials for Surveyor.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1980–1981.
- Klaus Hoffmann: Kann man Gold machen? Gauner, Gaukler und Gelehrte. Aus der Geschichte der chemischen Elemente, Urania-Verlag; Leipzig, Jena, Berlin 1979, keine ISBN, S. 233.
- L. H. Baetsle: Application of Partitioning/Transmutation of Radioactive Materials in Radioactive Waste Management, September 2001 (PDF, 2,4 MB (Memento vom 26. April 2005 im Internet Archive)).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1972.
- H. O. Haug: Curium Sesquioxide Cm2O3, in: J. Inorg. Nucl. Chem., 1967, 29 (11), S. 2753–2758 (doi:10.1016/0022-1902(67)80014-9).
- J. Fuger, R. G. Haire, J. R. Peterson: Molar Enthalpies of Formation of BaCmO3 and BaCfO3, in: J. Alloys Compds., 1993, 200 (1–2), S. 181–185 (doi:10.1016/0925-8388(93)90491-5).
- T. K. Keenan: Lattice Constants of K7Cm6F31 trends in the 1:1 and 7:6 Alkali Metal-actinide(IV) Series, in: Inorg. Nucl. Chem. Lett., 1967, 3 (10), S. 391–396 (doi:10.1016/0020-1650(67)80092-8).
- L. B. Asprey, T. K. Keenan, F. H. Kruse: Crystal Structures of the Trifluorides, Trichlorides, Tribromides, and Triiodides of Americium and Curium, in: Inorg. Chem., 1965, 4 (7), S. 985–986 (doi:10.1021/ic50029a013).
- D. Damien, J. P. Charvillat, W. Müller: Preparation and Lattice Parameters of Curium Sulfides and Selenides, in: Inorg. Nucl. Chem. Lett., 1975, 11 (7–8), S. 451–457 (doi:10.1016/0020-1650(75)80017-1).
- Christoph Elschenbroich: Organometallchemie, 6. Auflage, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 589.
.jpg.webp)
