Europium
Europium ist ein chemisches Element mit dem Elementsymbol Eu und der Ordnungszahl 63. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der Seltenen Erden. Nur Europium und Americium sind nach einem Erdteil benannte Elemente.
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Europium, Eu, 63 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Lanthanoide | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | La, 6, f | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß | |||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-161-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.328 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,099 ppm[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 151,964(1)[3] u | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 185 (231) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 198 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f7 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 5.670385(5) eV[4] ≈ 547.11 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 11.240(6) eV[4] ≈ 1084.5 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 24.84(3) eV[4] ≈ 2400 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 42.94(11) eV[4] ≈ 4140 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 63.2(4) eV[4] ≈ 6100 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch raumzentriert | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 5,245 g/cm3 (25 °C)[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 0,013)[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1099 K (826 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 1713 K[9] (1440 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 28,97 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 176 kJ·mol−1[9] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 9,2 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 1,11 · 106 A·V−1·m−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 14 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 2, 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −1,99 V (Eu3+ + 3 e− → Eu) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||
Wie die anderen Lanthanoide ist Europium ein silberglänzendes Schwermetall. Die Eigenschaften des Europiums folgen nicht der Lanthanoidenkontraktion. Aufgrund seiner Elektronenkonfiguration weist das Element eine deutlich geringere Dichte sowie einen niedrigeren Schmelz- und Siedepunkt auf als die benachbarten Elemente. Es ist das chemisch reaktivste Seltenerdmetall. Nach ersten Hinweisen auf das Element durch William Crookes und Paul Émile Lecoq de Boisbaudran konnte 1896 Eugène-Anatole Demarçay das Element zunächst spektroskopisch nachweisen und dann isolieren.
Europium hat eine hohe technische Bedeutung in Leuchtstoffen, wie sie etwa in Kathodenstrahlröhrenbildschirmen, welche früher für Computermonitore und Fernseher verwendet wurden, in Leuchtstofflampen sowie in Plasmabildschirmen eingesetzt werden. Sowohl der rote als auch der blaue Leuchtstoff in diesen Bildschirmen und Leuchtmitteln sind Substanzen, die mit Europium dotiert sind und dadurch Fluoreszenz in dem entsprechenden Spektralbereich zeigen.
Geschichte
Einen ersten Hinweis auf das später Europium genannte Element fand 1885 William Crookes. Bei der Untersuchung von Fluoreszenzspektren von Samarium-Yttrium-Mischungen konnte er Signale einer ungewöhnlichen orangefarbenen Spektrallinie messen, die in Mischungen der Elemente stärker war als in den reinen Stoffen. Diese auf ein unbekanntes Element hindeutende Spektrallinie nannte er „anormale Linie“, das hypothetische Element Sδ.[12] Eine weitere Entdeckung auf dem Weg zum unbekannten Element machte 1892 Paul Émile Lecoq de Boisbaudran, als er im Funkenspektrum von Samarium neben der anormalen Linie Crookes auch drei bislang unbekannte blaue Spektrallinien entdeckte.[13] 1896 postulierte Eugène-Anatole Demarçay anhand von Ultraviolett-Spektren die Existenz eines bislang unbekannten Elements zwischen Samarium und Gadolinium,[14] wobei er im Jahr 1900 erkannte, dass dieses Element gleich dem von Crookes und Boisbaudran vermuteten sein muss. 1901 gelang es Demarçay, dieses durch fraktionierte Kristallisation der Samarium/Europium-Magnesium-Nitrat-Doppelsalze zu isolieren. Er nannte das Element nach dem Kontinent Europa Europium.[15][16] In Analogie zum Europium benannten Glenn T. Seaborg, Ralph A. James und Leon O. Morgan 1948 das sich im Periodensystem direkt unter dem Europium befindende Actinoid ebenfalls nach einem Kontinent Americium.[17]
Die erste wichtige technische Anwendung des Elements war die Produktion von mit Europium dotiertem Yttriumvanadat. Dieser 1964 von Albert K. Levine und Frank C. Palilla entdeckte rote Leuchtstoff spielte bald eine wichtige Rolle bei der Entwicklung des Farbfernsehens.[18] Für diese Anwendung wurde daraufhin das erste Bergwerk für die Gewinnung von Seltenen Erden, das seit 1954 im kalifornischen Mountain Pass betrieben wurde,[19] stark ausgebaut.[20]
Vorkommen
Europium ist auf der Erde ein seltenes Element, die Häufigkeit in der kontinentalen Erdkruste beträgt etwa 2 ppm.[21]
Europium kommt als Nebenbestandteil in verschiedenen Lanthanoid-Mineralen vor, Minerale mit Europium als Hauptbestandteil sind unbekannt. Das Element ist sowohl in Ceriterden wie Monazit und Bastnäsit als auch in Yttererden wie Xenotim enthalten, der Anteil an Europium beträgt in der Regel zwischen 0,1 und 0,2 %.[22] Das für die Gewinnung von Europium wichtigste Vorkommen war bis 1985 das Bastnäsiterz in Mountain Pass, Kalifornien, danach gewannen chinesische Bergwerke – vor allem das Erzvorkommen in Bayan Obo – große Bedeutung.[23]
In manchen magmatischen Gesteinen ist die Konzentration an Europium höher oder geringer, als nach dem mit Chondriten als Standard bestimmten relativen Häufigkeitsverhältnis der Seltenerdmetalle zu erwarten wäre. Dieses Phänomen wird als Europiumanomalie bezeichnet und beruht darauf, dass unter reduzierenden Bedingungen in Magma Eu3+ zu Eu2+ reduziert werden kann. Dieses besitzt einen größeren Ionenradius als dreiwertiges Europium und wird darum leicht in bestimmte Minerale, etwa an Stelle von Strontium oder Calcium in Kalifeldspat und Plagioklas eingebaut, welche dadurch eine positive Europiumanomalie aufweisen. Diese Minerale kristallisieren aus der Magmaschmelze und werden dadurch abgetrennt, während dreiwertiges Europium in der Restschmelze gelöst bleibt.[24][25] Für den Einbau in mafische Gesteine wie Pyroxen und Olivin anstelle von Eisen, Magnesium und Calcium ist das Eu2+-Ion dagegen zu groß und es kommt zu einer negativen Europiumanomalie.[26] Außer durch Kristallisation von Plagioklas kann eine Europiumanomalie auch beim Aufschmelzen von Gesteinen entstehen. Da der Verteilungskoeffizient zwischen Kristall und Schmelze etwa 10-fach größer als für die anderen Seltenerdelemente ist, wird beim teilweisen Aufschmelzen eines Plagioklas-reichen Gesteins nur wenig Europium in die Schmelze abgegeben und es resultiert beim Wiedererstarren ein Gestein mit negativer Europiumanomalie. Die Europiumanomalie ist ein Indikator für den Fraktionierungsgrad eines magmatischen Gesteins.
Eine ausgeprägte Europiumanomalie wurde in Mondgestein gefunden, wobei die Plagioklas-reichen Felsen des Mondhochlandes eine positive (erhöhte Europiumgehalte), die in Kratern und Maria gefundenen Basaltgesteine eine negative Europiumanomalie aufweisen. Dies lässt Rückschlüsse auf die geologische Geschichte des Mondes zu.[27] Dabei wird angenommen, dass die Hochländer mit ihren Anorthositen vor etwa 4,6–4,4 Milliarden Jahren aus dem Mondmantel differenzierten und dieser somit aus Europium-verarmten Olivin-Pyroxen-Gesteinen besteht. Die jüngeren Basalte in den Maria, die aus basaltischen Teilschmelzen dieses Mantels bestehen, sind darum so arm an Europium.[28]
Gewinnung und Darstellung

Aufgrund der Ähnlichkeit zu den Begleitmetallen und der geringen Konzentration in den Erzen ist die Abtrennung von den anderen Lanthanoiden schwierig, gleichzeitig aber wegen der Verwendung des Elements technisch besonders wichtig. Nach dem Aufschluss der Ausgangsmaterialien wie Monazit oder Bastnäsit mit Schwefelsäure oder Natronlauge sind verschiedene Wege zur Abtrennung möglich. Neben dem Ionenaustausch wird vor allem ein Verfahren eingesetzt, das auf Flüssig-Flüssig-Extraktion und der Reduktion von Eu3+ zu Eu2+ beruht. Dabei wird bei Bastnäsit als Ausgangsmaterial zunächst das Cer in Form von Cer(IV)-oxid abgetrennt und die verbleibenden Seltenen Erden in Salzsäure gelöst. Daraufhin werden mit Hilfe einer Mischung von DEHPA (Di(2-ethylhexyl)phosphorsäure) und Kerosin in Flüssig-Flüssig-Extraktion Europium, Gadolinium und Samarium von den übrigen Seltenerdmetallen getrennt. Die Trennung dieser drei Elemente erfolgt über die Reduktion des Europiums zu Eu2+ und Fällung als schwerlösliches Europium(II)-sulfat, während die anderen Ionen in Lösung bleiben.[22]
Metallisches Europium kann durch Reaktion von Europium(III)-oxid mit Lanthan oder Mischmetall gewonnen werden. Wird diese Reaktion im Vakuum durchgeführt, destilliert Europium ab und kann so von anderen Metallen und Verunreinigungen getrennt werden:[22]
2010 wurden etwa 600 Tonnen Europium produziert und 500 Tonnen verbraucht (jeweils gerechnet als Europiumoxid). Durch den steigenden Bedarf an Europium ist jedoch zu befürchten, dass mittelfristig die Nachfrage das Angebot übersteigt und es zu einer Verknappung kommen wird. Daher wird an einer Ausweitung der Europiumproduktion, insbesondere durch Eröffnung weiterer Minen wie der im australischen Mount Weld und einer Wiedereröffnung der Mountain Pass Mine gearbeitet. Durch die hohe Nachfrage nach Europium ist auch der Preis des Elements stark gestiegen. Lag er 2002 noch bei 240 US-Dollar pro Kilogramm, stieg er 2011 auf bis zu 1830 Dollar pro Kilogramm (jeweils 99 % Reinheit).[29][30]
Eigenschaften
Physikalische Eigenschaften
Europium ist wie die anderen Lanthanoide ein silberglänzendes weiches Schwermetall. Es besitzt mit 5,245 g/cm3 eine ungewöhnlich niedrige Dichte, die deutlich niedriger als diejenige der benachbarten Lanthanoide wie Samarium oder Gadolinium und geringer als die des Lanthans ist. Vergleichbares gilt auch für den verhältnismäßig niedrigen Schmelzpunkt von 826 °C und den Siedepunkt von 1440 °C (Gadolinium: Schmelzpunkt 1312 °C, Siedepunkt 3000 °C). Diese Werte stehen der sonst geltenden Lanthanoidenkontraktion entgegen und werden durch die Elektronenkonfiguration [Xe] 4f7 6s2 des Europiums verursacht. Durch die halb gefüllte f-Schale stehen nur die zwei Valenzelektronen (6s2) für metallische Bindungen zur Verfügung; es kommt daher zu geringeren Bindungskräften und zu einem deutlich größeren Metallatomradius. Vergleichbares ist auch bei Ytterbium zu beobachten. Bei diesem Element stehen durch eine vollständig gefüllte f-Schale ebenfalls nur zwei Valenzelektronen für metallische Bindungen zur Verfügung.[31]
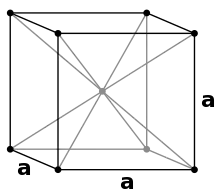
Europium kristallisiert unter Normalbedingungen in einem kubisch-raumzentrierten Gitter mit dem Gitterparameter a = 455 pm.[32] Neben dieser Struktur sind noch zwei weitere Hochdruckmodifikationen bekannt. Dabei entspricht die Reihenfolge der Modifikationen bei steigendem Druck wie bei Ytterbium nicht derjenigen der übrigen Lanthanoide. So ist weder eine Europiummodifikation in doppelt-hexagonaler Struktur noch in Samarium-Struktur bekannt. Der erste Phasenübergang im Metall findet bei 12,5 GPa statt, oberhalb dieses Druckes kristallisiert Europium in einer hexagonal-dichtesten Struktur mit den Gitterparametern a = 241 pm und c = 545 pm. Oberhalb von 18 GPa wurde mit Eu-III eine weitere, der hexagonal-dichtesten Kugelpackung ähnliche Struktur gefunden.[33][34]
Bei hohen Drücken von mindestens 34 GPa ändert sich die Elektronenkonfiguration des Europiums im Metall von zwei- auf dreiwertig. Dies ermöglicht auch eine Supraleitfähigkeit des Elements, die bei einem Druck von etwa 80 GPa und einer Temperatur von etwa 1,8 K auftritt.[35]
Europiumionen, die in geeignete Wirtsgitter eingebaut sind, zeigen eine ausgeprägte Fluoreszenz. Dabei ist die abgestrahlte Wellenlänge von der Oxidationsstufe abhängig. Eu3+ fluoresziert weitgehend unabhängig vom Wirtsgitter zwischen 613 und 618 nm, was einer intensiv roten Farbe entspricht.[36] Das Maximum der Emission von Eu2+ ist dagegen stärker vom Wirtsgitter abhängig und liegt beispielsweise bei Bariummagnesiumaluminat mit 447 nm im blauen[37], bei Strontiumaluminat (SrAl2O4:Eu2+) mit 520 nm im grünen Spektralbereich.[38]
Chemische Eigenschaften

Europium ist ein typisches unedles Metall und reagiert mit den meisten Nichtmetallen. Es ist das reaktivste der Lanthanoide und reagiert schnell mit Sauerstoff. Wird es auf etwa 180 °C erhitzt, entzündet es sich an der Luft spontan und verbrennt zu Europium(III)-oxid.[39]
Auch mit den Halogenen Fluor, Chlor, Brom und Iod reagiert Europium zu den Trihalogeniden. Bei der Reaktion mit Wasserstoff bilden sich nichtstöchiometrische Hydridphasen, wobei der Wasserstoff in die Lücken der Kugelpackung des Metalls eintritt.[31]
Europium löst sich in Wasser langsam, in Säuren schnell unter Bildung von Wasserstoff und des farblosen Eu3+-Ions. Das ebenfalls farblose Eu2+-Ion lässt sich durch elektrolytische Reduktion an Kathoden in wässriger Lösung gewinnen. Es ist das einzige zweiwertige Lanthanoid-Ion, das in wässriger Lösung stabil ist. Europium löst sich in Ammoniak, wobei sich wie bei Alkalimetallen eine blaue Lösung bildet, in der solvatisierte Elektronen vorliegen.[31]
Das Eu3+-Kation gehört neben u. a. Sm3+, Tb3+ und Dy3+ zu den Lanthanoid-Kationen, die in einem geeigneten Komplex bei Absorption bestimmter Wellenlängen Licht im sichtbaren Bereich emittieren kann. Das dreiwertige Europium-Kation ist in einer wässrigen Lösung farblos, werden aber organische Liganden mit einem ausgedehnten π-Elektronensystem koordiniert sorgt der Antenneneffekt dafür, dass die lumineszenten Eigenschaften des Zentralteilchens stark steigen. So leiten die π-Elektronen des Ligandens die absorbierte Energie des einfallenden Lichtes (ca. 355 nm) zu den 5d-Elektronen des Eu3+, wodurch diese in das 4f-Orbital gelangen und beim Zurückfallen Licht im sichtbaren Bereich (bei ca. 610 nm) emittieren.
Isotope
Es sind insgesamt 38 Isotope und weitere 13 Kernisomere des Europiums zwischen 130Eu und 167Eu bekannt. Von diesen ist eines, 153Eu, stabil, ein weiteres, 151Eu, galt lange Zeit als stabil; es wurden 2007 jedoch Hinweise darauf gefunden, dass es mit einer Halbwertszeit von mindestens 1,7 Trillionen Jahren als Alphastrahler zerfällt.[40] Diese beiden Isotope kommen in der Natur vor, wobei 153Eu mit einem Anteil von 52,2 % an der natürlichen Isotopenzusammensetzung das häufigere ist, der Anteil an 151Eu beträgt dementsprechend 47,8 %.[41]
Mehrere Europiumisotope wie 152Eu, 154Eu und 155Eu entstehen bei Kernspaltungen von Uran und Plutonium. Dabei ist 155Eu mit einem Anteil von etwa 0,03 % an der Gesamtmenge der Spaltprodukte das häufigste Europiumisotop unter den Spaltprodukten.[42] Es konnte unter anderem im Rongelap-Atoll drei Jahre nach der Kontaminierung durch den Castle-Bravo-Atomwaffentest nachgewiesen werden.[43]
Verwendung

Europium wird vor allem als Dotierungsmittel für die Produktion von Leuchtstoffen eingesetzt, die etwa in Kathodenstrahlröhrenbildschirmen, welche früher hauptsächlich für Computerbildschirme und Fernseher verwendet wurden sowie für Flugzeuginstrumente benötigt werden, und in Kompaktleuchtstofflampen Verwendung finden. Es werden Leuchtstoffe sowohl mit zwei- als auch dreiwertigem Europium für verschiedene Farben verwendet. Für rote Leuchtstoffe wird vor allem mit Europium dotiertes Yttriumoxid (Y2O3:Eu3+), früher wurden auch Yttriumoxysulfid oder als erster wichtiger roter Leuchtstoff Yttriumvanadat:Eu3+ genutzt. Eu2+ wird meist als blauer Leuchtstoff in Verbindungen wie Strontiumchlorophosphat (Sr5(PO4)3Cl:Eu2+, Strontiumchloroapatit SCAP) und Bariummagnesiumaluminat (BaMgAl11O17:Eu2+, BAM) eingesetzt.[44][37] Plasmabildschirme erfordern Leuchtstoffe, die die vom Edelgas-Plasma emittierte VUV-Strahlung in sichtbares Licht umwandeln. Hierfür werden sowohl für das blaue als auch rote Spektrum europiumdotierte Leuchtstoffe genutzt – für blaues Licht BAM, für rotes (Y,Gd)BO3:Eu3+.[45]
In Quecksilberhochdrucklampen, die etwa in der Straßenbeleuchtung eingesetzt werden, wird europiumdotiertes Yttriumvanadat auf das Glas aufgebracht, damit das Licht weiß und natürlicher erscheint.[46]
Europium kann auf Grund seiner Neutronenabsorption in Steuerstäben für Kernreaktoren verwendet werden. Europiumhaltige Steuerstäbe wurden unter anderem in verschiedenen sowjetischen Versuchsreaktoren wie BOR-60 und BN-600 erprobt.[47]
Als EuropiumHexaBorid wird es auch als Beschichtung für die Herstellung von Oxidkathoden zur Glühemission angeboten.
Bei Euro-Banknoten wird die Europium-Fluoreszenz gegen Fälschungen verwendet.[48]
Diese Eigenschaft kann auch in der Fluoreszenzspektroskopie ausgenutzt werden. Dazu wird das Europium beispielsweise in einem geeigneten Komplex gebunden, der an der gewünschten Stelle, etwa mit einem bestimmten Protein, bevorzugt reagiert und sich dort anreichert.[36]
Biologische Bedeutung und Toxizität
Europium kommt nur in minimalen Mengen im Körper vor und hat keine biologische Bedeutung. Auch durch Pflanzenwurzeln kann das Element nicht aufgenommen werden.[39]
Lösliche Europiumverbindungen sind leicht giftig; so wurde für Europium(III)-chlorid ein LD50-Wert von 550 mg/kg für intraperitoneale und 5000 mg/kg für orale Gabe an Mäusen ermittelt. Es konnte keine chronische Toxizität festgestellt werden, was möglicherweise mit der geringen Aufnahme von Europium im Darm und der schnellen Umwandlung von löslichem Europiumchlorid zu unlöslichem Europiumoxid unter basischen Bedingungen zusammenhängt.[49] Unlösliche Europiumverbindungen gelten als weitgehend ungiftig, wie in einer Studie mit Europium(III)-hydroxid-Nanopartikeln an Mäusen ermittelt wurde.[50]
Bei Europium(III)-hydroxid-Nanopartikeln (nicht jedoch bei amorphem Europium(III)-hydroxid) wurde eine pro-angiogenetische Wirkung festgestellt, sie fördern in vitro die Zellproliferation von Endothelzellen, in vivo an Hühnereiern wurde eine vermehrte Bildung von kleinen Blutgefäßen beobachtet. Ein möglicher Mechanismus für diese Beobachtung ist die Bildung von reaktiven Sauerstoffspezies und die Aktivierung von MAP-Kinasen durch diese Nanopartikel.[51]
Verbindungen
Es sind Verbindungen in den Oxidationsstufen +2 und +3 bekannt, wobei wie bei allen Lanthanoiden zwar die dreiwertige Stufe die stabilere, die zweiwertige jedoch ebenfalls ungewöhnlich stabil ist und daher eine Vielzahl von Eu(II)-Verbindungen existieren. Die Ionenradien unterscheiden sich je nach Oxidationsstufe, wobei Eu2+-Ionen größer als Eu3+-Ionen sind. Mit der Koordinationszahl sechs betragen sie 131 pm für Eu2+ und 108,7 pm für Eu3+. Der effektive Ionenradius (der als Bezugsgröße ein mit 140 pm um 14 pm größeres O2−-Ion verwendet) beträgt dementsprechend 117 pm bzw. 94,7 pm für die Koordinationszahl sechs. In höheren Koordinationszahlen sind die Ionenradien größer, so beträgt er für Eu2+ in der Koordinationszahl acht 139 pm.[52]
Sauerstoffverbindungen

Europium(III)-oxid, Eu2O3, ist die technisch wichtigste Europiumverbindung und dient als Ausgangsmaterial zur Herstellung anderer Europiumverbindungen sowie als Dotierungsmittel für Fluoreszenzfarbstoffe wie Y2O3:Eu3+, das eine besonders intensive rote Fluoreszenz bei einem Europium(III)-oxid-Gehalt von etwa 10 % zeigt. Es kristallisiert wie die anderen Lanthanoidoxide in der kubischen Lanthanoid-C-Struktur.[53][54]
Europium(II)-oxid, EuO, ist ein violett-schwarzer ferromagnetischer Feststoff mit einer Curie-Temperatur von 70 K, der in einer Natriumchlorid-Struktur kristallisiert. Es lässt sich durch Reduktion von Europium(III)-oxid mit Europium gewinnen und ist das einzige zweiwertige Oxid der Lanthanoide, das unter Normalbedingungen stabil ist.[22] Neben diesen beiden Oxiden ist auch das gemischtvalente Oxid Europium(II,III)-oxid, Eu3O4, bekannt.[55]
Weitere Europiumverbindungen
Ähnliche Eigenschaften wie EuO haben auch die Eu-Chalkogenide (also -Sulfide, -Selenide und -Telluride) sowie ihre ungeordneten Legierungen. Eu1-xSrxS ist z. B. für x=0 ein Ferromagnet, der für zu einem isolierenden Spinglas wird, das u. a. wegen seines nichtmetallischen Verhaltens für Computersimulationen besonders geeignet ist.[56]
Mit den Halogenen Fluor, Chlor, Brom und Iod reagiert Europium zu den Trihalogeniden. Diese zersetzen sich beim Erhitzen zu den Dihalogeniden und elementaren Halogenen.[31]
In einer äquimolaren Lösung aus Europium(III)-acetat und Chrom(VI)-oxid kann auch Europium(III)-chromat erstellt werden.
Europium bildet metallorganische Verbindungen. Anders als bei den anderen Lanthanoiden lässt sich aber keine Cyclopentadienylverbindung des dreiwertigen Europiums synthetisieren. Bekannt ist zwar eine Verbindung, die neben drei Molekülen Cyclopentadienyl zusätzlich ein Molekül Tetrahydrofuran enthält, dieses ist jedoch stark an das Europium gebunden und lässt sich durch Erhitzen oder im Vakuum nicht entfernen, da die Verbindung sich vorher zersetzt.[57] Dagegen sind das Europiumdicyclopentadienyl (Cp)2Eu(II) und weitere bekannte Derivate stabil.[58][59] Vom zweiwertigen Europium sind auch Alkinyl-Europium-Verbindungen bekannt.[60]
Einen Überblick über Europiumverbindungen bietet die Kategorie:Europiumverbindung.
Literatur
- Ian McGill: Rare Earth Elements. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2012, doi:10.1002/14356007.a22_607.
Weblinks
- Eintrag zu Europium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Europium) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu europium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu europium bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Europium) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1579.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Europium) entnommen.
- Eintrag zu Europium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. November 2021. (JavaScript erforderlich)
- William Crookes: On Radiant Matter Spectroscopy. Part II. Samarium. In: Philosophical Transactions of the Royal Society of London. Band 176, 1885, S. 691–723, doi:10.1098/rstl.1885.0014.
- Paul Émile Lecoq de Boisbaudran: Recherches sur le samarium. In: Comptes rendus. Band 114, 1892, S. 575–577 (Digitalisat auf Gallica).
- Eugène-Anatole Demarçay: Sur un nouvel élément contenu, dans les terres rares voisines du samarium. In: Comptes rendus. Band 122, 1896, S. 728–730 (Digitalisat auf Gallica).
- Eugène-Anatole Demarçay: Sur un nouvel élément, europium. In: Comptes rendus. Band 132, 1901, S. 1484–1486 (Digitalisat auf Gallica).
- William Crookes: On the Phosphorescent Spectra of S δ and Europium. In: Proceedings of the Royal Society of London. Band 76, Nr. 511, 1905, S. 411–414 (Abstract).
- G. T. Seaborg, R. A. James, L. O. Morgan: The New Element Americium (Atomic Number 95). In: NNES PPR. (National Nuclear Energy Series, Plutonium Project Record). Vol. 14 B The Transuranium Elements: Research Papers. Paper No. 22.1, McGraw-Hill Book Co., New York 1949; Abstract; Maschinoskript (Januar 1948) (PDF; 1,9 MB).
- Albert K. Levine, Frank C. Palilla: A new, highly efficient red-emitting cathodoluminiscent phosphor (YVO4:Eu) for color television. In: Applied Physics Letters. Band 5, 1964, S. 118, doi:10.1063/1.1723611.
- Stephen B. Castor: Rare Earth Deposits of North America. In: Resource Geology. Band 58, 2008, S. 337–347, doi:10.1111/j.1751-3928.2008.00068.x.
- Harald Elsner: Kritische Versorgungslage mit schweren Seltenen Erden – Entwicklung „Grüner Technologien“ gefährdet? In: Commodity Top News. 2011, Nr. 36 (PDF)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth’s Crust and in the Sea, S. 14-18.
- Ian McGill: Rear Earth Elements. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2012, doi:10.1002/14356007.a22_607.
- Gordon B. Haxel, James B. Hedrick, Greta J. Orris: Rare Earth Elements—Critical Resources for High Technology. United States Geological Survey Fact Sheet 087-02, 2002.
- Shyama P. Sinha: Systematics and the properties of the lanthanides. Springer, 1983, ISBN 90-277-1613-7, S. 550–551 (eingeschränkte Vorschau in der Google-Buchsuche).
- D. F. Weill, M. J. Drake: Europium Anomaly in Plagioclase Feldspar: Experimental Results and Semiquantitative Model. In: Science. Band 180, 1973, S. 1059–1060, doi:10.1126/science.180.4090.1059.
- Myron G. Best: Igneous and Metamorphic Petrology. Freeman, New York, 1982, ISBN 0-7167-1335-7, S. 56.
- S. R. Taylor, P. Jakes: The geochemical evolution of the moon. In: Lunar Science Conference, 5th, Houston, Tex., March 18–22, 1974, Proceedings. Band 2, 1974, S. 1287–1305 (Volltext)
- S. R. Taylor: Lunar Science: A post-Apollo View. Pergamon, New York 1975, S. 156.
- Steven Chu: Critical Materials Strategy. DIANE Publishing, 2011, ISBN 978-1-4379-4418-1, S. 87–88 (eingeschränkte Vorschau in der Google-Buchsuche).
- Abigail Walters, Paul Lusty: Rear Earth Elements. British Geological Survey, 2011 (pdf, 4.7 MB).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1938–1944.
- C. S. Barrett: Crystal Structure of Barium and Europium at 293, 78, and 5°K. In: The Journal of Chemical Physics. Band 25, 1956, S. 1123, doi:10.1063/1.1743161.
- K. Takemura, K. Syassen: Pressure-volume relations and polymorphism of europium and ytterbium to 30 GPa. In: Journal of Physics F: Metal Physics. Band 15, 1985, S. 543–559, doi:10.1088/0305-4608/15/3/010.
- W. A. Grosshans, W. B. Holzapfel: X-ray studies on europium and ytterbium up to 40 GPa. In: Journal of Magnetism and Magnetic Materials. Band 47–48, 1985, S. 295–296, doi:10.1016/0304-8853(85)90420-2.
- M. Debessai, T. Matsuoka, J. Hamlin, J. Schilling, K. Shimizu: Pressure-Induced Superconducting State of Europium Metal at Low Temperatures. In: Physical Review Letters. Band 102, 2009, S. 197002–197005, doi:10.1103/PhysRevLett.102.197002.
- F. W. D. Rost: Fluorescence Microscopy. Band 2, Cambridge University Press, 1995, ISBN 0-521-41088-6, S. 291 (eingeschränkte Vorschau in der Google-Buchsuche).
- Peter Bamfield: Chromic phenomena. Technological applications of colour chemistry. Royal Society of Chemistry, 2001, ISBN 0-85404-474-4, S. 159 (eingeschränkte Vorschau in der Google-Buchsuche).
- Arunachalam Lakshmanan: Luminescence and Display Phosphors. Phenomena and Applications. Nova Publishers, 2008, ISBN 978-1-60456-018-3, S. 269 (eingeschränkte Vorschau in der Google-Buchsuche).
- John Emsley: Nature’s building blocks. An A–Z guide to the elements. Oxford University Press, 2001, ISBN 0-19-850341-5, S. 139–141 (eingeschränkte Vorschau in der Google-Buchsuche).
- P. Belli, R. Bernabei, F. Cappella, R. Cerulli, C. J. Dai, F. A. Danevich, A. d Angelo, A. Incicchitti, V. V. Kobychev, S. S. Nagorny, S. Nisi, F. Nozzoli, D. Prosperi, V. I. Tretyak, S. S. Yurchenko: Search for α decay of natural Europium. In: Nuclear Physics. Band A 789, 2007, S. 15–29, doi:10.1016/j.nuclphysa.2007.03.001.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- Argonne National Laboratory: Europium (Memento vom 16. Dezember 2011 im Internet Archive) (PDF; 93 kB). Human Health Fact Sheet, August 2005.
- Ralph F. Palumbo, Frank G. Lowman: The occurence of antimony-125, europium-155, iron-55, and other radionuclides in rongelap atoll soil. United States Atomic Energy Commission. 1958 (pdf)
- Regino Saez, Paul A. Caro: Rare Earths. Editorial Complutense, 1998, ISBN 84-89784-33-7, S. 323–326 (eingeschränkte Vorschau in der Google-Buchsuche).
- Pekka Hänninen, Harri Härmä: Lanthanide Luminescence. Photophysical, Analytical and Biological Aspects. Springer, 2011, ISBN 978-3-642-21022-8, S. 220 (eingeschränkte Vorschau in der Google-Buchsuche).
- Per Enghag: Encyclopedia of the Elements. John Wiley & Sons, 2008, ISBN 978-3-527-61234-5, S. 485–486 (eingeschränkte Vorschau in der Google-Buchsuche).
- E. P. Klochkov, V. D. Risovanyi, Yu. E. Vaneev, A. N. Dorofeev: Radiation Characteristics of Europium-Containing Control Rods in a SM-2 Reactor after Long-Term Operation. In: Atomic Energy. Band 93, Nr. 2, 2002, S. 656–660, doi:10.1023/A:1021096715382.
- Simon Cotton: Lanthanide and Actinide Chemistry. John Wiley & Sons, 2007, ISBN 978-0-470-01007-5, S. 77.
- Thomas J. Haley, N. Komesu, G. Colvin, L. Koste, H. C. Upham: Pharmacology and toxicology of europium chloride. In: Journal of Pharmaceutical Sciences. Band 54, 1965, S. 643–645, doi:10.1002/jps.2600540435.
- Chitta Ranjan Patra, Soha S. Abdel Moneim, Enfeng Wang, Shamit Dutta, Sujata Patra, Michal Eshed, Priyabrata Mukherjee, Aharon Gedanken, Vijay H. Shah, Debabrata Mukhopadhyay: In vivo toxicity studies of europium hydroxide nanorods in mice. In: Toxicology and Applied Pharmacology. Band 240, 2009, S. 88–98, doi:10.1016/j.taap.2009.07.009.
- C. R. Patra, R. Bhattacharya, S. Patra, N. E. Vlahakis, A. Gabashvili, Y. Koltypin, A. Gedanken, P. Mukherjee, D. Mukhopadhyay: Pro-angiogenic Properties of Europium(III) Hydroxide Nanorods. In: Advanced Materials. Band 20, 2008, S. 753–756, doi:10.1002/adma.200701611.
- R. D. Shannon: Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides. In: Acta Crystallographica Section A. 32, 1976, S. 751–767, doi:10.1107/S0567739476001551.
- Mihail Nazarov, Do Young Noh: New Generation of Europium- and Terbium-Activated Phosphors. From Syntheses to Applications. CRC Press, 2011, ISBN 978-981-4310-77-2, S. 280–282 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Europiumverbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. März 2012.
- H. Baernighausen, G. Brauer: Ein neues Europiumoxid Eu3O4 und die isotype Verbindung Eu2SrO4. In: Acta Crystallographica. Band 15, 1962, S. 1059–1059, doi:10.1107/S0365110X62002807.
- K. Binder: Spin glasses: Experimental facts, theoretical concepts, and open questions. In: Reviews of Modern Physics. 58, 1986, S. 801–976, doi:10.1103/RevModPhys.58.801.
- Switlana Manastyrskyj, Michael Dubeck: The Tetrahydrofuranate of Europium(III) Cyclopentadienide. In: Inorganic Chemistry. Band 3, 1964, S. 1647–1648, doi:10.1021/ic50021a044.
- E. O. Fischer, Hartmut Fischer: Europiumdicyclopentadienyl. In: Angewandte Chemie. Band 76, 1964, S. 52–52, doi:10.1002/ange.19640760114.
- William J. Evans, Laura A. Hughes, Timothy P. Hanusa: Synthesis and x-ray crystal structure of bis(pentamethylcyclopentadienyl) complexes of samarium and europium: (C5Me5)2Sm and (C5Me5)2Eu. In: Organometallics. Band 5, 1986, S. 1285–1291, doi:10.1021/om00138a001.
- Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 577.
