Salzsäure
Salzsäure (HCl(aq)), auch Chlorwasserstoffsäure genannt, ist eine wässrige Lösung von gasförmigem Chlorwasserstoff, der in Oxonium- und Chloridionen protolysiert ist. Sie ist eine starke, anorganische Säure und zählt zu den Mineralsäuren. Ihre Salze heißen Chloride, das bekannteste ist das Natriumchlorid (NaCl, Kochsalz).
| Allgemeines | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Name | Salzsäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | HCl x(H2O) | ||||||||||||||||||
| Kurzbeschreibung |
farblose, durch Verunreinigungen oft gelbliche, stechend riechende Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 36,46 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,19 g·cm−3 (37-prozentige Lösung)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
2 ml·m−3 bzw. 3,0 mg·m−3 [2] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Indirekt findet ihr Gebrauch schon bei Plinius Erwähnung, bei der Trennung von Gold und Silber im Bergbau, indem bei hohen Temperaturen Kochsalz und Vitriol Salzsäure bilden, die eine Verbindung mit dem Silber eingeht. Möglicherweise erwähnt Georgius Agricola ein ähnliches Verfahren für die Trennung von Silber in seinem De Re Metallica von 1556 (das angegebene Rezept würde Salzsäure ergeben, wenn mit Salz Kochsalz gemeint ist).[4] Pseudo-Geber (13. Jahrhundert) beschrieb eine Reaktion von Quecksilber nach Erhitzen mit Kochsalz und Alaun oder Eisensulfat, wobei sich durch Reaktion mit Salzsäure feine weiße Nadeln von Quecksilberchlorid bildeten. Ihm und mittelalterlichen Alchemisten war auch Königswasser bekannt, das durch Zugabe von Salmiak (Ammoniumchlorid) oder Kochsalz zu Salpetersäure erzeugt wurde. Im 15. Jahrhundert wurden Salzsäure und ihre Verwendung zum Aufweichen von Knochen und Elfenbein für Schnitzarbeiten erwähnt, zuerst in einem anonymen italienischen Manuskript der Mitte des 15. Jahrhunderts, das sich in der Universität Bologna befindet[5], dann in einem Rezept von Caterina Sforza (1490).[6] Hergestellt wurde sie bei beiden Autoren durch Erhitzen von Kochsalz und Vitriol und Destillation.
In der ersten Hälfte des 15. Jahrhunderts gewann Basilius Valentinus Salzsäure durch Reaktion von Halit (Steinsalz) mit Eisenvitriol. 1597 erwähnt Libavius Salzsäure in seinem Buch Alchemia, sie wurde aber auch von Giambattista della Porta (Magiae Naturalis 1558, 1589) als bestes Mittel zum Bleichen von Zähnen erwähnt. Die Herstellung in großem Maßstab aus Speisesalz und Schwefelsäure gelang Johann Rudolph Glauber im 17. Jahrhundert. Lavoisier nannte Salzsäure acide muriatique (lat. muria ‚Salzlake‘). Kochsalzhaltige Quellen werden heute noch als muriatische Quellen bezeichnet. In Nordamerika wird Salzsäure auch muriatic acid genannt.
Vorkommen
In der Natur findet sich Salzsäure in Vulkangasen und stark verdünnt in Kraterseen. In freier Form kommt sie im Magensaft der Wirbeltiere vor (0,1 bis 0,5 Prozent Massenanteil). Fast unerschöpflich sind die Vorkommen an Salzen der Salzsäure, als Steinsalz und gelöst im Meerwasser.
Darstellung und Gewinnung
Salzsäure wird im Labor aus konzentrierter Schwefelsäure und Kochsalz (daher der Name) hergestellt:
Die Schwefelsäure verdrängt den Chlorwasserstoff aus seinem Salz. Da Chlorwasserstoff gasförmig ist, wird es ständig dem Gleichgewicht entzogen, welches dadurch nahezu vollständig auf der Seite der Produkte liegt. Das entstandene Natriumhydrogensulfat ist ein saures Schwefelsäuresalz. Das entstandene Chlorwasserstoffgas wird anschließend in Wasser eingeleitet:
Salzsäure mit höheren Massenanteilen Chlorwasserstoff wird auch als rauchende Salzsäure bezeichnet, da Chlorwasserstoffgas entweicht und mit dem Wasser aus der Luftfeuchtigkeit wieder Salzsäure entsteht, so dass sich über offenen Gefäßen ein weißer Nebel bildet.
In der chemischen Industrie wird hochreiner Chlorwasserstoff durch die Reaktion von Wasserstoff mit Chlor gewonnen:
Auch hier lässt man den Chlorwasserstoff mit Wasser reagieren.
Technisch reine Salzsäure fällt hauptsächlich als Nebenprodukt bei der Chlorierung organischer Verbindungen an.
Eigenschaften
| Massen- anteil w in % |
Massen- konzentration β in g/l |
Stoffmengen- konzentration c in mol/l |
Dichte ϱ in g/cm³ |
|---|---|---|---|
| 10,5 | 110 | 3,06 | 1,050 |
| 15,5 | 166 | 4,61 | 1,075 |
| 20,4 | 224 | 6,22 | 1,100 |
| 22,3 | 248 | 6,89 | 1,110 |
| 24,3 | 272 | 7,56 | 1,120 |
| 26,2 | 296 | 8,22 | 1,130 |
| 28,2 | 321 | 8,92 | 1,140 |
| 30,1 | 347 | 9,64 | 1,150 |
| 32,1 | 372 | 10,23 | 1,160 |
| 34,2 | 400 | 11,11 | 1,170 |
| 36,2 | 428 | 11,89 | 1,180 |
| 38,3 | 456 | 12,67 | 1,190 |
| 40,4 | 485 | 13,47 | 1,200 |
Chlorwasserstoffgas löst sich sehr gut in Wasser: Bei 0 °C löst 1 Liter Wasser, sofern es dabei noch als flüssige Phase vorliegt, unter Wärmeentwicklung 815 g beziehungsweise 507 Liter Gas. Bei 20 °C enthält ein Liter gesättigte Salzsäure 720 g HCl.[7] Die Konzentrationsabhängigkeit der Dichte ist in nebenstehender Tabelle gezeigt, wobei zwischen ihr und dem prozentualen Gehalt an Chlorwasserstoff zufällig ein einfacher rechnerischer Zusammenhang besteht: Die verdoppelten Nachkommastellen entsprechen in etwa der Konzentration, z. B. eine Salzsäure der Dichte 1,10 g·cm−3 einem HCl-Gehalt von 20 Prozent.
Das Schmelz- und Siedeverhalten von Salzsäure hängt stark von der Zusammensetzung ab.[8] In fester Phase werden vier stöchiometrische Hydrate mit definierten Schmelzpunkten gebildet. Das sind ein Monohydrat HCl·H2O mit einem Schmelzpunkt bei −15 °C, ein Dihydrat HCl·2H2O mit einem Schmelzpunkt bei −18 °C, ein Trihydrat HCl·3H2O mit einem Schmelzpunkt bei −25 °C und ein Hexahydrat HCl·6H2O mit einem Schmelzpunkt bei −70 °C. Im Phasendiagramm ergeben sich für Zusammensetzungen zwischen den stöchiometrischen Hydraten entsprechende eutektische Schmelzen. Diese liegen für ein Gemisch aus Mono- und Dihydrat mit einem Massenanteil Chlorwasserstoff von 57,3 % bei −23 °C, aus Di- und Trihydrat mit einem Massenanteil von 44,0 % bei −28 °C, aus Tri- und Hexahydrat mit einem Masseanteil von 26,6 % bei −73 °C und aus Hexahydrat und Eis mit einem Massenteil von 23,0 % bei −75 °C. Zusätzlich wird ein metastabiles Eutektikum zwischen Trihydrat und Eis mit einem Massenanteil von 24,8 % bei −87 °C gebildet. Im Konzentrationsbereich von 0 bis 25 % wird somit ein starkes Absinken des Schmelzpunktes beobachtet. Das Dampf-Flüssig-Phasendiagramm zwischen Chlorwasserstoff und Wasser zeigt ein negatives Azeotrop. Das resultierende azeotrope Siedepunktsmaximum liegt bei Normaldruck mit einem Massenanteil von 20,2 % bei 109 °C. Bei der Verdampfung von Salzsäurelösungen mit von der Azeotropzusammensetzung abweichender Konzentration wird zunächst bevorzugt die Überschusskomponente verdampft, d. h., bei Salzsäure mit einem Massenanteil <20,2 % erfolgt eine Aufkonzentrierung, bei Salzsäure mit >20,2 % eine Abkonzentrierung, bis die konstant siedende Azeotropzusammensetzung erreicht wird. Die Siedekurve im Phasendiagramm oberhalb der Azeotropzusammensetzung korreliert mit Löslichkeitskurve von Chlorwasserstoff in Wasser. Bei 25 °C ergibt sich ein Massenanteil von 42 %, was der „rauchenden“ Salzsäure entspricht.
 Binäres Fest-Flüssig-Gleichgewicht von Chlorwasserstoff mit Wasser
Binäres Fest-Flüssig-Gleichgewicht von Chlorwasserstoff mit Wasser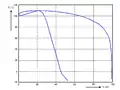 Binäres Dampf-Flüssig-Gleichgewicht von Chlorwasserstoff mit Wasser
Binäres Dampf-Flüssig-Gleichgewicht von Chlorwasserstoff mit Wasser
In Wasser dissoziiert Chlorwasserstoff vollständig, Salzsäure mit 32 % hat einen pH-Wert von −1. An feuchter Luft bildet Chlorwasserstoffgas einen Nebel aus feinen Salzsäure-Tröpfchen. Verdünnte Salzsäure ist ein guter elektrischer Leiter.
Reaktionen

Salzsäure löst die meisten Metalle mit Ausnahme der Edelmetalle und einiger anderer (zum Beispiel Tantal und Germanium) unter Bildung von Chloriden und Wasserstoff, sofern diese nicht durch Passivierung geschützt sind.
Sie ist sehr gut geeignet zum Entfernen von Oxidschichten auf Metallen, da Metalloxide mit Salzsäure zu Chloriden und Wasser reagieren:
Durch Neutralisation von Salzsäure mit wässriger Ammoniaklösung kann Ammoniumchlorid gewonnen werden:
Eine Mischung von Salzsäure und Salpetersäure wird Königswasser genannt, weil sie auch Gold, den „König der Metalle“, zu lösen vermag. Dazu trägt neben der oxidierenden Wirkung des Nitrosylchlorids und des nascierenden Chlors auch die Verringerung der effektiven Goldionenkonzentration durch Komplexbildung bei:
Verwendung
Salzsäure ist eine wichtige Grundchemikalie mit großer Bedeutung in der chemischen Industrie als anorganische Säure. Sie wird beispielsweise bei der Aufarbeitung von Erzen und Rohphosphat eingesetzt. Sie wird zur Stimulation von Erdöl- und Erdgas-Sonden, im Speziellen in Karbonatlagerstätten, aber auch in Sandsteinlagerstätten verwendet. Mit ihrer Hilfe werden dort auch z. B. Calciumcarbonat-Anlagerungen an Gerätschaften entfernt und Reinigungen nach Bohrungen mit Filterkieseinschüttung („Gravel pack“) und an Bohrlöchern selbst durchgeführt. In der Metallverarbeitung wird sie beim Beizen, Ätzen und Löten eingesetzt. Außerdem wird verdünnte Salzsäure im Bauwesen zum Entfernen der Mörtelreste am Mauerwerk benutzt – das sog. Absäuern. Fliesenleger entfernen nach dem Verfugen den Kalkschleier auf den Fliesen mit verdünnter Salzsäure.
Salzsäure ist auch ein wichtiges Reagenz in der chemischen Analyse. Sie vermag eine Gruppe von Metallen, die schwerlösliche Chloride bilden, durch Fällung von anderen Metallen abzutrennen. Anschließend können diese getrennt weiter analysiert werden (siehe Salzsäuregruppe). Die Alkalimetrie ist ein weiteres Verwendungsgebiet von Salzsäure.
Als Lebensmittelzusatzstoff trägt Salzsäure die Bezeichnung E 507.
In der Pharmaindustrie wird Salzsäure benutzt, um basische, in Wasser schlecht- oder unlösliche Arzneistoffe (Beispiele: Ciprofloxacin, Citalopram, Clenbuterol, Clindamycin, Dibenzepin) in besser lösliche Hydrochloride zu überführen.[9]
Eine der wichtigsten Anwendungen von Salzsäure ist das Beizen von Stahl, um Rost- oder Eisenoxidzunder von Eisen oder Stahl vor der anschließenden Verarbeitung zu entfernen, z. B. durch Extrudieren, Walzen, Galvanisieren und andere Techniken.
In der Stahlbeizindustrie wurden Salzsäureregenerationsverfahren wie der Sprühröster oder das Wirbelbett-HCl-Regenerationsverfahren entwickelt, mit denen man HCl aus verbrauchter Beizflüssigkeit rückgewinnen kann. Der gebräuchlichste Regenerationsprozess ist der Pyrohydrolyseprozess:
Durch Rückgewinnung der verbrauchten Säure entsteht ein geschlossener Säurekreislauf. Das Eisen(III)-oxid-Nebenprodukt des Regenerationsprozesses ist wertvoll und wird in einer Vielzahl von Sekundärindustrien verwendet.[10][11]
Bei normalen Säure-Base-Reaktionen kann man mit Salzsäure zahlreiche Produkte herstellen, die zu anorganischen Verbindungen führen. Dazu gehören Chemikalien zur Wasseraufbereitung wie Eisen(III)-chlorid und Polyaluminiumchlorid.
Eisen(III)-chlorid und auch Polyaluminiumchlorid werden als Flockungsmittel bei der Abwasserbehandlung, der Trinkwasserherstellung und der Papierherstellung eingesetzt.
Weitere anorganische Verbindungen, die mit Salzsäure hergestellt werden, sind Calciumchlorid als Streusalz, Nickel(II)-chlorid für die Galvanik und Zinkchlorid für die Galvanik und die Batterieherstellung.[11]
Biologische Bedeutung
Bei Mensch und Tier ist die Salzsäure ein Bestandteil des Magensaftes, wo sie unter anderem die Denaturierung von Proteinen bewirkt, aber auch zum Abtöten von Mikroorganismen vor Eintritt in das weitere Verdauungssystem dient. Außerdem schafft sie das saure Milieu, in dem das Verdauungsenzym Pepsin am wirksamsten ist.
Nachweis
Salzsäure wird zum einen durch ihren Säurecharakter nachgewiesen. Ergänzend dazu identifiziert man das Chlorid-Anion in stark verdünnter Lösung (bei einem Überschuss an Chloridionen bildet sich ein löslicher Dichloroargentat-Komplex) durch Zugabe von Silbernitratlösung, wobei schwer lösliches Silberchlorid ausfällt:
Wenn sich der entstandene weiße Niederschlag in verdünntem Ammoniakwasser unter Komplexbildung auflöst, ist der Beweis erbracht, dass es sich um Chloridionen handelte:
Wird Salzsäure mit Mangandioxid (Braunstein) erhitzt, so entsteht Chlor:
Der Salzsäuregehalt einer Lösung wird durch Titration mit Natronlauge ermittelt (Acidimitrie, Maßanalyse). Photometrisch lässt sich diese Bestimmung sowie die von Chloriden mit Hilfe des Quecksilbersalzes der Chloranilsäure durchführen. Den Gehalt an Salzsäure im Magensaft bestimmt man mit Günzburgs Reagenz.[12]
Weblinks
Einzelnachweise
- Eintrag zu E 507: Hydrochloric acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 29. Dezember 2020.
- Eintrag zu Salzsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eintrag zu Hydrochloric acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Zur frühen Geschichte der Salzsäure: Ladislao Reti, How old is hydrochloric acid ?, Chymia, Band 10, 1965, S. 11–23
- Il libro dei colori, Herausgegeben von O. Guerrini, C. Ricci, Bologna 1887
- Abgedruckt in Pier Desiderio Pasolini, Caterina Sforza, 3 Bände, Rom 1893
- Eintrag zu Chlorwasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Juni 2011. (JavaScript erforderlich)
- alle Daten aus Gmelins Handbuch der Anorganischen Chemie, Systemnummer 6 Chlor, Verlag Chemie Berlin 1927 und Gmelins Handbuch der Anorganischen Chemie, Systemnummer 6 Chlor, Ergänzungsband Teil B – Lieferung 1, Verlag Chemie Weinheim 1968.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dietmar Reichert: Pharmaceutical Substances, 4. Auflage (2000), 2 Bände erschienen im Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- Hydrochloric Acid. In: Chemicals Economics Handbook. SRI International, 2001, S. 733.4000A–733.3003F.
- Greenwood and Earnshaw, pp. 946–48
- Eintrag zu Günzburgs Reagenz. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. September 2014.

