Zirconium
Zirconium, häufig auch Zirkonium, ist ein chemisches Element mit dem Elementsymbol Zr und der Ordnungszahl 40. Sein Name leitet sich vom Zirkon, dem häufigsten Zirconium-Mineral, ab. Im Periodensystem steht es in der 5. Periode; es ist das zweite Element der 4. Gruppe (veraltet 4. Nebengruppe) oder Titangruppe. Zirconium ist ein sehr korrosionsbeständiges Metall. Biologische Funktionen sind nicht bekannt; es kommt in geringen Mengen (4 mg/kg) im menschlichen Organismus vor und ist nicht toxisch.[14]
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Zirconium, Zr, 40 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 4, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-176-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.342 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,021 %[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 91,224(2)[3] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 155 (206) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 148 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d2 5s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 6.634126(5) eV[4] ≈ 640.1 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 13.13 eV[4] ≈ 1267 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 23.170(4) eV[4] ≈ 2236 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 34.41836(6) eV[4] ≈ 3320.87 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 80.348(7) eV[4] ≈ 7752 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | zwei (α-/β-Zr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal; | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 6,501 g/cm3 (25 °C)[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 1,1 · 10−4)[8][9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 2130 K (1857 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 4650 K[10] (4377 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 14,02 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 591 kJ/mol[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 16,9 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | 0,00168 Pa bei 2125 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 4650 (long.), 2250 (trans.) m·s−1 bei 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 270,0 J·kg−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 2,36 · 106 A·V−1·m−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 22,7 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 4, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −1,553 V (ZrO2 + 4 H+ + 4 e− → Zr + 2 H2O) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,33 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Geschichte
Das wichtige zirconiumhaltige Mineral Zirkon (Zr[SiO4]) ist als Schmuckstein bereits seit der Antike bekannt. Zirconium als Element wurde 1789 von Martin Heinrich Klaproth in einer aus Ceylon stammenden Probe des Minerals Zirkon entdeckt und nach diesem benannt. Erstmals dargestellt wurde das Metall 1824 von Jöns Jakob Berzelius durch Reduktion von K2ZrF6 mit Kalium. Dazu erhitzte er „ein Gemenge aus flusssaurem Zirkon-Kali mit Kalium in einer eisernen Röhre“. Nach Behandlung mit Wasser, Trocknen und längerem Erhitzen mit verdünnter Salzsäure erhielt Berzelius ein „klumpiges Pulver, welches wie Kohle schwarz“ war und erst „durch Zusammendrücken mit dem Polierstahl eine dunkelgraue Farbe und Glanz“ erhielt.[15] Die korrekte Atommasse konnte dagegen erst 1924 bestimmt werden, da – neben Fehlern bei der Durchführung der Experimente – nicht bekannt war, dass Zirconium stets geringe Mengen Hafnium enthält. Ohne diese Information ergaben Messungen immer eine etwas zu hohe Atommasse.[16] Die erste praktische Anwendung von Zirconium war der Einsatz als rauchloses Blitzlichtpulver.
Vorkommen
Zirconium kommt in der Erdkruste mit einem Gehalt von ca. 0,016 %[17] vor. In der nach Häufigkeit geordneten Liste der Elemente steht Zirconium an 18. Stelle[18] und ist häufiger als die bekannteren Elemente Chlor und Kupfer. Es ist zwar sehr weit verbreitet, findet sich aber meist nur in sehr geringen Mengen und in sehr kleinen Kristallen (typischerweise um 0,1 mm). Darum wurde Zirconium in früherer Zeit als selten angesehen. Zirconium wird vor allem in silikatischen Intrusivgesteinen wie Granit gefunden. Es kommt nicht gediegen, sondern nur in einigen Mineralen, vor allem als Zirkon (ZrSiO4) und Baddeleyit (ZrO2) sowie dem selteneren roten Eudialyt (Na4(CaCeFeMn)2ZrSi6O17(OHCl)2) gebunden vor. Es ist fast immer mit Hafnium vergesellschaftet. Zirkon ist wegen seines hohen Schmelzpunktes von 2550 °C[19], seiner großen Härte und geringen Reaktivität das älteste auf der Erde auffindbare Mineral und kann auf Grund eingelagerter Uran- und Thoriumisotope für radiometrische Altersbestimmungen verwendet werden.
Als Rohstoffe dienen meist sekundäre Lagerstätten, so genannte Seifenlagerstätten. Diese entstehen, wenn das umliegende Gestein verwittert und nur der besonders verwitterungsresistente Zirkon zurückbleibt. Weitere solche Lagerstätten können durch Wasserströmungen entstehen, die Zirkonkristalle ausspülen und an anderen Stellen anspülen. Primäre Lagerstätten haben dagegen meist einen für den rentablen Abbau zu geringen Zirconium-Gehalt.
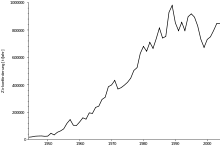
Die wichtigsten Zirconium-Lagerstätten liegen in Australien, den USA und Brasilien. Bei abbauwürdigen Reserven von 38 Millionen Tonnen lag die Weltjahresförderung von Zirconiummineralen 2006 bei 920.000 Tonnen (gerechnet als Zirkon). Davon werden nur etwa 5 % zu Metall und Legierungen weiterverarbeitet.[20] Die wichtigsten Förderländer waren 2006 mit großem Abstand Australien und Südafrika.[21] Laut USGS lag die Weltjahresförderung an Zirconiummineralen 2013 bei 1,5 Mio. t, davon 850.000 t in Australien. Weitere wichtige Förderländer waren Südafrika (170.000 t) und China (150.000 t). Die Preise für Zirkon lagen 2012 bei 2.650 USD je Tonne und 2013 bei 1.050 USD je Tonne.[22]
Gewinnung und Darstellung

Zirkon als häufigster Zirconium-Rohstoff muss vor der Weiterverarbeitung erst in Zirconiumdioxid umgewandelt werden. Dazu wird der Zirkon in einer Natriumhydroxid-Schmelze gekocht (alkalischer Aufschluss). Das Zirconiumdioxid wird danach mit Koks im Lichtbogen zu Zirconiumkarbonitrid (Kohlenstoff- und stickstoffhaltiges Zirconium) und anschließend mit Chlor zu Zirconiumtetrachlorid umgesetzt.
Eine direkte Reduktion von Zirconiumdioxid mit Kohlenstoff (wie im Hochofenprozess) ist nicht möglich, da die hierbei entstehenden Carbide sehr schwer vom Metall zu trennen sind. Stattdessen wird Zirconiumtetrachlorid im so genannten Kroll-Prozess mit Magnesium in einer Helium-Atmosphäre zu Zirconiummetall reduziert.
Um reineres Zirconium gewinnen zu können, wird das Van-Arkel-de-Boer-Verfahren angewendet. Dabei reagiert während des Erhitzens unter Vakuum zunächst das Zirconium mit Iod zu Zirconium(IV)-iodid. Dieses wird an einem heißen Draht wieder zu Zirconium und Iod zersetzt:
Zirconiumtetraiodid bildet sich bei 200 °C aus Zirconium und Iod; es zerfällt wieder bei 1300 °C.
Zirconium und Hafnium sind auf einfache chemische Art nicht zu trennen. Deshalb enthält auch dieses hochreine Zirconium noch immer Hafnium. Da es für viele Anwendungen in der Reaktor-Technik wichtig ist, dass das Zirconium kein Hafnium mehr enthält, spielen Trennverfahren für diese beiden Metalle eine wichtige Rolle. Eine Möglichkeit sind Extraktionsverfahren, in denen die unterschiedliche Löslichkeit von Zirconium- und Hafniumverbindungen in speziellen Lösungsmitteln ausgenutzt wird. Häufig werden die Thiocyanate und ihre unterschiedliche Löslichkeit in Methylisobutylketon ausgenutzt. Weitere Möglichkeiten bieten Ionenaustauscher oder die fraktionierte Destillation von geeigneten Verbindungen.
Der USGS gibt als US-Importpreise für Zirconium 75 USD je kg im Jahre 2013 an.[22]
Eigenschaften
Physikalische Eigenschaften
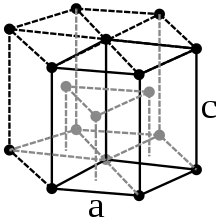
Zirconium ist ein silbrig-glänzendes Schwermetall (Dichte 6,501 g/cm3 bei 25 °C[7]), es ähnelt äußerlich Stahl. Das Metall kristallisiert in zwei unterschiedlichen Modifikationen, in die es durch Temperaturänderung überführt werden kann. Unterhalb von 870 °C kristallisiert α-Zirconium im hexagonalen Kristallsystem (hexagonal-dichteste Kugelpackung, Magnesium-Typ) in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) mit den Gitterparametern a = 323 pm und c = 514 pm sowie zwei Formeleinheiten pro Elementarzelle. Bei 870 °C ändert sich die Kristallstruktur zur kubisch-innenzentrierten β-Struktur (Wolfram-Typ) mit der Raumgruppe Im3m (Nr. 229) und dem Gitterparameter a = 361 pm.[7]
Zirconium ist relativ weich und biegsam. Es lässt sich gut durch Walzen, Schmieden und Hämmern verarbeiten. Durch geringe Verunreinigungen von Wasserstoff, Kohlenstoff oder Stickstoff im Metall wird es aber spröde und schwer zu verarbeiten. Die elektrische Leitfähigkeit ist nicht so hoch wie die anderer Metalle. Sie beträgt nur etwa 4 % von der des Kupfers. Bezogen auf seine schlechte elektrische Leitfähigkeit ist Zirkonium ein relativ guter Wärmeleiter. Im Vergleich zum leichteren Homologen Titan sind Schmelz- und Siedepunkt etwas höher (Schmelzpunkt: Titan: 1667 °C, Zirconium: 1857 °C). Auch die elektrische und Wärmeleitfähigkeit sind besser. Unterhalb von 0,55 K[14] wird Zirconium supraleitend.
Die Eigenschaften des Zirconiums und des schwereren Homologen Hafnium ähneln sich auf Grund der Lanthanoidenkontraktion sehr. Diese bedingt ähnliche Atomradien (Zr: 159 pm, Hf: 156 pm[14]) und damit ähnliche Eigenschaften. Die beiden Metalle unterscheiden sich allerdings erheblich in ihrer Dichte (Zr: 6,5 g/cm3, Hf: 13,3 g/cm3[23]).
Eine wichtige Eigenschaft, wegen der Zirconium eine große Bedeutung im Reaktorbau erlangt hat, ist sein geringer Einfangquerschnitt für Neutronen. In dieser Eigenschaft unterscheidet sich Zirconium ebenfalls sehr vom Hafnium. Dies macht die aufwändigen Trennverfahren für diese Anwendungen nötig.
Chemische Eigenschaften
Zirconium ist ein unedles Metall, welches besonders unter hoher Temperatur mit vielen Nichtmetallen reagiert. Vor allem als Pulver verbrennt es mit weißer Flamme zu Zirconiumdioxid, bei Anwesenheit von Stickstoff auch zu Zirconiumnitrid und Zirconiumoxinitrid. Kompaktes Metall reagiert erst bei Weißglut mit Sauerstoff und Stickstoff. Bei erhöhtem Druck reagiert Zirconium auch bei Raumtemperatur mit Sauerstoff, da das gebildete Zirconiumoxid im geschmolzenen Metall löslich ist.[14] Bei der Verbrennung von Zirconium in Sauerstoff wird eine Temperatur von ca. 4660 °C erreicht.[24]
Zirconium ist an der Luft durch eine dünne, sehr dichte Zirconiumoxidschicht passiviert und deshalb reaktionsträge. Es ist darum in fast allen Säuren unlöslich, lediglich Königswasser und Flusssäure greifen Zirconium schon bei Raumtemperatur an. Wässrige Basen reagieren nicht mit Zirconium.
Isotope
Vom Zirconium sind viele Isotope zwischen 78Zr und 110Zr bekannt.[25] Dabei ist natürliches Zirconium ein Mischelement, das aus insgesamt fünf Isotopen besteht. Dies sind 90Zr, das mit einem Anteil von 51,45 % des natürlichen Zirconiums am häufigsten vorkommt, sowie die schwereren Isotope 91Zr (11,32 %), 92Zr (17,19 %), 94Zr (17,28 %) und 96Zr mit 2,76 % Anteil. 96Zr ist als einziges natürliches Isotop schwach radioaktiv, es zerfällt mit einer Halbwertszeit von 24 · 1018 Jahren unter doppeltem Betazerfall zu 96Mo. Das Isotop 89Zr wird zur Herstellung langlebigerer Radioliganden für die Positronen-Emissions-Tomographie verwendet. Das Isotop 91Zr kann mit Hilfe der NMR-Spektroskopie nachgewiesen werden.
88Zr besitzt einen sehr großen Einfangquerschnitt für thermische Neutronen. Insgesamt handelt es sich nach 135Xe um den zweitgrößten bisher bestimmten Wirkungsquerschnitt für den Einfang thermischer Neutronen. Der Wert ist etwa 80.000-mal größer als die theoretische Vorhersage nahelegt.[26]
Verwendung

Eine wichtige Verwendung für Zirconium sind die aus Zircaloy hergestellten Hüllen der Uran-Brennelemente in Kernkraftwerken. Diese Legierung besteht aus ca. 90 % Zirconium und geringen Anteilen an Zinn, Eisen, Chrom oder Nickel, darf jedoch kein Hafnium enthalten. Der Grund für die Wahl dieses Elements ist der schon oben beschriebene geringe Einfangquerschnitt für thermische Neutronen bei gleichzeitig großer Korrosionsbeständigkeit, die es auch als Baumaterial für chemische Anlagen, vor allem für spezielle Apparateteile wie Ventile, Pumpen, Rohre und Wärmeaustauscher geeignet macht. Als Legierungszusatz zu Stahl erhöht es ebenfalls die Korrosionsbeständigkeit. Aus entsprechenden Legierungen werden unter anderem chirurgische Instrumente hergestellt.
Da Zirconium mit geringen Mengen Sauerstoff und Stickstoff reagiert, kann es als Gettermaterial in Glühlampen und Vakuumanlagen zur Aufrechterhaltung des Vakuums genutzt werden. Diese Eigenschaft wird auch in der Metallurgie ausgenutzt, um Sauerstoff, Stickstoff und Schwefel aus Stahl zu entfernen.
Wegen seiner Eigenschaft, beim Verbrennen ein sehr helles Licht auszusenden, wurde es neben Magnesium als Blitzlichtpulver verwendet. Im Gegensatz zu Magnesium hat Zirconium den Vorteil, rauchfrei zu sein. Diese Eigenschaft wird ebenso in Feuerwerkskörpern und Signallichtern ausgenutzt.
Zirconium sendet beim Aufprall auf Metalloberflächen einen Funkenschwall ab und ist brennbar. Dieses nutzt das Militär in einigen Munitionssorten wie der Schrotflinten-Spezialmunition Dragon’s Breath und der US-amerikanischen Allzweck-Streumunition BLU-97 aus. In der Filmtechnik wird dieser Effekt für nicht-pyrotechnische Aufpralleffekte von beispielsweise Gewehrkugeln auf Metalloberflächen benutzt.
Zirconium-Niob-Legierungen sind supraleitend und bleiben dies auch, wenn starke Magnetfelder angelegt werden. Sie wurden daher früher für supraleitende Magnete verwendet.[27][28]
Zirconium wird in den 2010er Jahren auch als Bestandteil von Gelenkprothesen eingesetzt.[29]
Das Radioisotop 89Zr wird für die Positronen-Emissions-Tomographie verwendet und ermöglicht durch seine vergleichsweise lange Halbwertszeit von 3,5 Tagen PET-Aufnahmen bis zu 2 Wochen nach der Applikation.
Sicherheitshinweise
Es sind keine toxischen Effekte von Zirconium und seinen Verbindungen bekannt. Wegen der dichten Oxidschicht ist kompaktes Zirconium nicht brennbar. In Pulverform kann es dagegen beim Erhitzen an der Luft anfangen zu brennen. Zirconiumbrände sind sehr gefährlich, da zum Löschen weder Wasser (heftige Reaktion unter Wasserstoffbildung) noch Kohlenstoffdioxid oder Halon verwendet werden können. Zirconiumbrände müssen mit Metallbrandlöschern (Klasse D) oder trockenem Sand gelöscht werden.[13]
Nachweis
Mit Alizarinrot-S bildet Zirconium im Sauren eine charakteristische rot-violette Verbindung (Farblack), welche bei Zugabe von Fluoridionen unter Bildung des Zirconium-Fluorokomplexes wieder verschwindet. Diese Reaktion kann als qualitativer Nachweis sowohl von Zirconium als auch von Fluor dienen. Da schon geringe Mengen Fluorid (und anderer Anionen) stören, ist dieser Nachweis für Mineralanalysen ungeeignet.[30][31] Daneben sind einige andere organische Verbindungen, wie Tannin, Kupferron, Phenylarsonsäure, Oxin oder Xylenolorange, als Nachweisreagenz geeignet. Eine weitere charakteristische Verbindung ist Zirconiumoxidchlorid ZrOCl2 · 8 H2O, die in typischen Nadeln kristallisiert. In der modernen Analytik kann Zirconium über Atomabsorptionsspektrometrie (AAS) oder Massenspektrometrie (auch anhand des Isotopenmusters) nachgewiesen werden.
Eine Möglichkeit zur quantitativen Analyse ist die Fällung von schwerlöslichem Zirconium(IV)-hydroxid mit Ammoniak und anschließendem Verglühen zu Zirconiumdioxid.
-
- Fällung des Hydroxids
-
- Umsetzen zur Wägeform
Verbindungen
→ Kategorie:Zirconiumverbindung
Zirconium bildet als unedles Metall eine Vielzahl von Verbindungen. Die meisten Zirconiumverbindungen sind Salze. Häufig sind sie sehr stabil und besitzen einen hohen Schmelzpunkt. Die Oxidationsstufe +IV ist bevorzugt und am stabilsten. Es sind aber auch Verbindungen in den Oxidationsstufen +III bis +I, bei Komplexen sogar in den Stufen 0, −I und −II bekannt.
Zirconiumdioxid

Die wichtigste Zirconiumverbindung ist Zirconiumdioxid ZrO2, ein sehr stabiles und hochschmelzendes Oxid. Zirconiumdioxid dient zur Herstellung feuerfester Auskleidungen in Tiegeln und Öfen. Um es hierfür zu verwenden, muss es aber zur Stabilisierung der kubischen Hochtemperaturphase mit Calcium, Yttriumoxid oder Magnesiumoxid stabilisiert werden. Zirkoniumdioxid-verstärktes Aluminiumoxid (ZTA, Zirconia Toughened Aluminum Oxide) wird als Technische Keramik für hohe Temperaturen eingesetzt.[32]
Zirconiumdioxid-Kristalle sind farblos und besitzen einen hohen Brechungsindex. Darum dienen sie unter dem Namen Zirkonia als künstlicher Schmuckstein und Ersatz für Diamanten. Daneben wird Zirconiumdioxid als Schleifmittel und wegen der weißen Farbe als Weißpigment für Porzellan genutzt.
Wird Zirconiumoxid mit Yttriumoxid dotiert, ergeben sich weitere Anwendungsmöglichkeiten. Bei drei Prozent Yttriumoxid-Gehalt wird das ZrO2 in einer verzerrten Fluorit-Struktur stabilisiert. Dadurch wirkt es bei Temperaturen von über 300 °C als Leiter für Sauerstoff-Ionen. Eine wichtige Anwendung hierfür ist die Lambdasonde in Autos, die zum Messen des Sauerstoffgehaltes in Abgasen für den Katalysator dient. Bei 15 % Yttriumoxidgehalt sendet Zirconiumoxid bei 1000 °C ein sehr helles, weißes Licht aus. Dieses findet in der so genannten Nernst-Lampe Anwendung. Da Yttrium-Zirconium-Keramiken eine extrem hohe Bruchzähigkeit besitzen, werden sie beispielsweise in der Zahntechnik als hochstabiles Kronen- und Brückengerüst, in künstlichen Hüftgelenken und Zahnimplantaten oder als Verbindungselement bei Teleskopen verwendet. Dabei lösen sie zunehmend Gold und andere Metalle in der Funktion ab.
Zirconiumoxid wird zudem oft für Kugellager verwendet. Vor allem für die Laufringe der Lager hat ZrO2 den großen Vorteil, dass der Wärmeausdehnungskoeffizient nahe dem von Stahl ist. Andere technische Keramiken wie Siliciumnitrid haben üblicherweise einen erheblich geringeren Wärmeausdehnungskoeffizienten.[33]
Halogenide
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Zirconium mehrere Reihen von Verbindungen. Es sind von allen Halogenen Verbindungen der Formen ZrX4, ZrX3 und ZrX2 bekannt. Dazu kommen noch die Chloride, Bromide und Iodide der Form ZrX. Am stabilsten sind dabei die Tetrahalogenide der Form ZrX4. Von keinem der Zirconiumhalogenide sind wichtige Anwendungsbereiche bekannt, wobei Zirconiumchloride als Zwischenprodukte bei der Herstellung von reinem Zirconium entstehen.
Weitere Zirconiumverbindungen
Zirconiumsilicat, ZrSiO4, besser bekannt unter dem Mineralnamen Zirkon, ist die in der Natur häufigste Zirconium-Verbindung. Es stellt die wichtigste Quelle für Zirconium und seine Verbindungen dar. Daneben wird Zirkon als Schmuckstein verwendet.
Organische Zirconiumverbindungen sind meist instabil. Von Bedeutung sind vor allem organische Zirconiumkomplexe, sog. Zirconocene, mit Resten wie Cyclopentadienyl. Sie sind technisch wichtig als Katalysator bei der Polymerisation von Alkenen, insbesondere für die Herstellung von Polypropylen. Eine weitere Anwendung einer organischen Zirconium-Verbindung besteht in der Hydrozirconierung. Dabei werden Alkene mit Hilfe des Schwartz-Reagenzes Cp2ZrHCl (Cp = Cyclopentadienyl) in Alkohole oder Halogenkohlenwasserstoffe überführt. Bei der Reaktion von terminalen Alkinen mit dem Schwartz-Reagenz entstehen bei der Hydrozirconierung trisubstituierte Doppelbindungen, die weitere Umsetzung mit einem elektrophilen Reagenz führt zu trans-funktionalisierten Alkenen in hoher stereochemischer Reinheit.
Aluminium-Zirconium-Komplexe können als Antitranspirant verwendet werden. Kaliumhexafluoridozirconat(IV) K2ZrF6 (CAS-Nummer: 16923-95-8) kann zur Trennung von Zirconium von Hafnium eingesetzt werden.
Zirconiumcarbonat liegt als basischer Komplex vor. Es wird unter anderem in der Papierindustrie verwendet.
Zirkoniumsalze werden – neben aluminiumhaltigen Alaunen – bei der „Weißgerbung“ von Fellen eingesetzt.[34]
Blei-Zirkonat-Titanat-Keramiken (PZT-Keramiken) werden für Piezoelemente verwendet.
Natrium-Zirconium-Cyclosilicat ist ein nicht-resorbierbares Pulver mit mikroporöser Struktur, das Kalium im Austausch gegen Wasserstoff und Natrium-Kationen aufnehmen kann. Es wird daher medizinisch als oral verfügbarer Kaliumbinder verwendet.[35]
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Hans Breuer: dtv-Atlas Chemie. Band 1, 9. Auflage. dtv-Verlag, 2000, ISBN 3-423-03217-0.
- Michael Binnewies: Allgemeine und Anorganische Chemie. 1. Auflage. Spektrum Verlag, 2004, ISBN 3-8274-0208-5.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, 1988, ISBN 3-527-26169-9.
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind aus www.webelements.com (Zirconium) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu zirconium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu zirconium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind aus www.webelements.com (Zirconium) entnommen.
- Gordon B. Skinner, Herrick L. Johnston: Thermal Expansion of Zirconium between 298°K and 1600°K. In: J. Chem. Phys. 21, 1953, S. 1383–1284, doi:10.1063/1.1699227.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert. Beim Vorzeichen dürfte es sich in dieser Quelle um einen Druckfehler handeln, da Übergangsmetalle grundsätzlich paramagnetisch sind (siehe zweite Quelle).
- H. Kojima, R. S. Tebble, D. E. G. Williams: The variation with temperature of the magnetic susceptibility of some of the transition elements. In: Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences. 260 (1301), 1961, S. 237–250. Werte dort sind auf die Masse in Gramm bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert. Im Gegensatz zur vorigen Quelle ist hier das Vorzeichen positiv.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind aus www.webelements.com (Zirconium) entnommen.
- Eintrag zu Zirconium im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Zirkonium, Pulver, nicht stabilisiert in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. August 2016. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Johann Joseph Prechtl: Jahrbücher des kaiserlichen königlichen polytechnischen Instituts in Wien. Band 9, 1826, S. 265.
- O. Hönigschmied, E. Zintl, F. Gonzalez: Über das Atomgewicht des Zirconiums. In: Zeitschrift für allgemeine und anorganische Chemie. 139, 1924, S. 293–309.
- Hans Breuer: dtv-Atlas Chemie. Band 1, 9. Auflage. dtv-Verlag, 2000, ISBN 3-423-03217-0.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. 1988, ISBN 3-527-26169-9, S. 1231.
- Datenblatt Zirconium bei Acros, abgerufen am 19. Februar 2010..
- Mineral Yearbook 2005 der U.S. Geological Society für Zirconium (PDF; 158 kB).
- Zirconium bei usgs mineral Resources (PDF; 62 kB).
- MINERAL COMMODITY SUMMARIES 2015. (PDF 2,3 MB) USGS, S. 191–192 (188–189), abgerufen am 7. September 2015 (englisch).
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, 1988, ISBN 3-527-26169-9.
- Eintrag zu Zirconium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2019.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- Spektrum der Wissenschaft: Kernphysik-Rekord: Radioaktiver Exot entpuppt sich als Neutronenschreck - Spektrum der Wissenschaft, abgerufen am 9. März 2019
- Helmut Hofmann, Gerhart Jander: Qualitative Analyse. de Gruyter, Berlin 1972, S. 147.
- H. Lohninger: Zirconium. In: Anorganische Chemie. abgerufen am 23. April 2014.
- In einem Endoprothesenpass findet sich diese Angabe: Modular Prosthesis Head, Material Zirconia toughened aluminia ceramic Homepage des Herstellers Link GmbH, Hamburg.
- Gerhard Jander, Ewald Blasius: Einführung in das anorganisch chemische Praktikum (qualitative Analyse). 13. Auflage. S. Hirzel Verlag, Stuttgart 1990, S. 130.
- Verordnung über die Analyse von Kosmetika (PDF; 920 kB).
- Eintrag zu Oxidkeramik. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. April 2014.
- Hochleistungskeramiken von CEROBEAR.
- Jörg Zimpel: Industrielle und gewerbliche Abwassereinleitungen in öffentliche Abwasseranlagen: Anforderungen und Problemlösungen. expert-Verlag, 1997, ISBN 3-8169-1421-7, S. 195.
- Sheridan M. Hoy: Sodium Zirconium Cyclosilicate: A Review in Hyperkalaemia. In: Drugs. Band 78, Nr. 15, Oktober 2018, S. 1605–1613, doi:10.1007/s40265-018-0991-6, PMID 30306338, PMC 6433811 (freier Volltext).
