Grignard-Verbindungen
Eine Grignard-Verbindung [ɡriˈɲaːr-] ist ein metallorganisches Reagenz, welches nach Victor Grignard benannt wurde. Für diese Entdeckung bekam er 1912 den Nobelpreis für Chemie. Grignard-Verbindungen entstehen, wenn ein Alkylhalogenid (z. B. Brommethan, BrCH3) oder ein Arylhalogenid (z. B. Chlorbenzol C6H5Cl) in Anwesenheit von Lösungsmitteln mit metallischem Magnesium reagiert. Die Grignard-Reaktion, die mit Hilfe dieser Reagenzien durchgeführt wird, ist eine wichtige Namensreaktion in der Organischen Chemie.
Bildung
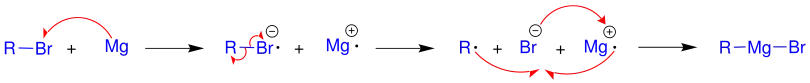
Diese Reaktion spielt sich auf der Oberfläche des Metalls ab.[1] Das Magnesium-Atom fügt sich in die Kohlenstoff-Halogen-Bindung ein. Im Folgenden wird das Halogen Brom benutzt, wobei auch eines der Halogene Chlor oder Iod verwendet werden können. Im ersten Schritt der Synthese der Magnesium-organischen Verbindung, welcher analog der Sandmeyer-Reaktion ist, wird ein Elektron von dem Metall auf das Alkyl- bzw. Arylhalogenid übertragen, wobei ein Radikalanion entsteht. Wegen der schwachen Kohlenstoff-Halogen-Bindung zerfällt das Radikalanion zu einem Organylradikal R• und dem Halogenid. Im letzten Schritt entsteht die Grignard-Verbindung:
Diese Reaktion wird in nukleophilen Lösungsmitteln, die keinen aktiven Wasserstoff besitzen, wie wasserfreiem Diethylether oder höheren Ethern (Dibutylether, Anisol, Tetrahydrofuran) durchgeführt. Je zwei freie Elektronenpaare von diesen Ethermolekülen sind komplex an das Magnesium gebunden und stellen das zur Stabilität notwendige Elektronenoktett her, was in der Literatur,[2] hier am Beispiel des Tetrahydrofurans, so präsentiert werden kann:

Lösungen von Grignard-Reagenzien können zahlreiche andere Spezies enthalten, die über labile Gleichgewichte miteinander in Beziehung stehen.[3]
Schlenk-Gleichgewicht
Das Schlenk-Gleichgewicht, welches nach Wilhelm Schlenk benannt wurde, beschreibt die molekulare Zusammensetzung der Grignard-Verbindung in Abhängigkeit vom Lösungsmittel. Je nach Lösungsmittel, welches die Grignard-Verbindung in einem Komplex stabilisiert, werden unterschiedliche Strukturen der Grignard-Verbindungen ausgebildet.
Eigenschaften
Die Grignard-Verbindung hat die allgemeine Formel RMgX, wobei X für die Halogene Chlor, Brom oder Iod steht. Dabei fällt die Reaktionsgeschwindigkeit vom Iodid zum Chlorid. Mit Chlorid erhält man eine bessere Ausbeute als mit Bromid oder Iodid.[4] Alkyl- bzw. Arylfluoride reagieren normalerweise nicht zu einer Grignard-Verbindung. Sehr reaktive Verbindungen, wie Iodide, können Nebenreaktionen unterliegen, z. B. der Wurtz-Kupplung.
In der Grignard-Verbindung trägt das Magnesium eine positive Partialladung und das benachbarte Kohlenstoffatom eine negative Partialladung. Diese Polarisierung ist so stark, dass z. B. ein nucleophiler Angriff an einem positiv polarisierten C-Atom stattfinden kann. Man kann die Stärke der Polarität durch den Ionencharakter ausdrücken, welcher 35 % beträgt. Somit verhält es sich ähnlich wie ein Carbanion und kann somit auch als Resonanzformel dargestellt werden, welche eine ionische Bindung mit Ladungstrennung besitzt.[5]
Grignard-Verbindungen reagieren mit Substanzen, welche aktiven Wasserstoff besitzen, wie z. B. Wasser, Alkohole, Phenole, Carbonsäuren, Thiol oder Amin-Gruppen. Dies liegt daran, dass Grignard-Verbindungen stark basisch reagieren. In folgender Abbildung wird die Grignard-Verbindung zum entsprechenden Alkan und Metallhalogenidhydroxid (Mischsalz) hydrolysiert.
Verwendung der Grignard-Verbindungen
Bei der Grignard-Reaktion handelt es sich um eine Namensreaktion in der Organischen Chemie, welche nach ihrem Entdecker Victor Grignard benannt wurde. Diese metallorganische chemische Reaktion, bei der Alkyl- oder Aryl-Magnesiumhalogenide (Grignard-Verbindung) als Nucleophil an elektrophile Gruppen wie z. B. Carbonylgruppen reagieren, dient zum Aufbau von Kohlenstoff-Kohlenstoff-Einfachbindungen.[6]

Die Bedeutung der Grignard-Verbindungen liegt darin, dass sie sehr gute Nukleophile sind. Sie reagieren unter der neuen Bildung einer Kohlenstoff-Kohlenstoff-Bindung mit Elektrophilen, wie beispielsweise mit Ketonen, Aldehyden, Estern und Nitrilen. Grignard-Verbindungen reagieren mit Kohlenstoffdioxid zu Magnesium-Salzen von Carbonsäuren. Analog reagieren Grignard-Verbindungen mit Schwefelkohlenstoff. Die Hydrolyse der Umsetzungsprodukte mit Kohlendioxid liefert Carbonsäuren, R–CO2H, bzw. Dithiocarbonsäuren, R-CS2H. Bei der Reaktion von Grignard-Verbindungen mit elementarem Selen bilden sich durch eine Insertionsreaktion Substanzen des Typs RSeMgX; deren Hydrolyse liefert unter Sauerstoffausschluss Selenole, in Gegenwart von Luftsauerstoff entstehen durch Oxidation der Selenole Diselenide. Eine Methode, um CH-acide Verbindungen in einer Probe mit Grignard-Reagenzien quantitativ zu bestimmen, ist die Zerewitinow-Reaktion.
Technische Bedeutung
Früher hatte eine elektrochemische Variante der Grignard-Reaktion, also die Reaktionen von Grignard-Verbindungen eine Bedeutung bei der Herstellung von Tetraethylblei, einer dem Benzin zur Erhöhung der Klopffestigkeit zugesetzten organischen Bleiverbindung. In der Synthese von Arzneistoffen und anderen Feinchemikalien wird die Grignard-Reaktion häufig angewandt.
Siehe auch
Literatur
- Heinz G. O. Becker, Werner Berger, Günter Domschke: Organikum. 22. Auflage. Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3.
Einzelnachweise
- Reinhard Brückner: Reaktionsmechanismen. 3. korrigierte Auflage. Spektrum Akademischer Verlag, 2007, ISBN 978-3-8274-1579-0, S. 774.
- Heinz G. O. Becker, Werner Berger, Günter Domschke, Egon Fanghänel, Jürgen Faust, Mechthild Fischer, Fritjof Gentz, Karl Gewald, Reiner Gluch, Roland Mayer, Klaus Müller, Dietrich Pavel, Hermann Schmidt, Karl Schollberg, Klaus Schwetlick, Erika Seiler, Günter Zeppenfeld: Organikum. 19. Auflage. Barth, 1993, ISBN 3-335-00343-8, S. 564.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1988, ISBN 3-527-26169-9, S. 162–169.
- K. Schwetlick: Organikum. 23. Auflage. Wiley-VCH Verlag, Weinheim 2009, ISBN 978-3-527-32292-3, S. 563–572.
- K. P. C. Vollhardt, N. E. Schore: Organische Chemie. Hrsg.: H. Butenschön. 4. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2005, ISBN 3-527-31380-X, S. 348–349.
- V. Grignard: Sur quelques nouvelles combinaisons organométalliques du magnèsium et leur application à des synthèses d’alcools et d’hydrocarbures. In: CR Hebd. Séances Acad. Sci., Ser. C. Band 130, 1900, S. 1322–1324 (Digitalisat auf Gallica – frz.; dt. Über einige neue metallorganische Verbindungen von Magnesium und deren Anwendung auf Synthesen von Alkoholen und Kohlenwasserstoffen).