Lutetium
Lutetium ist ein chemisches Element mit dem Elementsymbol Lu und der Ordnungszahl 71. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der Seltenen Erden. Wie die anderen Lanthanoide ist Lutetium ein silberglänzendes Schwermetall. Wegen der Lanthanoidenkontraktion besitzen Lutetiumatome den kleinsten Atomradius, außerdem hat das Element die höchste Dichte und den höchsten Schmelz- und Siedepunkt aller Lanthanoide.
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Lutetium, Lu, 71 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Lanthanoide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | La, 6, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-103-0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.275 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,7 ppm[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 174,9668(1)[3] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 175 (217) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 187 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f14 5d1 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 5.425871(12) eV[4] ≈ 523.52 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 14.13(5) eV[4] ≈ 1363 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 20.9594(12) eV[4] ≈ 2022.27 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 45.249(25) eV[4] ≈ 4365.9 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 66.8(3) eV[4] ≈ 6450 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 9,84 g/cm3 (25 °C)[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm > 0)[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1925 K (1652 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3603 K[9] (3330 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 17,78 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 414 kJ/mol[9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 22 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 1,72 · 106 A·V−1·m−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 16 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,30 V (Lu3+ + 3 e− → Lu) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,27 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Das Element wurde 1907 nahezu gleichzeitig, aber unabhängig voneinander von Georges Urbain, Carl Auer von Welsbach und Charles James entdeckt. Obwohl 1909 entschieden wurde, dass Urbain die Entdeckung zusteht und damit auch der von ihm vorgeschlagene Name Lutetium festgelegt wurde, war besonders im deutschsprachigen Raum die von Carl Auer von Welsbach vorgeschlagene Bezeichnung Cassiopeium (Cp) lange verbreitet.
Lutetium zählt zu den seltensten Seltenerdmetallen und wird darum und infolge der schwierigen Abtrennung von den anderen Lanthanoiden nur in geringem Umfang wirtschaftlich genutzt. Zu den wichtigsten Anwendungen des Elements zählt die Verwendung von Lutetiumoxyorthosilicat für Szintillationszähler in der Positronen-Emissions-Tomographie.
Geschichte

Lutetium wurde 1907 als vorletztes Lanthanoid (nur das radioaktive und damit instabile Promethium wurde später entdeckt) annähernd gleichzeitig und unabhängig voneinander durch drei Chemiker entdeckt. Sowohl der Franzose Georges Urbain, der Österreicher Carl Auer von Welsbach als auch der Amerikaner Charles James untersuchten das 1878 von Jean Charles Galissard de Marignac entdeckte Ytterbium genauer. Urbain berichtete am 4. November 1907 in der Pariser Académie des sciences, dass er durch 800fache Fraktionierung von Ytterbiumnitraten, die er aus Xenotim gewonnen hatte, aus dem Ytterbium von Marignac zwei Elemente erhalten habe. Diese nannte er Neo-ytterbium und Lutecium nach dem alten Namen von Paris, Lutetia.[12][13]
Kurze Zeit später, am 19. Dezember 1907, gab Carl Auer von Welsbach als Ergebnis von Forschungen, die er seit 1905 durchführte, bekannt, dass er aus den Funkenspektren verschiedener Proben, die er durch fraktionierte Kristallisation von Ytterbium-Ammoniumoxalat gewonnen hatte, geschlossen habe, dass dieses aus zwei verschiedenen Elementen bestehen müsse. Diese nannte er Cassiopeium (Cp, nach dem Sternbild Cassiopeia, entspricht Lutetium) und Aldebaranium (Ab, nach dem Stern Aldebaran, entspricht Ytterbium). Er konnte jedoch keine Reinstoffe gewinnen.[14][13]
Auch Charles James arbeitete an der Trennung von Ytterbium mit Hilfe von Ytterbium-Magnesiumnitrat-Salzen und erhielt 1907 größere Mengen der reinen Salze. Nachdem er von der Entdeckung Urbains erfahren hatte, verzichtete er jedoch auf eventuelle Ansprüche auf die Entdeckung des neuen Elements.[13]
In der folgenden Zeit kam es zwischen Urbain und Welsbach zu einigen – durch die politischen Gegensätze zwischen Frankreich und Österreich-Ungarn verstärkten – Auseinandersetzungen um die Anerkennung als rechtmäßiger Entdecker des neuen Elements und damit auch um das Recht, den Namen des Elements festzulegen.[15] Der internationale Atomgewichts-Ausschuss, bestehend aus Frank Wigglesworth Clarke, Wilhelm Ostwald, Thomas Edward Thorpe und Georges Urbain, entschied sich 1909 schließlich für Urbain und seine Elementnamen. Allerdings wurde der Name Neo-ytterbium zu Ytterbium geändert.[16] Endgültig wurde der Name Lutetium für das Element 1949 von der IUPAC festgelegt.[17] Bis dahin hatten vor allem viele deutsche Chemiker an der Bezeichnung Cassiopeium festgehalten.[18]
Das exakte Atomgewicht wurde 1911 von Theodore William Richards anhand Lutetium(III)-bromid bestimmt, das in 15.000 fraktionierten Kristallisationen gereinigt wurde.[13] Metallisches Lutetium wurde erstmals 1953 hergestellt.[18]
Vorkommen

Lutetium ist auf der Erde ein seltenes Element, seine Häufigkeit in der kontinentalen Erdkruste beträgt etwa 0,8 ppm.[19] Es ist das seltenste Lanthanoid nach dem instabilen Promethium und Thulium, aber häufiger als Elemente wie Silber (0,079 ppm), Quecksilber oder Bismut.
Es sind keine Lutetiumminerale bekannt, das Element kommt immer als Beimengung in anderen Seltenerd-Mineralen, vor allem solchen des Yttriums und der schwereren Lanthanoide, wie Xenotim oder Gadolinit, vor. So enthält Xenotim aus Malaysia neben Yttrium, Dysprosium, Erbium und Ytterbium auch 0,4 % Lutetium. Bastnäsit als Mineral der leichteren Ceriterden enthält dagegen nur Spuren des Elements, Monazit bis zu 0,1 %.[20]
Wichtige Quellen für Lutetium sind die Xenotimvorkommen in Malaysia (dort als Begleitmineral von Kassiterit), sowie ionenadsorbierende lateritische Tonminerale in den südchinesischen Provinzen Jiangxi und Guangdong. Aufgrund der schwierigen Gewinnung wird es nur in geringen Mengen hergestellt und eingesetzt und besitzt einen hohen Preis. Aufgrund der geringen Nachfrage wird die Versorgung mit Lutetium nicht als kritisch angesehen.[21][22]
Gewinnung und Darstellung

Die Gewinnung von Lutetium ist vor allem durch die schwierige Trennung der Lanthanoide kompliziert und langwierig. Die Ausgangsminerale wie Monazit oder Xenotim werden zunächst mit Säuren oder Laugen aufgeschlossen und in Lösung gebracht. Die Trennung des Lutetiums von den anderen Lanthanoiden ist dann durch verschiedene Methoden möglich, wobei die Trennung durch Ionenaustausch die technisch wichtigste Methode für Lutetium darstellt, sowie auch für andere seltene Lanthanoide. Dabei wird die Lösung mit den seltenen Erden auf ein geeignetes Harz aufgetragen, an das die einzelnen Lanthanoid-Ionen unterschiedlich stark binden. Anschließend werden sie in einer Trennsäule mit Hilfe von Komplexbildnern wie EDTA, DTPA oder HEDTA vom Harz gelöst, durch die unterschiedlich starke Bindung an das Harz erzielt man somit die Trennung der einzelnen Lanthanoide.[20][23]
Eine Gewinnung von Lutetiummetall ist durch Reduktion von Lutetiumfluorid mit Calcium bei 1500 bis 1600 °C möglich.[20]
Eigenschaften
Physikalische Eigenschaften
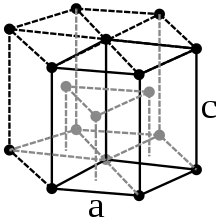
Lutetium ist ein weiches, silberglänzendes Schwermetall. Die Lanthanoidenkontraktion bewirkt, dass Lutetium als das Lanthanoid mit der höchsten Ordnungszahl mit 175 pm den kleinsten Atomradius besitzt. In der Folge besitzt es auch mit 9,84 g/cm3 die höchste Dichte und den höchsten Schmelz- (1652 °C) und Siedepunkt (3330 °C) aller Lanthanoide.
Unter Standardbedingungen kristallisiert Lutetium in einer hexagonal-dichtesten Kugelpackung mit den Gitterparametern a = 351,6 pm und c = 557,3 pm. Neben dieser Struktur sind auch mehrere Hochdruckmodifikationen bekannt. Ab einem Druck von 32 GPa kristallisiert Lutetium in einer Struktur vom Samarium-Typ, einer kompliziert aufgebauten, trigonalen Kristallstruktur, mit den Gitterparametern a = 317,6 pm und c = 2177 pm. Beim Phasenübergang kommt es zu einem Volumenverlust von 1,6 %.[24] Weitere Phasenübergänge gibt es bei einem Druck von 45 GPa, ab dem eine doppelt-hexagonal-dichteste Struktur am stabilsten ist, und bei 88 GPa mit einem Übergang zu einer verzerrten kubisch-dichtesten Struktur (hR24).[25]
Unterhalb von 0,1 K, bei einem Druck von 18 GPa unterhalb von 1,2 K, wird Lutetium zum Supraleiter.[26]
Chemische Eigenschaften
Lutetium ist ein typisches unedles Metall, das, vor allem bei höheren Temperaturen, mit den meisten Nichtmetallen reagiert. Mit Sauerstoff reagiert es bei Standardbedingungen an trockener Luft langsam, schneller bei Anwesenheit von Feuchtigkeit. Metallisches Lutetium ist wie andere unedle Metalle, vor allem bei großer Oberfläche, brennbar.[11] Die Reaktion von Lutetium und Wasserstoff ist nicht vollständig, der Wasserstoff tritt stattdessen in die Oktaederlücken der Metallstruktur ein, und es bilden sich nicht-stöchiometrische Hydridphasen aus, wobei die genaue Zusammensetzung von der Temperatur und dem Wasserstoffdruck abhängt.[27][20]
In Wasser löst sich Lutetium nur langsam, in Säuren schneller unter Wasserstoffbildung. In Lösung liegen immer dreiwertige, farblose Lutetiumionen vor.[27]
Isotope
Es sind insgesamt 34 Isotope (150Lu bis 184Lu) und 35 Kernisomere des Lutetiums bekannt. Von diesen ist nur 175Lu stabil, und 176Lu ist mit einer Halbwertszeit von 3,8 · 1010 Jahren das langlebigste. Diese beiden Isotope kommen natürlich vor, wobei 175Lu mit einem Anteil von 97,41 % in der natürlichen Isotopenzusammensetzung überwiegt. Daher hat ein Gramm natürliches Lutetium eine geringe Eigenstrahlung von 51,8 Bq. Alle weiteren Isotope besitzen nur kurze Halbwertszeiten, mit einem Maximum von 3,31 Jahren bei 174Lu.[28]
Der langsame Zerfall von 176Lu zu 176Hf kann zur Altersbestimmung sehr alter Gesteine verwendet werden. Dabei werden die unterschiedlichen Verhältnisse der Isotope 176Hf und 177Hf bestimmt, und mit dem Verhältnis in Gesteinen bekannten Alters verglichen.[29] Mit dieser Methode gelang eine Altersbestimmung des ältesten bekannten Marsmeteoriten ALH84001 auf 4,091 Milliarden Jahre.[30]
Das Radionuklid 177Lu wird – komplexiert mit Liganden wie DOTA – als kurzreichweitiger Betastrahler in der Therapie gegen neuroendokrine Tumoren und Prostatakrebs verwendet.[31]
Verwendung
Metallisches Lutetium hat keine wirtschaftliche Bedeutung, es wird nur in geringen Mengen für wissenschaftliche Zwecke verwendet.[18] Als Legierung ist das Element wie die anderen Lanthanoide Bestandteil von Mischmetall.[32]
In Verbindungen kann Lutetium als Katalysator für das Cracken von Erdöl und für Polymerisationsreaktionen,[13] als Szintillatormaterial in der Positronen-Emissions-Tomographie[33] oder als Dotierungsmittel für Magnetblasenspeicher aus Gadolinium-Gallium-Granat genutzt werden.[34]
Biologische Bedeutung und Toxizität
Lutetium besitzt keine biologische Bedeutung und ist nur in äußerst geringen Mengen im menschlichen Körper enthalten.[18] Es wurde bei Versuchen an Ratten festgestellt, dass aufgenommenes Lutetium vor allem in der Leber, in geringeren Mengen auch in Knochen und Milz gespeichert wird.[35]
Über toxische Effekte von Lutetium und seinen Verbindungen auf Lebewesen ist wenig bekannt. Bei Ratten wurde für Lutetiumchlorid eine akute Toxizität mit einem LD50-Wert von 315 mg/kg bei intraperitonealer Gabe und 7100 mg/kg für orale Gabe über jeweils sieben Tage bestimmt. Eine chronische Toxizität konnte nicht festgestellt werden.[36] Gelöste Lutetiumionen wirken toxisch für Bakterien wie Aliivibrio fischeri. Lu3+-Ionen besitzen einen EC50-Wert von 1,57 μM und sind damit in der Bakterientoxizität toxischer als Zink- oder Cadmiumionen und vergleichbar mit Kupferionen.[37]
Verbindungen
In Verbindungen kommt Lutetium stets in der Oxidationsstufe +3 vor.
Halogenide
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Lutetium jeweils ein Halogenid mit der Verhältnisformel LuX3. Es handelt sich dabei um typische Salze mit Schmelzpunkten zwischen 892 °C (Lutetium(III)-chlorid) und 1184 °C (Lutetium(III)-fluorid). Mit Ausnahme von Lutetiumfluorid, das in einer Terbium(III)-chlorid-Raumstruktur kristallisiert, bilden die Lutetiumhalogenide eine Aluminiumchlorid-Schichtstruktur.[38]
Metallorganische Verbindungen
Es sind eine Reihe von metallorganischen Verbindungen bekannt. Verbindungen mit einer direkten Bindung zwischen Lutetium und Kohlenstoff sind nur in geringem Umfang bekannt, da es bei diesen wie bei vielen Übergangsmetallen leicht zu Folgereaktionen wie β-Hydrideliminierungen kommt. Sie sind daher mit sterisch anspruchsvollen Resten wie der tert-Butylgruppe oder einer größeren Zahl kleiner Reste wie in einem Hexamethyllutetat-Komplex [Lu(CH3)6]3+ stabil. Die wichtigsten Liganden des Lutetiums sind Cyclopentadienyl (Cp) und dessen Derivate. Ein Sandwichkomplex des Lutetiums ist jedoch nicht bekannt, die wichtigsten Klassen sind solche mit den Formeln CpLuX2, Cp2LuX und Cp3Lu (X kann dabei ein Halogenid, Hydrid, Alkoxid oder weiteres sein). Bei drei Cyclopentadienyl-Liganden werden zwei Liganden η5, einer η1 als Brücke zu einem weiteren Lutetiumatom gebunden.[39]
Weitere Verbindungen
Mit Sauerstoff reagiert Lutetium zu Lutetium(III)-oxid, Lu2O3, das wie die anderen dreiwertigen Oxide der schwereren Lanthanoide in der kubischen Lanthanoid-C-Struktur kristallisiert.[38]
Die technisch wichtigste Lutetiumverbindung ist Lutetiumoxyorthosilicat. Diese ist, mit Cer dotiert, ein Szintillator und wird in Szintillationszählern in der Positronen-Emissions-Tomographie eingesetzt. Aufgrund der sehr kurzen Abklingzeit von 40 ns hat es dort andere Materialien wie Bismutgermanat verdrängt.[33]
Lutetium-Aluminium-Granat (LuAG), beispielsweise mit Europium dotiert, wird unter anderem in Infrarot-Lasern[40] und als Leuchtstoff in weißen Leuchtdioden und Feldemissionsbildschirmen verwendet.[41]
Eine Übersicht über Lutetiumverbindungen bietet die Kategorie:Lutetiumverbindung.
Literatur
- Ian McGill: Rare Earth Elements. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a22_607.
Weblinks
- Eintrag zu Lutetium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Februar 2012.
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Lutetium) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu lutetium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu lutetium bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Lutetium) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1579.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Lutetium) entnommen.
- Datenblatt Lutetium bei Sigma-Aldrich, abgerufen am 26. April 2017 (PDF).
- M. G. Urbain: Un nouvel élément, le lutécium, résultant du dédoublement de l'ytterbium de Marignac. In: Comptes rendus. 145, 1908, S. 759–762 (Digitalisat auf Gallica).
- Per Enghag: Encyclopedia of the elements: technical data, history, processing, applications. John Wiley & Sons, 2004, ISBN 3-527-30666-8, S. 456–458 (eingeschränkte Vorschau in der Google-Buchsuche).
- C. Auer v. Welsbach: Die Zerlegung des Ytterbiums in seine Elemente. In: Monatshefte für Chemie. 29, 1908, S. 181–225, doi:10.1007/BF01558944.
- G. Urbain: Lutetium und Neoytterbium oder Cassiopeium und Aldebaranium. In: Monatshefte für Chemie. 31, 1910, S. I–VI, doi:10.1007/BF01530262.
- F. W. Clarke, W. Ostwald, T. E. Thorpe, G. Urbain: Bericht des Internationalen Atomgewichts-Ausschusses für 1909. In: Berichte der deutschen chemischen Gesellschaft. 42, 1909, S. 11–17, doi:10.1002/cber.19090420104.
- W. H. Koppenol: Naming of new elements (IUPAC Recommendations 2002). In: Pure and Applied Chemistry. 74, 2002, S. 787–791, doi:10.1351/pac200274050787.
- John Emsley: Nature's building blocks: an A-Z guide to the elements. Oxford University Press, 2001, ISBN 0-19-850341-5, S. 240–242 (eingeschränkte Vorschau in der Google-Buchsuche).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea, S. 14-18.
- Ian McGill: Rear Earth Elements. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a22_607.
- Harald Elsner: Kritische Versorgungslage mit schweren Seltenen Erden – Entwicklung „Grüner Technologien“ gefährdet? In: Commodity Top News. Nr. 36, 2011, (pdf)
- Gordon B. Haxel, James B. Hedrick, Greta J. Orris: Rare Earth Elements—Critical Resources for High Technology. (= U.S. Geological Survey Fact Sheet 087-02, 2002). (pdf)
- V. M. Gelis, E. A. Chuveleva, L. A. Firsova, E. A. Kozlitin, I. R. Barabanov: Optimization of Separation of Ytterbium and Lutetium by Displacement Complexing Chromatography. In: Russian Journal of Applied Chemistry. 78, 2005, S. 1420–1426, doi:10.1007/s11167-005-0530-6.
- L. Liu: Lutetium: High pressure polymorph and compression. In: Journal of Physics and Chemistry of Solids. 36, 1975, S. 31–35, doi:10.1016/0022-3697(75)90127-4.
- Gary Chesnut, Yogesh Vohra: Phase transformation in lutetium metal at 88 GPa. In: Physical Review B. 57, 1998, S. 10221–10223, doi:10.1103/PhysRevB.57.10221.
- Cristina Buzea, Kevin Robbie: Assembling the puzzle of superconducting elements: a review. In: Superconductor Science and Technology. 18, 2005, S. R1–R8, doi:10.1088/0953-2048/18/1/R01.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1938–1941.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- Attila Vértes, Sándor Nagy, Zoltán Klencsár: Handbook of Nuclear Chemistry. Band 2, Springer, 2003, ISBN 1-4020-1305-1, S. 169–170 (eingeschränkte Vorschau in der Google-Buchsuche).
- T. J. Lapen, M. Righter, A. D. Brandon, V. Debaille, B. L. Beard, J. T. Shafer, A. H. Peslier: A Younger Age for ALH84001 and Its Geochemical Link to Shergottite Sources in Mars. In: Science. 328, 2010, S. 347–351, doi:10.1126/science.1185395.
- Magdy M. Khalil: Basic Sciences of Nuclear Medicine. Springer, 2010, ISBN 978-3-540-85961-1, S. 37 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Lutetium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Februar 2012.
- Gopal B. Saha: Physics and radiobiology of nuclear medicine. 3. Auflage. Springer, 2006, ISBN 0-387-30754-0, S. 84 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. W. Nielsen, S. L. Blank, D. H. Smith, G. P. Vella-Coleiro, F. B. Hagedorn, R. L. Barns, W. A. Biolsi: Three garnet compositions for bubble domain memories. In: Journal of Electronic Materials. 3, 1974, S. 693–707, doi:10.1007/BF02655293.
- Artur Palasz, Piotr Czekaj: Toxicological and cytophysiological aspects of lanthanides action. In: Acta Biochemica Polonica. 47, 2000, S. 1107–1114 (Volltext, pdf).
- Thomas J. Haley, N. Komesu, M. Efros, L. Koste, H. C. Upham: Pharmacology and toxicology of lutetium chloride. In: Journal of Pharmaceutical Sciences. 53, 1964, S. 1186–1188, doi:10.1002/jps.2600531011.
- Lennart Weltje, Lars R. C. W. Verhoof, Wilko Verweij, Timo Hamers: Lutetium Speciation and Toxicity in a Microbial Bioassay: Testing the Free-Ion Model for Lanthanides. In: Environmental Science & Technology. 38, 2004, S. 6597–6604, doi:10.1021/es049916m.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1941–1943.
- Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 573–583.
- L. Yi-kun, J. Dan-yu, S. Jian-lin: Transparent lutetium aluminum garnet sintered from carbonate coprecipitated powders. In: Materials Letters. Band 59, Nummer 28, Dezember 2005, S. 3724–3727, doi:10.1016/j.matlet.2005.07.006.
- D. Uhlicha, P. Huppertzb u. a.: Preparation and characterization of nanoscale lutetium aluminium garnet (LuAG) powders doped by Eu3+. In: Optical Materials. Band 29, Nummer 11, Juli 2007, S. 1505–1509, doi:10.1016/j.optmat.2006.07.013.
