Ribose
Ribose ist ein Zucker mit fünf Kohlenstoff-Atomen, eine Pentose, und kommt als D-Ribose in der Natur häufig vor, während die enantiomere L-Ribose nur geringe Bedeutung hat.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
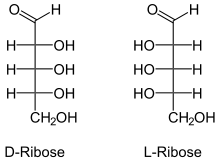 | ||||||||||
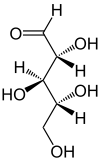
| Fischer-Projektion, offenkettige Darstellung | ||||||||||
| Allgemeines | ||||||||||
| Name | Ribose | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C5H10O5 | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 150,13 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
0,80 g·cm−3 (20 °C)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
D-Ribose ist Bestandteil der Bausteine von Ribonukleinsäure (RNA). In den Nukleosiden ist die Ribose über das C1-Atom mit einer Nukleobase verknüpft, so in Adenosin, Cytidin, Guanosin, Uridin und Ribothymidin. Durch zusätzliche Phosphorylierung der Hydroxygruppe (-OH) am C5-Atom entstehen die entsprechenden Nukleotide. Das Rückgrat (Backbone) eines RNA-Makromoleküls bilden die über Phosphorsäureester-Bindungen miteinander verknüpften Ribose-Einheiten.
Mit „Ribose“ ist gewöhnlich D-Ribose gemeint. Von dieser unterscheidet sich die D-Desoxyribose in Desoxyribonukleinsäure (DNA) nur am C2-Atom durch ein fehlendes Sauerstoffatom. Über den Pentosephosphat-Zyklus kann Ribose auch im menschlichen Organismus aus anderen Monosacchariden synthetisiert werden.
Etymologie und Isolierung
Der bedeutende Chemiker Emil Fischer erkannte, dass es neben den aus fünf Kohlenstoffatomen bestehenden Kohlenhydraten Xylose und Arabinose noch ein weiteres Isomer (Epimer) geben müsse, dem er den Namen Ribose gab. Dieser ist ein Kunstname, kombiniert aus vertauschten Buchstaben des Namens Arabinose. Der aus den USA in Fischers Berliner Institut gekommene Forscher Phoebus Levene stellte die Weiche für eine in die Zukunft führende Schiene, was er damals jedoch nicht absehen konnte: er hydrolysierte aus Bäckerhefe "Hefenucleinsäure" und erhielt eine Ribose mit D,D,D-Konfiguration. Das Ergebnis wurde im Jahre 1909 in den Berichten der deutschen chemischen Gesellschaft beschrieben.[2]
Weitere Untersuchungen von Levene und W. A. Jacobs ergaben, dass der Zucker Ribose an heterocyclische Basen, z. B. Adenin, gebunden war, d. h. als Nukleosid vorlag. Wie oben beschrieben, sind an die Nukleoside Phosphat-Gruppen gebunden (Nukleotide).
Zur Herstellung größerer Mengen Ribose waren jedoch Levenes Verfahren zu aufwendig. Hellmut Bredereck erarbeitete verbesserte Methoden, indem er ein Enzym aus Süßmandeln zur Hydrolyse einsetzte. So konnte die Reaktionstemperatur abgesenkt werden.[3][4]
Synthesen
Zeitlich vor der D-Ribose wurde von Oskar Piloty durch Partialsynthese, ausgehend von der aus Gummi arabicum durch Hydrolyse erhältlichen L-Arabinose, erstmals (1891) die L-Ribose gewonnen. Dazu wurde die Aldehydgruppe der Aldose mit Bromwasser zur Carbonsäure (L-Arabonsäure, L-Arabinsäure) oxidiert. Nach Erhitzen mit der schwachen Base Pyridin in wässriger Lösung trat Epimerisierung am C2-Atom ein, d. h. im Gleichgewicht mit L-Arabonsäure entstand L-Ribonsäure. Diese wurde abgetrennt und zum Lacton cyclisiert, welches im letzten Schritt mittels Natriumamalgam zu L-Ribose reduziert wurde. Willem Alberda van Ekenstein und Jan Johannes Blanksma verbesserten die Reinigung der L-Ribose nach der Reduktion mit Natriumamalgam.[5] Nachdem auch D-Arabinose durch Wohl-Abbau der billigen D-Glucose zugänglich geworden war, stellten van Ekenstein und Blanksma auch D-Ribose nach der Fischer-Piloty-Methode her.[6]

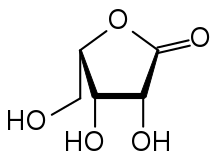
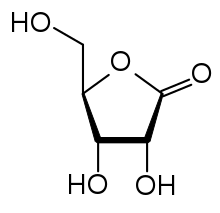
Die in der Zeit der Aufklärung dieser Kohlenhydrate benutzen Fischer-Projektionsformeln geben keinen Eindruck von der räumlichen Struktur. Daher sind perspektivische Skelettformeln der Lactone eingefügt.
Otto Ruff veröffentlichte im Jahre 1898 eine zweite Methode zur Umwandlung der D-Gluconsäure in D-Arabinose (Ruff-Abbau). Das Calciumsalz der Carbonsäure (Calcium-D-gluconat) wurde mit Wasserstoffperoxid in Gegenwart von Eisensalzen oxidativ decarboxyliert.[7]
Eine wichtige Verbesserung der Synthese des D-Epimers war die elektrochemische Oxidation der D-Arabinose an der Anode, wobei Calciumcarbonat zugesetzt wurde. Die D-Arabonsäure konnte als Calciumsalz isoliert und weiterverarbeitet werden.[8]
Paul Karrer und Mitarbeiter nutzten diese Reaktionsschritte für eine Synthese des Lactoflavins.[9]
In neuerer Zeit ist auch die "unnatürliche" L-Ribose wieder ins Blickfeld gerückt; Derivate mit dieser Pentose könnten für die Entwicklung von pharmazeutischen Wirkstoffen interessant sein. So kann durch Biotechnologie aus L-Arabinose L-Ribose hergestellt werden (vgl. mit Pilotys Synthese, siehe oben).[10]
Eigenschaften
Ribose ist ein farbloser Feststoff mit einem Schmelzpunkt bei 90–95 °C und ist in Wasser löslich.[1]
Die Konstitution und Strukturen der D-Ribose waren mühsam erarbeitet worden. Erst im Jahre 2010 wurde über eine Kristallstrukturanalyse der Verbindung berichtet. Röntgenbeugungs- und NMR-spektroskopische Experimente kamen zu dem Ergebnis, dass die Moleküle in kristalliner D-Ribose ein Halbacetal bilden und als Sechserring in einer Pyranoseform vorliegen. Es existieren zwei isomere Formen, α-D-Ribopyranose und β-D-Ribopyranose, welche im Kristall in unterschiedlichen Verhältnissen enthalten sind.[11]
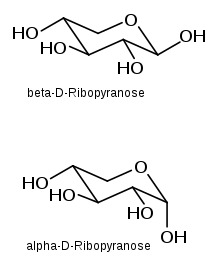
In Wasser gelöst behält Ribose die Pyranosestruktur zum Teil bei; außerdem werden – wie schon seit langem bekannt – in einem chemischen Gleichgewicht Fünferringe, d. h. Furanosen gebildet. In beiden Fällen sind α- und β-anomere Formen möglich.
Bei 31 °C liegt das D-Ribose-Molekül zu 58,5 % in der β-D-pyranoiden, zu 21,5 % in der α-D-pyranoiden, zu 13,5 % in der β-D-furanoiden, zu 6,5 % in der α-D-furanoiden und zu 0,05 % in der offenkettigen Form vor.[12] In wässriger Lösung ist somit die β-Pyranoseform am häufigsten, da hier drei der vier Hydroxygruppen in äquatorialer Ebene liegen.
| D-Ribose – Schreibweisen | ||
|---|---|---|
| Keilstrichformel | Haworth-Schreibweise | |
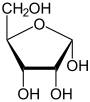
 |
 α-D-Ribofuranose |
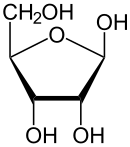 β-D-Ribofuranose |
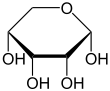 α-D-Ribopyranose |
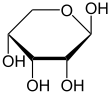 β-D-Ribopyranose | |
Biologische Bedeutung und Biosynthese
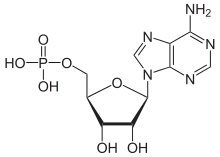
D-Ribose ist, am C5-OH mit Phosphorsäure verestert, als Ribose-5-phosphat ein Glied des Kohlenhydratstoffwechsels. Seine Biosynthese erfolgt auf mehreren Wegen. Eine Vorstufe ist Ribulose-5-phosphat, eine andere Glycerinaldehyd-3-phosphat, welches mit einem C2-Fragment in einer Transketolase-Reaktion zum C5-Zuckerphosphat erweitert wird.[13]
Ribose ist ein Baustein der Nukleoside und Nukleotide. Ribosyl-Nukleosidphosphate spielen eine wichtige Rolle im Stoffwechsel von Zellen, beispielsweise als biologische Energieträger wie Adenosindiphosphat (ADP) und Adenosintriphosphat (ATP). Die Wirkung hormoneller und nervöser Signale in der Zelle kann durch cyclisches Adenosinmonophosphat (cAMP), das als sekundärer Botenstoff dient, verstärkt werden.
Interstellares Vorkommen
In Meteoriten wurde im Jahre 2019 Ribose nachgewiesen.[14] Da dieses Kohlenhydrat für das Leben auf der Erde essenziell ist, stellt dieser Befund ein weiteres Mal die Frage nach der Chemischen Evolution, d. h. wie sich das präbiotische "Leben" auf unserem Planeten entwickelt hat.
Nachweis
Ribose lässt sich mit dem Bial-Reagenz nachweisen (einer Lösung von Orcin und Eisen(III)-chlorid in konzentrierter Salzsäure). Der Test ist positiv, wenn sich nach Zugabe von Bial-Reagenz zum Kohlenhydrat und nach Erhitzen eine grün-blaue Färbung einstellt.
Weblinks
Einzelnachweise
- Eintrag zu CAS-Nr. 50-69-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. September 2014. (JavaScript erforderlich)
- P. A. Levene, W. A. Jacobs. Berichte der deutschen chemischen Gesellschaft, Jg. 1909, Bd. 42, 1201.
- Hellmut Bredereck: Darstellung der Nucleoside durch enzymatische Hydrolyse der Hefenucleinsäure; zugleich ein Beitrag zur Darstellung der d-Ribose. In: Berichte der deutschen chemischen Gesellschaft. Jg. 1938, Bd. 71, 408.https://doi.org/10.1002/cber.19380710237
- Hellmut Bredereck, Martin Köthnig, Eva Berger: Über die d-Ribose (Darstellung einer krystallisierten Anhydroribose), In: Berichte der deutschen chemischen Gesellschaft. 1940, Bd. 73, 956. https://doi.org/10.1002/cber.19400730906
- W. Alberda van Ekenstein, J. Blanksma: Über krystallisierte l-Ribose. In: Chemisch Weekblad Bd. 6, S. 373–375. Nach dem Referat von Henle in Chemisches Zentralblatt Jg. 1908, Bd. 2, S. 1584. https://delibra.bg.polsl.pl/dlibra/publication/38191/edition/34381/content?ref=struct, abgerufen am 19. Oktober 2020.
- W. Alberda van Ekenstein, J. Blanksma: Über d-Ribose. In: Chemisch Weekblad Bd. 10, S. 664. Nach dem Referat von Schönfeld in Chemisches Zentralblatt Jg. 1913, Bd. 2, S. 1562. https://delibra.bg.polsl.pl/dlibra/publication/18297/edition/17223/content?ref=struct, abgerufen am 19. Oktober 2020.
- Otto Ruff: Ueber die Verwandlung der d-Gluconsäure in d-Arabinose, In: Berichte der deutschen Chemischen Gesellschaft, Jg. 1898, Bd. 31, S. 1573. https://doi.org/10.1002/cber.18980310250
- Marguerite Steiger, Helvetica chimica Acta. Bd. 19, S. 189. In ihrer digitalisierten, im Internet zugänglichen Dissertation sind experimentelle Details ausführlich beschrieben. https://www.research-collection.ethz.ch/bitstream/handle/20.500.11850/133644/1/eth-20781-01.pdf
- Paul Karrer, B. Becker, F. Benz, P. Frei, H. Salomon, K. Schopp, Zur Synthese des Lactoflavins. In: Helvetica Chimica Acta. Jg. 1935, Bd. 18, S. 1435–1448. DOI : 10.1002/hlca.193501801196
- M. Helanto, K. Kiviharju, T. Granström, M. Leisola, A. Nyyssölä: Biotechnological production of l-ribose from l-arabinose. In: Applied Microbiology and Biotechnology Jg. 2009, Bd. 83, S. 77–83.
- Dubravka Šišak, L. B. McCusker, G. Zandomeneghi, B. H. Meier, D. Bläser, R. Boese, W. B. Schweizer, R. Gylmour, J. D. Dunitz. Besser spät als nie! Die in unzähligen Biomolekülen erscheinende Furanose-Form von D-Ribose kommt nicht in der kristallinen Verbindung vor. In: Angewandte Chemie, Jg. 2010, Bd. 122, 4605; Angewandte Chemie International Edition, Jg. 2010, Bd. 49, 4503. https://doi.org/10.1002/ange.201001266
- Stephen J. Angyal: The Composition of Reducing Sugars in Solution. In: Advances in Carbohydrate Chemistry and Biochemistry. Jg. 1984, Band 42, S. 15–68, doi:10.1016/S0065-2318(08)60122-5.
- Peter Karlson et al., Kurzes Lehrbuch der Biochemie für Mediziner und Naturwissenschaftler, 13. Aufl., 1988, S. 218–230, Thieme, Stuttgart, New York.
- Yoshihiro Furukawa, Yoshito Chikaraishi, Naohiko Ohkouchi, O. Ogawa, Daniel P. Glavin, Jason P. Dworkin, Chiaki Abe, Tomoki Nakamura: Extraterrestrial ribose and other sugars in primitive meteorites, In: PNAS Jg. 2019, Bd. 116, S. 24440–24445; https://www.pnas.org/content/116/49/24440