Katalysator
Katalysator (von der Katalyse – griechisch κατάλυσις katálysis, deutsch ‚Auflösung‘ mit lateinischer Endung) bezeichnet in der Chemie einen Stoff, der die Reaktionsgeschwindigkeit durch die Senkung der Aktivierungsenergie einer chemischen Reaktion erhöht, ohne dabei selbst verbraucht zu werden. Er beschleunigt die Hin- und Rückreaktion gleichermaßen und ändert somit die Kinetik chemischer Reaktionen, nicht aber deren Thermodynamik.
Ein Katalysator nimmt an einer chemischen Reaktion unter Bildung einer intermediären Stufe mit den Reaktanten teil, aus der der Katalysator nach Entstehung des Produkts wieder unverändert freigesetzt wird. Ein Katalysator kann diesen so genannten Katalysezyklus viele Male durchlaufen.
Je nachdem, in welchen Phasen Katalysator und Reaktanten vorliegen, spricht man von homogenen oder heterogenen Katalysatoren. Biochemische Prozesse werden durch Enzyme katalysiert.
Geschichte
Seit der Antike werden chemische Reaktionen mit Hilfe von Katalysatoren ausgeführt. Erst Jöns Jakob Berzelius kam 1835 zu der Erkenntnis, dass eine Vielzahl von Reaktionen nur erfolgte, wenn ein bestimmter Stoff zugegen war, der jedoch nicht verbraucht wurde. Seiner Meinung nach wurden diese Stoffe nicht umgesetzt, lieferten jedoch durch ihre Anwesenheit die Energie über ihre katalytische Kraft. Er bezeichnete diese Stoffe als Katalysatoren.
In der Folgezeit gelang es, tieferes Verständnis für die thermodynamischen Hintergründe der Katalyse zu gewinnen. Wilhelm Ostwald definierte den Katalysator 1895:
„Ein Katalysator ist ein Stoff, der die Geschwindigkeit einer chemischen Reaktion erhöht, ohne selbst dabei verbraucht zu werden und ohne die endgültige Lage des thermodynamischen Gleichgewichts dieser Reaktion zu verändern.“
Für seine Arbeiten um die Katalyse erhielt Wilhelm Ostwald den Nobelpreis für Chemie.
Chemie
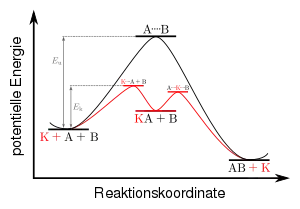
Die Wirkungsweise eines Katalysators beruht auf seiner Möglichkeit, den Mechanismus einer chemischen Reaktion derart zu verändern, dass die Aktivierungsenergie verändert wird. Man „geht einen anderen Weg“ auf der Potential-Hyperebene.
Das Potential ist im Allgemeinen eine Funktion mehrerer Variablen. Deshalb ist im einfachsten Fall, der Abhängigkeit des Potentials von nur zwei Variablen, die sich ändern, das Potential eine dreidimensionale Ebene. Die Variablen können z. B. zwei Bindungsabstände zwischen den Reaktanten sein, die sich während der Reaktion ändern. Dieser einfachste Fall ist zwar anschaulich, aber unrealistisch.
Diese Veränderung der Reaktion geschieht über die Bildung einer reaktiven Zwischenstufe und deren Abreaktion zu den Endprodukten, wobei der eingesetzte Katalysator zurückgebildet wird. In der Praxis werden Katalysatoren durch Nebenreaktionen nach einiger Zeit des Gebrauchs unwirksam, da sie durch Nebenprodukte blockiert werden. Die folgende Grafik ergibt sich als Schnitt durch die Energie-Hyperpotentialfläche.
In der Grafik gibt die obere Kurve (schwarz) die nicht-katalysierte Reaktion
wieder. Die Aktivierungsenergie dieser unkatalysierten Reaktion wird mit bezeichnet. Die untere Kurve (rot) zeigt den Energieverlauf der durch katalysierten Reaktion an. Hier wird über einen Übergangszustand (erstes Profilmaximum) eine Zwischenstufe (lokales Profilminimum) erreicht:
Über einen weiteren Übergangszustand (zweites Profilmaximum) wird das Produkt gebildet, wobei der Katalysator zurückgebildet wird:
Die mit bezeichnete Aktivierungsenergie der katalysierten Reaktion ist geringer.
Als Beispiel kann die katalytische Verbrennung von Wasserstoff mit Sauerstoff angeführt werden. Diese Verbrennung ist thermodynamisch so günstig, dass sie prinzipiell „freiwillig“ ablaufen sollte, jedoch aufgrund der bei Zimmertemperatur hohen Aktivierungsenergie so stark gehemmt ist, dass die Reaktionsgeschwindigkeit sehr gering ist. Die Anwesenheit eines Platin-Katalysators kann diese Aktivierungsenergie derart erniedrigen, dass diese Reaktion hinreichend schnell bei niedrigeren Temperaturen abläuft. Eine Anwendung dafür war das Döbereinersche Feuerzeug.
Bei Gleichgewichtsreaktionen verändert ein Katalysator Hin- und Rückreaktion auf die gleiche Weise, so dass die Lage des Gleichgewichts nicht verändert wird, das Gleichgewicht sich aber schneller einstellt.
Bedeutung der Katalysatoren

Katalysatoren kommen in der Natur in vielfältiger Weise vor. In Lebewesen laufen fast alle lebensnotwendigen chemischen Reaktionen katalysiert ab (beispielsweise bei der Photosynthese, der Atmung oder der Energiegewinnung aus der Nahrung). Die verwendeten Katalysatoren sind meist bestimmte Eiweiße, wie zum Beispiel die Enzyme.
Die Herabsetzung der Aktivierungsenergie durch Katalysatoren ist bei chemischen Reaktionen von großer kommerzieller Bedeutung. Derzeit wird geschätzt, dass etwa 80 % aller chemischen Erzeugnisse eine katalytische Stufe in ihrer Wertschöpfungskette durchlaufen. Ohne die Anwesenheit des Katalysators würde die jeweilige chemische Reaktion sehr viel langsamer oder gar nicht erfolgen. Deshalb sind Katalysatoren heutzutage kaum noch aus der Chemietechnik wegzudenken.
Entstehen bei Reaktionen mehrere Produkte, spielt die Selektivität eines Katalysators eine sehr wichtige Rolle. Dabei wird der Katalysator so gewählt, dass nur diejenige Reaktion beschleunigt wird, die das erwünschte Produkt erzielt. Verunreinigungen durch Nebenprodukte werden so weitgehend vermieden.
Aus der Sicht des Umweltschutzes wird durch den Einsatz von selektiven und aktiven Katalysatoren Energie eingespart und die Menge an Nebenprodukten reduziert. Nicht minder bedeutsam für die Umwelt ist die Abgasnachbehandlung in der industriellen Produktion oder in Elektrizitätswerken. Im Falle der abgaskatalytischen Verfahren (z. B. in PKW) werden unvermeidbare, gefährliche Substanzen in weniger gefährliche umgesetzt.
Beispiel: Im Autoabgaskatalysator reagieren das Atemgift Kohlenstoffmonoxid (CO) sowie unverbrannte Kohlenwasserstoffe mit NOx und Sauerstoff (O2) zu Kohlenstoffdioxid (CO2) sowie Stickstoff und Wasser (H2O).
Beispiele für Katalysatoren

Cereisen (Ammoniaksynthese), Raney-Nickel, Platin, Rhodium, Palladium, Braunstein, Vanadiumpentoxid und Samarium(III)-oxid katalysieren die Dehydrierung von Ethanol.
Hopcalite, eine Gruppe von Katalysatoren aus verschiedenen Metalloxiden, katalysieren die Oxidation von Kohlenstoffmonoxid zu Kohlenstoffdioxid bei Raumtemperatur.
Fahrzeugkatalysator: Bekanntestes Beispiel ist der Katalysator im Automobil zur Reduktion der Abgasemissionen, bei dem das ganze Gerät nach dem chemisch-physikalischen Prinzip benannt ist.
Aktivkohlewärmer: Salz und Wasser dienen als Katalysatoren. Er dient als Handwärmer.
Für Veresterungen werden saure Katalysatoren als Protonendonatoren verwendet. Diese sorgen dafür, dass das chemische Gleichgewicht während der Fischer-Veresterung auf die Seite der Produkte verlagert wird. Bekannte Katalysatoren sind die p-Toluolsulfonsäure und die Schwefelsäure, aber auch Natriumhydrogensulfat kann als Katalysator wirken.
Wichtige katalytische Verfahren
| Verfahren | Produkt | Katalysator | Bedingung | Reaktor |
|---|---|---|---|---|
| Haber-Bosch-Verfahren | NH3 | α-Eisen/Al2O3 | T = 450…500 °C; p = 25…40 MPa | Festbettreaktor |
| Methanolherstellung | CH3OH | CuO/Cr2O3, ZnO/Cr2O3 oder CuO/ZnO | T = 210…280 °C; p = 6 MPa | Festbettreaktor |
| Kontaktverfahren | H2SO4 | V2O5/Träger | T = 400…500 °C | Festbettreaktor |
| Ostwaldverfahren | HNO3 | Platin/Rhodium | T = 800 °C |
Literatur
- Ferdi Schüth: Schlüsseltechnologie der chemischen Industrie: Heterogene Katalyse. In: Chemie in unserer Zeit, 2006, 40, S. 92–103.
- Michael Röper: Homogene Katalyse in der chemischen Industrie. In: Chemie in unserer Zeit, 2006, 40, S. 126–135.
- Rainer Stürmer, Michael Breuer: Enzyme als Katalysatoren. Chemie und Biologie Hand in Hand. In: Chemie in unserer Zeit, 2006, 40, S. 104–111.
Weblinks
- Literatur von und über Katalysator im Katalog der Deutschen Nationalbibliothek
Einzelnachweise
- Eugen Hintsches: Nanozwiebeln würzen die Styrolchemie. In: MaxPlanckForschung, Schwerpunkt Materialwissenschaften, Nr. 4, 2002, S. 44–50, hier Seite 48 (Kasten).