Dimethylsulfid
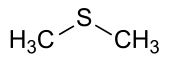
Dimethylsulfid (DMS), auch Methylthiomethan ist eine schwefelhaltige organische Verbindung (also eines der Dialkylsulfide) mit der chemischen Formel (CH3)2S. Es ist der einfachste Thioether, die am häufigsten biogen in die Atmosphäre emittierte Schwefelverbindung und verantwortlich für den typischen Geruch des Meeres. DMS entsteht unter anderem beim Kochen von verschiedenen Gemüsen, insbesondere Getreide und Kohl, sowie Meeresfrüchten. Außerdem dient es als Indikator für eine bakterielle Infizierung bei der Malzherstellung. Dimethylsulfid ist ein Zersetzungsprodukt des Dimethylsulfoniumpropionats (DMSP), kann aber auch bei der bakteriellen Verstoffwechselung von Methanthiol entstehen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethylsulfid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C2H6S | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit unangenehmem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 62,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,85 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
37 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,4438 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
noch nicht eingestuft[2] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−65,3 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
DMS aus dem Meer
DMS wird von Phytoplankton gebildet und ist in einigen nmol/l im Oberflächenwasser der Ozeane gelöst, wovon jährlich etwa 30 Millionen Tonnen in die Atmosphäre ausgasen.[7] Dort oxidiert DMS über Dimethylsulfoxid (DMSO) und Schwefeldioxid zu Schwefelsäure, die zu Tröpfchen kondensiert. Über den Ozeanen ist das die dominante Quelle von Kondensationskeimen für die Wolkenbildung und beeinflusst damit deutlich das Erdklima, siehe CLAW-Hypothese.
Bedeutung als Geruchsstoff
Krill frisst Phytoplankton und riecht daher nach DMS, was manche Nahrung suchende Seevögel wahrnehmen. Durch Bewuchs mit Phytoplankton riecht auch treibender Müll nach DMS und wird mit Krill verwechselt.[8]
DMS ist weiterhin eine Komponente der Blähungsgase und von Mundgeruch im menschlichen Atem, es wird von anaeroben Bakterien im Mund- und Zungenbereich erzeugt[9] oder wird als Abbauprodukt von Medikamenten über die Lunge ausgeschieden.
Herstellung
DMS wird mit Aluminiumoxid als Katalysator aus Schwefelwasserstoff und Methanol hergestellt.[10]
Verwendung
In der Industrie wird DMS bei der Raffination von Erdöl sowie in petrochemischen Produktionsprozessen zur Kontrolle der Bildung von Koks und Kohlenstoffmonoxid verwendet. Außerdem wird es zur Staubkontrolle in Stahlwalzwerken und in einer Reihe von organischen Synthesen genutzt. Ein weiteres Anwendungsgebiet findet sich in der Lebensmittelindustrie als Gewürzkomponente.
Dimethylsulfid kann natürlich oder künstlich zu Dimethylsulfoxid oxidiert werden, welches verschiedene wichtige Eigenschaften als Lösungsmittel hat.
Sicherheitshinweise
Dimethylsulfid ist eine leichtentzündliche Chemikalie (Flammpunkt: −45 °C im geschlossenen Tiegel; Zündtemperatur: 205 °C) und als gesundheitsschädlich eingestuft. Es ist sehr leicht flüchtig, die Dämpfe sind schwerer als Luft und bilden mit ihr ein explosionsfähiges Gemisch. Die untere Explosionsgrenze liegt bei 2,2, die obere bei 19,7 Volumenprozent DMS.
Die LD50 bei oraler Applikation beträgt für Mäuse 3700 mg/kg, die Werte für Ratten reichen von 535 bis 3300 mg/kg.
Einzelnachweise
- Eintrag zu DIMETHYL SULPHIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- Eintrag zu Dimethylsulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Dimethylsulfid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-210.
- Eintrag zu Dimethyl sulfide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- A. Lana et al.: An updated climatology of surface dimethlysulfide[sic!] concentrations and emission fluxes in the global ocean, Global Biogeochemical Cycles 25, 2011, GB1004, doi:10.1029/2010GB003850.
- Research Highlight: Plastic smells good to marine birds. Nature 539, 2016, doi:10.1038/539332a.
- Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag (2011) S. 61–62, ISBN 978-3-8348-1245-2.
- Kathrin-Maria Roy: Thiols and Organic Sulfides. In: Ullmann's Encyclopedia of Industrial Chemistry. 2000. doi:10.1002/14356007.a26_767.

