Elektrode
Eine Elektrode [elɛkˈtroːdə] (von altgriechisch ηλεκτρόν elektron, „Bernstein“, i. ü. S. „elektrisch“, und ὁδός hodós, „Weg“) ist ein Elektronenleiter, der im Zusammenspiel mit einer Gegenelektrode (Anode – Kathode) mit einem zwischen beiden Elektroden befindlichen Medium in Wechselwirkung steht. Elektroden bestehen aus elektrischen Leitern, meist einem Metall oder Graphit. Sie dienen dazu, nicht elektronenleitende Bereiche mit Kabeln zu verbinden, und finden dazu beispielsweise Anwendung in elektrochemischen Elementen, als Werkzeug (z. B. beim Widerstandspunktschweißen) und ggf. Materialspender beim Elektroschweißen, als Anschlüsse und elektronenoptische Elemente in Elektronenröhren. Über die elektrische Funktion hinaus kann Elektrodenmaterial abgeschieden oder verbraucht werden, oder es können physikalische Prozesse in der Elektrode stattfinden wie in der Anode einer Röntgenröhre.
Elektroden im Gas oder Vakuum oder mit Isolator

Je nach Art des die Elektrode umgebenden Mediums kommt es zu unterschiedlichen Formen der Wechselwirkung:
Ist das Medium ein Isolator, baut sich zwischen den Elektroden ein elektrisches Feld auf. Diese Konfiguration wird Kondensator genannt. Siehe hierzu jedoch auch stille elektrische Entladung.
Ist das Medium ein Vakuum oder ein Gas, so baut sich wie im Falle des Isolators ein elektrisches Feld zwischen den Elektroden auf. Jedoch können sich Elektronen von einer Elektrode, der Kathode, zur anderen bewegen, wenn der Austritt aus der Kathode ermöglicht wird, z. B. durch Feldemission oder thermische Emission beziehungsweise den Edison-Richardson-Effekt wie dies bei verschiedenen Elektronenröhren mit Glühkathoden der Fall ist.
Ist das Medium ein Gas, dann werden die Atome bzw. Moleküle des Gases teilweise ionisiert, so dass ein Plasma entsteht. Im Plasma bewegen sich neben den Elektronen auch die Ionen im elektrischen Feld, wie bei einer Gasentladungslampe.
Auch die Elektroden der Zündkerzen, die Schweißelektroden beim Elektroschweißen und die Elektroden im Inneren der Düse beim Plasma-Schmelzschneiden fallen in diese Kategorie. Die Schweißelektroden erzeugen beim Schweißen einen Lichtbogen mit dem zu schweißenden Material. In der Hitze des Lichtbogens schmelzen beide und die Elektrode dient als Zusatzwerkstoff, so dass die Materialien verbunden werden.
Elektrochemische Elektroden
Hier ist das Medium, das an die Elektrode grenzt, ein flüssiger oder fester Ionenleiter, der Elektrolyt. Durch Oxidations- und Reduktionsreaktionen oder durch eine äußere Spannung baut sich an der Elektrode ein elektrochemisches Potential auf.
Man unterscheidet je nach Art der Abhängigkeit des Potentials von der Konzentration des Elektrolyten vier Typen von Elektroden:
- Elektroden erster Art
- Elektroden zweiter Art, bei denen Feststoffe an der Reaktion beteiligt sind
- Redox-Elektroden; hier treten keine Metallionen, sondern Elektronen durch die Phasengrenzen. Das Metall selbst wird dabei nicht angegriffen, da kein Stofftransport durch die Phasengrenzen stattfindet.
- Ionenselektive Elektroden, bei denen das Potential im Idealfall von der Konzentration nur eines bestimmten Ions abhängt.
Schließt man zwei Elektroden, die in unterschiedlich konzentrierte Elektrolytlösungen tauchen oder aus unterschiedlichen Materialien bestehen, über einen Stromkreis aneinander, erhält man ein galvanisches Element. Zwischen den Elektroden ist eine Spannung messbar, die aus der Potentialdifferenz resultiert und die Quellenspannung oder „reversible Zellspannung“ genannt wird. Solch eine Anordnung kann Strom abgeben (Batterie). Durch Zuschalten einer äußeren Spannung laufen andere chemische Reaktionen an den Elektroden ab (Elektrolyse). Die Elektroden können aus Metallen oder Halbleitern bestehen, z. B. auch aus Graphit, Glaskohlenstoff, und können flüssig (Quecksilber) oder fest sein.
Eine zum Korrosionsschutz verwendete Elektrode ist die Opferanode.
In der Brennstoffzelle, bei Gassensoren sowie bei einigen Batterien kommt die Gasdiffusionselektrode zum Einsatz.
Polarität elektrochemischer Elektroden
| Anode | Kathode | |
|---|---|---|
| Galvanische Zelle | Oxidation − |
Reduktion + |
| Elektrolysezelle | Oxidation + |
Reduktion − |
Für die elektrochemischen Elektroden gilt:
- Die Elektrode, an der die Oxidation abläuft, ist die Anode. Elektronen fließen von der Anode über einen Leiter ab. Anionen in Lösung fließen zur Anode.
- Die Elektrode, an der die Reduktion abläuft, ist die Kathode. Elektronen fließen über einen Leiter zur Kathode. Kationen in Lösung fließen zur Kathode.
Welche der beiden Elektroden Plus- und welche Minuspol ist, hängt von der elektrochemischen Vorrichtung ab:
- Wenn die chemische Reaktion durch einen von einer äußeren Spannung hervorgerufenen Stromfluss erzwungen wird (Elektrolyse, Galvanisierung), wird die Oxidation durch den Elektronenentzug an der positiv geladenen Anode hervorgerufen: Die Anode ist in diesem Fall der Pluspol (+).
- Wenn die elektrische Spannung durch die chemischen Vorgänge von sich aus erzeugt wird, wie zum Beispiel bei Galvanischen Zellen (Batterie oder Brennstoffzelle), ist die Anode negativ geladen, da bei der freiwillig ablaufenden Oxidation Elektronen frei werden. Die Anode ist dann der Minuspol (−).
Da sich bei einer Elektrolyse im Vergleich zu einem galvanischen Element die Polarität der Elektroden umkehrt, ist die Zuordnung von Anode und Kathode oft verwirrend. Man kann sich jedoch an der Flussrichtung der Elektronen orientieren. Dazu stelle man sich die Zelle schematisiert vor: Die Vorsilbe ana- bedeutet aufwärts, die Vorsilbe kata- bedeutet abwärts. In der Regel ist die Anode in Zeichnungen links dargestellt, die Kathode rechts.
Elektroden erster Art
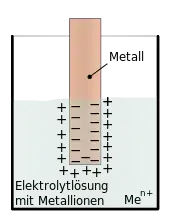
Elektroden erster Art sind Elektroden, deren elektrisches Potential direkt von der Konzentration der sie umgebenden Elektrolytlösung abhängt. Dies sind beispielsweise alle Metalle, die in eine Lösung ihrer Metallionen (Elektrolytlösung) eintauchen. An der Phasengrenze kommt es zur Ausbildung eines Gleichgewichtes zwischen dem Lösungsdruck des Metalles und dem osmotischen Druck der Elektrolytlösung.
- Der Lösungsdruck des Metalles kommt dadurch zustande, dass jedes Metall versucht, aus seinem Gitter Kationen zu lösen. Durch den Überschuss an Elektronen im Metall lädt das Metall sich negativ auf. Infolge der Coulomb-Anziehung bleiben die Kationen in relativer Nähe zur Elektrode. Es bildet sich eine elektrochemische Doppelschicht aus. Das Vermögen eines Metalles, Kationen aus seinem Gitter zu entlassen, wurde für jedes Metall in der elektrochemischen Spannungsreihe aufgelistet. Je niedriger es steht, desto unedler ist es und desto höher ist damit auch sein Vermögen, Kationen zu entlassen.
- Die gegenläufige Tendenz kommt durch den osmotischen Druck der Elektrolytlösung zustande oder einfacher ausgedrückt: Elektrolytlösungen möchten sich verdünnen. Dies erreichen sie, indem sie die gelösten Metallionen in das Gitter der Elektrode drängen und dort einbauen. Dies gelingt ihnen besonders gut, wenn viele Metallionen gelöst vorliegen. Es kommt so zur Ausbildung einer elektrochemischen Doppelschicht mit umgekehrten Vorzeichen. Unterstützt wird dieser gegenläufige Trend durch die elektrostatische Anziehung der gelösten Salzionen durch die beim Lösungsvorgang des Metalls zurückbleibenden Elektronen im Metall.
Im Gleichgewicht halten sich also Lösungsdruck, sowie osmotischer Druck und elektrischer Druck die Waage. Auf welcher Seite (Lösungsdruck vs. osmotischer Druck) das Gleichgewicht liegt, hängt also einerseits von der Stellung des Metalles in der elektrochemischen Spannungsreihe und andererseits von der Konzentration der Elektrolytlösung ab.
Elektroden zweiter Art
Elektroden zweiter Art sind Elektroden, deren elektrisches Potential nur indirekt von der Konzentration der sie umgebenden Elektrolytlösung abhängt. Die Abweichung zur Elektrode erster Art ist jedoch nur eine konstante Spannungsdifferenz. Elektroden zweiter Art werden als Bezugselektroden eingesetzt.
Die Konzentrationsunabhängigkeit des Potentials wird durch den besonderen Aufbau der Elektrode erreicht. Genauer gesagt, wird durch die besondere Zusammensetzung der Elektrolytlösung das Potential konstant gehalten. Die Elektrolytlösung besteht zum einen aus einer gesättigten Lösung eines schwerlöslichen Salzes, welches als Kation aus dem gleichen Metall wie die Elektrode besteht und zum anderen aus einem gut löslichen und genau konzentrierten Alkalisalz, welches das gleiche Anion wie das schwerlösliche Salz enthält.
Das Potential hängt von der Konzentration des Kations des schwerlöslichen Salzes ab. Diese Konzentration ist wiederum über das Löslichkeitsprodukt mit der Konzentration des Anions gekoppelt. Wird die Konzentration des Anions konstant gehalten, bleibt folglich auch das Potential konstant. Diese Anionenkonzentration lässt sich nahezu konstant halten, indem deren Konzentration sehr groß gewählt wird. Durch Subtraktion dieser Spannungswerte vom Messwert erhält man das tatsächliche Potential, bzw. die Quellenspannung einer Lösung.
Wichtige Bezugselektroden sind die Silber-Silberchlorid-Elektrode und die Kalomel-Elektrode. Eingesetzt werden sie beispielsweise in der Potentiometrie.
Ionenselektive Elektroden
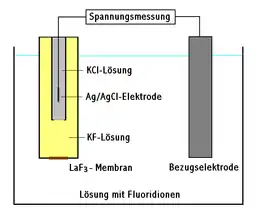
Das an ionenselektiven Elektroden gemessene Potential ist abhängig von der Konzentration (genauer Aktivität) einer bestimmten Ionenart. Eine solche Elektrode besteht im Prinzip aus einer Elektrode, die nicht an der elektrochemischen Reaktion teilnimmt, z. B. einer Graphitelektrode, und einer damit verbundenen Elektrodenphase, die im einfachsten Fall aus einem schwerlöslichen Salz mit der Ionenart besteht, die mit dem entsprechenden Ion in der Lösung im Gleichgewicht steht. In der Praxis sind ionenselektive Elektroden ähnlich wie eine Glaselektrode aufgebaut, wobei die Membranen ionenspezifisch z. B. aus dem schwerlöslichen Salz (Kristallmembran) oder aus Kali- oder Natrongläsern bestehen. Flüssigkeitsmembranen bestehen aus einem inerten Träger, auf denen in organischen Lösungsmitteln gelöste Ionophore aufgezogen sind. Die Selektivität der Elektrode wird im Wesentlichen durch das Löslichkeitsprodukt und die Ionenleitfähigkeit bestimmt. Hierbei ist außerdem zu beachten, dass viele andere in der Lösung gleichzeitig vorhandene Ionen einen Störfaktor bilden können.
Beispiele:
- Bei einer cadmiumselektiven Elektrode besteht die feste Elektrodenphase bzw. die Membran aus Cadmiumsulfid.
- Mit einer Silberchlorid-Silbersulfid-Elektrode, die eine Silberchlorid-Silbersulfid-Mischkristallmembran besitzt, lassen sich sowohl die Konzentrationen von Silberionen als auch die von Chlorid- und Sulfidionen bestimmen.
Inzwischen werden eine Vielzahl von Ionen selektiv bestimmt. In der analytischen Praxis wird u. a. die Fluoridelektrode zur Bestimmung von Fluoridionen in Wasser mit einer Genauigkeit bis 0,01 mg/l und in einem abgewandelten Prinzip die Ammoniakelektrode (eine gasdurchlässige Membranelektrode) benutzt. Eine spezielle Entwicklung sind elektrochemische Biosensoren, z. B. Enzymelektroden.[2]
Mikroelektroden
Die Vorteile von Mikroelektroden sind der sehr kleine Gesamtstrom (nur geringfügige Störung des zu untersuchenden Systems durch Reaktionsprodukte, nur kleiner Spannungsabfall in der Lösung), kein Einfluss (moderater) Strömungen auf das Messergebnis, Nachweisbarkeit sehr kleiner Konzentrationen, Vernachlässigbarkeit kapazitiver Effekte (dies ermöglicht sehr hohe Messraten), und Realisierbarkeit sehr hoher Stromdichten. Diesen stehen Nachteile gegenüber wie ein kleiner Gesamtstrom trotz hoher Stromdichte und ein extrem großes Verhältnis von Probenvolumen zur Elektrodenoberfläche (wenn auch nur Spuren von oberflächenaktiven Stoffen vorliegen, so bedecken sie leicht die gesamte Elektrodenoberfläche).[3]
Historisches
Die Begriffe Elektrode, Elektrolyt, Anode und Kathode entstanden auf Anregung von Michael Faraday (1791–1867) und wurden durch ihn publik gemacht.[4] Faraday, der kein Griechisch gelernt hatte, ließ sich dabei von William Whewell (1794–1866) beraten, dem Rektor des Trinity College der Universität von Cambridge.
Literatur
- International Electrotechnic Vocabulary (IEV), herausgegeben von der Internationalen Elektrotechnischen Kommission (IEC)
Weblinks
- Das IEV im Internet
- Ionenselektive Elektroden Uni Jena (PDF; 184 kB)
- Ionenselektive Elektroden Uni Bern (Memento vom 15. Dezember 2011 im Internet Archive) (PDF; 50 kB)
- Video: Elektroden (Basiswissen Physikalische Chemie #12). Jakob Günter Lauth (SciFox) 2019, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/40359.
Einzelnachweise
- Charles E. Mortimer, Ulrich Müller: Chemie. 8. Auflage, Georg Thieme Verlag KG, 2007, ISBN 978-3-13-484309-5, S. 352.
- H. Wenck, K. Hörner: Ionenselektive Elektroden, Chemie in unserer Zeit, 23. Jahrg. 1989, Nr. 6, S. 207
- Ludwig Pohlmann: Elektrochemische Messmethoden: Mikroelektroden
- https://www.plasma.uaic.ro/topala/articole/Faraday%201834%20VII.pdf (Memento vom 8. März 2018 im Internet Archive) Abschnitt 662, 664 beziehungsweise 663