Vanadium
Vanadium, veraltet auch Vanadin, ist ein chemisches Element mit dem Symbol V und der Ordnungszahl 23. Es ist ein stahlgraues, bläulich schimmerndes, in reinem Zustand sehr weiches Übergangsmetall. Im Periodensystem bildet das Metall zusammen mit den schwereren Niob, Tantal und Dubnium die 5. IUPAC-Gruppe oder Vanadiumgruppe. Der Großteil des Vanadiums wird als sogenanntes Ferrovanadium in der Stahlherstellung eingesetzt. Der Zusatz von Vanadium in Chrom-Vanadium-Stählen führt zu einer Erhöhung der Zähigkeit und damit zu einer erhöhten Widerstandsfähigkeit des Stahls.
| Eigenschaften | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Vanadium, V, 23 | |||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | |||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 5, 4, d | |||||||||||||||||||||||||||||||||
| Aussehen | stahlgrau metallisch, bläulich schimmernd | |||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-171-1 | |||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.337 | |||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,041 %[1] | |||||||||||||||||||||||||||||||||
| Atomar [2] | ||||||||||||||||||||||||||||||||||
| Atommasse | 50,9415(1)[3] u | |||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 135 (171) pm | |||||||||||||||||||||||||||||||||
| Kovalenter Radius | 153 pm | |||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d3 4s2 | |||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 6.746187(21) eV[4] ≈ 650.91 kJ/mol[5] | |||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 14.634(7) eV[4] ≈ 1412 kJ/mol[5] | |||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 29.3111(25) eV[4] ≈ 2828.09 kJ/mol[5] | |||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 46.709(5) eV[4] ≈ 4506.7 kJ/mol[5] | |||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 65.28165(17) eV[4] ≈ 6298.72 kJ/mol[5] | |||||||||||||||||||||||||||||||||
| Physikalisch [2] | ||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch raumzentriert | |||||||||||||||||||||||||||||||||
| Dichte | 6,11 g/cm3 (20 °C)[6] | |||||||||||||||||||||||||||||||||
| Mohshärte | 7,0 | |||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 3,8 · 10−4)[7] | |||||||||||||||||||||||||||||||||
| Schmelzpunkt | 2183 K (1910 °C) | |||||||||||||||||||||||||||||||||
| Siedepunkt | 3680 K[8] (3407 °C) | |||||||||||||||||||||||||||||||||
| Molares Volumen | 8,32 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 444 kJ/mol[8] | |||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 21,5[9] kJ·mol−1 | |||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 4560 m·s−1 bei 293,15 K | |||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 489[1] J·kg−1·K−1 | |||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 5 · 106 A·V−1·m−1 | |||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 31 W·m−1·K−1 | |||||||||||||||||||||||||||||||||
| Chemisch [2] | ||||||||||||||||||||||||||||||||||
| Oxidationszustände | +5, +4 ,+3 ,+2 | |||||||||||||||||||||||||||||||||
| Elektronegativität | 1,63 (Pauling-Skala) | |||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||
Das Element besitzt verschiedene biologische Bedeutungen und ist für viele Lebewesen essentiell. So spielt es eine Rolle bei der Steuerung von Enzymen der Phosphorylierung und wird von Bakterien zur Stickstofffixierung genutzt. Andererseits steht es oder seine Verbindungen in Verdacht, als mutagenes Klastogen Chromosomenaberrationen hervorzurufen und somit als Gift und Karzinogen zu wirken.[11]
Die bekannteste Verbindung des Vanadiums ist Vanadium(V)-oxid, das als Katalysator für die Produktion von Schwefelsäure eingesetzt wird.
Geschichte
_retrato.png.webp)
Zum ersten Mal wurde das spätere Vanadium 1801 vom spanischen Mineralogen Andrés Manuel del Río in einem mexikanischen Bleierz, dem späteren Vanadinit, entdeckt. Er nannte das neue Element zunächst wegen der Vielfarbigkeit der Verbindungen Panchromium, später Erythronium, da sich die Salze beim Ansäuern rot färbten. Die Entdeckung widerrief del Rio jedoch kurze Zeit später, als zunächst Alexander von Humboldt und später der französische Chemiker H.V. Collett-Desotils auf Grund der Ähnlichkeit zu Chromverbindungen behaupteten, bei dem neuen Element würde es sich um verunreinigtes Chrom handeln.[12]
Die Wiederentdeckung des Elementes gelang 1830 dem schwedischen Chemiker Nils Gabriel Sefström. Er untersuchte Eisen aus der schwedischen Eisenerzgrube Taberg, indem er dieses in Salzsäure löste. Dabei entdeckte er neben anderen bekannten Stoffen ein unbekanntes Element, das in manchen Eigenschaften dem Chrom, in anderen dem Uran ähnelte, aber nach weiteren Untersuchungen keines dieser Elemente war. Das neue Element benannte er nach Vanadis, einem Beinamen der nordischen Gottheit Freyja. Kurze Zeit später erbrachte Friedrich Wöhler, der sich bei Berzelius bereits mit der Aufgabe beschäftigt hatte, den Identitätsnachweis von Vanadium mit Erythronium.[13][14]
Metallisches Vanadium wurde erstmals 1867 von Henry Enfield Roscoe durch Reduktion von Vanadium(II)-chlorid mit Wasserstoff hergestellt. 99,7 % reines Vanadium konnten erstmals 1925 John Wesley Marden und Malcolm Rich durch Reduktion von Vanadium(V)-oxid mit Calcium gewinnen.[15]
Vanadium wurde erstmals 1903 verwendet, als in England der erste vanadiumhaltige Stahl produziert wurde. Die stärkere Verwendung des Elements in der Stahlindustrie begann ab 1905, als Henry Ford Vanadiumstähle für den Bau von Automobilen einsetzte.[16]
Vorkommen
.jpg.webp)
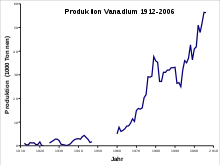
Vanadium ist auf der Erde ein häufiges Element, sein Anteil an der kontinentalen Erdkruste beträgt etwa 120 ppm. Eine ähnliche Elementhäufigkeit besitzen Zirconium, Chlor und Chrom. Das Element kommt überwiegend gebunden in verschiedenen Mineralen vor. Trotz der Häufigkeit des Vanadiums sind Lagerstätten mit hohen Konzentrationen des Elements selten, viele Vanadiumminerale kommen nicht häufig vor. Im Vergleich zur Erdkruste ist der Gehalt im Meerwasser deutlich geringer, er liegt bei etwa 1,3 μg/l.[17]
Zu den wichtigsten Vanadiummineralen zählen vor allem Vanadate wie Vanadinit [Pb5(VO4)3Cl], Descloizit Pb(Zn,Cu) [OH|VO4] und Carnotit [K2(UO2)2(VO4)2·3H2O], sowie das Vanadiumsulfid Patrónit VS4. Der größte Teil des Vanadiums findet sich in Spuren in anderen Mineralen, vor allem Eisenerzen wie Magnetit. Der Vanadiumgehalt von Titan-Magnetit-Erzen beträgt meist zwischen 0,3 und 0,8 %,[18] kann aber in manchen südafrikanischen Erzen bis zu 1,7 %[16] erreichen.
Tiere und Pflanzen enthalten Vanadium, so enthält der Mensch etwa 0,3 mg/kg. Dieses befindet sich zumeist in Zellkernen oder Mitochondrien. Einige Lebewesen, vor allem einige Seescheidenarten und der Fliegenpilz, sind in der Lage, Vanadium anzureichern. In Seescheiden ist der Vanadiumgehalt bis zu 107-mal so groß wie im umgebenden Meerwasser.[19] Auf Grund des Vanadiumgehaltes von Lebewesen sind auch Kohle und Erdöl, die aus diesen entstehen, vanadiumhaltig. Der Gehalt beträgt bis zu 0,1 %.[18] Besonders hohe Vanadiumgehalte findet man in Erdöl aus Venezuela und Kanada.[20]
Im Jahr 2015 wurden insgesamt 79.400 Tonnen Vanadiumerz gefördert (gerechnet als Vanadiummetall). Die wichtigsten Förderländer sind Südafrika, China und Russland. Bei bekannten Reserven von insgesamt 15 Millionen Tonnen (Stand 2015) ist ein Lieferengpass bei Vanadium auf absehbare Zeit nicht zu erwarten.[21]
→ Kategorie:Vanadiummineral
Vanadium als Mineral
Seit 2012 ist Vanadium von der International Mineralogical Association (IMA) als Mineral anerkannt. Es konnte erstmals durch Mikhail Ostrooumov als Resublimationsprodukt in Hochtemperatur-Fumarolen des mexikanischen Vulkans Colima entdeckt werden.[22] Als Begleitminerale traten das ebenfalls erstmals dort entdeckte Kalium-Vanadium-Sulfid Colimait (K3VS4) und das Vanadiumoxid Shcherbinait (V5+2O5) auf.
Die Publikation der Erstbeschreibung erfolgte durch Ostrooumov und Yuri Taran 2015 zunächst in der Macla. Revista de la Sociedad Española de Mineralogía[23] und 2016 im Mineralogical Magazine.[24]
Neben seiner Typlokalität am Vulkan Colima konnte Vanadium gediegen bisher nur noch an einer nicht näher benannten Hibonit-Fundstätte in der argentinischen Sierra de los Comechingones entdeckt werden. Ein weiterer Fund im Vanadiumerz-Tagebau Rhovan bei Rustenburg in der südafrikanischen Provinz Nordwest wurde bisher nicht bestätigt.[25]
Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Vanadium unter der System-Nr. 1.AF.05 (Elemente – Metalle und intermetallische Verbindungen – Eisen-Chrom-Familie – Eisengruppe) eingeordnet.[26]
Gewinnung und Darstellung



Die Darstellung von Vanadium läuft in mehreren Schritten ab. Zunächst muss aus verschiedenen Ausgangsstoffen Vanadium(V)-oxid gewonnen werden. Dieses lässt sich dann zum elementaren Metall reduzieren und gegebenenfalls reinigen.
Mögliche Ausgangsstoffe, aus denen Vanadium gewonnen werden kann, sind Vanadiumerze wie Carnotit oder Patronit, vanadiumhaltige Titan-Magnetit-Erze und Erdöl. Vanadiumerze waren in früherer Zeit für die Produktion wichtig, spielen jedoch keine wichtige Rolle mehr und sind vor allem von den Titan-Magnetit-Erzen abgelöst worden.
Werden vanadiumhaltige Eisenerze im Hochofenprozess zu Eisen reduziert, bleibt das Vanadium zunächst im Roheisen. Um das Roheisen weiter zu Stahl zu verarbeiten, wird während des Frischens Sauerstoff eingeblasen. Dabei geht das Vanadium in die Schlacke über. Diese enthält bis zu 25 % Vanadium(V)-oxid und ist die wichtigste Quelle für die Gewinnung des Metalls. Um das reine Vanadium(V)-oxid zu gewinnen, wird die feingemahlene Schlacke mit Natriumsalzen wie Natriumchlorid oder Natriumcarbonat oxidierend geröstet. Dabei bildet sich wasserlösliches Natriummetavanadat, das von der restlichen Schlacke durch Auslaugen abgetrennt wird. Durch Zugabe von Säure und Ammoniumsalzen fällt das entstandene unlösliche Ammoniumpolyvanadat aus der Lösung aus. Dieses kann durch Rösten zu Vanadium(V)-oxid umgewandelt werden. Auch aus anderen vanadiumhaltigen Erzen kann auf identischem Weg das Oxid gewonnen werden. Aus Erdöl kann das Vanadium durch Bildung einer Emulsion unter Zugabe von Wasser und Magnesiumnitrat extrahiert werden. Die weitere Aufarbeitung geschieht wie bei der Gewinnung aus Eisenerzen.[16]
Die eigentliche Vanadiumgewinnung findet durch Reduktion des Vanadium(V)-oxids mit anderen Metallen statt. Als Reduktionsmittel können Aluminium, Calcium, Ferrosilicium oder Kohlenstoff verwendet werden; mit letzterem bilden sich jedoch bei der Reaktion Carbide, die schwer vom Metall abgetrennt werden können.
- Reduktion mit Calcium
Um reines Vanadium zu erhalten, wird teures Calcium oder Aluminium als Reduktionsmittel verwendet, da mit dem billigeren Ferrosilicium keine hohe Reinheit zu erreichen ist. Während mit Calcium direkt reines Vanadium gewonnen wird, bildet sich mit Aluminium zunächst eine Vanadium-Aluminium-Legierung, aus der durch Sublimation im Vakuum reines Vanadium gewonnen wird.
Ein Großteil des Vanadiums wird jedoch nicht als reines Metall, sondern in Form der Eisen-Vanadium-Legierung Ferrovanadium, die mindestens 50 % Vanadium[16] enthält, verwendet. Um diese herzustellen, ist es nicht nötig, vorher das reine Vanadium zu gewinnen. Stattdessen wird die vanadium- und eisenhaltige Schlacke mit Ferrosilicium und Kalk zu Ferrovanadium reduziert. Diese Legierung reicht für die meisten technischen Anwendungen aus.
Reinstes Vanadium kann entweder elektrochemisch oder nach dem Van-Arkel-de-Boer-Verfahren dargestellt werden. Dazu wird das reine Vanadium zusammen mit Iod in eine luftleere Glasampulle eingeschmolzen. Das in der geheizten Ampulle gebildete Vanadium(III)-iodid zersetzt sich an einem heißen Wolframdraht zu hochreinem Vanadium und Iod.
- Reaktion im Van-Arkel-de-Boer-Verfahren
Eigenschaften
Physikalische Eigenschaften
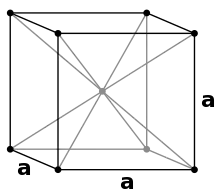
Vanadium ist ein nichtmagnetisches, zähes, schmiedbares und deutlich stahlblaues Schwermetall mit einer Dichte von 6,11 g/cm3.[16] Reines Vanadium ist relativ weich, wird aber durch Beimengungen anderer Elemente härter und besitzt dann eine hohe mechanische Festigkeit. In den meisten Eigenschaften ähnelt es seinem Nachbarn im Periodensystem, dem Titan. Der Schmelzpunkt von reinem Vanadium liegt bei 1910 °C, dieser wird jedoch durch Verunreinigungen wie Kohlenstoff deutlich erhöht. Bei einem Gehalt von 10 % Kohlenstoff liegt er bei etwa 2700 °C.[20] Vanadium kristallisiert wie Chrom oder Niob in einer kubisch-raumzentrierten Kristallstruktur mit der Raumgruppe Im3m (Raumgruppen-Nr. 229) und dem Gitterparameter a = 302,4 pm sowie zwei Formeleinheiten pro Elementarzelle.[27]
Unterhalb einer Sprungtemperatur von 5,13 K wird Vanadium zum Supraleiter.[28] Ebenso wie reines Vanadium sind auch Legierungen des Vanadiums mit Gallium, Niob und Zirconium supraleitend. Bei Temperaturen unter 5,13 K zeigt Vanadium, ebenso wie die Vanadiumgruppenmetalle Niob und Tantal, in kleinsten Klümpchen bis 200 Atomen eine bisher nicht erklärte, spontane elektrische Polarisation, wie sie sonst nur nichtmetallische Stoffe aufweisen.[29][30]
Chemische Eigenschaften
Vanadium ist ein unedles Metall und in der Lage, mit vielen Nichtmetallen zu reagieren. An der Luft bleibt es wochenlang metallisch glänzend. Bei der Betrachtung über längere Zeiträume wird deutlich sichtbarer grüner Rost wahrgenommen. Soll Vanadium konserviert bleiben, so muss es unter Argon aufbewahrt werden. In der Hitze wird es von Sauerstoff angegriffen und zu Vanadium(V)-oxid oxidiert. Während Kohlenstoff und Stickstoff mit Vanadium erst bei Weißglut reagieren, findet die Reaktion mit Fluor und Chlor schon in der Kälte statt.
Gegenüber Säuren und Basen ist Vanadium bei Raumtemperatur meist stabil auf Grund einer dünnen passivierenden Oxidschicht; angegriffen wird es in diesem Zustand nur von Flusssäure sowie stark oxidierend wirkenden Säuren wie heißer Salpetersäure, konzentrierter Schwefelsäure und Königswasser.
Bis zu einer Temperatur von 500 °C ist Vanadium in der Lage, Wasserstoff zu absorbieren. Dabei wird das Metall spröde und lässt sich leicht pulvern. Entfernen lässt sich der Wasserstoff bei 700 °C im Vakuum.[16]
Isotope
Von Vanadium sind insgesamt 27 Isotope und weitere 6 Kernisomere bekannt.[31] Von diesen kommen zwei natürlich vor. Dies sind die Isotope 50V mit einer natürlichen Häufigkeit von 0,25 % und 51V mit einer Häufigkeit von 99,75 %. 50V ist schwach radioaktiv, es zerfällt mit einer Halbwertszeit von 1,5 · 1017 Jahren zu 83 % unter Elektroneneinfang zu 50Ti, zu 17 % unter β−-Zerfall zu 50Cr.[31] Beide Kerne können für Untersuchungen mit der NMR-Spektroskopie genutzt werden.
Die stabilsten künstlichen Isotope sind 48V mit einer Halbwertszeit von 16 Tagen und 49V mit einer Halbwertszeit von 330 Tagen. Diese finden als Tracer Verwendung.[20] Alle anderen Isotope und Kernisomere sind sehr instabil und zerfallen in Minuten oder Sekunden.
Verwendung

Reines Vanadium wird nur zu einem geringen Prozentsatz aufgrund seines geringen Neutroneneinfangquerschnitts als Hüllwerkstoff für Kernbrennstoffe verwendet.[32] Es können aber auch beständigere Vanadiumlegierungen genutzt werden. Über 90 % der Produktion werden in einer Vielzahl von Legierungen, meist mit den Metallen Eisen, Titan, Nickel, Chrom, Aluminium oder Mangan eingesetzt. Nur ein kleiner Teil wird in Verbindungen, meist als Vanadium(V)-oxid genutzt.

Mit 85 % des produzierten Vanadiums wird der weitaus größte Teil in der Stahlindustrie verbraucht. Da hierfür keine hohen Reinheiten nötig sind, wird Ferrovanadium als Rohstoff genutzt. Vanadium steigert schon in kleinen Mengen die Festigkeit und Zähigkeit von Stählen und dadurch deren Verschleißfestigkeit deutlich. Dies wird durch die Bildung von hartem Vanadiumcarbid bewirkt. Je nach Anwendung werden unterschiedliche Mengen Vanadium beigegeben; so enthalten Baustähle und Werkzeugstähle nur geringe Mengen (0,2 bis 0,5 %) Vanadium, Schnellarbeitsstahl bis zu 5 %.[18] Vanadiumhaltige Stähle werden vor allem für mechanisch beanspruchte Werkzeuge und Federn genutzt.
Titanlegierungen, die Vanadium und meist auch Aluminium enthalten, sind besonders stabil und hitzebeständig und werden im Flugzeugbau für tragende Teile und Turbinenblätter von Flugzeugtriebwerken eingesetzt.[16]
Vanadiumverbindungen können zur elektrochemischen Energiespeicherung in Redox-Flow-Zellen dienen, siehe Vanadium-Redox-Akkumulator. Dabei werden Vanadiumsalze in sauren wässrigen Lösungen eingesetzt, die in Tanks gespeichert werden.
Nachweis
Eine Vorprobe liefert die Phosphorsalzperle, bei der Vanadium in der Reduktionsflamme charakteristisch grün erscheint. Die Oxidationsflamme ist schwach gelb und damit zu unspezifisch.[33]
Ein qualitativer Nachweis für Vanadium beruht auf der Bildung von Peroxovanadiumionen. Dazu wird eine saure Lösung, die Vanadium in der Oxidationsstufe +5 enthält, mit wenig Wasserstoffperoxid versetzt. Es bildet sich das rötlich-braune [V(O2)]3+-kation. Dieses reagiert mit größeren Mengen Wasserstoffperoxid zur schwach gelben Peroxovanadiumsäure H3[VO2(O2)2].[33]
Quantitativ kann Vanadium durch Titration bestimmt werden. Dazu wird eine vanadiumhaltige schwefelsaure Lösung mit Kaliumpermanganat zu fünfwertigem Vanadium oxidiert und anschließend mit einer Eisen(II)-sulfatlösung und Diphenylamin als Indikator rücktitriert. Auch eine Reduktion von vorliegenden fünfwertigem Vanadium mit Eisen(II)-sulfat zum vierwertigen Oxidationszustand und anschließender potentiometrischer Titration mit Kaliumpermanganatlösung ist möglich.[16]
In der modernen Analytik kann Vanadium mit mehreren Methoden nachgewiesen werden. Dies sind beispielsweise die Atomabsorptionsspektrometrie bei 318,5 nm und die Spektralphotometrie mit N-Benzoyl-N-phenylhydroxylamin als Farbreagenz bei 546 nm.[18]
Biologische Bedeutung

Vanadiumverbindungen besitzen verschiedene biologische Bedeutungen. Charakteristisch für Vanadium ist, dass es sowohl anionisch als Vanadat, als auch kationisch als VO2+, VO2+ oder V3+ vorkommt. Vanadate besitzen große Ähnlichkeit zu Phosphaten und haben dementsprechend ähnliche Wirkungen. Da Vanadat stärker an geeignete Enzyme bindet als Phosphat, ist es in der Lage, Enzyme der Phosphorylierung zu blockieren und so zu steuern. Dies betrifft beispielsweise die Natrium-Kalium-ATPase, die den Transport von Natrium und Kalium in Zellen steuert. Diese Blockierung kann mit Desferrioxamin B, das einen stabilen Komplex mit Vanadat bildet, schnell wieder aufgehoben werden.[17] Weiterhin beeinflusst Vanadium die Glucoseaufnahme. Es ist in der Lage, in der Leber die Glykolyse zu stimulieren und den Konkurrenzprozess der Gluconeogenese zu hemmen. Dadurch kommt es zu einer Senkung des Glucose-Spiegels im Blut.[18] Daher wird untersucht, ob Vanadiumverbindungen für die Behandlung von Diabetes mellitus Typ 2 geeignet sind. Es sind jedoch noch keine eindeutigen Ergebnisse gefunden worden.[34] Daneben stimuliert Vanadium auch die Oxidation von Phospholipiden und unterdrückt die Synthese von Cholesterin durch Hemmung der Squalensynthase, einem mikrosomalen Enzymsystem der Leber. Folgerichtig verursacht ein Mangel erhöhte Konzentrationen von Cholesterin und Triglyceriden im Blutplasma.[35]
In Pflanzen spielt Vanadium eine Rolle in der Photosynthese. Es ist in der Lage, die Reaktion zur Bildung von 5-Aminolävulinsäure ohne Enzym zu katalysieren. Diese ist eine wichtige Vorstufe zur Bildung von Chlorophyll.[17]
In einigen Organismen kommen vanadiumhaltige Enzyme vor, so besitzen einige Bakterienarten zur Stickstofffixierung vanadiumhaltige Nitrogenasen. Dies sind beispielsweise Arten der Gattung Azotobacter sowie das Cyanobakterium Anabaena variabilis.[17] Diese Nitrogenasen sind jedoch nicht so leistungsfähig wie die häufigeren Molybdän-Nitrogenasen und werden daher nur bei Molybdänmangel aktiviert.[36] Weitere vanadiumhaltige Enzyme finden sich in Braunalgen und Flechten. Diese besitzen vanadiumhaltige Haloperoxidasen, mit denen sie Chlor-, Brom- oder Iod-organische Verbindungen aufbauen.
Die Funktion des in großen Mengen in Seescheiden als Metalloproteine Vanabine vorhandenen Vanadiums ist noch nicht bekannt. Ursprünglich wurde vermutet, dass das Vanadium ähnlich dem Hämoglobin als Sauerstofftransporter dient; dies hat sich jedoch als falsch herausgestellt.[36]
Gefährdungen
Wie andere Metallstäube ist auch Vanadiumstaub entzündlich. Vanadium und seine anorganischen Verbindungen haben sich im Tierversuch als karzinogen erwiesen.[37] Sie werden von der MAK-Kommission als karzinogen, Kategorie 2 und keimzellenmutagen, Kategorie 2 eingestuft.[38] Wird Vanadiumstaub etwa von Arbeitern in der Metallverhüttung über längere Zeit eingeatmet, kann es zum sogenannten Vanadismus kommen. Diese anerkannte Berufskrankheit kann sich in Schleimhautreizung, grünschwarzer Verfärbung der Zunge sowie chronischen Bronchial-, Lungen- und Darmerkrankungen äußern.[18]
Verbindungen
In Verbindungen kann Vanadium in verschiedenen Oxidationsstufen vorliegen. Häufig sind die Stufen +5, +4, +3 und +2, seltener sind +1, 0, −1 und −3. Die wichtigsten und stabilsten Oxidationsstufen sind +5 und +4.
→ Kategorie:Vanadiumverbindung
Wässrige Lösung
In wässriger Lösung lässt sich Vanadium leicht in verschiedene Oxidationsstufen überführen. Da die verschiedenen Vanadiumionen charakteristische Farben besitzen, kommt es dabei zu Farbänderungen.
In saurer Lösung bildet fünfwertiges Vanadium farblose VO2+-Ionen, die bei der Reduktion zunächst zu blauen vierwertigen VO2+-Ionen werden. Die dreiwertige Stufe mit V3+-Ionen ist von grüner Farbe, die tiefste, in wässriger Lösung erreichbare Stufe, das zweiwertige V2+-Ion ist grauviolett.
Sauerstoffverbindungen
_oxide.jpg.webp)
Die wichtigste und stabilste Vanadium-Sauerstoff-Verbindung ist Vanadium(V)-oxid V2O5. Diese orangefarbene Verbindung wird in größeren Mengen als Katalysator für die Schwefelsäureherstellung verwendet. Sie wirkt dort als Sauerstoffüberträger und wird während der Reaktion zu einem weiteren Vanadiumoxid, dem Vanadium(IV)-oxid VO2 reduziert. Weitere bekannte Vanadiumoxide sind Vanadium(III)-oxid V2O3 und Vanadium(II)-oxid VO.
In alkalischer Lösung bildet Vanadium(V)-oxid Vanadate, Salze mit dem Anion VO43−. Im Gegensatz zu den analogen Phosphaten ist jedoch das Vanadat-Ion die stabilste Form; Hydrogen- und Dihydrogenvanadate sowie die freie Vanadiumsäure sind instabil und nur in verdünnten wässrigen Lösungen bekannt. Werden basische Vanadatlösungen angesäuert, bilden sich anstatt der Hydrogenvanadate die Polyvanadate, in denen sich bis zu zehn Vanadateinheiten zusammenlagern. Vanadate finden sich in verschiedenen Mineralen, Beispiele sind Vanadinit, Descloizit und Carnotit.
Halogenverbindungen
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Vanadium eine Vielzahl von Verbindungen. In den Oxidationsstufen +4, +3 und +2 existieren Verbindungen mit allen Halogenen, lediglich mit Iod sind nur Verbindungen in den Stufen +2 und +3 bekannt. Von diesen Halogeniden sind jedoch nur die Chloride Vanadium(IV)-chlorid und Vanadium(III)-chlorid technisch relevant. Sie dienen unter anderem als Katalysator für die Herstellung von Ethylen-Propylen-Dien-Kautschuk.[16]
Vanadiumoxidchloride
Vanadium bildet auch Mischsalze mit Sauerstoff und Chlor, die sogenannten Vanadiumoxidchloride. Vanadium(III)-oxidchlorid, VOCl, ist ein gelbbraunes, wasserlösliches Pulver. Das in der Photographie und als Textilbeize eingesetzte Vanadium(IV)-oxidchlorid, VOCl2 besteht aus grünen, hygroskopischen Kristalltafeln, die sich in Wasser mit blauer Farbe lösen. Vanadium(V)-oxidchlorid, VOCl3 schließlich ist eine gelbe Flüssigkeit, die durch Wasser sehr leicht hydrolysiert wird. VOCl3 dient als Katalysatorkomponente bei der Niederdruckethenpolymerisation.[39]
Weitere Vanadiumverbindungen
In organischen Vanadiumverbindungen erreicht Vanadium seine niedrigsten Oxidationsstufen 0, −I und −III. Hier sind vor allem die Metallocene, die sogenannten Vanadocene, wichtig. Diese werden als Katalysator für die Polymerisation von Alkinen verwendet.[40]
Vanadiumcarbid VC wird in Pulverform unter anderem zum Plasmaspritzen bzw. Plasma-Pulver-Auftragschweißen eingesetzt.[41] Weiterhin wird Vanadiumcarbid Hartmetallen zugesetzt, um das Kornwachstum zu verringern.[16]
Literatur
- Günter Bauer u. a.: Vanadium and Vanadium Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2000, doi:10.1002/14356007.a27_367.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1542–1552.
Weblinks
- Eintrag zu Vanadium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Vanadium) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu vanadium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu vanadium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1260.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Fluid Properties; Enthalpy of Fusion, S. 6-135.
- Eintrag zu Vanadium, Pulver in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. April 2017. (JavaScript erforderlich)
- Juan J. Rodríguez-Mercado, Rodrigo A. Mateos-Nava, Mario A. Altamirano-Lozano: DNA damage induction in human cells exposed to vanadium oxides in vitro. In: Toxicology in Vitro. 25, Nr. 8, 2011, S. 1996–2002, doi:10.1016/j.tiv.2011.07.009.
- L. R. Caswell: Andres del Rio, Alexander von Humboldt, and the Twice-Discovered Element. (PDF; 124 kB). In: Bull. Hist. Chem. 28 (1), 2003, S. 35–41.
- N. G. Sefstöm: Ueber das Vanadin, ein neues Metall, gefunden im Stangeneisen von Eckersholm, einer Eisenhütte, die ihr Erz von Taberg in Småland bezieht. In: Annalen der Physik und Chemie. 97 (1), 1831, S. 43–49.
- „Im hohen Norden wohnte in alter Zeit die Göttin Vanadis, schön und liebenswürdig. Eines Tages klopfte es an der Tür. Die Göttin blieb bequem sitzen und dachte: es kann wohl noch einmal angeklopft werden, aber es wurde nicht mehr geklopft, sondern der klopfende ging die Treppe hinunter. Die Göttin war neugierig […] Ach! […] das ist der Schalk Wöhler. […] Nach einigen Tagen klopfte es nochmals an der Tür; es wurde aber immer und immer wieder geklopft. Die Göttin kam endlich selbst und öffnete die Tür. Sefström trat ein, und aus dieser Begegnung wurde Vanadin geboren.“ (Brief von Berzelius an Wöhler vom 22. Januar 1831. In: O. Wallach (Hrsg.): Briefwechsel zwischen J. Berzelius und F. Wöhler. Leipzig 1901.)
- Vanadium. In: Encyclopædia Britannica. 2008. Encyclopædia Britannica Online, aufgerufen am 6. Oktober 2008 (online)
- Günter Bauer u. a.: Vanadium and Vanadium Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2000, doi:10.1002/14356007.a27_367.
- Dieter Rehder: Bioanorganische Chemie des Vanadiums. In: Angew. Chem. 103, 1991, S. 152–172.
- Eintrag zu Vanadium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1542.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1543.
- U.S. Geological Survey: Vanadium. In: Mineral Commodity Summaries. Januar 2008. (PDF; 84 kB).
- P. A. Williams, f. Hatert, M. Pasero, S. J. Mills: IMA/CNMNC Newsletter 14: New minerals and nomenclature modifications approved in 2012 and 2013. In: Mineralogical Magazine. Band 77, Nr. 1, 2013, S. 1–12 (main.jp [PDF; 125 kB; abgerufen am 1. Januar 2018]).
- Mikhail Ostrooumov, Yuri Taran: Discovery of Native Vanadium, a New Mineral from the Colima Volcano, State of Colima (Mexico). In: Macla. Revista de la Sociedad Española de Mineralogía. Band 20, Juli 2015, S. 109–110 (ehu.eus [PDF; 134 kB; abgerufen am 1. Januar 2018]).
- Mikhail Ostrooumov, Yuri Taran: Vanadium, V – a new native element mineral from the Colima volcano, State of Colima, Mexico, and implications for fumarole gas composition. In: Mineralogical Magazine. Band 80, Nr. 2, April 2016, S. 371–382, doi:10.1180/minmag.2016.080.006 (abgerufen über De Gruyter Online).
- Mindat – Vanadium (englisch)
- Mineralienatlas: Strunz 9 Systematik: Eisen-Chrom-Familie
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 30, 1974, S. 193–204, doi:10.1107/S0567740874002469.
- Aaron Waxler, William S. Corack: Superconductivity of Vanadium. In: Physical Review. 85, (1), 1952, S. 85–90, doi:10.1103/PhysRev.85.85.
- T. Krome: Metalle auf Abwegen. Über das ungewöhnliche Tieftemperaturverhalten winziger Metallklumpen. In: Spektrumdirekt.de. 22. Mai 2003; Abstract.
- Ramiro Moro, Xiaoshan Xu, Shuangye Yin, Walt A. de Heer: Ferroelectricity in Free Niobium Clusters. In: Science. Vol. 300, Nr. 5623, 2003, S. 1265–1269, doi:10.1126/science.1083247.
- G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
- Vanadium. In: Lexikon der Physik. abgerufen 9. Juli 2008.
- G. Jander, E. Blasius, J. Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. Hirzel Verlag, Stuttgart 1995, ISBN 3-7776-0672-3, S. 218–219.
- D. M. Smith, R. M. Pickering, G. T. Lewith: A systematic review of vanadium oral supplements for glycaemic control in type 2 diabetes mellitus. In: QJM: An International Journal of Medicine. 101, (5), 2008, S. 351–358, doi:10.1093/qjmed/hcn003.
- Vanadium. In: Lexikon der Biologie. abgerufen 9. Juli 2008.
- Wolfgang Kaim, Brigitte Schwederski: Bioanorganische Chemie. 4. Auflage. Teubner, Wiesbaden 2005, ISBN 3-519-33505-0, S. 241–243.
- Presseerklärung der DFG zu Änderungen in der Liste der MAK- und BET-Werten (Memento vom 13. August 2007 im Internet Archive), 19. Juli 2005.
- Ständige Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe: MAK- und BAT-Werte-Liste 2021. 57. Mitteilung. In: Deutsche Forschungsgemeinschaft (Hrsg.): Maximale Arbeitsplatzkonzentrationen und Biologische Arbeitsstofftoleranzwerte. Publisso, 2021, ISBN 978-3-9822007-1-2, doi:10.34865/mbwl_2021_deu.
- Vanadiumoxidchloride. In: Lexikon der Chemie. abgerufen 9. Juli 2008.
- Eintrag zu Vanadium-organische Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- Verwendung von Vanadiumcarbid der H. C. Starck-Gruppe.