Natriumsulfid
Natriumsulfid, Na2S ist ein Salz des Schwefelwasserstoffs H2S, einer sehr schwachen Säure.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
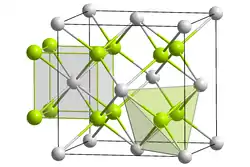 | |||||||||||||||||||
| _ Na+ _ S2− | |||||||||||||||||||
| Kristallsystem |
Antifluorit (kubisch) | ||||||||||||||||||
| Raumgruppe |
Fm3m (Nr. 225)[1] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumsulfid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Verhältnisformel | Na2S | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, hygroskopischer Feststoff[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 78,05 g·mol−1 (wasserfrei) 240,18 g·mol−1 (Nonahydrat) | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (188 g·l−1 bei 20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Schwefelhaltige Substanzen (z. B. Natriumsulfat) werden durch Glühen mit Holzkohlepulver und Soda zu Natriumsulfid reduziert. Es entsteht auch beim Einleiten von Schwefelwasserstoff in Natronlauge. Im Exsikkator über Schwefelsäure oder Phosphorsäure kann der Wassergehalt auf 4 Prozent gesenkt werden. Der restliche Wasseranteil kann nur durch Erhitzen auf 700 °C in Wasserstoff entfernt werden.[6]
Im Labor kann das wasserfreie Salz durch Reduktion von Schwefel mit Natrium in wasserfreiem Ammoniak hergestellt werden.[7]
Eigenschaften

Natriumsulfid ist im reinen Zustand ein farbloser kristalliner Feststoff, der nach faulen Eiern riecht und als Nonahydrat Na2S · 9 H2O vorliegt. Die wasserfreie Variante ist geruchlos. Bei Berührung mit Säure (auch Kohlenstoffdioxid CO2, in der Atemluft) wird der giftige und brennbare Schwefelwasserstoff (Geruch!) freigesetzt. Fein verteiltes, kristallwasserfreies, Natriumsulfid kann sich an der Luft selbst entzünden, es reagiert heftig mit Oxidationsmitteln wie Kaliumpermanganat oder Kaliumdichromat. Es ist gut in Wasser löslich, die Lösung reagiert stark alkalisch und ist sehr ätzend. Die Hydrate des Natriumsulfids sind nicht brennbar, verlieren aber beim Erhitzen das gebundene Wasser. Bei längerer Lagerung färbt sich die Substanz durch langsame Oxidation unter Bildung von Polysulfiden gelblich.[4] Natriumsulfid kristallisiert in einer Antifluorit-Struktur (kubische Symmetrie, Raumgruppe Fm3m (Raumgruppen-Nr. 225)), mit dem Gitterparameter a = 6,526 Å.[1] Bei 7 GPa geht es in eine Hochdruckform mit anti-PbCl2-Struktur (Raumgruppe Pnma (Nr. 62)), bei 16 GPa in eine Form mit Ni2In-Struktur (Raumgruppe P63/mmc (Nr. 194)) über.[8]
Verwendung
Natriumsulfid wird u. a. in der Gerberei als Enthaarungsmittel, im Bergbau zur Erzflotation, in der organischen Chemie als Reduktionsmittel, in der Abwasserbehandlung zur Schwermetallfällung sowie zur Herstellung von Schwefelfarbstoffen verwendet. Weiterhin dient es zum Färben von Glas, zur Entfernung von NOx (Stickoxiden) aus Abgasen und zum Holzaufschluss. In der Schwarz/Weiß-Fotografie und Lithographie wird es in der Dunkelkammer zur Schwefeltonung (Sepia-Tonung) eingesetzt.
Einzelnachweise
- Eduard Zintl, A. Harder, B. Dauth: Gitterstruktur der Oxyde, Sulfide, Selenide und Telluride des Lithiums, Natriums und Kaliums. In: Zeitschrift für Elektrochemie und angewandte physikalische Chemie, 40, 1934, S. 588–593.
- Eintrag zu SODIUM SULFIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Natriumsulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Natriumsulfide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- Eintrag zu Disodium sulphide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 358–60.
- J.-H. Also, P. Boudjouk: Hexamethyldisilathiane. In: Inorganic Syntheses. 1992, 29, S. 30, doi:10.1002/9780470132609.ch11.
- A. Vegas, A. Grzechnik, M. Jansen, M. Hanfland, I. Loa, K. Syassen: Reversible phase transitions in Na2S under pressure: a comparison with the cation array in Na2SO4. In: Acta Crystallographica, B57, 2001, S. 151–156, doi:10.1107/S0108768100016621.


