Umpolung
Umpolung nennt man in der Organischen Chemie die Modifikation einer funktionellen Gruppe mit dem Ziel, ihre Polarität umzukehren.[1][2][3] Dadurch kehrt sich auch ihre Reaktivität: Aus einem Elektronenmangel kann eine Elektronenüberschuss-Situation erzeugt werden; es ergeben sich neue Reaktionsmöglichkeiten. Der Germanismus umpolung ist auch im angelsächsischen Sprachraum etabliert.
Viele organische Reaktionen verlaufen über polare Donor- und Akzeptor-Zentren, wobei negativ polarisierte Atome im Molekül als Nucleophile mit positiv polarisierten Atome (oder elektrophilen Zentren) Verbindungen eingehen.
Heteroatome wie Sauerstoff oder Stickstoff in einem Kohlenstoffgerüst verursachen durch ihre höhere Elektronegativität eine höhere Elektronendichte am Heteroatom und am benachbarten Kohlenstoffatom eine positive Polarisierung. An einem Kohlenstoffgerüst entstehen dadurch alternierend Donor- und Akzeptor-Zentren, die zu einem normalen Reaktionsmuster in polaren Reaktionen führen.
Die Methode der Umpolung wird häufig verwendet um eine C-C Verknüpfung herzustellen. Das Prinzip ist hierbei ein negativ polarisiertes Kohlenstoffatom zu erzeugen, welches dann ein positiv polarisiertes C-Atom nucleophil angreifen kann.
Dieter Seebach und E. J. Corey führten das Konzept ein. Klassische Beispiele einer Umpolung sind die Grignard-Reaktion und die Benzoin-Kondensation.
Carbonyl-Umpolung
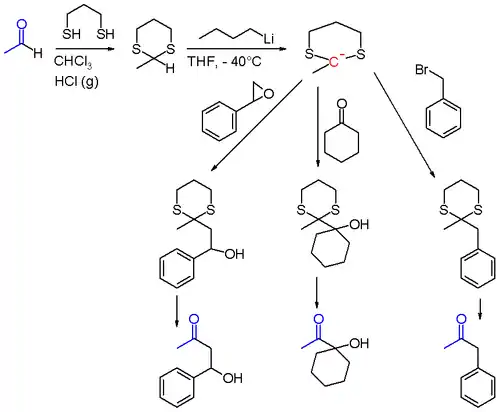
Ein bekanntes Beispiel ist die Dithian-Methode oder Corey-Seebach-Reaktion. Dabei wird beispielsweise eine Carbonylgruppe eines Aldehyds in ein Thioacetal überführt, der vorherige Carbonyl-Kohlenstoff wird nach Deprotonierung mit z. B. n-Butyllithium zum Nucleophil, das mit Halogenalkanen, Carbonylkomponenten oder Oxiranen in einer nucleophilen Substitution abreagiert. Nach Hydrolyse des Thioacetals erhält man z. B. α-Alkyl-Ketone.
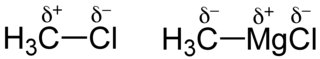
Umpolung durch Bildung einer Grignard-Verbindung
Bei der Synthese von Grignard-Verbindungen aus Halogenalkanen findet eine Umpolung statt.
Umpolung der Methylengruppe von Malonsäurediethylester bei Umsetzung mit Ethanolat
Die Methylengruppe des Malonsäurediethylesters ist durch die beiden benachbarten Carboxygruppen stark positiv polarisiert und an Elektronen verarmt. Durch die starke Base Ethanolat wird ein Proton abgespalten und das C-Atom so umgepolt. Durch Umsetzung mit Alkyl- oder Arylhalogeniden lässt sich dieses C-Atom alkylieren, siehe Malonestersynthese.

Umpolungs-Katalysatoren
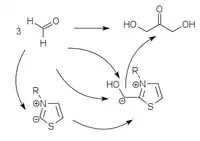
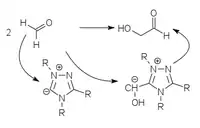
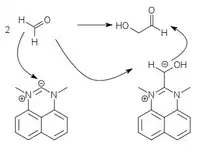
Stark azide CH-Verbindungen (Cyanid, Thiazolium- oder Triazolium-Heterozyklen) können als Carbanionen an Carbonylverbindungen addieren und dadurch deren C-H Bindung so azide machen, dass die daraus gebildeten Carbanionen als Nukleophile zur Reaktion gebracht werden können. Das entspricht einer Umpolung des elektrophilen Carbonyl-C-Atom zum nukleophilen Carbanion. Die C-C Bindung zum aziden Katalysator ist sehr labil und löst sich leicht, sodass der Katalysator wieder für einen neuen Katalysezyklus zur Verfügung steht.
Das klassische Beispiel für solch eine Umpolungs-Katalyse ist die Benzoin-Kondensation mit Cyanid, die nur mit aromatischen Aldehyden funktioniert. Heterozyklische Umpolungs-Katalysatoren (Thiazolium- oder Triazolium-Heterozyclen) können diese Kondensation auch mit aliphatischen Aldehyden durchführen.[4][5][6] Auch Perimidiniumylide können verwendet werden.[7]
| Katalytische Umpolung | ||
 |
 |
 |
| Thiazolium-Katalyse | Triazolium-Katalyse | Perimidinium-Katalyse |
Siehe auch
Einzelnachweise
- Seebach D.: Methods of Reactivity Umpolung. In: Angewandte Chemie International Edition in English. 18, Nr. 4, 1979, S. 239–258. doi:10.1002/anie.197902393.
- Gröbel B. T., Seebach D.: Methods of Reactivity Umpolung Reactivity of Carbonyl-Compounds Through Sulfur-Containing Reagents. In: Synthesis. 6, 1977, S. 357–402. doi:10.1055/s-1977-24412.
- Seebach D., Corey E. J.: Generation and synthetic applications of 2-lithio-1,3-dithianes. In: Journal of Organic Chemistry. 40, Nr. 2, 1975, S. 231–237. doi:10.1021/jo00890a018.
- Patent DE000004122669A1: Verfahren zur Herstellung von Dihydroxyaceton. Veröffentlicht am 9. Juli 1991, Anmelder: BASF AG, 67063 Ludwigshafen, DE.
- Patent DE000004212264A1: Verfahren zur katalytischen Herstellung von Kondensationsprodukten des Formaldehyds. Veröffentlicht am 11. April 1992, Anmelder: BASF AG, 67063 Ludwigshafen, DE.
- Patent DE000004230466A1: Verfahren zur katalytischen Herstellung von Kondensationsprodukten des Formaldehyds. Veröffentlicht am 11. September 1992, Anmelder: BASF AG, 67063 Ludwigshafen, DE.
- Patent DE000019536403A1: Perimidiniumsalze, ihre Herstellung und Verwendung. Veröffentlicht am 29. Mai 1995, Anmelder: BASF AG, 67063 Ludwigshafen, DE.