Claus-Prozess
Der Claus-Prozess ist ein Verfahren zur industriellen Herstellung von Schwefel aus Schwefelwasserstoff.[1] Schwefelwasserstoff ist Bestandteil von sogenanntem saurem Erdgas ("Sauergas"), das zum Beispiel in Norddeutschland bei Oldenburg, in der kanadischen Provinz Alberta bei Calgary sowie in der chinesischen Provinz Sichuan gefördert wird. Schwefelwasserstoff entsteht aber vor allem bei der großtechnisch durchgeführten hydrierenden Entschwefelung von Erdöl in praktisch allen Raffinerien weltweit. In Raffinerien entstehen erhebliche Mengen an Schwefelwasserstoff auch bei Konversionsprozessen, die ohne Wasserstoff auskommen, zum Beispiel beim Cracking im Steam-Cracker.
Saures Erdgas besteht aus Erdgas (hauptsächlich CH4 und anderen Kohlenwasserstoffen) und H2S, sowie sonstigen Bestandteilen wie etwa H2O, CO2, Thiolen sowie COS und CS2. Da für den Claus-Prozess ein relativ hoher H2S-Gehalt des Gases erforderlich ist (>40 %), wird das H2S zunächst aus dem Erdgas selektiv herausgewaschen (z. B. mit Methyldiethanolamin, MDEA, oder Diisopropylamin) und dann aus der Waschlösung durch Erhitzen freigesetzt (Aminwäsche).
Geschichte
Das Claus-Verfahren wurde ursprünglich 1883 dem deutsch-britischen Chemiker Carl Friedrich Claus patentiert, und zwar sowohl in Deutschland als auch in England.[2] Ursprünglich wurde es zur Rückgewinnung von Schwefel aus Calciumsulfid bei der Natriumcarbonat-Produktion aus Pflanzen verwendet.
Heutzutage wird nur noch der modifizierte Claus-Prozess durchgeführt, der in den frühen 1930er Jahren von der deutschen IG Farben entwickelt wurde.[3] Weltweit wurden im Jahr 2014 ca. 52,8 Mio. t Schwefel produziert, verteilt auf viele Länder wie folgt (Daten in Mio. t): China (10.5), USA (9.6), Russland (7.3), Canada (5.9), Deutschland (3.8), Japan (3.3), Saudi-Arabien (3.3), Indien (2.8), Kasachstan (2.7), Iran (2.1), Vereinigte Arabische Emirate (1.9), Mexiko (1.8), Chile (1.7), Südkorea (1.4), Polen (1.1), gefolgt von Frankreich, Australien, Venezuela, Kuwait und anderen. Für 2015 wurde die globale Schwefelproduktion auf über 70 Mio. t geschätzt, der überwiegend bei der Entschwefelung von Erdgas und Rohöl anfällt ("Claus-Schwefel").[4]
Verfahren
Der grundlegende chemische Prozess kann durch folgende drei Gleichungen beschrieben werden,[5] wobei die angegebenen Reaktionsenthalpien für gasförmige Reaktionspartner bei 1 bar Druck und 298 K gelten:[6]
Der in der Aminwäsche abgetrennte Schwefelwasserstoff wird aus der Waschlösung ausgetrieben. Ein Drittel dieses Schwefelwasserstoffgases wird im Claus-Ofen mit Prozessluft zu Schwefeldioxid verbrannt, indem so viel Sauerstoff in Form von Luft oder mit Sauerstoff angereicherter Luft dosiert wird, dass folgende Stöchiometrie erfüllt wird:
(I)
Ein Teil des übrigen Schwefelwasserstoffs reagiert mit dem entstandenen SO2 unter Komproportionierung zu elementarem Schwefel in der Molekülgröße S2:
(II)
Der restliche Schwefelwasserstoff wird mit dem verbliebenen SO2 bei tieferer Temperatur katalytisch zu elementarem Schwefel umgesetzt (hauptsächlich S8):
(III)
Das technische Verfahren besteht folglich aus drei Stufen:[1]
1. Thermische Stufe: In einem Claus-Ofen wird durch teilweises Verbrennen des H2S mit Luft oder einem Luft-Reinsauerstoff-Gemisch die benötigte Menge SO2 erzeugt (Reaktion I; ca. 950–1200 °C). Zentraler Teil des Ofens ist der Brenner (Burner), der die Reaktionsgase optimal vermischt (F1; siehe Abb. 1). Das entstehende SO2 reagiert bereits im Claus-Ofen teilweise mit dem vorhandenen H2S zu elementarem Schwefel, der wegen der hohen Temperatur zunächst als S2 anfällt (Reaktion II). Hinter dem Claus-Ofen wird das Gasgemisch in einem Wärmeaustauscher mit Kesselspeisewasser (KSW) auf ca. 300 °C abgekühlt, wobei Dampf erzeugt wird. Durch die Kühlung wird der erzeugte Schwefel flüssig abgeschieden, wobei die S2-Moleküle zu einem Gemisch von Ringmolekülen wie S8, S7 und S6 oligomerisieren. Ungefähr 60–70 % der maximal möglichen Schwefelmenge werden bereits hier gewonnen, sofern der H2S-Gehalt des Feed-Gases ausreichend hoch ist. Hinter dem ersten Schwefelabscheider besteht das Gas dann überwiegend aus Stickstoff, Wasserdampf, H2S und SO2.
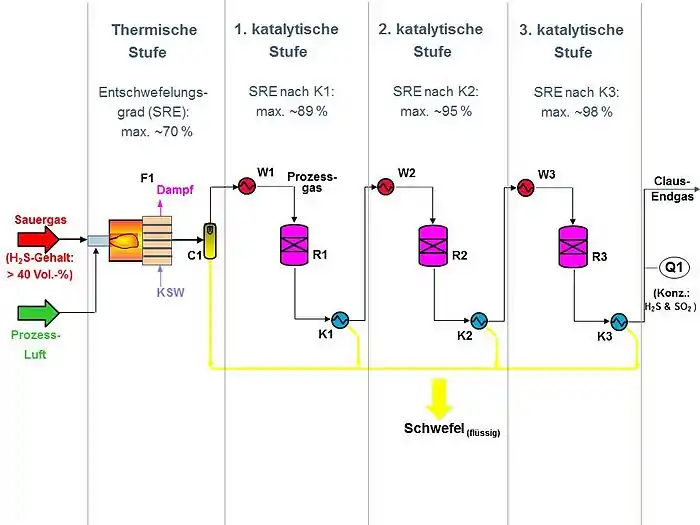
2. Katalytische Stufen: In zwei oder drei aufeinander folgenden katalytischen Stufen wird nach Reaktion III weiterer Schwefel gewonnen. Bei dieser exothermen Gasphasen-Reaktion handelt es sich um einen Gleichgewichtsprozess, wobei das Gleichgewicht bei niedrigen Temperaturen am weitesten auf der Seite des elementaren Schwefels liegt. Zur Beschleunigung der Gleichgewichtseinstellung wird synthetisches Aluminiumoxid oder Titandioxid als Katalysator eingesetzt. Die Austrittstemperaturen der katalytischen Reaktoren werden hoch genug eingestellt, um ein Kondensieren von Schwefeldampf auf dem Katalysatormaterial und damit dessen Deaktivierung sicher zu vermeiden. Um eine maximale Ausbeute bei gleichzeitig akzeptabler Reaktionszeit zu erzielen, liegt die Temperatur in ersten Reaktor R bei 305–350 °C, im zweiten bei ca. 225 °C und im dritten bei 180–200 °C. Hinter jedem Reaktor wird der erzeugte Schwefel durch Kühlung des Gasgemischs flüssig abgeschieden (K1 bis K3), wonach das verbleibende Gas aber wieder in einer Vorwärmstufe (W1 bis W3) auf die notwendige Reaktionstemperatur aufgeheizt werden muss, sofern noch ein weiterer Reaktor angeschlossen ist.
Der erste katalytische Reaktor hat darüber hinaus die Funktion, Kohlendisulfid und Carbonylsulfid hydrolytisch zu zersetzen, wozu eine möglichst hohe Temperatur erforderlich ist:
(IV)
(V)
Die gesamte Ausbeute an Schwefel beträgt bei zwei katalytischen Stufen ca. 95 %, während bei drei Stufen bis zu 98 % des Schwefels gewonnen werden können. Der erzeugte, von gelöstem H2S befreite Flüssigschwefel wird in dampfbeheizten Behältern gelagert und transportiert; er ist so rein, dass er ohne weitere Nachreinigung z. B. direkt zur Herstellung von Schwefelsäure herangezogen werden kann. Insgesamt erzeugt eine Claus-Anlage mehr Energie (in Form von Dampf) als sie selbst verbraucht.
3. Im Claus-Endgas hinter der letzten katalytischen Stufe befinden sich neben N2, Wasserdampf, Wasserstoff, CO und CO2 immer noch Spuren von Schwefeldampf sowie SO2, COS, CS2 und H2S, die entfernt werden müssen, um Geruchsbelästigungen und Umweltschäden zu minimieren (die Geruchsschwelle für H2S liegt bei nur 0.1 ppm). Hierzu sind mehr als ein Dutzend unterschiedliche Varianten zur Feinentschwefelung im Einsatz. In hohem Maße durchgesetzt hat sich mittlerweile ein Feinentschwefelungsverfahren, welches auf der hydrierenden Umsetzung aller vorhandener Schwefelkomponenten zu H2S basiert. Letzteres wird in einer nachgeschalteten Waschstufe mit Hilfe einer Aminlösung (typischerweise wasserhaltiges MDEA) selektiv ausgewaschen und damit als konzentrierter H2S-Strom gewonnen, welcher in den Claus-Ofen geleitet wird. Damit sind Schwefelrückgewinnungsraten von über 99,8 % realisierbar, das heißt Spitzenwerte im Vergleich zu anderen Feinentschwefelungsprozessen (wie z. B. katalytische H2S-Oxidation mit Hilfe von Luft oder SO2). Allerdings muss diese Leistungsfähigkeit bezüglich der Minimierung von SO2-Emissionen durch relativ hohen apparativen sowie energetischen Aufwand erkauft werden. Da auch nach der Feinentschwefelung noch mit geringen Konzentrationen von Schwefelverbindungen wie z. B. H2S im Prozessgas zu rechnen ist, wird dieses abschließend einer katalytischen oder (häufiger) thermischen Luftoxidation unterworfen, so dass praktisch alle Schwefelkomponenten zu SO2 umgesetzt werden, welches dann schließlich emittiert wird.
Literatur
- Ralf Steudel: Elemental Sulfur and Sulfur-Rich Compounds. Top. Curr. Chem., Vol. 230, Springer, Berlin, 2003, ISBN 3-540-40191-1.
- F. P. Springer, Über Schwefel und Schwefelwasserstoff – Zur Geschichte dieser Bestandteile von Erdgasen. Erdöl-Erdgas-Kohle, 2011, Heft 10, S. 382–388.
- Linde-Broschüre Sulfur Process Technology. 2012. (PDF.)
Siehe auch
Einzelnachweise
- Bernhard Schreiner: Der Claus-Prozess. Reich an Jahren und bedeutender denn je. In: Chemie in unserer Zeit. Band 42, Nr. 6, Dezember 2008, S. 378–392, doi:10.1002/ciuz.200800461.
- Ralf Steudel, Lorraine West, Vita of Carl Friedrich Claus - inventor of the Claus process for production of sulfur from hydrogen sulfide, online-Dokument von 2015, verfügbar auf der Plattform ResearchGate.net
- Hans Baehr, Gas Purification by the Alkacid Process and Sulfur Recovery by the I.G. Claus Process, Refiner & Natural Gasoline Manufacturer, 1938, Vol. 17(6), p. 237-244.
- Mineral Commodity Summary 2016
- Ralf Steudel: Chemie der Nichtmetalle. de Gruyter, Berlin, 2013, ISBN 978-3-11-030439-8, S. 465–466.
- Berechnet aus den Enthalpie-Daten der NIST-Datenbank
.jpg.webp)